INTRODUCCIÓN
Uno de los estímulos más importantes que recibe el hueso para regular la masa ósea, la forma y la microarquitectura es la fuerza mecánica. El endoesqueleto reacciona ante un aumento de carga formando más hueso o disminuyendo su masa ante la falta de tensión mecánica1. Esto es debido a que la estimulación desencadena el proceso de mecano-transducción en el cual los osteocitos, que se consideran las células clave mecanosensoras del hueso, cuando son estimulados, envían señales químicas que afectan a la regulación paracrina del comportamiento de los osteoblastos y los osteoclastos2,3. También se ha observado que conlleva un efecto antiapoptótico de los osteocitos4.
Con la carga mecánica, la expresión de esclerostina, que es un inhibidor de la vía de señalización proteica Wnt/β-catenina secretado de manera constitutiva por los osteocitos, disminuye provocando un incremento de la osteoblastogénesis5,6. Por otra parte, los osteocitos apoptóticos inducen la secreción del ligando del receptor activador del factor nuclear kB (RANKL, del inglés Receptor Activator for Nuclear Factor κ B Ligand), estimulando indirectamente la osteoclastogénesis7.
Además, algunas quimioquinas, una familia de citoquinas quimiotácticas, podrían estar involucradas en la remodelación ósea al ser expresadas por células óseas y proporcionar señales clave para reclutar diferentes subpoblaciones celulares8.
Hay estudios recientes que indican que la proteína del grupo 1 de alta movilidad (HMGB1, del inglés High Mobility Group Box 1), la proteína reguladora de la activación de linfocitos T y monocitos (RANTES o CCL5, del inglés Regulated upon Activation, Normal T cell Expressed, and Secreted/Chemokine (C-C motif) Ligand 5, respectivamente ) y la proteína quimiotáctica de monocitos de tipo 1 (MCP1 o CCL2, del inglés Monocyte Chemoattractant Protein 1/Chemokine (C-C motif) Ligand 2, respectivamente) intervienen en el reclutamiento de células madre mesenquimales para promover la reparación del tejido99,10.
En base a estas evidencias, los objetivos del presente trabajo se centran en recrear un modelo de carga in vitro parar generar mecanotransducción en un entorno de cultivo controlado11 y poder estudiar el efecto del medio condicionado secretado por los osteocitos tras ser estimulados mecánicamente en la promoción de la capacidad proliferativa y migratoria de células mesenquimales y células óseas; así como la posible expresión proteica de ciertos factores quimiotácticos implicados en procesos de proliferación y migración.
MATERIALES Y MÉTODOS
Cultivos celulares. Para los ensayos del presente trabajo se utilizaron diferentes tipos celulares:
Células mesenquimales preadiposas (adipose stromal cells, ASC) obtenidas por cultivo primario de lipoaspirados humanos realizados en el Hospital HM Montepríncipe (HM Hospitales), según se describió en los trabajos de Zuk y cols. en 200112. Todos los donantes dieron su consentimiento informado, de acuerdo con el protocolo clínico apropiado. Los pacientes fueron operados en el Departamento de Cirugía Plástica de HM Hospitales (Madrid, España), y la recogida de muestra de tejido fue aprobado por la Junta de Revisión Institu-cional/Comité Ético de Investigación Clínica de HM Hospitales (Madrid, España). Estas células se cultivaron con DMEM (dulbecco modified Eagles minimal essential medium) + GlutaMAX (Gibco, Life Technologies, Alcobendas, España) con 10% de suero fetal bovino (fetal bovine serum, FBS) y 1% de penicilina-estreptomicina (Invitrogen) a 37ºC con 5% de CO2.
Línea continua de osteocitos MLO-Y4 de huesos largos murinos extraídos según se describe en Kato y cols. en 1997, por cortesía de L. Bonewald13, que fue cultivada en placa de 100 mm de diámetro (Jet Biofil, Guangzhou, China) previamente colagenizada con Colágeno I (Sigma-Aldrich) con α-MEM (Minimum Essential Medium Eagle -Alpha Modification) al 2,5% de suero de ternero (calf serum, CS) (Sigma-Aldrich), 2,5% de FBS y 1% de penicilina-estreptomicina a 37ºC con 5% de CO2.
Línea continua de preosteoblastos de ratón de hueso de la bóveda del cráneo, MC3T3-E1 subclone 4 (ATCC CRL-2593).
Línea continua de macrófagos de ratón capaces de diferenciarse a osteoclastos, RAW 264.7 (ATCC TIB-71), que fueron cultivadas con α-MEM con 10% de FBS, 1% de penicilina-estreptomicina y 2 mM de L-glutamina a 37ºC con 5% de CO2.
Ensayos de estimulación mecánica por paso de fluido (Fluid Flow, FF). Es una técnica para generar estímulo mecánico, fisiológicamente relevante, en las células óseas in vitro11. Para ello, se sembraron 250.000 células MLO-Y4 en portaobjetos de cristal delimitados con teflón dejando un espacio de 15 cm2 previamente colagenizado y se incubaron al menos 48 horas a 37ºC con 5% de CO2 hasta que llegaron a la confluencia. Posteriormente, las células fueron sometidas a estímulo mecánico o no (control estático o SC) con el dispositivo Flexcell Streamer de tensión de corte medio que produce un estrés de 10 dinas/cm2 durante 10 minutos (Flexcell Internacional Corporation, Hillsborough, Carolina del Norte, EE.UU.). A continuación, las células se incubaron con α-MEM Medium sin rojo fenol (Gibco) con 0,5% de CS, 0,5% de FBS y 1% de penicilina-estreptomicina para obtener medios condicionados (CM) de los diferentes grupos experimentales: CM de células estimuladas (FF) recogido a las 6 horas después del estímulo, CM de células SC recogido a las 24 horas después del estímulo y CM de células FF recogido a las 24 horas tras el estímulo.
Ensayo de proliferación. Para realizar el ensayo de proliferación, tanto las células preosteoblásticas de ratón como las células preadiposas humanas fueron sembradas a una concentración de 6.000 células/pocillo en placas de cultivo de 12 pocillos (Jet Biofil), una placa por condición con cada una de las líneas celulares, e incubadas a 37ºC con 5% de CO2. Al día siguiente se cambió el medio por 20% de medio condicionado y 80% de su medio de cultivo ajustando el FBS al 10%. Pasadas 24 horas de incubación a 37ºC con 5% de CO2, se levantaron las células con Tripsina-EDTA y se hizo un recuento celular con Trypan Blue 0,4% en PBS (GE Healthcare, Hyclone, Logan, Utah, EE.UU.) en la cámara de Neubauer. Se repitió el proceso a las 48 y 72 horas, obteniéndose así una valoración de proliferación con cada uno de los medios condicionados durante 3 días y por triplicado.
Ensayo de migración en Transwell. Se sembraron en 4 placas de cultivo de 6 pocillos Transwell (Corning, Costar, Life Sciences, Nueva York, EE.UU.) 75.000 células/pocillo con su medio de cultivo sobre la membrana, y abajo se puso 20% de medio condicionado y 80% de su medio de cultivo al 1% de FBS. Pasadas 24 horas de incubación a 37ºC con 5% de CO2, se retiraron ambos medios y la capa celular superior de la membrana con la ayuda de un hisopo de algodón. Las células que quedaron en la parte inferior de la membrana se fijaron con paraformaldehído al 4% en PBS (Alfa Aesar, Thermo Fisher) durante 10 minutos y se tiñeron con 0,1% de cristal violeta en agua destilada (MERCK, Kenilworth, Nueva Jersey, EE.UU.) durante 15 minutos. Finalmente, las membranas se montaron en portaobjetos y se observaron en el microscopio de contraste de fase (Leica Microsystems DM5500 CTR6000) de donde se obtuvieron 20 imágenes a 50 μm por pocillo para analizar el número de células que habían migrado en función del medio condicionado utilizado.
Western Blot. Las células se prepararon para extraer la proteína total con buffer RIPA (Sigma-Aldrich) suplementado con inhibidores de proteasas y fosfatasas (Calbiochem). Por otro lado, el medio condicionado se liofilizó y el pellet se resuspendió en agua MiliQ. Para cuantificar la cantidad de proteína que había en cada una de las muestras, tanto del medio condicionado liofilizado como del lisado celular, se utilizó el Varioskan Flash Multimode Reader (Thermo Scientific) con una plantilla Comassie. Una vez cuantificadas, se separaron en geles de 15% de acrilamida y se transfirieron a membranas de nitrocelulosa. A continuación, se bloqueó la membrana con albúmina de suero bovino (en inglés BSA) al 5% disuelta en TBS con Tween 20 (Sigma-Aldrich) durante una hora a temperatura ambiente y se incubó durante toda la noche a 4ºC con los anticuerpos policlonales de conejo: anti-HMGB1, anti-MCP1 y anti-RANTES (Abcam, Cambridge, Reino Unido). Como control, se usó el anticuerpo monoclonal de ratón anti-α-tubulina. Después se incubó durante una hora a temperatura ambiente con la correspondiente IgG acoplada a peroxidasa y se reveló la membrana en el transiluminador (Syngene DYV 6-E) con el sistema ECL (Electro-quimio-luminiscencia, GE-Amersham, Pittsburgh, EE.UU.). Las intensidades de las bandas fueron cuantificadas por densitometría.
Análisis estadístico. En el análisis estadístico de los resultados, los datos se expresan como media ± desviación estándar de al menos dos experimentos llevados a cabo por triplicado. Se realizó utilizando el programa GraphPad Prism V 7.0 (software GraphPad, La Jolla, California, EE.UU.), mediante un estudio no paramétrico usando t-test de dos colas o test de U-Mann-Whitney para las comparaciones dos a dos, y el test de Kuskal-Wallis para comparaciones de grupos. Se detectaron y se excluyeron los outliers mediante el programa GraphPad QuickCalcs ©2018 que utiliza el test de Grubb, y se consideraron como resultados significativos los valores de p<0,05.
RESULTADOS
Efecto de los medios condicionados de los osteocitos estimulados mecánicamente en la proliferación de preosteoblastos y células mesenquimales preadiposas
Se realizó un estudio de proliferación de células preosteoblásticas de ratón MC3T3-E1 y de células mesenquimales preadiposas con 20% de medios condicionados de células osteocíticas de ratón MLO-Y4 en presencia (FF 6 horas y FF 24 horas) y ausencia (SC o control estático) de estímulo mecánico por paso de fluido.
Tal y como se representa en la figura 1A, no hay diferencias significativas en la proliferación de la línea celular MC3T3-E1 tras 24 horas ni tras 72 horas en presencia de medios condicionados de 6 y 24 horas. En el caso de las células mesenquimales preadiposas, los resultados tampoco mostraron diferencias significativas tras 24 horas ni tras 72 horas en presencia de los medios condicionados anteriormente mencionados (Figura 1B).

Figura 1. Proliferación celular de MC3T3-E1 (A) y ASC (B) (células mesenquimales de origen adiposo) en presencia y ausencia de medios condicionados de 6 y 24 horas tras estímulo mecánico. Los valores son la media ± desviación estándar de 3 experimentos independientes por triplicado. Resultados presentados como número de células vs. control
Efecto de los medios condicionados de los osteocitos estimulados mecánicamente en la migración de preosteoblastos, células mesenquimales preadiposas y macrófagos
El estudio de migración de células preosteoblásticas MC3T3-E1, células mesenquimales preadiposas y macrófagos RAW 264.7 se realizó con medio de cultivo específico de cada estirpe celular (control) y los medios condicionados de células osteocíticas MLO-Y4 en presencia (FF 6 horas y FF 24 horas) y ausencia (SC) de estimulación mecánica.
Las células preosteoblásticas duplicaron y triplicaron su migración en presencia de los medios condicionados de los osteocitos recogidos tras 6 y 24 horas de ser sometidos a estímulos por paso de fluido, respectivamente (Figura 2).

Figura 2. Migración de células MC3T3-E1. Imágenes representativas correspondientes a la migración de MC3T3-E1 en cada una de las condiciones de estudio (A-C). Número de células por campo de la migración de MC3T3 en ausencia y presencia de los medios condicionados de estudio (D). Los valores son la media ± desviación estándar de 2 experimentos independientes por triplicado. **p<0,001 vs. control estático
De la misma manera, las células mesenquimales preadiposas también duplicaron su migración en presencia de dichos medios (Figura 3).

Figura 3. Migración de células ASC (células mesenquimales de origen adiposo). Imágenes representativas correspondientes a la migración de ASC en cada una de las condiciones de estudio (A-C). Número de células por campo de la migración de ASC en ausencia y presencia de los medios condicionados de estudio (D). Los valores son la media ± desviación estándar de 2 experimentos independientes por triplicado. **p<0,001 vs. control estático
En el caso de la línea de macrófagos de ratón RAW 264.7, nuestros resultados señalan una disminución de tres veces su migración en presencia de medios condicionados recogidos tras 24 horas de realizarles el Fluid Flow (Figura 4).

Figura 4. Migración de células RAW 264.7. Imágenes representativas correspondientes a la migración de RAW 264.7 en cada una de las condiciones de estudio (A-C). Número de células por campo de la migración de RAW 264.7 en ausencia y presencia de los medios condicionados de estudio (D). Los valores son la media ± desviación estándar de 2 experimentos independientes por triplicado. **p<0,001 vs. control estático
Análisis de la expresión y secreción de quimioquinas tras estimular mecánicamente los osteocitos
Con el fin de corroborar los resultados obtenidos anteriormente, se llevó a cabo el análisis de la expresión de proteínas quimioatrayentes mediante la técnica de Western Blot. Para ello se obtuvieron por un lado los lisados de células osteocíticas MLO-Y4 en presencia y ausencia de estimulación mecánica por paso de fluido y, por otro, el liofilizado de sus respectivos medios condicionados, tal y como se describe en el apartado de materiales y métodos.
Se estudiaron tres posibles proteínas implicadas en la migración de las células mesenquimales tras un estímulo mecánico, dos de ellas pertenecientes a la familia de las quimioquinas con patrón C-C: MCP1 y RANTES, y la proteína de alta movilidad del grupo 1 (HMGB1). Para normalizar las muestras de lisado celular se utilizó la tubulina.
Como se observa en la figura 5, en los lisados celulares de MLO-Y4 estimuladas mecánicamente se produjo una disminución de dos veces en la expresión de la proteína quimiotáctica MCP1 (Figuras 5A-5B). En las muestras de medios condicionados liofilizados se observó que la secreción de MCP1 también disminuyó en las condiciones de estímulo mecánico, en este caso disminuyo tres veces (Figuras 5C-5D).
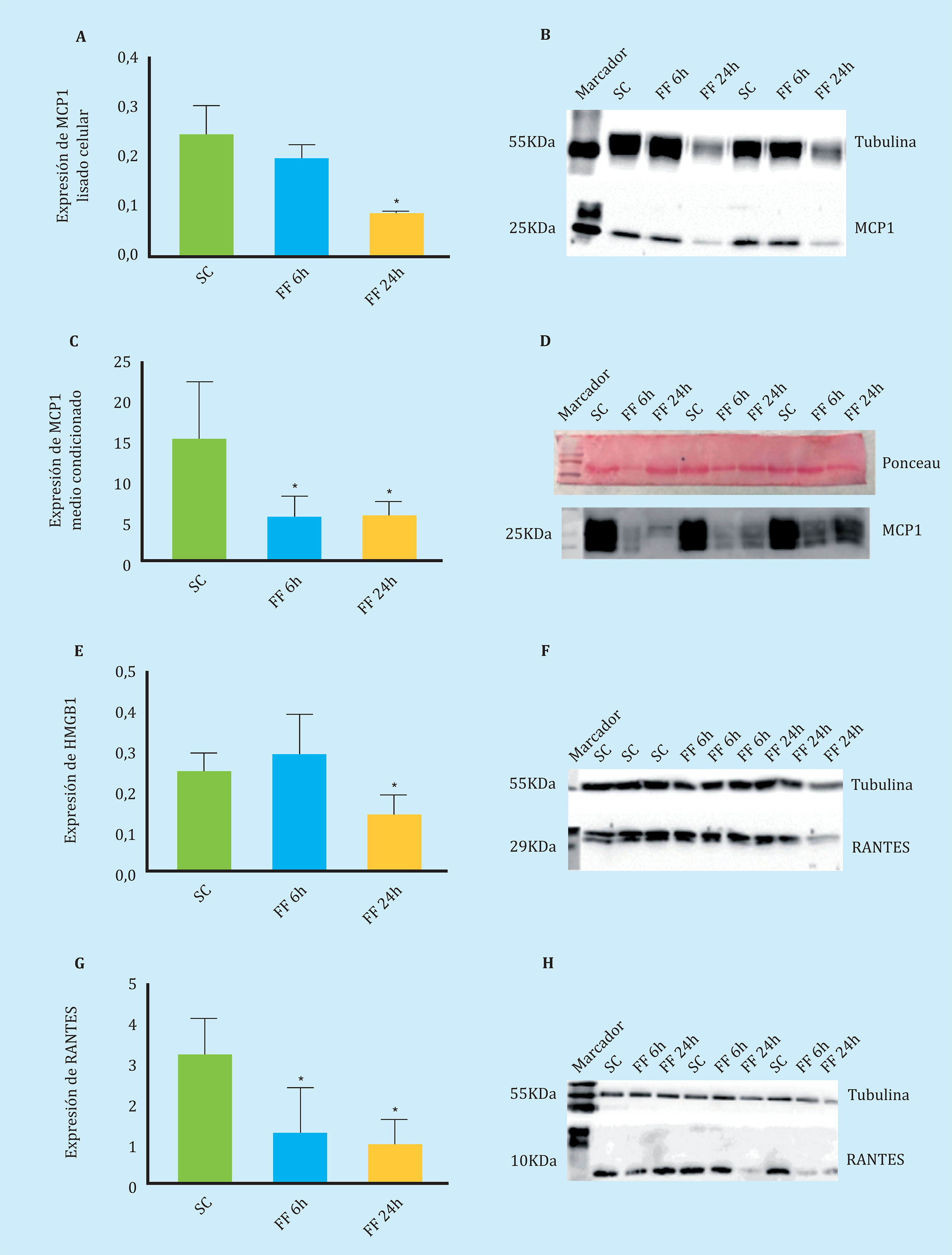
Figura 5. Secreción y expresión de proteínas quimiotácticas medidas por Western Blot (A-C). Expresión de la proteína MCP1 en lisado celular de MLO-Y4 en ausencia de estímulo mecánico (SC) y tras 6 y 24 horas de realizar FF durante 10 minutos (FF6h y FF24h) (C-D). Secreción de la proteína MCP1 en medios condicionados de MLO-Y4 en ausencia y presencia de estímulo mecánico (E-F). Expresión de HMGB1 en lisado celular de MLO-Y4 en ausencia y presencia de estímulo mecánico (G-H). Expresión de RANTES en lisado celular de MLO-Y4 en ausencia y presencia de estímulo mecánico. Los valores densitométricos relativos son la media ± desviación estándar de 2 experimentos independientes por triplicado. *p<0,05 vs. control estático
En los lisados celulares de MLO-Y4 estimuladas mecánicamente se observó una disminución de dos veces en la expresión de la proteína quimiotáctica HMGB1 en la condición de FF a 24 horas (Figuras 5E-5F).
De forma similar, en los lisados celulares de MLO-Y4 estimuladas mecánicamente se observó una disminución de tres veces en la expresión de la proteína quimiotáctica RANTES en las condiciones de FF a 6 y 24 horas (Figuras 5G-5H).
DISCUSIÓN
El envejecimiento, la pérdida de esteroides sexuales, el exceso de glucocorticoides y ciertas enfermedades óseas como la osteoporosis, provocan un desacoplamiento en el remodelado óseo y una pérdida de la calidad de la masa ósea por la acumulación de osteocitos apoptóticos que preceden el reclutamiento de precursores osteoclásticos y su diferenciación para llevar a cabo el proceso de resorción ósea dirigida14,15.
Sin embargo, niveles fisiológicos de estimulación mecánica como el ejercicio físico mantiene la viabilidad de los osteocitos y, además, como se demuestra en este trabajo, actúa sobre su comportamiento modificando la producción de ciertas quimioquinas y regulando la migración de diferentes tipos celulares.
En nuestros resultados encontramos que la exposición de las células preosteoblásticas MC3T3-E1 y de las células mesenquimales preadiposas humanas a medios condicionados de células osteocíticas MLO-Y4 de ratón estimuladas mecánicamente no afecta a su proliferación, pero si aumenta su capacidad migratoria. Estudios anteriores ya evidenciaron que el medio condicionado de los osteocitos estimulados mecánicamente es capaz de reclutar osteoprogenitores (células mesenquimales y osteoblastos) y promover el compromiso del linaje osteogénico de estas células para reponer los osteoblastos agotados, mejorar la formación ósea y fortalecer el tejido16,17.
Por otra parte, nuestros resultados señalan una disminución de la migración de los macrófagos RAW 264.7 en presencia de medios condicionados de células MLOY4 recogidos tras 24 horas de realizarles el Fluid Flow. Lo que corrobora lo observado por otros autores que indican que dicho medio condicionado también es capaz de inhibir la osteoclastogénesis18.
Todo esto sugiere un mecanismo de retroalimentación negativa mediado por factores paracrinos que regularían el proceso de formación y resorción del hueso. Por ello, comprobamos si ciertas quimioquinas seleccionadas intervienen en este proceso a través de ensayos de Western Blot tanto de las células osteocitícas estimuladas mecánicamente como de los medios condicionados. Según nuestros resultados, aunque se observa una disminución significativa de la proteína quimiotáctica de monocitos de tipo 1 (MCP-1), de la proteína de alta movilidad del grupo 1 (HMGB1) y de la proteína quimiotáctica RANTES en los lisados celulares de MLO-Y4 estimuladas mecánicamente, no parecen estar directamente asociadas con la migración de las células formadoras y repobladoras del hueso.
No obstante, a diferencia de lo que ocurre en nuestro trabajo, hay estudios previos que señalan que la HMGB1 es liberada en el entorno extracelular mediante la secreción activa de células estimuladas19 y promueve la migración y diferenciación osteogénica de las MSC9,20. En el caso de la MCP-1, se ha observado que las células madre mesenquimales de la médula ósea migran en respuesta a esta quimiocina21. Y hay hallazgos que indican que la RANTES es capaz de provocar la migración de diferentes tipos celulares, entre ellos las células madre mesenquimales de médula ósea, mediante la inducción de autofagia22-24.
Para futuras investigaciones, sería necesario realizar un estudio proteómico de los medios condicionados de los osteocitos tanto sin estímulo como con estímulo mecánico para profundizar en los procesos de comunicación de los osteocitos con su entorno.











 texto em
texto em 


