Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.31 no.3 Cantabria 2011
Aspectos vasculares y metabólicos de manidipino
Vascular and metabolic properties of manidipine
N. Buset Ríos1, F. Rodríguez Esparragón1, C. Fernández-Andrade Rodríguez2, J.C. Rodríguez Pérez3
1Unidad de Investigación. Hospital Universitario de Gran Canaria Dr. Negrín, Universidad de Las Palmas de Gran Canaria. Las Palmas de Gran Canaria
2Servicio de Nefrología. Hospital Universitario Virgen del Rocío. Sevilla
3Servicio de Nefrología y Unidad de Investigación. Hospital Universitario de Gran Canaria Dr. Negrín, Universidad de Las Palmas de Gran Canaria. Las Palmas de Gran Canaria
Este manuscrito se enmarca dentro de las ayudas recibidas por los autores desde la Fundación Mapfre-Guanarteme y Laboratorios Chiesi a los que agradecemos su apoyo y colaboración. Los autores declaran un Research Agreement entre Chiesi Farmaceutica S.p.A y la Unidad de Investigación del Hospital Universitario de Gran Canaria Dr. Negrín.
Dirección para correspondencia
RESUMEN
En el tratamiento de la hipertensión y la diabetes, la combinación de bloqueantes del sistema renina-angiotensina y de los canales de calcio se presenta como una de las opciones más eficaces. Sin embargo, no todos los bloqueantes de calcio se comportan del mismo modo. Manidipino, a diferencia de otros derivados dihidropiridínicos de tercera generación, bloquea los canales de calcio T presentes en las arteriolas glomerulares eferentes, disminuyendo la presión intraglomerular y la microalbuminuria. Además, los canales T están relacionados con proliferación, inflamación, fibrosis, vasoconstricción y activación del sistema renina-angiotensina. La inhibición de estos factores podría explicar la acción no hemodinámica del manidipino frente a otros bloqueantes.
Palabras clave: Bloqueantes de canales de calcio, Manidipino, Canales de calcio tipo T.
ABSTRACT
The combination of renin-angiotensin system blockers with calcium channel blockers appears to be one of the most effective options for treating hypertension and diabetes. Nevertheless, not all calcium blockers behave in the same manner. Manidipine, unlike other third-generation dihydropyridine derived drugs, blocks T-type calcium channels present in the efferent glomerular arterioles, reducing intraglomerular pressure and microalbuminuria. In addition, T-type channels are related to proliferation, inflammation, fibrosis, vasoconstriction and activation of the renin-angiotensin system. The inhibition of these factors could explain the non-haemodynamic effects of manidipine as compared to other blockers.
Key Words: Calcium channel blockers, Manidipine, T-type calcium channels.
Canales de calcio
Los canales de calcio dependientes de voltaje median el flujo de calcio en respuesta a la despolarización de la membrana y regulan procesos intracelulares tales como contracción, secrección, neurotransmisión o expresión génica, en los que el ion calcio actúa como segundo mensajero.
Están compuestos por múltiples subunidades heteroméricas: α, β, γ y δ, codificadas por múltiples genes. Se nombran usando el símbolo químico del principal ion al que son permeables (Ca) y su principal regulador fisiológico, el voltaje (v). El identificador numérico corresponde a la subfamilia génica a la que corresponde (1-3) y la letra (A-I) al orden en el que han sido descubiertos, excepto la unidad a1S, a la que le fue asignada la S por relacionarse con el músculo esquelético (skeletal muscle).
La subunidad α1, codificada por CACNA1, parece ser la responsable de las principales características de estos canales, ya que está implicada en la conductividad y selectividad iónicas y en la sensibilidad de voltaje1-3.
Las corrientes de calcio registradas en distintos tipos celulares tienen diversas propiedades farmacológicas y fisiológicas, según las cuales es posible agrupar a los canales de calcio en L, P/Q, N, R y T1.
Los canales de tipo L (long-lasting) se activan por despolarizaciones intensas, mediando el flujo prolongado de calcio al interior de una gran variedad de tipos celulares. De esta manera, desempeñan un papel central en la contracción y excitación del músculo esquelético, cardiaco y liso4 (Cav1.2 [α1C]), son responsables del tono del músculo liso arterial y se han convertido en dianas farmacológicas para tratar la hipertensión y la angina. En el riñón (Cav1.2 [α1C] y Cav1.3 [α1D]) promueven la dilatación de las arteriolas preglomerulares o aferentes, incrementando de manera ostensible la presión intraglomerular. Además, encontramos otros canales tipo L en músculo esquelético Cav1.1 (α1S), cerebro y riñón (Cav1.2 [α1C], Cav1.3 [α1D]), páncreas (Cav1.3 [α1D]) y retina (Cav1.4 [α1F])1.
Otros menos conocidos como los canales tipo P/Q, N y R también requieren fuertes despolarizaciones para ser activados1.
A diferencia de todos los anteriores, los canales de tipo T (transient) se activan por despolarizaciones débiles y provocan un flujo de calcio transitorio5. Los canales T se expresan en el sistema nervioso (Cav3.1 [α1G]), cerebro (Cav3.1 [α1G], Cav3.2 [α1H] y (Cav3.3 [α1D]), corazón (Cav3.2 [(α1H]), riñón (Cav3.1 [α1G], Cav3.2 [α1H]) e hígado (Cav3.2 [α1H])1. Están relacionados con ritmo cardíaco, contracción de músculo liso vascular y crecimiento celular4. Su influencia en la secreción de hormonas como renina, aldosterona, péptido natriurético auricular e insulina ha sido postulada en múltiples ocasiones. En las arteriolas posglomerulares o eferentes, únicamente aparecen canales de tipo T, no L, por lo que su tono deberá estar controlado por los canales T y los receptores AT1 de la angiotensina II.
En principio, el bloqueo de los canales L se postula como él de mayor relevancia en la regulación de las funciones vasculares, ya que fundamentalmente Cav1.2 es la principal vía de entrada de calcio a células de músculo esquelético, corazón y riñón1,6. No obstante, la acción no hemodinámica del bloqueo de los canales tipo T podría tener múltiples efectos beneficiosos al inhibir procesos inflamatorios (inhibición de Rho quinasas, NFkB, adhesión leucocitaria), bloquear el sistema renina-angiotensina o el sistema nervioso simpático7 (tabla 1).
Tabla 1. Canales de calcio 
Tomada de Hayashi K, et al. Circ Res 2007; 100:342-53.
Bloqueantes de canales de calcio. Tipos
Los bloqueantes de los canales de calcio (BCC) constituyen una clase de moléculas altamente heterogéneas, que pueden ser agrupadas en: derivados de la fenilalquilamina, como el verapamilo, derivados de benzodiazepinas, cuyo prototipo es el diltiazem, o derivados de 1,4-dihidropiridinas, como el manidipino8. Estas moléculas bloquean principalmente a los canales de tipo L.
La primera generación de bloqueantes de canales de calcio dihidropiridínicos, como el nifedipino, se caracteriza por liberación instantánea, vida media corta y absorción rápida. A pesar de tener un perfil metabólico favorable, presentan algunos efectos adversos como caída brusca de la presión arterial, taquicardia o activación simpática. Es en la segunda generación, en la que se incluye al nimodipino entre otros, donde se observa que la liberación de la molécula es más lenta9.
La última generación de BCC de vida media larga y acción prolongada ha mostrado una disminución clara de la presión arterial reduciendo notablemente los efectos secundarios (tabla 2). A diferencia de los bloqueantes tradicionales, este nuevo grupo de moléculas, en las que se incluye el manidipino, bloquea tanto los canales de tipo L como los T10.
Tabla 2. Bloqueantes de canales de calcio 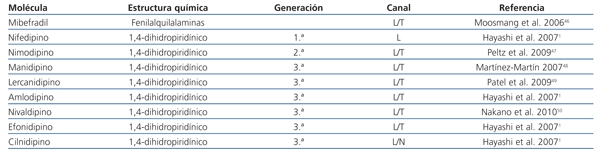
Efecto de los BCC sobre la morbimortalidad cardiovascular
La enfermedad cardiovascular está relacionada con la presión arterial de manera clara y consistente. El objetivo principal de la terapia antihipertensiva es reducir la morbimortalidad cardiovascular y renal. Para ello, se establece un presión arterial diana menor de 140/90 mmHg, aunque en pacientes con diabetes o enfermedad renal parece ser que este límite debiera ser inferior a 130/80 mmHg11.
Según las guías para el manejo de la hipertensión arterial12, los diuréticos tiazídicos deberían ser el tratamiento de elección, aunque ciertas condiciones de alto riesgo podrían tratarse con antagonistas del receptor de angiotensina II (ARA-II), BCC o inhibidores de la enzima de conversión de la angiotensina (IECA) como primera elección11. Existen firmes indicaciones en el uso de agentes antihipertensivos como BCC, IECA y ARA-II para prevenir el desarrollo de diabetes en pacientes hipertensos11.
El estudio CAMELOT concluye que, en monoterapia, los BCC se muestran más eficaces en disminuir eventos cardiovasculares y ralentizar la progresión de aterosclerosis que los IECA13. En cuanto a BBC combinados con otros fármacos, Fogari et al., demuestran que la combinación de manidipino (BCC)/delapril (IECA) frente a olmesartán (ARAII)/hidroclorotiazida resulta beneficiosa ya que reduce la presión ortostática y no presenta efectos metabólicos adversos14.
Otros estudios, como el de la Sociedad Japonesa de Hipertensión, afirman que los BCC poseen mayor eficacia antihipertensiva frente a los demás fármacos antihipertensivos de elección, sin afectar al flujo de sangre de distintos órganos. Esta característica los convierte en el grupo de fármacos indicado para pacientes con edad avanzada y complicaciones, tales como hipertrofia ventricular izquierda, taquicardia, angina de pecho, enfermedad cerebrovascular crónica15.
En este sentido, un ensayo con 30 pacientes hipertensos obesos, a los que se les sometió a tratamiento con amlodipino, manidipino y cilnidipino, reveló que estos BCC de larga duración disminuyen la presión arterial y además reducen la resistencia insulínica, sugiriendo propiedades cardiometabólicas de interés16.
No obstante, en otros estudios no parece observarse diferencias significativas en cuanto a eficacia en la reducción de la presión arterial entre los diferentes bloqueantes de canales de calcio de última generación17,18.
BCC y resistencia a la insulina. Manidipino y expresión de AP2
Si nos referimos a la morbilidad y mortalidad cardiovascular, hipertensión arterial y diabetes son factores de riesgo clave. Están interrelacionadas de manera compleja y multifactorial. Los pacientes hipertensos con síndrome metabólico (SM) tienen un elevado riesgo de presentar diabetes mellitus (DM). La incidencia de DM aparece aumentada en pacientes con HTA, en parte por el elevado porcentaje de obesidad en ambos grupos. En el estudio UKPDS se demuestra que la presión arterial elevada y glicemia aumentan el riesgo de enfermedad cardiovascular de manera independiente y aditiva19,20.
En este sentido, en el estudio MARIMBA, manidipino frente aamlodipino21 realizado en pacientes no diabéticos con síndrome metabólico, la presión arterial y la proteína C reactiva (PCR) disminuyeron con ambos tratamientos, aunque manidipino consiguió disminuir significativamente albuminuria y la resistencia a insulina, asociada a un incremento de adiponectina plasmática. Además, este último presentó menor incidencia de efectos adversos.
Si comparamos manidipino con otro BCC de las mismas características cinéticas y lipofílicas como el lercanidipino, el primero vuelve a ser más efectivo en la disminución de la resistencia a insulina en pacientes obesos hipertensos22. En otros estudios, el manidipino se muestra tan efectivo como pioglitazona en la reducción de la expresión de RAGE y en la producción de ROS y reducción de la PCR. Estos experimentos realizados con inhibidores específicos concluyen que el mecanismo es dependiente de PPAR-γ. La disminución del efecto inflamatorio de la hiperglicemia y el daño vascular podrían explicarse a través de este mecanismo23.
La «hipótesis de lipotoxicidad» relaciona la diabetes tipo 2 con una pérdida de capacidad del tejido adiposo para acomodar el exceso de calorías. La pérdida de diferenciación adipocitaria hace que el exceso de calorías se acumule principalmente en hígado, páncreas y músculo, contribuyendo al desarrollo de resistencia insulínica24. Sabemos que los adipocitos pequeños son sensibles a la insulina, al contrario que los maduros, que se hipertrofian y se vuelven resistentes a la hormona. Por ello, favorecer la adipogénesis contribuiría a disminuir la resistencia insulínica en diabéticos tipo 2.
La mejora de la sensibilidad insulínica con BCC dihidropiridínicos es casi imperceptible. En el caso del nifedipino que bloquea sólo canales de tipo L, incluso la empeora e inhibe la liberación de glucosa16. Sin embargo, los estudios con manidipino muestran resultados sorprendentes en este sentido. Si bien algunos de estos estudios ya se han introducido en un ensayo clínico realizado en 64 pacientes hipertensos con síndrome metabólico evaluados según criterios NCEP/ATPIII y aleatorizados a manidipino o amlodipino durante 12 semanas, se observaron reducciones similares de la presión arterial entre ambos tratamientos y una reducción significativa de la resistencia a la insulina en los pacientes tratados con manidipino25. En el mismo sentido, el análisis más reciente de la combinación manidipino/delapril frente a olmesartán/hidroclorotiazida, sobre la sensibilidad a la insulina y el fibrinógeno plasmático en pacientes obesos hipertensos, mostró que la primera combinación redujo significativamente la resistencia a la insulina y los niveles plasmáticos de fibrinógeno, a pesar de que la reducción de los valores de presión arterial mostrara similar eficacia entre ambas combinaciones26. Un estudio posterior comparó la combinación manidipino/delapril frente a losartán/hidroclorotiazida, en pacientes hipertensos con diabetes y microalbuminuria, concluyendo que la primera combinación supone una opción terapéutica útil en estos pacientes27.
Experimentalmente se ha observado que manidipino pero no amlodipino ni lercanidipino, activan PPAR-γ adipocitos 3T3-L1 de rata23,28. En nuestros estudios en células NIH3T3 tratadas con manidipino, se observa un aumento tanto de la expresión PPAR-γ (receptor activado por proliferadores de peroxisomas) como de la expresión del gen de diferenciación adipocitaria 2 (aP2), que puede considerarse testigo29 de la expresión del primero (figura 1). Estos resultados sugieren mecanismos que vinculan al manidipino, con el aumento observado a la sensibilidad insulínica en pacientes hipertensos diabéticos y con la formación adipocitaria de novo. En este sentido, se ha observado, que el aumento del nivel de calcio intracelular inhibe la diferenciación de preadipocitos30. Este hecho contrasta con el papel habitual del calcio en procesos más rápidos, como la neurosecreción, la excitación o la contracción.

Figura 1. La exposición a manidipino de células preadipocitarias NIH-3T3
activa la expresión del gen aP2 de forma tiempo-dependiente.
La adipogénesis, como otros procesos de diferenciación, depende de factores de transcripción promotores, como PPAR-γ, o inhibidores, como la familia GATA, que a su vez son activados por señales extracelulares. La homeostasis del calcio ha sido estudiada poniendo especial interés en la calreticulina, principal proteína de unión al calcio en el lumen del retículo endoplasmático, y responsable en gran medida del intercambio rápido de calcio. Un estudio realizado en células madre y preadipocitos 3T3-L1, muestra como la calreticulina podría modular la adipogénesis mediante un mecanismo de feed-back negativo. PPAR-γ es un potente activador transcripcional de calreticulina, ya que se une a su promotor. De esta manera, aumenta la expresión de calreticulina, pero una vez está sobreexpresada, la calreticulina inhibe la unión cis del heterodímero PPAR-γ-RxR a elementos de respuesta a PPAR-γ (PPRE), anulando la activación transcripcional de PPAR-γ por ácidos grasos. Mediante este mecanismo, la calreticulina regula negativamente la expresión tanto de PPAR-γ como de otros factores de transcripción proadipogénicos críticos como C/EBPa31.
La acción del manidipino, como bloqueador de canales de calcio, podría evitar la entrada de calcio al interior celular, disminuyendo la concentración de calcio en el retículo endoplasmático, y por tanto, la de calreticulina, favoreciendo de esta manera la diferenciación adipocitaria.
Efecto de los BCC sobre la microalbuminuria
La protección renal se asocia a protección cardiovascular y la evolución de la albuminuria es un excelente predictor tanto de la evolución de la función renal como de las complicaciones cardiovasculares32. La presencia de microalbuminuria hace necesario el uso de IECA o de ARA-II, sin dejar de considerar a los BCC como parte de la terapia combinada. En ausencia de albuminuria y con filtrado glomerular conservado o disminuido el BCC puede ser la primera opción farmacológica. No obstante, un alto porcentaje de pacientes requieren IECA y/o ARA-II33.
Manidipino, a diferencia de otras dihidropiridinas, bloquea los canales T de las arteriolas eferentes, por lo que disminuye la presión intraglomerular y con ello la excreción de albúmina, pero a la vez bloquea los canales tipo L favoreciendo la dilatación de la arteriola aferente. De esta manera, los bloqueantes de los canales de calcio (BCC) de tipo T1,7,34 influyen en la hemodinámica mediante su acción antihipertensiva. Por tanto, podemos considerar su efecto como protector ante el daño renal, ya que el riñón es uno de los órganos diana en los pacientes hipertensos y diabéticos. El estudio AMANDHA (Efficacy and Safety Assessment of Manidipine in Type 2 Diabetic Patients with Hypertension and Microalbuminuria Uncontrolled with Renin-Angiotensin System Blockers)35, realizado en diabéticos con hipertensión no controlada y microalbuminuria, compara manidipino y amlodipino. Si bien ambos BCC son igual de efectivos en la reducción de la PCR y la presión arterial, el primero conlleva menos efectos adversos. Además, la reducción de albuminuria y de resistencia a insulina fue significativamente superior en los tratados con manidipino. Un estudio reciente demuestra de nuevo que el manidipino es capaz de reducir la excreción urinaria de albúmina de forma significativa en pacientes con hipertensión esencial, sin causar efectos adversos, por lo que la combinación de manidipino con antagonistas del sistema renina-angiotensina podría ser beneficiosa en estos casos36.
Manidipino y estrés oxidativo
La estructura y función endotelial podría mejorar considerablemente por el efecto de los BCC. Estudios como INSIGHT (International Nifedipine Intervention as a Goal in Hypertension Treatment) o MIDAS (Myocardial Infarction Data Acquisition System) muestran la superioridad de éstos frente a diuréticos tiazídicos en cuanto al menor aumento de la íntima33,37,38.
Los efectos beneficiosos de los bloqueantes de calcio en células del endotelio macrovascular han de ser demostrados y justificados mediante mecanismos que no incluyan a los canales de calcio, ya que estos no se expresan en células endoteliales39,40. Así pues, algunos autores han postulado que la acción de los DHP en este tejido estaban relacionados con su lipofilicidad41.
El estrés oxidativo desempeña un papel fundamental en el desarrollo de la aterosclerosis. Toba et al. señalan un efecto antioxidante y antiinflamatorio del manidipino u otros BCC como el amlodipino, mediado por el aumento de la expresión de la sintetasa de óxido nítrico endotelial (eNOS) y la inhibición de la expresión de la enzima conversora de la angiotensina (ECA), no así por su posible acción sobre la disminución de la presión arterial. En este estudio, se observa cómo manidipino normaliza la disminución tanto del gen como de la proteína de eNOS y, atenúa la sobreexpresión de NAPDH oxidasa, VCAM y MCP-1 en aorta de ratas hipertensas42. Además, manidipino muestra otro efecto beneficioso en aterogénesis, ya que inhibe la expresión de LOX-1, receptor de lipoproteínas de baja densidad inducido por la angiotensina II43.
Sun X et al.44 demuestran recientemente que, tanto en adipocitos maduros diferenciados como en células 3T3-L1 o en co-cultivos de ambos tipos celulares, el calcitriol aumenta la expresión de moléculas inflamatorias como MCP-1, MIF, M-CSF, MIP, IL-644, TNF o CD14. El tratamiento con nifedipino o con dinitrofenol inhibe la acción del calcitriol, por lo que se revela un mecanismo dependiente del calcio y del desacoplamiento mitocondrial. Por tanto, cabría esperar que el bloqueo de canales de calcio con manidipino, al disminuir el nivel de calcio intracelular, mostrará un efecto antioxidativo y antiinflamatorio α.
En nuestros estudios preliminares en células de músculo liso se advierte un incremento del gen de la óxido nítrico sintetasa endotelial (eNOS) tras tratamientos con manidipino. Frente a agresiones diversas, la expresión de eNOS en células tratadas con manidipino permanece prácticamente estable frente al cultivo control. Estos datos podrían sugerir un efecto beneficioso del BCC frente a la disfunción endotelial (figura 2).

Figura 2. La expresión de eNOS en células tratadas con angiotensina II y
manidipino es significativamente superior a la de células tratadas con angiotensina II.
Conclusiones
Los bloqueantes de los canales de calcio tipo T proporcionan un efecto de protección renal, ya que mejoran la microcirculación glomerular debido a su acción vasodilatadora tanto en arteriolas aferentes como eferentes. Manidipino destaca entre este tipo de bloqueantes de los canales de calcio, por su acción antiinflamatoria independiente del sistema renina-angiotensina y por su posible efecto beneficioso frente a la disfunción endotelial.
Referencias Bibliográficas
1. Hayashi K, Wakino S, Sugano N, et al. Ca2 channel subtypes and pharmacology in the kidney. Circ Res 2007;100:342-53. [ Links ]
2. Tiwari S, Zhang Y, Heller J, Abernethy DR, Soldatov NM. Atherosclerosis-related molecular alteration of the human CaV1.2 calcium channel alpha1C subunit. Proc Natl Acad Sci USA 2006;103:17024-9. [ Links ]
3. Bergh JJ, Shao Y, Puente E, Duncan RL, Farach-Carson MC. Osteoblast Ca(2) permeability and voltage-sensitive Ca(2) channel expression is temporally regulated by 1,25-dihydroxyvitamin D(3). Am J Physiol Cell Physiol 2006;290:C822-C31. [ Links ]
4. Tanaka H, Shigenobu K. Pathophysiological significance of T-type Ca2 channels: T-type Ca2 channels and drug development. J Pharmacol Sci 2005;99:214-20. [ Links ]
5. Catterall WA, Striessing J, Terrance P, Snutch P, Perez-Reyes E. International Union of pharmacology. XL. Compedium of Voltage-Gated Ion Channels: Calcium channels. Pharmacol Rev 2003;55:579-81. [ Links ]
6. Cheng X, Liu J, Asuncion-Chin M, et al. A novel Ca(V)1.2 N terminus expressed in smooth muscle cells of resistance size arteries modifies channel regulation by auxiliary subunits. J Biol Chem 2007;282:29211-21. [ Links ]
7. Hayashi K, Wakino S, Homma K, Sugano N, Saruta T. Pathophysiological significance of T-type Ca2 channels: role of T-type Ca2 channels in renal microcirculation. J Pharmacol Sci 2005;99:221-7. [ Links ]
8. Abernethy DR, Schwartz JB. Calcium-antagonist drugs. N Engl J Med 1999;341:1447-57. [ Links ]
9. Gojanovic B, Feihl F, Liaudet L, Waeber B. Concomitant calcium entry blockade and inhibition of the renin-angiotensin system: a rational and effective means for treating hypertension. J Renin Angiotensin Aldosterone Syst 2008;9:1-9. [ Links ]
10. Hayashi K, Nagahama T, Oka K, Epstein M, Saruta T. Disparate effects of calcium antagonists on renal microcirculation. Hypertens Res 1996;19:31-6. [ Links ]
11. Chobanian AV, Bakris GL, Black HR, et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003;42:1206-52. [ Links ]
12. Bonny A, Lacombe F, Yitemben M, et al. The 2007 ESH/ESC guidelines for the management of arterial hypertension. J Hypertens 2008;26:825-6. [ Links ]
13. Nissen SE, Tuzcu EM, Libby P, et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controlled trial. JAMA 2004;292:2217-25. [ Links ]
14. Fogari R, Derosa G, Zoppi A, et al. Effects of manidipine/delapril versus olmesartan/hydrochlorothiazide combination therapy in elderly hypertensive patients with type 2 diabetes mellitus. Hypertens Res 2008;31:43-50. [ Links ]
15. Ebina T, Kimura K, Umemura S. Calcium antagonists: current and future applications based on new evidence. Calcium channel blockers and JSH 2009. Clin Calcium 2010;20:16-22. [ Links ]
16. Ueshiba H, Miyachi Y. Effects of the long-acting calcium channel blockers, amlodipine, manidipine and cilnidipine on steroid hormones and insulin resistance in hypertensive obese patients. Intern Med 2004;43:561-5. [ Links ]
17. Payeras AC, Sladek K, Lembo G, Alberici M. Antihypertensive efficacy and safety of manidipine versus amlodipine in elderly subjects with isolated systolic hypertension: MAISH study. Clin Drug Invest 2007;27:623-32. [ Links ]
18. Zanchetti A, Omboni S, La Commare P, De Cesaris R, Palatini P. Efficacy, tolerability, and impact on quality of life of long-term treatment with manidipine or amlodipine in patients with essential hypertension. J Cardiovasc Pharmacol 2001;38:642-50. [ Links ]
19. Scheen AJ, Paquot N, Lefebvre PJ. United Kingdom Prospective Diabetes Study (UKPDS): 10 years later. Rev Med Liege 2008;63:624-9. [ Links ]
20. Gore MO, McGuire DK. The 10-year post-trial follow-up of the United Kingdom Prospective Diabetes Study (UKPDS): cardiovascular observations in context. Diab Vasc Dis Res 2009;6:53-5. [ Links ]
21. Martínez Martín FJ. Manidipine in hypertensive patients with metabolic syndrome: the MARIMBA study. Expert Review of Cardiovascular Therapy 2009;7:863-9. [ Links ]
22. Li CJ, Shi ZD. Calcium channel blockers. Clin Ther 2009;31:1652-63. [ Links ]
23. Nakami T, Martinez MFJ. Manidipine prevents hepatic C-reactive protein production and reactive oxygen species generation by down-regulation of the age receptor expression, dependent on PPAR-gamma activation. J Hypertens 2007;25:S119-S20. [ Links ]
24. Sharma AM, Janke J, Gorzelniak K, Engeli S, Luft FC. Angiotensin blockade prevents type 2 diabetes by formation of fat cells. Hypertens 2002;40:609-11. [ Links ]
25. Martínez Martín FJ. Manidipine (but not amlodipine), increases insulin sensitivity and rises plasma adiponectin cocentrations in hypertensive non-diabetic patients with metabolic syndrome and impaired fasting glucose. Diabetologia 2005;48(Suppl 1):A374. [ Links ]
26. Fogari R, Derosa G, Zoppi A, et al. Effect of delapril/manidipine vs olmesartan/ hydrochlorothiazide combination on insulin sensitivity and fibrinogen in obese hypertensive patients. Intern Med 2008;47:361-6. [ Links ]
27. Kohlmann O, Jr., Roca-Cusachs A, Laurent S, et al. Fixed-dose manidipine/delapril versus losartan/hydrochlorothiazide in hypertensive patients with type 2 diabetes and microalbuminuria. Adv Ther 2009;26:313-24. [ Links ]
28. Oshimura H, Nakami T, Javier MF. Manidipine has a marked non-haemodynamic nephroprotective action; Partly dependent on PPAR-gamma activation, and synergistic with angiotensin receptor blockade. J Hypertens 2007;25(Suppl):S8. [ Links ]
29. Buset Ríos N, Rodríguez Esparragón F, Rodríguez Pérez J. Cardio-metabolic properties of manidipine: beyond lowering arterial pressure?. Nefrologia 2009;29(3):203-7. [ Links ]
30. Meldolesi J. Inhibition of adipogenesis: a new job for the ER Ca2 pool. J Cell Biol 2008;182:11-3. [ Links ]
31. Szabo E, Qiu Y, Baksh S, Michalak M, Opas M. Calreticulin inhibits commitment to adipocyte differentiation. J Cell Biol 2008;182:103-16. [ Links ]
32. Bakris GL, Williams M, Dworkin L, et al. Preserving renal function in adults with hypertension and diabetes: a consensus approach. National Kidney Foundation Hypertension and Diabetes Executive Committees Working Group. Am J Kidney Dis 2000;36:646-61. [ Links ]
33. Segura J, García-Donaire JA, Ruilope LM. Calcium channel blockers and renal protection: insights from the latest clinical trials. J Am Soc Nephrol 2005;16 (Suppl 1):S64-S6. [ Links ]
34. Sabbatini M, Leonardi A, Testa R, Vitaioli L, Amenta F. Effect of calcium antagonists on glomerular arterioles in spontaneously hypertensive rats. Hypertension 2000;35:775-9. [ Links ]
35. Martínez-Martín FJ, Saiz-Satjes M. Add-on manidipine versus amlodipine in diabetic patients with hypertension and microalbuminuria: the AMANDHA study. Expert Review Cardiovascular Therapy 2008;6:1347-55. [ Links ]
36. Galceran J, Plana J, Felip A, et al. Manidipine treatment in patients with albuminuria not sufficiently reduced with renin-angiotensin system blockers. Expert Review Cardiovascular Therapy 2010;8:751-7. [ Links ]
37. Rosenthal T. Role of calcium channel blockers in the future, in view of the INSIGHT Study. Kidney Int 2002;82(Suppl):S32-S5. [ Links ]
38. Borhani NO, Mercuri M, Borhani PA, et al. Final outcome results of the Multicenter Isradipine Diuretic Atherosclerosis Study (MIDAS). A randomized controlled trial. JAMA 1996;276:785-91. [ Links ]
39. Simon A, Levenson J. Effects of calcium channel blockers on atherosclerosis: new insights. Acta Cardiol 2002;57:249-55. [ Links ]
40. Adams DJ, Barakeh J, Laskey R, Van Breemen C. Ion channels and regulation of intracellular calcium in vascular endothelial cells. FASEB J 1989;3:2389-400. [ Links ]
41. Berkels R, Breitenbach T, Bartels H, et al. Different antioxidative potencies of dihydropyridine calcium channel modulators in various models. Vasc Pharmacol 2005;42:145-52. [ Links ]
42. Toba H, Nakagawa Y, Miki S, et al. Calcium channel blockades exhibit anti-inflammatory and antioxidative effects by augmentation of endothelial nitric oxide synthase and the inhibition of angiotensin converting enzyme in the N(G)-nitro-L-arginine methyl ester-induced hypertensive rat aorta: vasoprotective effects beyond the blood pressure-lowering effects of amlodipine and manidipine. Hypertens Res 2005;28:689-700. [ Links ]
43. Toba H, Shimizu T, Miki S, et al. Calcium [corrected] channel blockers reduce angiotensin II-induced superoxide generation and inhibit lectin-like oxidized low-density lipoprotein receptor-1 expression in endothelial cells. Hypertens Res 2006;29:105-16. [ Links ]
44. Sun X, Zemel MB. Calcitriol and calcium regulate cytokine production and adipocyte-macrophage cross-talk. J Nutr Biochem 2008;19:392-9. [ Links ]
45. Costa S, Zimetti F, Pedrelli M, Cremonesi G, Bernini F. Manidipine reduces pro-inflammatory cytokines secretion in human endothelial cells and macrophages. Pharmacol Res 2010;62:265-70. [ Links ]
46. Moosmang S, Haider N, Bruderl B, Welling A, Hofmann F. Antihypertensive effects of the putative T-type calcium channel antagonist mibefradil are mediated by the L-type calcium channel Cav1.2. Circ Res 2006;98:105-10. [ Links ]
47. Peltz A, Sherwani SI, Kotha SR, et al. Calcium and calmodulin regulate mercury-induced phospholipase D activation in vascular endothelial cells. Int J Toxicol 2009;28:190-206. [ Links ]
48. Martínez Martín FJ. Calcium channel-blockers for managing metabolic syndrome-associated hypertension. Trials with manidipine. Nefrologia 2007;27 (Suppl 6):26-35. [ Links ]
49. Patel RJ, Patel PD, Patel MM, Patel NJ, Thyagarajan B. Mechanisms of potentiation of Angiotensin II-induced contractile response of isolated rat aorta by hydrogen peroxide and tert-butyryl hydroperoxide. Indian J Pharmacol 2009;41:140-3. [ Links ]
50. Nakano N, Ishimitsu T, Takahashi T, et al. Effects of efonidipine, an L- and T-type calcium channel blocker, on the renin-angiotensin-aldosterone system in chronic hemodialysis patients. Int Heart J 2010;51:188-92. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Carlos Rodríguez Pérez,
Servicio de Nefrología y Unidad de Investigación,
Hospital Universitario de Gran Canaria Dr. Negrín,
Universidad de Las Palmas de Gran Canaria,
Bco. La Ballena s/n,
35010, Las Palmas de Gran Canaria
E-mail: jrodperd@gobiernodecanarias.org
Enviado a Revisar: 22 Sep. 2010
Aceptado el: 30 Nov. 2010














