Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.33 no.1 Cantabria 2013
https://dx.doi.org/10.3265/Nefrologia.pre2012.Sep.11470
Citomegalovirus y trasplante renal pediátrico: ¿es un problema actualmente?
Cytomegalovirus and paediatric renal transplants: is this a current issue?
Julia Fijo-López-Viota1, Laura Espinosa-Román2, Carlos Herrero-Hernando3, M. José Sanahuja-Ibáñez4, Anna Vila-Santandreu5, Juan M. Praena-Fernández6
1Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Universitario Virgen del Rocío. Sevilla
2Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Universitario La Paz. Madrid
3Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Universitari Vall d'Hebron. Barcelona
4Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Universitario La Fe. Valencia
5Unidad de Nefrología Pediátrica. Servicio de Pediatría. Hospital Maternoinfantil Sant Joan de Déu. Barcelona
6Unidad de Estadística, Metodología y Evaluación de la Investigación. Hospital Universitario Virgen del Rocío. Sevilla
Dirección para correspondencia
RESUMEN
Objetivo: Estudio retrospectivo observacional multicéntrico de los pacientes trasplantados renales pediátricos, para conocer la situación actual frente al citomegalovirus (CMV), antes de participar en un ensayo clínico internacional de profilaxis durante 6 meses.
Material y métodos: Se incluyen 239 pacientes menores de 19 años, procedentes de 5 centros entre 2005-2009, con seguimiento de 1 año.
Resultados: La serología frente al CMV era negativa en 54 % de los receptores y 34,7 % de los donantes. Sesenta pacientes (25,1 %) fueron considerados de alto riesgo [Donante (D)+/Receptor (R)-] para infección por CMV. El 80,8 % realizó algún tipo de profilaxis, incluyendo todos los pacientes de alto riesgo, un tiempo medio de 65,5 días. La incidencia de positivización de CMV fue del 24,26 % (58 pacientes de los 239 trasplantados), con una incidencia de enfermedad del 6,7 %. La infección por CMV se asociaba con el estatus serológico (D/R) (p < 0,001), con la seropositividad del donante (p < 0,001) y con un tiempo de profilaxis < 20 días (p < 0,05). No hubo ningún caso de éxitus o pérdida del injerto secundaria a la infección, ni de resistencia al tratamiento.
Conclusiones: La principal estrategia preventiva frente al CMV en el trasplante renal pediátrico en nuestro país es la quimioprofilaxis (81 %), con una incidencia de CMV del 24 % y de enfermedad del 6,7%, sin graves efectos directos ni indirectos en el primer año postrasplante. Su incidencia está relacionada, fundamentalmente, con el estatus serológico D/R y con la seropositividad del donante.
Palabras clave: Citomegalovirus, Trasplante renal pediátrico.
ABSTRACT
Objective: An observational retrospective multicentre study of kidney transplants in paediatric patients was performed to evaluate the current situation of cytomegalovirus (CMV) in this population, before our participation in an international clinical trial of prophylaxis for 6 months.
Material and method: Our study included 239 patients aged <19 years, from 5 Spanish centres between 2005-2009, with 1 year of follow-up.
Results: Pretransplant CMV serology was negative in 54% of recipients and 34.7% of donors. Sixty patients (25.1%) were considered at high risk (D+/R-) for CMV infection. Prophylaxis was used in 80.8% of recipients, including all high-risk patients, for an average time of 65.5 days. CMV viraemia occurred in 24.26% (58 cases among 239 patients), and disease in 6.7%. CMV infection was associated with serological status (D/R) (P<.001), positive serology of the donor (P<.001) and duration of prophylaxis <20 days (P<.05). There were no cases of patient or graft loss secondary to infection, nor resistance to treatment.
Conclusions: The main preventative strategy against CMV in paediatric renal transplantation in our country is chemical prophylaxis (81%), with an incidence of infection and disease of 24% and 6.7%, respectively. There were no serious direct or indirect effects in the first year post-transplant. The incidence is mainly linked with serological D/R and positive donor status.
Key words: Cytomegalovirus, Paediatric renal transplant.
Introducción y objetivo
El citomegalovirus (CMV) continúa siendo uno de los patógenos oportunistas más importantes por su frecuencia en el trasplantado renal, siendo causa de complicaciones tanto directas (síndrome viral agudo, enfermedad invasiva) como indirectas (infecciones oportunistas, episodios de rechazo, afectación cardiovascular, etc.)1,2. En la actualidad, en pacientes adultos, se usan principalmente dos estrategias para la prevención de su enfermedad: la profilaxis, utilizada los primeros 3-6 meses postrasplante fundamentalmente en los pacientes de alto riesgo (donante+/receptor- [D+/R-]), o el tratamiento anticipado, instaurado de forma precoz tras positivización de la viremia detectada mediante controles periódicos de laboratorio. La prolongación del tratamiento profiláctico a 6 meses parece que disminuye la incidencia de enfermedad de comienzo tardío3, aunque no hay consenso en su utilización por la aparición de posibles resistencias antivirales, toxicidad del medicamento, disminución del cumplimiento y aumento del coste, entre otros motivos.
Aunque tanto los pacientes adultos como pediátricos comparten factores de riesgo similares para el desarrollo de enfermedad por CMV postrasplante, en la población pediátrica aumenta la frecuencia de pacientes de alto riesgo, dada la mayor proporción de parejas de receptores con serología negativa para el CMV con donantes seropositivos y, por tanto, mayor probabilidad de infecciones primarias por el virus4,5. A pesar de ello, los estudios realizados en niños son escasos, aplicándose medidas derivadas generalmente de los realizados en población adulta.
En general, quizás la estrategia más utilizada actualmente en el trasplante renal pediátrico es una mezcla de las dos propuestas en receptores adultos: dar un período relativamente corto de tratamiento profiláctico, seguido de monitorización de la carga viral para realizar, en caso de positivización, tratamiento anticipado5,6. Aunque hay trabajos que recogen una reducción de la enfermedad por CMV a solo un 4 % en una cohorte de receptores pediátricos de trasplante renal, incluyendo una reducción del 50 % en pacientes de alto riesgo, comparados con aquellos que no recibieron profilaxis7, son necesarios ensayos multicéntricos, prospectivos y aleatorizados que resuelvan la estrategia a seguir, la apropiada duración de la profilaxis y/o la monitorización para prevenir la enfermedad en estos pacientes.
Tras proponernos participar en un ensayo de estas características, decidimos recoger previamente la situación de los pacientes pediátricos trasplantados renales en nuestro país, cuál era la proporción de alto riesgo, la incidencia de enfermedad/infección por CMV y la práctica clínica en cuanto a profilaxis/tratamiento anticipado.
Material y métodos
Realizamos un estudio retrospectivo observacional mediante una hoja de recogida de datos extraídos de las historias clínicas y bases de datos de los distintos centros, con las variables mostradas en la tabla 1, y llevado a cabo por 5 de las 7 Unidades de Nefrología Pediátrica donde se realizan prácticamente la totalidad de los trasplantes renales pediátricos españoles, cuya distribución está recogida en la figura 1. La población estudiada fueron todos los pacientes pediátricos trasplantados en esos 5 centros durante 5 años (entre el 1 de enero de 2005 y el 31 de diciembre de 2009). Se recogieron los datos de todos ellos durante el primer año postrasplante. Fueron incluidos en el estudio todos los que superaron 6 meses con injerto funcionante.
Tabla 1. Variables estudiadas 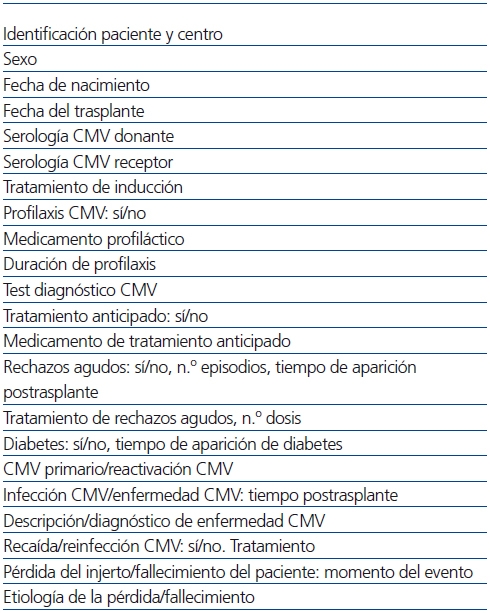
CMV: citomegalovirus.
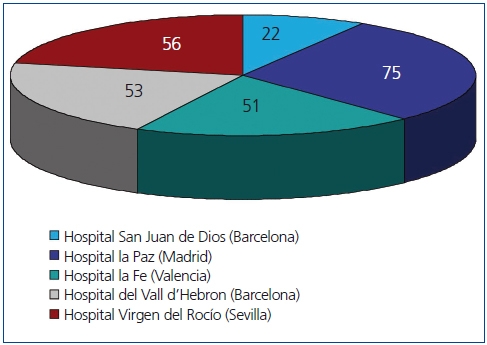
Figura 1. Pacientes incluidos en el estudio por cada hospital.
Definiciones: La infección fue definida como la detección de antigenemia (pp65 CMV en leucocitos) o o reacción en cadena de la polimerasa (PCR)-CMV positiva, considerándose enfermedad cuando a la detección del virus se sumaba síndrome viral (fiebre > 38o no explicada por otras causas, con al menos leucopenia) con o sin sintomatología acompañante de afectación orgánica, precisando tratamiento anti-CMV.
Diferenciamos entre CMV primario, cuando con anterioridad el paciente era serológicamente negativo para CMV, y reactivación de CMV, cuando su serología anterior era positiva, sin diferenciar entre reactivación y reinfección, ya que en ningún caso se estudió la cepa de CMV. Consideramos infección recurrente la nueva detección de CMV al menos 4 semanas después de haberse controlado la primera infección.
Entendemos por quimioprofilaxis el uso de un agente anti-CMV en ausencia de evidencia de infección activa, para prevenir la adquisición de la enfermedad. Denominamos tratamiento anticipado al uso de medicación anti-CMV de forma precoz, en pacientes con replicación asintomática del virus detectada mediante monitorización periódica por PCR o antigenemia. El valor para considerar replicación positiva dependió de la experiencia de cada centro y no fue recogido.
En aquellos pacientes que recibieron profilaxis con valganciclovir, las dosis fueron ajustadas a su superficie corporal y función renal8.
El análisis estadístico se realizó con el paquete IBM SSPS® Statistic, versión 19.0: para la estadística descriptiva de las variables cualitativas del estudio, se utilizaron frecuencias absolutas y relativas y se realizó una comprobación de los grupos de estudio mediante test χ2 o el test exacto de Fischer cuando fue necesario. La variable edad, al no seguir una distribución normal, se resume mediante la mediana [P25-P75] (rango intercuartílico) y se comparó mediante la técnica no paramétrica U-Mann-Whitney. El nivel de significación estadística se estableció en p < 0,05.
Resultados
Se recogieron los datos de 257 pacientes que habían recibido un trasplante renal en el tiempo descrito, sin distinción de donante vivo o cadáver, 160 varones y 97 mujeres, de edades comprendidas entre 6 meses y 19 años.
Posteriormente, fueron excluidos del análisis 18 de ellos:
- Ocho por pérdida precoz del injerto, todos ellos en las primeras 72 horas, debido a trombosis (n = 7) o complicaciones vasculares relacionadas con la intervención quirúrgica (pérdida intraoperatoria por complicación vascular con hemorragia incoercible).
- Los 10 restantes por escaso tiempo de seguimiento. Los motivos fueron: pseudoaneurisma micótico en un paciente que obligó a realizarle trasplantectomía al mes del trasplante; 5 por pérdidas precoces debidas a rechazos (uno por rechazo hiperagudo, uno por rechazo agudo en paciente hiperinmunizado al cuarto día postrasplante, uno por estallido renal a la semana del trasplante por severo rechazo celular y dos por rechazos agudos humorales anticuerpos contra el antígeno A asociado al complejo mayor de histocompatibilidad clase I (anti-MICA) a los 10 y 15 días respectivamente); 3 casos fueron éxitus secundarios a infecciones (uno por shock séptico de etiología no filiada a los 19 días del trasplante, otro ocurrido a los 3 meses por una aspergillosis cerebral y el tercero por un fallo multiorgánico tras infección por adenovirus a los 5,5 meses del trasplante, en un paciente que había recibido un trasplante hepatorrenal); el décimo caso excluido fue por pérdida de seguimiento, a los 5 meses del trasplante, de una paciente extranjera que volvió a su país.
Están incluidos en este trabajo los 239 pacientes restantes, distribuidos por sexo en 147 varones y 92 mujeres, con una mediana de edad de 11,92 años (rango 0,5-19 años) y una desviación típica de 5,3 años.
En 4 de ellos el trasplante fue hepatorrenal.
La situación frente al CMV era la siguiente: 129 receptores (54 %) y 83 donantes (34,7 %) eran seronegativos para el CMV, 110 receptores (46 %) y 122 donantes (51 %) eran seropositivos, siendo la situación de los 34 donantes restantes (14,2 %) desconocida. Al estudiar las parejas D/R, 60 de ellas (25,1 %) fueron consideradas de alto riesgo para infección por CMV al ser D+/R-, no siendo consideradas de riesgo 57 (23,8 %) al ser D-/R- (tabla 2).
Tabla 2. Incidencia de citomegalovirus según seroestatus donante/receptor 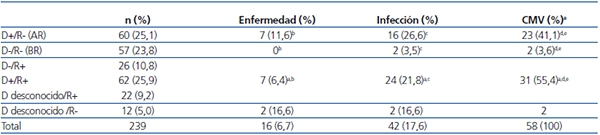
AR: alto riesgo; BR: bajo riesgo; CMV: citomegalovirus; D: donante; R: receptor.
aIncidencia en receptor positivo (riesgo intermedio; n = 110, 46 % del total), independiente del estatus del donante;
bp < 0,05; cp < 0,01; dp < 0,001; ePorcentajes calculados sobre 56 CMV positivos,
excluidas las dos parejas D desc./R-, en las que desconocemos el grado de riesgo.
El manejo del CMV fue diferente en las distintas unidades:
En el 19,2 % de los receptores solo se hizo terapia anticipada, no recibiendo profilaxis anti-CMV. Se realizó profilaxis en el 80,8 % restante (193 receptores) durante un tiempo medio de 65,5 días (rango de 7 a 180 días; desviación típica 50 días). Solo 12 pacientes (5 %) recibieron profilaxis prolongada durante 6 meses. Todos los pacientes considerados de alto riesgo estaban en el grupo que recibieron quimioprofilaxis.
Tras finalizar esta, se continuó con terapia anticipada también en estos pacientes durante los primeros 6 meses postrasplante.
El fármaco más utilizado fue el ganciclovir por vía intravenosa (i.v.), en el 66,3 % de los trasplantados que recibieron profilaxis (n = 128), siendo el único tratamiento (durante un tiempo medio de diez días) en el 36,8 % (n = 71) de estos pacientes; le sigue en frecuencia el valganciclovir oral (en 57,5 % de los pacientes [n = 111], en 28 % [n = 54] de los que recibieron profilaxis como única medicación y en el 29,5 % restante tras tratamiento con ganciclovir i.v.) (figura 2). En un 5,7 % de los casos (n = 11), la profilaxis se realizó con gammaglobulina i.v. durante 10 días, seguida de aciclovir oral durante 80 días más.
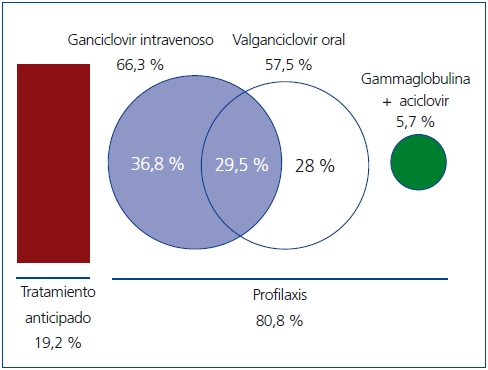
Figura 2. Esquema del tratamiento preventivo utilizado.
El tratamiento inmunosupresor de inducción utilizado fue con antiCD-25 en el 75,3 % de los casos (n = 180), un 23,8 % (n = 57) recibieron timoglobulina y en 1 caso (0,4 %) se utilizó anticuerpos monoclonales dirigidos contra el complejo CD·3 de los linfocitos maduros (OKT-3). Así, realizaron cuádruple terapia la mayoría de los pacientes (98,3 %), con un anticalcineurínico (hasta en el 96 % tacrolimus, n = 230, y en un 4 % ciclosporina), micofenolato mofetilo (100 % de los pacientes) y prednisona (en el 98,7 %). No encontramos relación significativa de ninguno de estos tratamientos con la incidencia de CMV.
El diagnóstico de CMV se realizó mediante antigenemias en el 34,3 % de los casos y PCR en el 36 %, no estando el método recogido en el 29,7 % restante. Su periodicidad fue con una media de 15 días los 2 primeros meses postrasplante, una media de cada 3 semanas durante el tercer y cuarto mes postrasplante y después mensualmente.
Infección y enfermedad por citomegalovirus
El CMV fue positivo en algún momento de la evolución del paciente en 58 casos (24,26 %), siendo el diagnóstico de infección en 42 de ellos y de enfermedad en los 16 restantes (incidencia del 6,7 %). El tiempo medio de positivización de CMV postrasplante fue de 92,5 días, con un rango de 20 a 310 días (desviación típica de 73,6), siempre una vez finalizada la profilaxis.
- En 27 pacientes fue una infección primaria por CMV, siendo 23 de ellos (85,2 %) de alto riesgo (D+/R-), 2 D-/R- y los 2 restantes D desconocido/R-; esta relación fue estadísticamente significativa (p < 0,001) (tabla 2). Todos ellos habían recibido profilaxis para CMV: 14 con ganciclovir i.v. una media de 13 días (10 a 14 días), con positivización del CMV a los 65 días de media postrasplante; 5 habían realizado profilaxis con valganciclovir oral una media de 130 días (rango de 90 a 180 días), con positivización del CMV a los 169 días postrasplante de media; 6 con ambos: ganciclovir i.v. seguido de valganciclovir oral hasta completar 100 días, y los dos últimos con gammaglobulina específica 10 días seguida de aciclovir oral hasta completar 80 días.
- De los 31 pacientes restantes en los que se consideró reactivación, 21 habían realizado algún tipo de profilaxis: 12 de ellos con ganciclovir i.v. durante 10 días, 8 con valganciclovir oral una media de 72 días (rango de 14 a 90 días) y uno con gammablobulina específica (10 dosis) seguida de aciclovir hasta completar 2 meses.
- De los 16 pacientes que tuvieron una enfermedad por CMV, 13 habían realizado profilaxis, 6 de ellos un tiempo menor a 20 días con ganciclovir i.v., 6 con valganciclovir oral durante 100 días y 1 con gammaglobulina 10 días seguida de aciclovir hasta completar 60 días. Los 3 restantes recibieron terapia anticipada. En 9 fue una infección primaria, considerándose reinfección en los 7 restantes. En cuanto a la sintomatología, 7 presentaron un síndrome viral, 2 una probable enfermedad digestiva y en los 7 restantes no fue recogida. Cuatro de los pacientes con enfermedad habían requerido un aumento de la inmunosupresión previo a esta: 3 de ellos por episodio de rechazo agudo (2 recibieron 3 bolos de esteroides y 1 bolo de esteroides más timoglobulina) y el cuarto paciente por recidiva de vasculitis postrasplante (bolos de esteroides y ciclofosfamida). Otros 2 de los pacientes con enfermedad habían sido diagnosticados de diabetes de novo postrasplante previa a la aparición de esta. No encontramos significación estadística entre el rechazo y la enfermedad por CMV (p = 0,15), ni entre diabetes y enfermedad (p = 0,085).
Todos los casos de enfermedad por CMV fueron tratados con ganciclovir i.v. con buena evolución.
- Tuvieron una infección recurrente 6 pacientes: 5 de ellos habían realizado profilaxis con ganciclovir i.v. menos de 20 días, y el restante, tratamiento preventivo. Ninguno había tenido episodios de rechazo, diabetes ni intensificación de la inmunosupresión por otra causa.
- No encontramos relación significativa entre haber recibido o no profilaxis con la aparición de CMV (p = 0,656), ni con la enfermedad por CMV (p = 0,95), pero sí cuando el tiempo de profilaxis era menor a 20 días postrasplante (p < 0,05) o la profilaxis utilizada había sido solo ganciclovir i.v. (p < 0,05).
Rechazos agudos/diabetes
Treinta y dos pacientes (13,4 % del total) tuvieron al menos un episodio de rechazo agudo, y seis de ellos sufrieron un segundo episodio. Once de ellos (34,3 %) presentaron, además, infección o enfermedad por CMV: en cuatro de ellos el CMV fue previo al rechazo (3 de alto riesgo D+/R- y el restante D+/R+) y en los siete restantes la aparición del CMV fue posterior a este. Estos últimos habían recibido tratamiento antirrechazo: cuatro de ellos, 3 bolos de esteroides; uno, 7 dosis de timoglobulina, y dos, ambos tratamientos de forma sucesiva.
Nueve pacientes fueron diagnosticados de diabetes de novo postrasplante durante ese primer año de seguimiento; el diagnóstico se hizo a los 34,3 días de media desde la intervención. Cuatro de ellos tuvieron una positivización del CMV, todos ellos posterior a la aparición de la diabetes.
Tampoco encontramos relación significativa entre los receptores que presentaron rechazo agudo y los que no y la infección por CMV, así como tampoco con la utilización o no de timoglobulina, ni con la aparición o no de diabetes.
No se recogió ningún caso de resistencia, de enfermedad linfoproliferativa, ni hubo ninguna pérdida de injerto relacionada con infección por CMV.
Discusión
Consideramos de gran valor el alto número de pacientes pediátricos presentado en este trabajo comparado con otras series, ya que en los últimos años ni siquiera los datos procedentes del North American Pediatric Renal Trials and Collaborative Studies (NAPRTCS)9 especifican su incidencia de CMV, y el artículo sobre la profilaxis del CMV en el que se han basado después muchos otros, procedente de este grupo, data ya de 1997, y se realizó solo en pacientes hospitalizados10. Además, el trabajo que aquí presentamos refleja fielmente la situación de estos pacientes en España al basarse en los resultados de 5 Unidades de Nefrología Pediátrica, de las 7 con actividad en trasplante renal infantil, que realizan casi su totalidad. No obstante, reconocemos que pierde algo de su validez al ser un estudio retrospectivo, realizado sobre una recogida de datos que ha tenido lugar en diferentes centros y con unas actitudes diferentes frente al tema de estudio, el CMV.
En los escasos estudios realizados en la población pediátrica recogidos en la literatura en los últimos años, el número de receptores con serología negativa para CMV en el momento del trasplante varía entre valores en torno al 55 %11,12 hasta valores tan altos como el 87 %13. En nuestra serie el 54 % de los pacientes eran CMV negativos. Estos porcentajes en pacientes pediátricos, como era de esperar, son mucho mayores que los recogidos en las series de adultos: entre el 11 %14 y el 29 %15.
En cuanto a la prevalencia de receptores de alto riesgo (D+/R-), 26 % en nuestra serie, es ligeramente inferior a la de otras series pediátricas, en las que oscilan entre 27,2 %11 y 42 %13, estando por el contrario en un término medio el número de receptores de bajo riesgo (D-/R-), 24 % en nuestra serie, comparados con los recogidos en otras que oscilan entre el 12 %10 y el 45 %11.
El valor umbral de antigenemia o ADNemia para considerar la existencia de infección por CMV e iniciar tratamiento preventivo no fue recogido, dada la no superponibilidad de los resultados obtenidos en los distintos centros según el método utilizado para el diagnóstico, como ya es conocido16,17. La periodicidad de las determinaciones, aunque realizadas según los protocolos de cada Unidad, fue bastante similar en todas ellas, con las medias antes recogidas. No es difícil realizar este seguimiento en los pacientes pediátricos, que, por protocolo, son controlados de forma frecuente y en el mismo centro donde se realiza el trasplante.
Tampoco diferenciamos, en los casos con serología para CMV positiva previa al trasplante, si las detecciones de CMV fueron reinfecciones o reactivaciones, ya que no se estudiaron las cepas del virus.
La incidencia de infección/enfermedad por CMV en nuestros pacientes durante el primer año postrasplante fue del 24,26 % (58 casos entre los 239 trasplantes estudiados), cifra situada en el rango inferior de la incidencia comunicada por otros grupos pediátricos (tabla 3)11-13,18,19. Es difícil sacar conclusiones sobre qué factores influyen en esta incidencia, dada la diversidad de pautas utilizadas en los pacientes pediátricos al enfrentarnos con el CMV, no solo entre los distintos trabajos publicados, sino, en un mismo estudio, entre unos pacientes y otros. Así, baja a valores del 13 % en pequeñas cohortes de pacientes pediátricos, excluidos los de bajo riesgo, utilizando profilaxis en todos ellos18. En nuestra serie, la baja incidencia de enfermedad por CMV la consideramos debida a que todos los pacientes realizaron o bien profilaxis o bien tratamiento anticipado, incluso este siguió a la quimioprofilaxis al finalizar esta.
Tabla 3. Comparativa con otras series 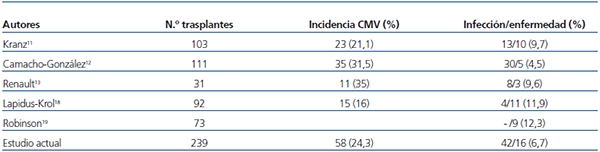
CMV: citomegalovirus.
Está comprobada, tanto en adultos4,14,16 como en población pediátrica11,12 -y de nuevo confirmamos con nuestra serie- la mayor incidencia de CMV en receptores de alto riesgo, así como también está recogido en la literatura el factor de riesgo independiente para la infección por CMV de la seropositividad del donante11,12, que también confirmamos en este trabajo, y que quizás (habrá que revalidar en posteriores estudios) apoyaría el uso de profilaxis en receptores con donante positivo, independientemente de la serología de dicho receptor. Por el contrario, no encontramos relación con la utilización o no de profilaxis, quizás por el alto número de pacientes que la realizaron, excepto cuando el tiempo en que esta se usó fue corto (< 20 días). Esto coincide con la relación significativa encontrada con la profilaxis con ganciclovir i.v. como única medicación y utilizado solo en las dos primeras semanas, con una incidencia de CMV del 35,2 % dentro del grupo de pacientes que realizó profilaxis (p < 0,05). Esta incidencia, mayor que la incidencia general de CMV en el total de la serie, se aproxima al mayor número de CMV (hasta el 52,4 %) reportado en otras series de pacientes con ganciclovir i.v. como única profilaxis20. Esta significación no la consideramos asociada tanto al medicamento utilizado, sino que probablemente guarde mayor relación con la precocidad de la profilaxis y su corta duración. De hecho, ya hay trabajos que apoyan retrasar su inicio hasta después de la segunda semana postrasplante, para permitir el desarrollo de inmunidad específica en el receptor21.
En resumen, el manejo actual de prevención de la enfermedad por CMV en los receptores pediátricos de trasplante renal, bien con tratamiento anticipado o con profilaxis, mantiene nuestra incidencia de dicha infección en valores similares a los de otros grupos pediátricos, sin producir pérdidas de injerto ni enfermedad de gravedad en el primer año postrasplante, aunque resaltando mayor incidencia del virus cuando la profilaxis se realiza menos de 3 semanas. Habrá que valorar si la extensión de dicha profilaxis a 6 meses puede mejorar estos resultados, y su influencia en los efectos indirectos tardíos.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias bibliográficas
1. Pérez-Sola MJ, Castón JJ, Solana R, Rivero A, Torre-Cisneros J. Indirect effects of cytomegalovirus infection in solid organ transplant recipients. Enferm Infecc Microbiol Clin 2008;26(1):38-47. [ Links ]
2. Nebbia G, Emery VC. Assessing the Full Impact of the Indirect Effects of Cytomegalovirus Following Solid Organ Transplantation. Trends in Transplant 2009;3(1):41-52. [ Links ]
3. Humar A, Lebranchu Y, Vincenti F, Blumberg EA, Punch JD, Limaye AP, et al. The efficacy and safety of 200 days valganciclovir cytomegalovirus prophylaxis in high-risk kidney transplant recipients. Am J Transplant 2010;10(5):1228-37. [ Links ]
4. Kotton CN, Kumar D, Caliendo AM, Asberg A, Chou S, Snydman DR, et al.; Transplantation Society International CMV Consensus Group. International consensus guidelines on the management of cytomegalovirus in solid organ transplantation. Transplantation 2010;89(7):779-95. [ Links ]
5. Comoli P, Ginevri F. Monitoring and managing viral infections in pediatric renal transplant recipients. Pediatr Nephrol 2012;27(5):705-17. [ Links ]
6. Martin JM, Danziger-Isakov LA. Cytomegalovirus risk, prevention, and management in pediatric solid organ transplantation. Pediatr Transplant 2011;15(3):229-36. [ Links ]
7. Prestidge C, Lee-Son K, Matsuda-Abedini M, et al. CMV antiviral prophylaxis in renal transplantation. Pediatr Transplant 2011;15:S111. [ Links ]
8. Pescovitz MD. Valganciclovir in pediatric organ transplantation. Pediatric Health 2010;4(2):147-56. [ Links ]
9. NAPRTCS. 2010 Annual Transplant Report. Available at: https://web.emmes.com/study/ped/annlrept/2010_Report.pdf (Accessed: April 15, 2012). [ Links ]
10. Bock GH, Sullivan EK, Miller D, Gimon D, Alexander S, Ellis E, et al. Cytomegalovirus infections following renal transplantation -effects of antiviral prophylaxis: a report of the North American Pediatric Renal Transplant Cooperative Study. Pediatr Nephrol 1997;11:665-71. [ Links ]
11. Kranz B, Vester U, Wingen A-M, Nadalin S, Paul A, Broelsch CE, et al. Acute rejection episodes in pediatric renal transplant recipients with cytomegalovirus infection. Pediatr Transplantation 2008;12:474-8. [ Links ]
12. Camacho-González AF, Gutman J, Hymes LC, Leong T, Hilinski JA. 24 weeks of valganciclovir prophylaxis in children after renal transplantation: a 4-year experience. Transplantation 2011;91(2):245-50. [ Links ]
13. Renoult E, Clermont M-J, Phan V, Buteau C, Alfieri C, Tapiero B. Prevention of CMV disease in pediatric kidney transplant recipients: evaluation of pp67 NASBA-based pre-emptive ganciclovir therapy combined with CMV hyperimmune globulin prophylaxis in high-risk patients. Pediatr Transplant 2008;12(4):420-5. [ Links ]
14. García-Testal A, Olagüe Díaz P, Bonilla Escobar BA, Criado-Álvarez JJ, Sánchez Plumed J. Análisis de infección por citomegalovirus y sus consecuencias en el trasplante renal: revisión de una década. Med Clin (Barc) 2011;137(8):335-9. [ Links ]
15. Kuo H-T, Ye X, Sampaio MS, Reddy P, Bunnapradist S. Cytomegalovirus serostatus pairing and deceased donor kidney transplant outcomes in adult recipients with antiviral prophylaxis. Transplantation 2010;90:1091-8. [ Links ]
16. de la Torre-Cisneros J, Fariñas MC, Castón JJ, Aguado JM, Cantisán S, Carratalá J, et al. GESITRA-SEIMC/REIPI recommendations for the management og cytomegalovirus infection in solid-organ transplant patients. Enferm Infecc Microbiol Clin 2011;29(10):735-58. [ Links ]
17. Pérez JL. Técnicas de monitorización de la infección por citomegalovirus en los trasplantados de órgano sólido. La infección por citomegalovirus en el trasplante de órgano sólido: nuevas evidencias de un patógeno clásico. Enferm Infecc Microbiol Clin 2011;29 Suppl 6:18-23. [ Links ]
18. Lapidus-Krol E, Saphiro R, Amir J, Davidovits M, Steinberg R, Mor E, et al. The efficacy and safety of valganciclovir vs. oral ganciclovir in the prevention of symptomatic CMV infection in children after solid organ transplantation. Pediatr Transplant 2010;14(6):753-60. [ Links ]
19. Robinson LG, Hilinski J, Graham F, Hymes L, Beck-Sague CM, Hsia J, et al. Predictors of cytomegalovirus disease among pediatric transplant recipients within one year of renal transplantation. Pediatr Transplant 2002;6(2):111-8. [ Links ]
20. Melgosa Hijosa M, García Meseguer C, Peña García P, Alonso Melgar A, Espinosa Román L, Peña Carrión A, et al. Preemptive treatment with oral ganciclovir forpediatric renal transplantation. Clin Nephrol 2004;61(4):246-52. [ Links ]
21. San Juan R, Yebra M, Lumbreras C, López-Medrano F, Lizasoain M, Meneu JC, et al. A new strategy of delayed long-term prophylaxis coul prevent cytomegalovirus disease in (D /R-) solid organ transplant recipients. Clin Transplant 2009;23(5):666-71. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Julia Fijo-López-Viota,
Unidad de Nefrología Pediátrica.
Servicio de Pediatría,
Hospital Universitario Virgen del Rocío,
C/Torcuato Luca de Tena s/n,
41013, Sevilla
mj.fijo.sspa@juntadeandalucia.es
juliaflv@hotmail.com
Enviado a Revisar: 16 Abr. 2012
Aceptado el: 17 Sep. 2012














