Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.33 no.5 Cantabria 2013
https://dx.doi.org/10.3265/Nefrologia.pre2013.May.11974
¿Puede un fallo renal agudo complicarse con un síndrome compartimental renal? Visión renovada de una antigua idea
Can acute renal failure be complicated by renal compartment syndrome? A new view of an old idea
Dirección para correspondencia
Sr. Director:
La insuficiencia renal aguda (IRA) es una enfermedad devastadora de alta incidencia, que carece de terapias curativas específicas. A pesar de que las terapias dialíticas son la piedra angular de su tratamiento contemporáneo, no existe evidencia fehaciente de que estas logren revertir el daño renal establecido ni prevenir el desarrollo de una insuficiencia renal crónica. Actualmente, la incidencia de enfermedad renal en etapa terminal secundaria a una IRA es cercana a un 25%, similar a la nefropatía diabética e hipertensiva1.
Prevención secundaria de la insuficiencia renal aguda
El tratamiento de la IRA es definido como preventivo, cuando se introduce previo a un evento potencialmente dañino, o intervencional, cuando la lesión ha ocurrido y ya indujo daño renal. La prevención primaria se refiere a la identificación de sujetos en riesgo. Aquellas intervenciones realizadas entre la identificación de la lesión renal y el desarrollo de una IRA establecida se denominan prevención secundaria (figura 1). De esta forma, la prevención secundaria es una forma de intervención precoz, atenuando o previniendo la progresión de la lesión.
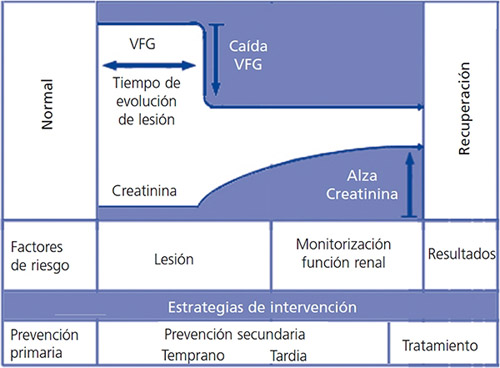
Figura 1. Potenciales opciones terapéuticas según progresión de una lesión renal aguda
VFG: velocidad de flujo glomerular.
En pacientes graves el incremento en la permeabilidad vascular a proteínas y el aumento neto de la presión hidrostática transcapilar favorecen el desarrollo de edema, mecanismo patogénico importante en el desarrollo de disfunciones multiorgánicas en pacientes con sepsis. Teóricamente, el edema tisular y el incremento de la presión hidrostática renal podrían afectar directamente su función. La reducción marcada del flujo sanguíneo corticomedular disminuye en forma importante la tasa de filtración glomerular durante las etapas tempranas de la IRA. La hipoperfusión de la médula externa es común en muchas formas de IRA y puede contribuir a la isquemia tubular, investigándose el uso de vasodilatadores para intentar restablecer el flujo sanguíneo y estabilizar la función renal, aunque sin éxito2,3. Así, aquellas maniobras terapéuticas capaces de aumentar la perfusión renal podrían reducir la isquemia medular y enlentecer la progresión hacia una IRA dependiente de diálisis4.
¿Puede una insuficiencia renal aguda constituir un «síndrome compartimental renal»?
El síndrome compartimental es el resultado final de un proceso iniciado con el aumento persistente de la presión al interior de un tejido o parénquima en una magnitud tal que es capaz de alterar el influjo vascular regional, pudiendo culminar en un fallo orgánico local y, de persistir la noxa, un fallo orgánico múltiple que produciría la muerte del sujeto. Esta afirmación es cierta en cualquier compartimento corporal rodeado de una continente rígido o semirrígido, como el síndrome de hipertensión intracraneal o el síndrome compartimental abdominal. Desde el punto de vista teórico, el «compartimento renal», cuyo contenido y continente son el parénquima y la cápsula renal, respectivamente, no debiera diferir de otros compartimentos corporales, dado que está sujeto a las mismas leyes físicas. Mirado desde una perspectiva hidráulica, el edema súbito que ocurre en un riñón agudamente lesionado podría aumentar la presión intrarrenal de manera exponencial, reduciendo el influjo vascular e induciendo isquemia en la médula externa, zona del parénquima renal de mayor consumo de oxígeno en relación con la masa, fenómeno ampliamente conocido en la IRA5. Esto podría acelerar la progresión de una lesión renal aguda e incluso contribuir a la irreversibilidad total o parcial del daño (figura 2).
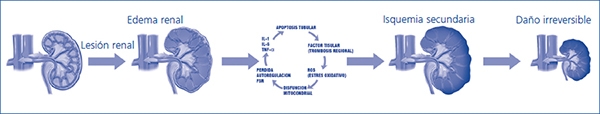
Figura 2. Secuencia hipotética de progresión de una lesión renal aguda hacia un daño irreversible.
FSR: flujo sanguíneo renal; IL: interleucina; ROS: especies reactivas derivadas del oxígeno;
TNF: factor de necrosis tisular.
Decapsulación renal: antecedentes de los últimas tres décadas
La decapsulación de riñones agudamente lesionados se comunicó entre 1901 y 1944 en 2307 pacientes; se logró una recuperación de la función renal en casi el 70% de los pacientes, describiéndose una pobre respuesta en intervenciones tardías, es decir, posteriores al establecimiento de una necrosis parenquimatosa6,7. Tras el progresivo perfeccionamiento de las terapias dialíticas, la decapsulación renal fue abandonada, renovándose su interés con estudios experimentales en estas últimas tres décadas. Estos han comunicado una recuperación más rápida de la función de riñones isquémicos y mejoría en la redistribución del flujo sanguíneo intrarrenal8-10. De este modo, la relativa rigidez de la cápsula renal y la mayor compliancia renal posterior a la decapsulación implican la posibilidad de desarrollo de presión compartimental durante el edema renal, y que la decapsulación libera esta presión, reafirmando la sospecha de un componente hidráulico durante una IRA.
Con base en los antecedentes hasta aquí expuestos, la aplicación de una decapsulación renal, posterior al desarrollo de una lesión renal aguda, podría tener efectos hidráulicos benéficos, mejorando la presión de perfusión renal por disminución de la presión intrarrenal, y de este modo atenuando la isquemia medular externa y evitando la progresión hacia un «síndrome compartimental renal» irreversible, hipótesis no estudiada en profundidad hasta la fecha.
Esto cobra mayor importancia si consideramos el abordaje habitual al parénquima renal durante la procuración de este órgano para trasplante renal, donde la decapsulación no plantearía una mayor dificultad en el proceso. Sin embargo, es perentorio profundizar en el conocimiento de los beneficios, riesgos y potenciales indicaciones de esta intervención.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Camila Salas1, Cassandra Cárcamo2, Pablo Cruces3
1Área de Cuidados Críticos. Hospital Padre Hurtado. Facultad de Medicina Clínica Alemana - Universidad del Desarrollo. Santiago de Chile
2Facultad de Medicina Clínica Alemana - Universidad del Desarrollo. Santiago de Chile,
3Área de Cuidados Críticos. Hospital Padre Hurtado. Centro de Investigación de Medicina Veterinaria.
Escuela de Medicina Veterinaria, Facultad de Ecología y Recursos Naturales. Universidad Andrés Bello. Santiago de Chile.
Referencias Bibliográficas
1. Hsu CY. Linking the population epidemiology of acute renal failure, chronic kidney disease and end-stage renal disease. Curr Opin Nephrol Hypertens 2007;16:221-6. [ Links ]
2. Sutton TA, Fisher CJ, Molitoris BA. Microvascular endothelial injury and dysfunction during ischemic acute renal failure. Kidney Int 2002;62:1539-49. [ Links ]
3. Morelli A, Ricci Z, Bellomo R, Ronco C, Rocco M, Conti G, et al. Prophylactic fenoldopam for renal protection in sepsis: a randomized, double-blind, placebo-controlled pilot trial. Crit Care Med 2005;33:2451-6. [ Links ]
4. Jo SK, Rosner MH, Okusa MD. Pharmacologic treatment of acute kidney injury: why drugs haven't worked and what is on the horizon. Clin J Am Soc Nephrol 2007;2:356-65. [ Links ]
5. Le Dorze M, Legrand M, Payen D, Ince C. The role of the microcirculation in acute kidney injury. Curr Opin Crit Care 2009;15:503-8. [ Links ]
6. Stone HH, Fulenwider JT. Renal decapsulation in the prevention of post-ischemic oliguria. Ann Surg 1977;186:343-55. [ Links ]
7. Khraibi AA, Knox FG. Effect of renal decapsulation on renal interstitial hydrostatic pressure and natriuresis. Am J Physiol 1989;257:R44-8. [ Links ]
8. Hill JL, Nakamura S. Capsulotomy for renal ischemia. Surg Forum 1975;26:321. [ Links ]
9. Stothert JC. Evaluation of decapsulation of the canine kidney on renal function following acute ischemia. J Surg Res 1979;26:560. [ Links ]
10. Stothert JC Jr. Renal blood flow and intrarenal distribution of blood flow after decapsulation in the postischemic kidney. Ann Surg 1980;191:456-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pablo Cruces,
Área de Cuidados Críticos. Hospital Padre Hurtado.
Centro de Investigación de Medicina Veterinaria.
Escuela de Medicina Veterinaria,
Facultad de Ecología y Recursos Naturales.
Universidad Andrés Bello. Santiago de Chile.
Av. República 237, Santiago de Chile
pcrucesr@gmail.com
cami.salas@gmail.com














