Introducción
La aparición de fracaso renal agudo (FRA) es una de las complicaciones más serias en los pacientes hospitalizados. Los pacientes con FRA tienen más riesgo de muerte a corto y largo plazo, un mayor riesgo de desarrollar enfermedad renal crónica y consumen más recursos sanitarios1-9. Aproximadamente, la mitad de los casos de FRA en los pacientes críticos están provocados por la sepsis10,11. Las altas tasas de mortalidad en los pacientes sépticos se deben en gran medida a la aparición de FRA entre 1/3 y 2/3 de los casos, según las series12-15.
Tradicionalmente se han venido utilizando diferentes clasificaciones para definir y estadiar el FRA. En lo últimos años se ha reconocido la necesidad de disponer de definiciones estandarizadas del FRA que pudieran aplicarse de forma práctica en la rutina diaria y para llevar a cabo estudios epidemiológicos y de investigación16. Así, desde 2004 se han propuesto 4 sistemas de definición y estadificación del FRA17-20. Los diversos estudios que han comparado la capacidad predictiva de cada sistema de clasificación del FRA entre sí no han observado ventajas sustanciales en ninguno de los métodos empleados21. El uso del sistema de clasificación basado en la cinética de la creatinina (CK) parece ofrecer algunas ventajas, especialmente en pacientes con enfermedad renal crónica previa22,23. Sin embargo, en los pacientes con sepsis, la síntesis de creatinina está profundamente disminuida24 y, con frecuencia, los pacientes están hemodiluidos, lo que modificaría la utilidad de usar un sistema de clasificación basado en los cambios absolutos en el valor de creatinina. El objetivo de nuestro estudio fue valorar el grado de acuerdo en el diagnóstico y clasificación del FRA y la capacidad predictiva de mortalidad en una cohorte de pacientes con sepsis entre los distintos métodos de clasificación del FRA.
Métodos
Se incluyó de forma prospectiva a todos los pacientes mayores de 18 años ingresados en la Unidad de Cuidados Intensivos (UCI) del Hospital Universitario Marqués de Valdecilla desde abril de 2008 hasta septiembre de 2010 con un cuadro de shock séptico de acuerdo con las definiciones propuestas por la Conferencia de Consenso SCCM/ESICM/ACCP/ATS/SIS, es decir, la presencia de sepsis grave con hipotensión arterial o signos de hipoperfusión tisular persistentes que no responden a la administración intravenosa de 20 ml/kg de fluidos y que precisan la infusión de fármacos vasoactivos25. Se excluyó del estudio a los pacientes con insuficiencia renal en tratamiento sustitutivo renal y a los trasplantados renales.
Se registraron de la historia clínica las variables demográficas y analíticas (leucocitos, lactato, exceso de bases, PCR, procalcitonina), el uso de vasopresores y los valores de clasificación de los pacientes mediante APACHE-II y SOFA calculados al ingreso en la UCI. El valor de creatinina plasmática se determinó diariamente durante la estancia del paciente en la UCI. Se consideró como creatinina basal el último valor de creatinina disponible entre los días 7-365 antes del ingreso26,27. En un 4% de los pacientes en los que no se disponía de valores previos en dicho periodo se consideró como creatinina basal la calculada para un filtrado glomerular de 75 ml/min/1,73 m2 estimado mediante la ecuación MDRD-4, siguiendo la recomendación del grupo ADQI28. Los pacientes se clasificaron de forma retrospectiva según las clasificaciones RIFLE, AKIN, KDIGO y CK de acuerdo con las definiciones previamente propuestas20,26.
Las variables continuas se expresaron como media±desviación estándar y las variables cualitativas por su valor absoluto o como porcentaje. La comparación de las proporciones se realizó mediante la prueba de Chi-cuadrado. El grado de acuerdo para clasificar a los pacientes por estadios entre las distintas clasificaciones se estimó mediante el índice kappa de Cohen ponderado. La capacidad de discriminación del riesgo de mortalidad intrahospitalaria para cada clasificación se midió mediante el área bajo la curva ROC (AUC-ROC). Se efectuó un análisis de regresión logística para estimar el riesgo de muerte en el hospital de acuerdo con cada método de clasificación del FRA, sin ajustar y ajustado, para APACHE-II y SOFA.
Resultados
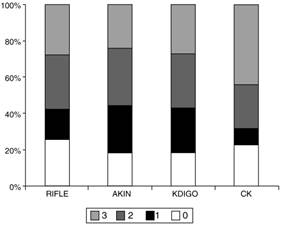
Las características principales de los pacientes se describen en la tabla 1. El porcentaje de pacientes que desarrolló FRA según cada clasificación fue: 74,3% RIFLE; 81,7% AKIN; 81,7% KDIGO y 77,5% CK. El número de pacientes incluidos en cada estadio según las distintas clasificaciones está reflejado en la tabla 2 y en la figura 1. El grado de acuerdo entre RIFLE y AKIN fue 95,7% (índice kappa 0,895; p < 0,001), entre RIFLE y KDIGO 97,1% (índice kappa 0,929; p < 0,001), entre RIFLE y CK 85,4% (índice kappa 0,666; p < 0,001), entre AKIN y KDIGO 98,3% (índice kappa 0,956; p < 0,001), entre AKIN y CK 85,7% (índice kappa 0,664; p < 0,001) y entre KDIGO y CK 85,5% (índice kappa 0,658; p < 0,001).
Tabla 1 Características principales de los pacientes
| N = 405 | |
|---|---|
| Edad (años) | 65 ± 16 |
| Sexo (varón) | 68,9% |
| Hipertensión arterial | 47,7% |
| Diabetes mellitus | 18,3% |
| Leucocitos | 15.413 ± 13.093 |
| Lactato | 30,7 ± 24,5 |
| Exceso de bases | −4,3 ± 5,4 |
| Vasopresores | 84,3% |
| APACHE | 20,7 ± 6,8 |
| SOFA | 8,5 ± 2,9 |
| PCR | 20,1 ± 12,4 |
| Procalcitonina | 24,1 ± 38,7 |
| Creatinina basal | 1,02 ± 0,37 |
| Estancia media en UCI | 9,7 ± 23,4 |
| Estancia media hospitalaria | 11,9 ± 26,6 |
Tabla 2 Estadios de fracaso renal agudo según cada clasificación
| n (%) | RIFLE | AKIN | KDIGO | CK |
|---|---|---|---|---|
| 0 | 104 (25,7) | 74 (18,3) | 74 (18,3) | 91 (22,5) |
| 1 | 66 (16,3) | 104 (25,7) | 100 (24,7) | 37 (9,1) |
| 2 | 124 (30,6) | 130 (32,1) | 121 (29,9) | 100 (24,7) |
| 3 | 111 (27,4) | 97 (24,0) | 110 (27,2) | 177 (43,7) |
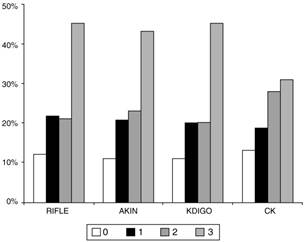
El número de pacientes fallecidos durante la hospitalización fue 101 (24,9%) y a 3 meses 109 (26,9%). El porcentaje de pacientes fallecidos en el hospital fue mayor en cada estadio de FRA en todas las clasificaciones de forma significativa (tabla 3 y figura 2). El AUC-ROC de mortalidad intrahospitalaria para RIFLE 0,673 (IC 95%: 0,612-0,734), AKIN 0,649 (IC 95%: 0,588-0,711), KDIGO 0,667 (IC 95%: 0,606-0,729), CK 0,600 (IC 95%: 0,539-0,661), sin diferencias significativas en la capacidad de discriminación. Ajustado para el sistema de clasificación de severidad APACHE-II, cada estadio de FRA por RIFLE (OR 1,452; 95%CI 1,137-1,854; p = 0,003), por AKIN (OR 1,349; IC 95%: 1,033-1,761; p = 0,028) y por KDIGO (OR 1,452; IC 95%: 1,115-1,892; p = 0,006) se relacionaba de forma independiente con la mortalidad intrahospitalaria. Por el contrario, aunque la clasificación mediante CK se relacionaba con una mayor mortalidad intrahospitalaria en cada estadio (OR 1,421; IC 95%: 1,151-1,755; p = 0,001), esta relación no se mantenía al ajustar por APACHE-II (OR 1,188; IC 95%: 0,941-1,499; p = 0,148). El ajuste mediante SOFA obtuvo resultados similares.
Tabla 3 Porcentaje de fallecimiento intrahospitalario con cada estadio de FRA
| % | RIFLE* | AKIN* | KDIGO* | CK** |
|---|---|---|---|---|
| 0 | 11,7 | 11,0 | 11,0 | 13,3 |
| 1 | 21,5 | 21,4 | 20,4 | 19,4 |
| 2 | 21,3 | 23,4 | 20,0 | 27,6 |
| 3 | 45,0 | 43,2 | 45,4 | 31,4 |
*p < 0,001.
**p = 0,011.
Discusión
En el contexto de la sepsis grave, una mayoría de pacientes desarrollan FRA. Dependiendo de la definición utilizada, entre un 74 y un 82% de la cohorte de pacientes con sepsis en UCI desarrollaron FRA. Las definiciones más sensibles fueron AKIN y KDIGO, mientras que, siguiendo los criterios RIFLE, un menor número de pacientes presentaron FRA. La ausencia de un método de referencia estandarizado impide estimar la precisión diagnóstica de cada clasificación16. En la mayoría de los estudios que comparan RIFLE y AKIN, se encuentra un mayor porcentaje de pacientes con FRA si se utilizan los criterios AKIN tanto en pacientes hospitalizados en general como en pacientes en UCI o cirugía cardiaca16, aunque no se ha confirmado en todos los estudios26,27,29. La definición por CK fue más sensible para diagnosticar FRA en un estudio comparada con RIFLE23, pero menos en otro comparada con KDIGO22. Diferencias en las características de las poblaciones estudiadas, en si se incluye o no la diuresis en la definición de FRA, en la definición de función renal basal y en el número de días de seguimiento de la creatinina pueden hacer variar los porcentajes de pacientes definidos como FRA por cada criterio.
Aunque haya diferencias en los porcentajes de diagnóstico de FRA, en general, el grado de acuerdo entre las definiciones es bueno. En nuestro estudio el grado de acuerdo fue «muy bueno» (kappa > 0,8) entre RIFLE, AKIN y KDIGO y «bueno» (kappa 0,6-0,8) entre CK y las otras clasificaciones. En estudios previos comparando RIFLE y KDIGO el índice kappa siempre fue bueno o muy bueno: variaba desde 0,682 hasta 0,84929-32. En el único estudio previo que analiza el grado de acuerdo entre CK y RIFLE los valores obtenidos fueron similares a lo que reportamos (0,67)23. A pesar del grado de concordancia, es interesante resaltar que, con la clasificación CK, la mayoría de los pacientes con FRA se clasifican dentro del grado máximo de severidad: 3. De forma similar, Liborio et al. detectaron que la mayoría de los pacientes clasificados como estadio 2 por KDIGO pasaban al estadio 3 al utilizar CK22.
En los pacientes con sepsis, la aparición de FRA es muy frecuente y contribuye a incrementar el riesgo de muerte15. El riesgo de FRA se puede reducir, al menos parcialmente, con una resucitación dirigida precoz15, aunque este último punto no se ha verificado en todos los estudios33. El aumento de mortalidad se relaciona no solo con el diagnóstico de FRA sino también con su severidad34. Así, la capacidad de discriminación medida mediante AUC-ROC siempre fue significativa con cada una de las clasificaciones que analizamos y ha sido también demostrada en trabajos previos, con valores mayores en contextos clínicos menos heterogéneos que en la sepsis (AUC-ROC de mortalidad 0,731 para KDIGO y 0,687 para CK tras infarto de miocardio y 0,852 para RIFLE y 0,887 para CK tras cirugía cardiaca)22,23. Ni en estos estudios ni en el nuestro se han observado diferencias significativas entre las distintas definiciones en su capacidad para discriminar el riesgo de muerte22,23.
Un estudio epidemiológico multicéntrico reciente que incluía a 1.802 pacientes en UCI ha demostrado la relación entre la severidad de FRA por cada uno de los estadios de KDIGO y el mayor riesgo de muerte34. La calidad de los estudios previos solo permite tener una evidencia baja-moderada de la relación entre cada estadio de RIFLE y AKIN y el riesgo de muerte21. En nuestra cohorte prospectiva de pacientes con sepsis, las clasificaciones mediante RIFLE, AKIN y KDIGO se relacionaban de forma independiente con el riesgo de muerte intrahospitalaria. La mínima diferencia en mortalidad detectada entre los estadios 1 y 2 con las 3 clasificaciones ha sido previamente reportada utilizando los criterios AKIN16,21.
Por el contrario, los estadios de severidad definidos por CK no se relacionaron de forma independiente con el riesgo de muerte en nuestra población. Solo 2 estudios previos han analizado la relación entre FRA clasificado por CK con el riesgo de muerte. En pacientes con infarto de miocardio el riesgo por cada estadio de CK fue significativo (OR 5,607; IC 95%: 1,915-16,421, ajustado por APACHE-II) y los hallazgos fueron similares en un grupo de pacientes operados de cirugía cardiaca22,23. En modelos experimentales se ha demostrado que la sepsis disminuye la producción de creatinina, lo que puede llevar a que se infraestime el daño renal en la sepsis más que en otras formas de AKI24, especialmente con una clasificación que no hace referencia a un valor basal «normal» previo de creatinina. De forma similar, la hemodilución que presentan los pacientes graves en la UCI puede hacer variar la eficacia de cada clasificación. El modelo de CK descrito por Waikar y Bonventre se basa en una simulación matemática «ideal» que no incluye toda la complejidad que conlleva la sepsis grave20.
Como conclusiones, un porcentaje de pacientes con sepsis grave desarrolla FRA que se puede diagnosticar y clasificar según los distintos métodos propuestos: RIFLE, AKIN, KDIGO y CK. Todos ellos tienen un grado de concordancia bueno o muy bueno entre sí. Utilizando las clasificaciones RIFLE, AKIN y KDIGO, cada estadio de mayor severidad de FRA se relaciona con un mayor riesgo de muerte intrahospitalaria, sin encontrar diferencias significativas entre ellas. Por el contrario, la nueva definición de CK no se relaciona con una mayor mortalidad en nuestra cohorte de pacientes con sepsis grave y no se debería usar en estos pacientes sin confirmar su utilidad en estudios posteriores.