El dializador es el elemento central de la hemodiálisis, donde se producen el intercambio de sustancias entre la sangre y el líquido de diálisis (LD); la ultrafiltración (UF) y la retrofiltración. Desde las primeras diálisis con dializadores tubulares de colodión, trinitrato de celulosa, conocido como dializador de Haas, en 19241, la hemodiálisis y los dializadores han evolucionado enormemente. En esta revisión nos vamos a centrar en los cambios de los dializadores que han aparecido en las dos últimas décadas, que puede que no sean tan evidentes.
Un dializador es más que una membrana, pero está claro que esta es uno de sus componentes fundamentales. Los poros de la membrana de un dializador deben ser de un tamaño determinado, numerosos y uniformes. Esto se consigue con la nanotecnología2. La formación de una capa proteica en la membrana, al ponerse en contacto con la sangre, restringe la eliminación de moléculas, modificando funcionalmente los poros3. De la aplicación de la nanotecnología van a depender varias de las especificaciones que se mencionan a continuación.
El coeficiente de ultrafiltración (CUF) de un dializador es una de las características que más se valoran. El CUF y el diseño del dializador van a condicionar la retrofiltración, que no debe generar ninguna preocupación con un LD ultrapuro4, requisito imprescindible hoy en día. De hecho, es una forma de eliminar moléculas medias y grandes sin tener que recurrir a la hemodiafiltración (HDF). Un CUF alto, mayor de 40 ml/mmHg/h, es un requisito de un dializador moderno.
El coeficiente de cribado (CC) debe ser alto para moléculas medias, sin pérdidas significativas de albúmina. En la hemodiálisis moderna necesitamos marcadores de eliminación de moléculas medias y grandes. El más utilizado es el CC para la β2 microglobulina, que debería ser mayor de 0,6 para el grupo EUDIAL5. En la mayoría de los dializadores modernos es superior a 0,7. El CUF depende del número de poros y del CC para la β2 microglobulina, de su tamaño y uniformidad. Lo anterior debe ser compatible con una mínima eliminación de albúmina, con un CC menor de 0,01. La pérdida de albúmina hay que valorarla al inicio de la sesión y cuando se somete el dializador a presiones transmembrana elevadas, como ocurre en la hemodiafiltración en línea (HDF-OL). En estas condiciones la pérdida de albúmina debería ser menor de 4 g por sesión6.
La distribución del LD debe ser uniforme en el dializador, no debe haber circuitos preferenciales, que eviten el contacto con los capilares. Esto se mejoró incluyendo filamentos intercalados, ondulando las fibras y mediante otros artificios. Actualmente se logra con una densidad de fibras muy alta, superior a 11.000. Con estos dializadores el flujo del LD (Qd) óptimo en hemodiálisis y HDF-OL está entre 400 y 500 ml/min7-9 y no tiene justificación utilizar un Qd de 700 a 1.000 ml/min.
La eliminación de agua y solutos de pequeño peso molecular ha obligado a mantener una cierta hidrofilia en la membrana. Esto en las membranas sintéticas se logra mediante la polivinilpirrolidona (PVP). Este compuesto está en las membranas sintéticas hidrófobas en mayor o menor cantidad y más o menos imbuido en la membrana. Su aparición en el eluido podría estar en relación con las reacciones alérgicas que presentan actualmente algunos pacientes con las membranas sintéticas10,11. El aspecto clínico más evidente de la bioincompatibilidad de los dializadores son las reacciones adversas. Estas reacciones adversas se denominan habitualmente como reacciones de hipersensibilidad tipos A y B. Actualmente creemos que es más útil definirlas por su clínica y causa. Ha habido reacciones por degranulación de los basófilos específica o inespecífica al óxido de etileno (ETO), activación del complemento por el cuprofán y otras membranas celulósicas, reacciones al AN-69 junto con los IECA, entre otras. En los últimos años asistimos a reacciones en algunos pacientes con el uso de membranas sintéticas con PVP, que dejan de aparecer al cambiarlos a dializadores de triacetato de celulosa12,13. En la actualidad contamos con dializadores de triacetato de celulosa asimétrico de alto flujo, con un CUF de 87 ml/mmHg/h y grandes prestaciones en HDF-OL14. Los nuevos dializadores deben solucionar estas interacciones con la sangre, ejemplo de ello ha sido la no esterilización de los dializadores con ETO. También, los materiales de la carcasa del dializador y los necesarios para el ensamblaje pueden desencadenar reacciones adversas o toxicidad. Por último se deberían eliminar otras sustancias tóxicas, como el bisfenol (BPA)15,16.
En los últimos años los dializadores se han ido especializando en función de la técnica de diálisis. Los de alto punto de corte (HCO), poros grandes, para eliminar la mayor cantidad de moléculas como las cadenas ligeras de las inmunoglobulinas en el tratamiento del riñón de mieloma17,18. Recientemente se han desarrollado membranas, de punto de corte medio (MCO) (fig. 1), con capacidad de eliminación de moléculas como las HCO, pero capaces de retener la albúmina (fig. 2)3. Con estos dializadores se puede obtener una depuración de moléculas medias superior que con los dializadores de alta eficacia (high-flux [HF])19.
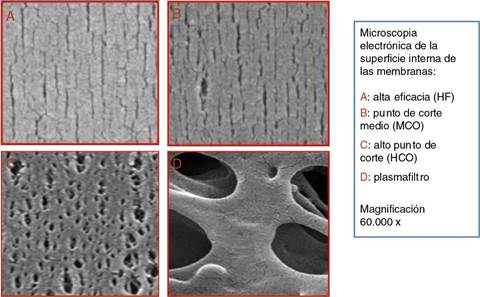
Figura 2 Microfotografía de la cara interna de los 4 tipos de membranas en función del tamaño de los poros: A) alta eficacia (HF); B) punto de corte medio (MCO) (Theranova®); C) alto punto de corte (HCO); D) plasmafiltro. Magnificación 60.000×.
Por otro lado, se han diseñado dializadores para aprovechar la retrofiltración, como forma de depuración por trasporte convectivo interno20, lo que se ha denominado hemodiafiltración interna (HDFi)21. Una de las formas de aumentar la HDFi es aumentar la densidad de los capilares, ≥74%, logrando una HDFi de 3,5 l/h22. Otra forma es disminuir el diámetro interno de los capilares para aumentar las resistencias internas y lograr mayor retrofiltración. En esa disminución por debajo de 200 μm se ha llegado hasta las 180 μ de diámetro, como en el dializador Theranova™. Hay que recordar que el radio interno del capilar figura a la cuarta potencia en la ecuación de Hagen-Poiseuille para calcular la resistencia de la sangre al paso por los capilares. Un dializador largo, estrecho y con un diámetro de los capilares de 185-180 μm va a provocar una caída de presión dentro del capilar muy grande, de alrededor de 200 mmHg para 500 de Qb. Este diseño sería el ideal para un dializador para una hemodiálisis de muy alta eficacia, en inglés de HD-VHF. Estos dializadores no se recomiendan para HDF-OL. En HDF-OL se recomiendan dializadores con un diámetro interno de los capilares igual o mayor de 200 μm. Así la empresa Fresenius (FMC™) creó una línea de dializadores FXclass® específica, como el Fx800®, distinto del Fx80®. En este número de NEFROLOGÍA se publica un estudio en el que el Dr. Maduell et al.23 demuestran unas tasas de reducción de moléculas pequeñas y medianas semejantes en HDF-OL posdilucional con autosustitución® comparando dializadores FX60 vs. FX600 y FX80 vs. FX800. En HDF-OL la eliminación de moléculas medias depende fundamentalmente del volumen ultrafiltrado y del CC de cada molécula. Con los dos tipos de dializadores consiguen una depuración semejante. El trabajo está realizado en condiciones óptimas, Qb 450 ml/min, 283 min de sesión con una media de 32,5 l de UF por sesión. Lo anterior significa una fracción de filtración media del 25,5%, no muy alta, y con un hematocrito medio del 29%. Los dializadores que se recomiendan para HDF-OL posdilucional están diseñados no para lograr más volumen de UF y mayor eliminación de moléculas, sino para evitar las complicaciones propias de la hemoconcentración en situaciones menos favorables y con fracciones de filtración mayores, de alrededor del 30%. Nosotros publicamos un trabajo24 comparando en HDF-OL posdilucional 4 dializadores: FX1000®, FX800®, Polyflux 210H® y Elisio 210H®. Los 3 primeros con un diseño para HDF-OL y el último para HD-HF. La tasa de reducción de la concentración de las moléculas evaluadas fue semejante con los 4 dializadores, así como el volumen ultrafiltrado. La diferencia estuvo en el número de alarmas/problemas que aparecieron en la máquina de diálisis con el Elisio®, lo que se debió a un aumento de la presión predializador superior en más de 100 mmHg respecto a los otros 3 dializadores. En este trabajo los Qb eran menores y 3 pacientes tenían un catéter como acceso vascular. La selección de los dializadores idóneos para HDF-OL ya ha sido abordada25,26. Por tanto, no se pueden extrapolar las conclusiones del trabajo de Maduell et al. en condiciones de diálisis menos óptimas.
También se ha avanzado en la capacidad de adsorción de algunas membranas, como el PMMA, disminuyendo su capacidad de activar las plaquetas y su trombogenicidad27. En otros se ha aprovechado esa capacidad adsortiva para injertar heparina y disminuir la trombogenicidad28. Su asociación a un LD con citrato logra resultados prometedores evitando tener que utilizar anticoagulación en la HD28.
Otros aspectos a tener en cuenta en el dializador son: el volumen en el compartimento sanguíneo, siendo óptimo por debajo <120 ml, para 2 m2 y volumen de sangre residual <1 ml. La superficie del dializador debería estar en función del Qb que se alcanza. La esterilización: el ETO se ha ido desterrando como método de esterilización de los dializadores. El vapor de agua y la radiación gamma son los métodos más frecuentes actualmente. Cuando valoremos los datos de un dializador, debemos comprobar que las pruebas in vitro deben atenerse a especificaciones estándar, como la ISO 8637: 2014.
En la tabla 1 se enumeran las características que nos deben orientar en la elección de un dializador para una técnica de diálisis y un paciente en concreto. Algunas de esas características se pueden considerar como criterios de calidad de un dializador.
Tabla 1 Características de un dializador recomendables para realizar una hemodiálisis o hemodiafiltración actual óptima
| 1. CUF alto, >40 ml/mmHg/h |
| 2. Coeficiente de cribado para la β2 microglobulina >0,7 |
| 3. Coeficiente de cribado <0,01 para la albúmina. En HDF-OL la pérdida de albúmina por sesión debería ser <4 g |
| 4. Alta densidad de empaquetado de los capilares, >11.000, que permita dializar con Qd entre 400 y 500 ml/min con buen rendimiento |
| 5. Altas resistencias internas en hemodiálisis, dializadores largos y con diámetro interno de los capilares <200 μm |
| 6. En HDF-OL posdilucional, si se funciona con Qb limitados, Hto. alto, FF ∼30%, dializadores con >200 μm de diámetro interno de los capilares. Presión prefiltro <700 mmHg |
| 7. Esterilización libre de ETO |
| 8. Buena biocompatibilidad. Recomendable, libre de BPA y otros tóxicos y no reacciones adversas |
Los avances tecnológicos han permitido que los dializadores hayan evolucionado enormemente en los últimos años, consiguiendo que la hemodiálisis sea más eficaz, más eficiente y más segura. Al igual que estamos individualizando la prescripción del LD, la tendencia actual es la de adecuar la elección del dializador a la técnica y a las características del acceso vascular de cada paciente. Se está mejorando y se tiene que mejorar todavía más en la biocompatibilidad de las membranas y dializadores para disminuir el riesgo de efectos adversos.
Los poros funcionalmente se modifican por varios factores, fundamentalmente por el contacto con la sangre y por la presión a la que se somete la membrana.
Puntos clave
Los avances tecnológicos en los dializadores permiten, hoy día, individualizar la elección del dializador a la técnica y a las características del acceso vascular en cada paciente.
De la hemodiálisis de alto flujo (HF) debemos pasar a la hemodiafiltración interna (HDFi). La HDFi no se debe considerar un competidor de la hemodiafiltración en línea (HDF-OL), sería una alternativa para aplicar las ventajas del trasporte convectivo a pacientes no susceptibles de HDF-OL, implicaría menos requerimientos técnicos y un menor coste. Están por demostrar sus beneficios a nivel clínico.
La HDF-OL en situaciones no óptimas y con fracciones de filtración del 30% precisan de dializadores específicos.
Los dializadores actuales deben evitar las reacciones adversas, incluyendo las reacciones de hipersensibilidad y tóxicas. Deben seguir mejorando su biocompatibilidad.
En la HDFi y en la HDF-OL las pérdidas de albúmina deben ser pequeñas, en todo caso con coeficientes de cribado (CC) menores de 0,01 y menores de 4 g por sesión.















