Introducción
Durante años el tratamiento de los tumores de mama avanzados con expresión de receptores hormonales se centró en el bloqueo de la vía de señalización de los receptores de estrógenos1. Recientemente se han desarrollado nuevas terapias endocrinas que han mejorado sus beneficios prolongando la supervivencia2. Sin embargo, algunos casos presentan resistencia a estos fármacos, lo que ha obligado a buscar alternativas o medicamentos potenciadores de su actividad antihormonal. Las quinasas dependientes de ciclinas (CDK) son una familia de quinasas serina-treonina que actúan en la regulación del ciclo celular. La interacción de la ciclina D con CDK4 y CDK6 facilita la hiperfosforilación de la proteína del retinoblastoma (Rb), lo cual lleva a la progresión desde la fase G1 (checkpoint) hacia la fase S del ciclo celular. Alteraciones en este circuito provocan la pérdida de regulación de estos puntos de control y desencadenan el desarrollo de neoplasias o mecanismos de resistencia. Un rasgo de los tumores luminales de mama es la activación del eje CDK4/CDK6/E2F. En parte, los tratamientos hormonales inhiben la actividad de CDK4 y CDK6, por lo que la reactivación de estas quinasas puede estar implicada en la resistencia endocrina3,4.
Palbociclib es una pequeña molécula que actúa inhibiendo a CDK4 y CDK65. En estudios preclínicos se objetiva su capacidad de impedir el crecimiento de las células de cáncer de mama que expresan receptores estrogénicos, potenciando la actividad de los antiestrógenos y revirtiendo la resistencia endocrina3. Esto ha llevado al diseño de múltiples ensayos clínicos englobados en el programa PALOMA (Palbociclib: Ongoing Trials in the Management of Breast Cancer), donde se evalúa la combinación de palbociclib con diferentes terapias hormonales en el contexto del cáncer de mama metastásico, así como en momentos distintos de la enfermedad. Los más relevantes hasta el momento son el PALOMA-1 (fase II con letrozol ± palbociclib en monoterapia en primera línea)6, PALOMA-2 (fase III diseñado para confirmar los resultados del estudio PALOMA-1)7 y PALOMA-3 (fase III con fulvestrant asociado o no a palbociclib en cáncer de mama avanzado, independientemente del status menopáusico y de la línea de tratamiento)8,9. Con esta evidencia ha sido aprobado por la US Food and Drug Administration y la European Medicines Agency en primera línea asociado a inhibidor de aromatasa y en segunda línea asociado a fulvestrant, para tumores de mama localmente avanzados o metastásicos con receptores hormonales positivos y receptor 2 de factor de crecimiento epidérmico humano (HER2) negativo.
El palbociclib se metaboliza en el hígado y se elimina en forma de metabolitos a través de la orina y las heces. En cuanto a su perfil de seguridad, las reacciones adversas más frecuentes (≥ 20%) de cualquier grado notificadas en ensayos clínicos son neutropenia, infecciones, leucopenia, fatiga, náuseas, estomatitis, anemia, diarrea, alopecia y trombocitopenia. Las reacciones adversas de grado ≥ 3 más frecuentes (≥ 2%) son neutropenia, leucopenia, infecciones, anemia, aspartato aminotransferasa elevada, fatiga y alanina aminotransferasa elevada. En los ensayos se produjeron reducciones o modificaciones de la dosis debido a alguna reacción adversa en el 38,4% de los pacientes y una interrupción permanente debido a alguna reacción adversa en el 5,2% de los casos tratados, independientemente de la combinación3, 7,9.
Otros dos inhibidores de CDK4/6 han sido aprobados para el tratamiento de tumores de mama luminal en primera o sucesivas líneas, asociados a hormonoterapia (HT): ribociclib y abemaciclib. Varios metaanálisis confirman su beneficio, sin que se haya demostrado la superioridad de uno u otro10-12. La combinación de terapia hormonal con inhibidores de CDK4/6 incrementa los efectos adversos frente a la monoterapia y la toxicidad grado 3-4 pasa del 20% al 70%. Los efectos secundarios de los tres son cualitativamente similares, pero existen diferencias en su frecuencia y naturaleza. La neutropenia puede darse con cualquiera, pero es limitante de dosis para palbociclib y ribociclib. La fatiga es más frecuente con palbociclib y abemaciclib y la toxicidad digestiva es más intensa con este último. La prolongación del intervalo QTc secundaria a ribociclib obliga a monitorización cardiaca, así como el ascenso de las enzimas de función hepática. Abemaciclib es el único aprobado en monoterapia tras tratamiento hormonal y previo a quimioterapia, y al atravesar la barrera hematoencefálica puede considerarse de elección cuando hay afectación en el sistema nervioso central13. Palbociclib debe tomarse con comidas y abemaciclib no tiene periodos de on/off, lo que puede generar preferencias por los pacientes. Los estudios de coste-efectividad, como el publicado por la Dra. GalveCalvo del Hospital de Basurto, varían de unos países a otros, así como las políticas económicas de las comunidades autónomas, lo cual pone en evidencia las diferencias para el acceso a fármacos oncológicos dentro del territorio nacional e internacional14.
Los objetivos de nuestro estudio son analizar la evolución clínica de las pacientes tratadas con HT y palbociclib en nuestro centro, la toxicidad presentada por la combinación y el manejo realizado en cada caso, así como relacionar la evolución clínica con los rasgos clínico-patológicos de las pacientes.
Métodos
Se recogieron de manera retrospectiva los datos de pacientes con cáncer de mama avanzado o metastásico que iniciaron tratamiento con HT y palbociclib en el Hospital Universitario de Cabueñes entre el 1 de enero de 2017 y el 31 de diciembre de 2019. El seguimiento clínico finalizó el 1 de septiembre de 2020. Para el estudio clínico se seleccionaron, entre los anteriores, aquellos pacientes que cumplían los siguientes criterios de selección:
Se excluyeron del estudio aquellos pacientes que no completaron al menos un ciclo de tratamiento y en los que no fue posible realizar un seguimiento clínico.
Se trata de un estudio observacional en el que no hay intervención por parte del investigador, que se limita a medir las siguientes variables clínico-patológicas: sexo, edad, Eastern Cooperative Oncology Group performance status (ECOG), status menopáusico, número de líneas hormonales previas incluyendo la adyuvancia, quimioterapia previa (incluyendo la adyuvancia), tipo de HT recibida, sensibilidad previa a HT, HT administrada junto a palbociclib, extensión de la enfermedad, toxicidad, tiempo de tratamiento con palbociclib, seguimiento, estado actual de la enfermedad. Para la valoración de la evolución clínica se consideró la supervivencia libre de progresión (SLP), definida como el tiempo transcurrido desde el inicio de palbociclib hasta la progresión de la enfermedad según los Response Evaluation criteria in Solid Tumors (RECIST). El tipo y grado de toxicidad se evaluó según los Common Terminology Criteria for Adverse Events (CTCAE 5.0). También se recogieron datos sobre modificaciones en la pauta de administración de palbociclib (reducciones de dosis o retrasos entre ciclos), así como la suspensión del tratamiento por toxicidad.
Salvo contraindicación por criterios médicos, los pacientes iniciaron con una dosis de palbociclib de 125 mg/24 h, siguiendo un régimen de 21 días de tratamiento con 7 días de descanso, repitiéndose el ciclo cada 28 días. Desde las consultas de Oncología Médica y de Farmacia Oncohematológica se incidió en la importancia de tomar el tratamiento con alimentos y siempre a la misma hora; asimismo, se ofreció información oral y escrita sobre olvidos de dosis, posibles interacciones farmacológicas y manejo de reacciones adversas. De acuerdo con la ficha técnica, se realizaron ajustes de dosis individualizadas según la seguridad y la tolerabilidad. Se continuó el tratamiento con palbociclib hasta la aparición de toxicidad inaceptable o progresión de la enfermedad. Las mujeres pre/perimenopáusicas iniciaron tratamiento con agonistas de hormona liberadora de la hormona luteinizante antes del inicio y durante el tratamiento con la combinación de palbociclib y fulvestrant, de acuerdo con la práctica clínica local.
Todos los resultados de las variables descriptivas y numéricas fueron tratados mediante la plataforma de software IBM SPSS statistics (paquete estadístico en su última versión 26.0). La evaluación de la supervivencia se hizo mediante las curvas de Kaplan-Meier, comparando las distribuciones de supervivencia mediante la prueba del logaritmo del rango log-rank test. El nivel de significación se fijó para una p ≤ 0,05. Se utilizó la base de datos de la National Library of Medicine (http://www.nlm.nih.gob) haciendo la selección de artículos por medio de términos científicos relacionados con cáncer de mama, hormonoterapia e inhibidores de ciclinas. El estudio realizado está aprobado por el Comité de Ética de la Investigación del Principado de Asturias y se ha producido una exención a la obligatoriedad de recogida de consentimiento informado por parte de los pacientes debido a que se trata de un estudio observacional con riesgo nulo para los sujetos, los datos son recogidos de manera retrospectiva y abarca un periodo largo de tiempo, resultando imposible recoger los consentimientos informados de todos los casos del estudio, ya que una parte de ellos han fallecido.
Resultados
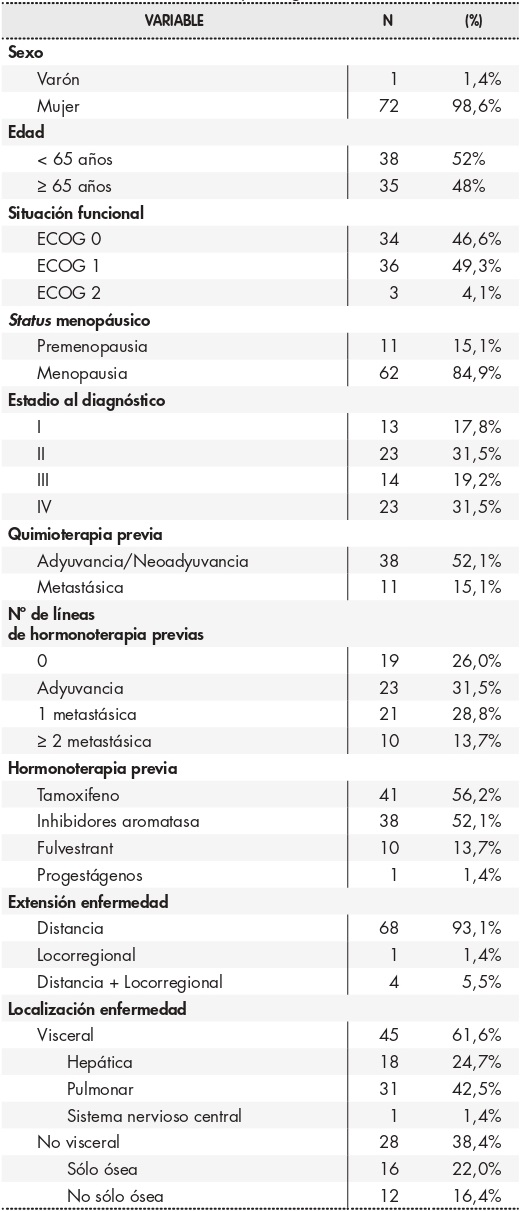
El total de pacientes tratados fueron 73 y los datos clínico-patológicos de la muestra se desglosan detalladamente en latabla 1. En general, se emplearon inhibidores de aromatasa en mujeres sin HT previa y fulvestrant en el resto o si había contraindicación a los anteriores. Prácticamente el doble de pacientes (64,4%) recibieron palbociclib asociado a inhibidor de aromatasa (45 letrozol y 2 exemestano), frente a la combinación con fulvestrant (35,6%). En 42 casos (57,5%) el tratamiento se administró en primera línea (19 de ellos de novo y 23 tras HT adyuvante), y en las 31 restantes (42,5%) se trató de una segunda o sucesivas líneas, incluyendo 10 pacientes (13,7%) para las que el tratamiento con palbociclib supuso al menos una tercera línea.
Tabla 1. Características clínicopatológicas de la muestra.
ECOG: Eastern Cooperative Oncology Group performance status.
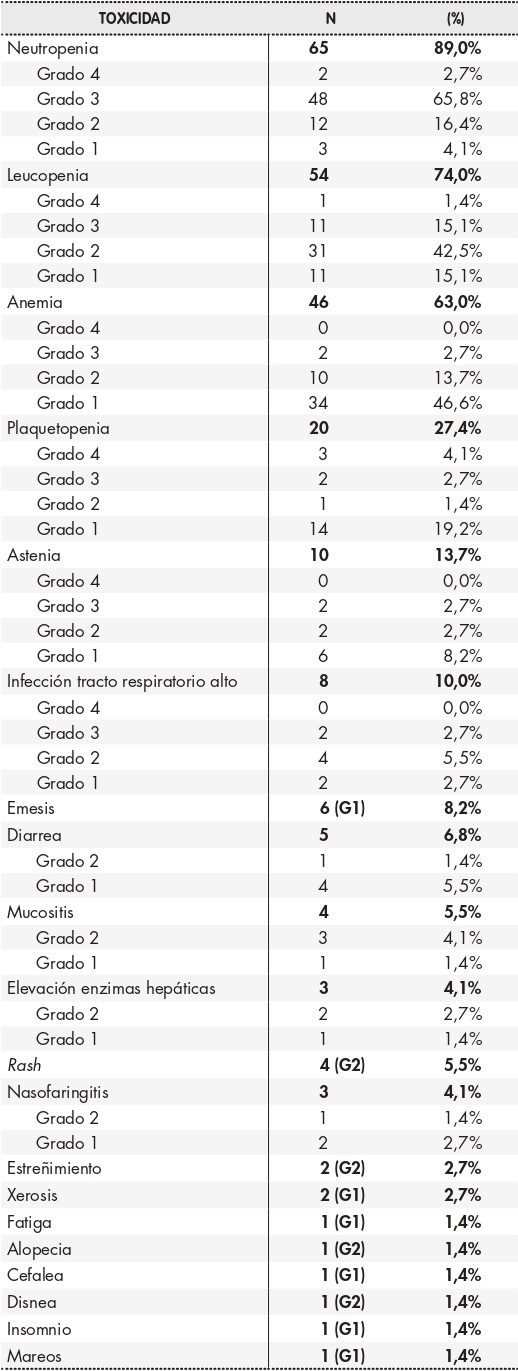
Un total de 70 pacientes (95,9%) presentaron algún tipo de toxicidad durante el tratamiento con palbociclib y HT, de los cuales en 52 casos (71,2%) fue grado 3-4. Los efectos más frecuentes fueron neutropenia (89%), leucopenia (74%), anemia (63%) y plaquetopenia (27,4%). En concreto, la neutropenia fue grado 3 en un 65,8% de los casos y grado 4 en un 2,7%, sin que haya sido necesario el empleo de factores estimulantes de colonias de granulocitos ni se haya documentado ninguna neutropenia febril. El resto de las toxicidades hematológicas fueron en su mayoría grado 1-2. Otros efectos frecuentes atribuibles a la combinación por no encontrarse causas externas que lo justificaran fueron astenia (13,7%), emesis (8,2%), diarrea (6,8%), rash (5,5%), mucositis (5,5%) y elevación de las enzimas hepáticas (4,1%). Existen más síntomas descritos durante el tratamiento y que se detallan en la tabla 2. En 31 pacientes (42,5%) se llevó a cabo reducción de dosis a 100 mg/día, de los cuales 16 (22%) redujeron hasta 75 mg/día durante 21 días. Sólo en una paciente la dosis de inicio fue de 75 mg a causa de sus características clínicas. Se produjo algún tipo de retraso al inicio de ciclo en 45 pacientes (61,7%) y sólo en 2 casos (2,7%) el intervalo entre ciclos fue persistentemente > 7 días. En ningún caso se interrumpió el tratamiento a causa de la toxicidad.
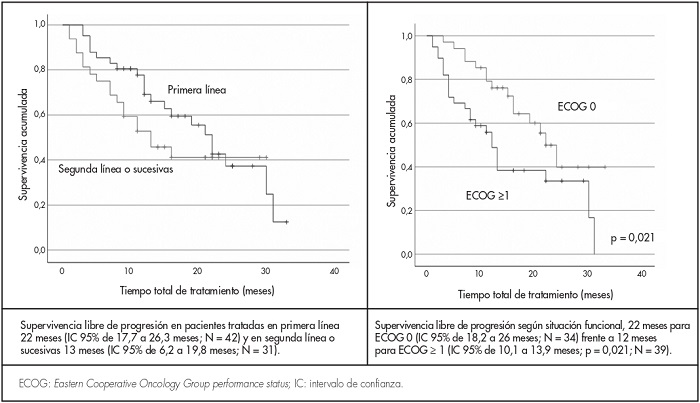
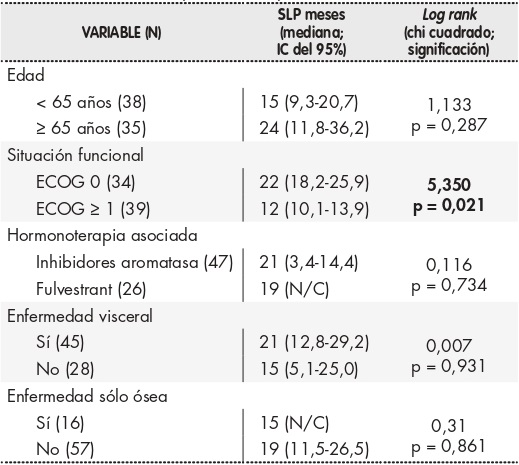
Con una mediana de seguimiento de 17 meses se han producido 21 fallecimientos (28,8%) y 40 pacientes (54,8%) han experimentado progresión de su enfermedad durante el tratamiento con palbociclib. En el momento del cierre del estudio, 52 mujeres (71,2%) seguían vivas y 33 de ellas (45,2%) en tratamiento activo de combinación. La SLP estimada en el grupo que recibió palbociclib más HT como primera línea de tratamiento fue de 22 meses (intervalo de confianza [IC] del 95% de 17,7 a 26,3 meses), mientras que en el que lo hizo en líneas sucesivas resultó de 13 meses (IC 95% de 6,2 a 19,8 meses). De una manera estadísticamente significativa, las pacientes asintomáticas con ECOG 0 tuvieron una mayor SLP estimada de 22 meses (IC 95% de 18,2 a 26 meses), frente a las que presentaban ECOG ≥ 1, con 12 meses de SLP (IC 95% de 10,1 a 13,9 meses; p = 0,021) (Figura 1). Sin embargo, no se encontraron diferencias significativas en la supervivencia según la edad, HT asociada o extensión de la enfermedad (Tabla 3).
Discusión
Nuestra muestra está formada por una población más heterogénea y agrupa tanto tratamientos de primera línea como líneas sucesivas en las que el palbociclib se asocia bien a inhibidores de aromatasa o a fulvestrant. La mediana de edad es ligeramente superior a la de la población del estudio PALOMA-27 y PALOMA-39, lo cual probablemente refleja mejor el perfil de pacientes que manejamos en nuestra práctica diaria, como sucede en el estudio FLATIRON15. El grupo de mujeres premenopáusicas está infrarrepresentado en nuestro estudio frente a otros estudios (PALOMA-3, MONALEESA-7, MONARCH-2)9,16,17. A pesar de todo ello, se mantiene un excelente estado funcional con un 95,9% de casos con ECOG 0-1. En nuestro caso, un porcentaje alto de pacientes habían recibido quimioterapia para la enfermedad localizada, lo que refleja una mayor población de alto riesgo comparado con los estudios PALOMA-2 y PALOMA-3, pero sin embargo el que lo hizo para la enfermedad metastásica fue relativamente menor. La proporción de pacientes tratadas con HT previa es similar a los estudios, igualmente representadas en el estudio PALOMA-3. Casi 2 de cada 3 casos presentaba enfermedad visceral al inicio de tratamiento y llama la atención el alto número de pacientes con afectación pulmonar, superior al de otros estudios donde incluso es más frecuente la afectación hepática (PALOMA-3). Estudios de vida real como FLATIRON, por el contrario, coinciden en estas cifras. No obstante, esto no parece haber influido en la situación funcional al inicio del tratamiento ni en el pronóstico a largo plazo (Tabla 1).
Resulta interesante la alta tasa de toxicidad hematológica presentada, fundamentalmente leucopenia y neutropenia, comparada con la comunicada en los estudios PALOMA-2 y PALOMA-3. Sin embargo, la neutropenia grado 4 es menor y no se ha producido ningún episodio de neutropenia febril. El resto de las toxicidades no hematológicas documentadas han presentado una incidencia menor que en los estudios pivotales (Tabla 2). Sí queda patente que los retrasos en el tratamiento son frecuentes y similares al PALOMA-27 y PALOMA-39, así como los ajustes de dosis, siendo éstos incluso superiores a los de los estudios publicados. A pesar de todo, ello no parece repercutir en la efectividad del tratamiento.
Las pacientes que reciben palbociclib en primera línea en nuestro estudio presentan una SLP de 22 meses, similar a la observada en el estudio PALOMA-2. De las 42 pacientes incluidas en este grupo, solamente 5 recibieron fulvestrant, por lo que es poco probable que este dato condicione de manera significativa los datos de supervivencia. En el estudio MONALEESA-3, que recoge este subgrupo de pacientes, la SLP fue de 20,5 meses18, y en el estudio FLIPPER del grupo GEICAM de Investigación en Cáncer de Mama de 31,8 meses19. Por otro lado, en aquellas mujeres que reciben palbociclib en segunda o sucesivas líneas la SLP resulta de 13 meses, siendo estos datos ligeramente superiores a los obtenidos en segunda línea en el estudio PALOMA-39.
El tipo de tratamiento hormonal empleado con palbociclib no parece haber influido en los resultados de supervivencia, aunque dado que el tamaño muestral es reducido y que estamos ante un estudio observacional retrospectivo, no es posible obtener conclusiones sólidas acerca de la mejor terapia de combinación. Se confirma que la situación funcional al inicio del tratamiento, reflejada en el ECOG, sigue siendo un factor pronóstico de supervivencia, al presentar las pacientes asintomáticas mejores datos de SLP de manera significativa (22 meses ECOG 0 versus 12 meses ECOG ≥ 1). La presencia de enfermedad visceral al inicio del tratamiento no ha condicionado la supervivencia de nuestras pacientes, algo que ya había sido constatado previamente (PALOMA-2, PALOMA-3), al quedar en evidencia que la presencia de metástasis más allá de la afectación ósea o ganglionar no resta beneficio de añadir inhibidores de CDK4/6 a la HT7,9.
Nuestro trabajo tiene importantes limitaciones, como es el número reducido de pacientes frente a otros estudios de vida real publicados15,20. Asimismo, se trata de una muestra heterogénea en cuanto al momento de la enfermedad en el que se emplea palbociclib, por reunir mujeres con tratamiento de novo, primera línea y líneas sucesivas, lo cual condiciona los resultados de supervivencia. El sesgo de selección que implica haber incluido solamente a los pacientes con posibilidad de seguimiento puede condicionar los resultados, así como el hecho de que no se realizara un análisis multivariante de mortalidad ni ajustado por líneas de tratamiento.
Aunque no podemos obtener conclusiones sólidas sobre efectividad, sí al menos nos permite establecer hipótesis en relación con la incorporación de los inhibidores de CDK4/6 al tratamiento de la enfermedad metastásica en el cáncer luminal. El seguimiento de 17 meses permite obtener datos orientativos de supervivencia hasta progresión, y con un mayor seguimiento podremos obtener datos de supervivencia global. Se confirma que aspectos como la edad o la afectación visceral no limitan el empleo de inhibidores de ciclinas en pacientes con tumores de tipo luminal, y que el momento en el que se empleen parece tener más importancia que el tipo de HT con el que se combine. Además, con este estudio se pone de nuevo en evidencia que los efectos secundarios hematológicos son los más frecuentes, pero también que su manejo es fácil y no repercuten en la continuación del tratamiento.
Los resultados de nuestro trabajo, en la línea de otros proyectos colaborativos multicéntricos e internacionales en marcha como The Ibrance Real World Insights (IRIS), ponen en evidencia que palbociclib, asociado a HT para el cáncer de mama luminal avanzado, es un tratamiento efectivo y con un perfil de toxicidad aceptable, que puede administrarse en diferentes momentos de la enfermedad metastásica en un grupo heterogéneo de pacientes.
Aportación a la literatura científica
No existen series publicadas en nuestro país hasta el momento que reúnan características como las de nuestro estudio. La mayoría de los trabajos publicados se realizan en situaciones ideales y bajo las condiciones óptimas. Los estudios basados en datos de vida real permiten generar evidencia postcomercialización acerca de la efectividad y seguridad de los fármacos. Este es el caso de palbociclib, que asociado a hormonoterapia para el cáncer de mama luminal avanzado parece un tratamiento efectivo y con un perfil de toxicidad aceptable, que puede administrarse en diferentes momentos de la enfermedad metastásica en un grupo heterogéneo de pacientes.