INTRODUCCIÓN
Las anomalías de la vena cava inferior (VCI) son el resultado de alteraciones en las diferentes etapas de un complejo proceso embrionario que tiene lugar entre la sexta y octava semana de gestación (1). Su presencia ha sido descrita por los anatomistas desde 1793 cuando Abernethy reportó por primera vez una interrupción de la VCI con continuación ácigos, en un niño de 10 meses con poliesplenia y dextrocardia (2). Se han reportado entre 15 y 60 tipos de variaciones de VCI, sin embargo pocas presentan significativa repercusión clínica (3). Usualmente son diagnosticadas a partir de hallazgos incidentales reportándose una prevalencia de 0,2 a 0,5 % entre la población sana y de hasta 2 % en pacientes con otras alteraciones cardiovasculares (4). La tomografía computada y la resonancia magnética nuclear son los estudios más comunes utilizados en la detección inicial (3,5).
A pesar de ser una entidad poco frecuente, estas anomalías deben ser altamente consideradas. El diagnóstico diferencial prequirúrgico debe tenerse muy en cuenta como génesis de graves complicaciones intraoperatorias relacionadas a la patología toracoabdominal y retroperitoneal reportadas en la literatura (6-9).
Es nuestro objetivo realizar una revisión describiendo la anatomía, embriogénesis, clasificación y diagnóstico de las anomalías de VCI destacando las implicaciones clínico-quirúrgicas relacionadas por su presencia.
ANATOMÍA DEL SISTEMA DE LA VENA CAVA INFERIOR
La vena cava inferior es la vena más larga del cuerpo con un diámetro aproximado de 18-32 mm de diámetro. Es la responsable de la mayoría del retorno venoso de los miembros inferiores y abdomen. Se origina por la confluencia de las venas iliacas primitivas, a nivel del disco intervertebral, entre la cuarta y quinta vértebras lumbares, desembocando en la aurícula derecha. Se encuentra desprovista de válvulas. En su configuración presenta tanto venas parietales como viscerales: venas iliacas, sacra media, lumbares, suprahepáticas, renales, suprarrenal derecha, gonadales (espermática u ovárica) derecha (10).
EMBRIOGÉNESIS
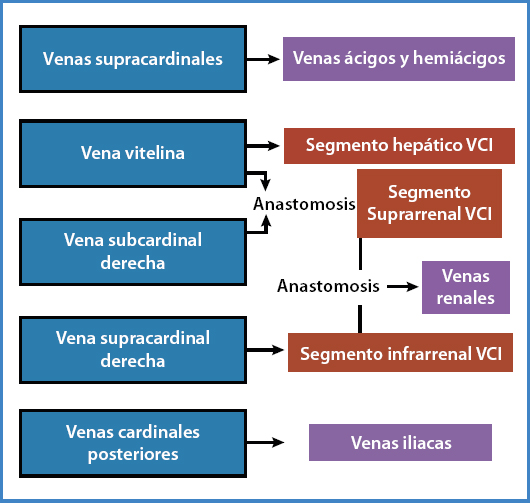
El desarrollo fetal del sistema venoso ocurre entre la sexta y octava semana de gestación como resultado de la continua aparición y regresión de tres pares de venas embrionarias (cardinales posteriores, subcardinales y supracardinales) que constituirán los cuatros segmentos principales de la VCI (11) (Fig. 1):
Un segmento hepático, que derivará de la vena hepática (parte proximal de la vena vitelina derecha) y sinusoides hepáticos.
Un segmento suprarrenal, proveniente de la vena subcardinal derecha y vena vitelina.
Un segmento renal, que derivará de las anastomosis entre las venas subcardinales y la supracardinales.
Un segmento infrarrenal, que se formará de la vena supracardinal derecha.
En la región torácica, las venas supracardinales darán origen a las venas ácigos y hemiácigos, y caudalmente las venas cardinales posteriores persistentes formarán las venas iliacas. Por tanto una anomalía de la VCI se producirá a causa de una anormal regresión o persistencia de estas venas (3,11,12).
CLASIFICACIÓN DE ANOMALÍAS DE LA VENA CAVA INFERIOR
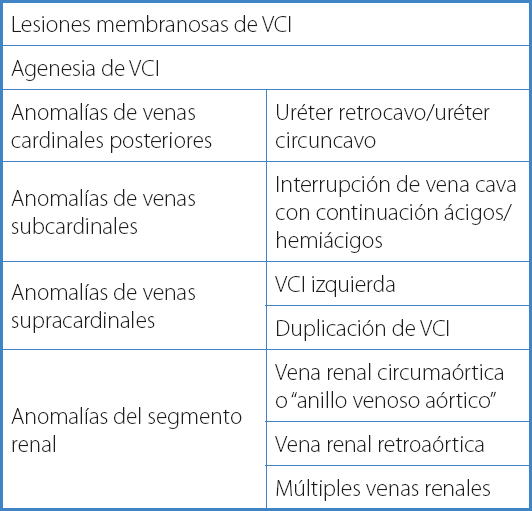
Entre los diversos modelos de clasificación genérica de malformaciones vasculares, el de Hamburgo es uno de los más aceptados e incluye criterios anatómicos, histológicos, fisiopatológicos y hemodinámicos (13). Sin embargo, con referencia a la vena cava inferior, la clasificación propuesta por Huntington y McClure basada en la regresión o persistencia de las venas embrionarias y en el segmento final anormal de la vena cava inferior parece ser la más específica facilitando la comprensión de las diferentes variantes anatómicas (14) (Tabla I).
Lesiones membranosas de la vena cava inferior
Se pueden manifestar de manera focal o segmentaria causando estenosis del segmento afectado. Como consecuencia de su carácter obstructivo pueden generar cuadros de insuficiencia venosa crónica a nivel de miembros inferiores o hipertensión portal (síndrome de Budd-Chiari). Se ha reportado una mayor incidencia epidemiológica entre individuos de origen asiático y africano (15).
Ausencia de vena cava inferior
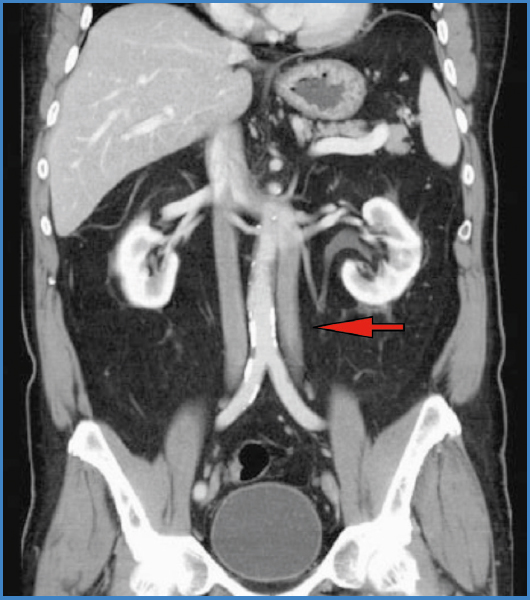
Constituye una malformación poco frecuente (0,07 %) (16) (Fig. 2), pero su presencia representa el 5-9,5 % de las trombosis venosas profundas (TVP) idiopáticas en pacientes menores de 30 años (17). Usualmente está asociada con otras patologías congénitas (18). Su origen aún es controversial. Algunos autores consideran que es resultado de una trombosis perinatal y subsecuente fibrosis, mientras otros consideran una etiología verdaderamente embriológica como consecuencia de un mal desarrollo de la vena supracardinal derecha (19).
Anomalías de las venas cardinales posteriores
Retrocava o uréter circuncavo
Ocurre en 1 % de la población (20). La vena supracardinal anterior falla en su desarrollo mientras que la vena supracardinal posterior persiste. Aunque la mayoría se presenta del lado derecho, también se han reportado casos con afectación del lado izquierdo asociado con situs inversus o compromiso bilateral (21).
Anomalías de las venas subcardinales
Interrupción de vena cava con continuación ácigos/hemiácigos
Su incidencia es del 0,6 % (22). Una falla en la anastomosis entre la vena subcardinal derecha y sinusoides hepáticos asociada a la atrofia de la vena subcardinal derecha son el motivo embriológico de esta anomalía. Consecuentemente, se genera un shunt entre la anastomosis suprasubcardinal a través del sistema ácigos. Este cambio hemodinámico producirá que el retorno venoso renal sea hacia la vena ácigos, la cual desemboca en la vena cava superior (23). Frecuentemente está asociada a otras malformaciones congénitas (24). La mayoría de los pacientes son asintomáticos aunque se han reportado casos de hipertensión en niños o estasis venosa y ulceración en adultos (18,25).
Anomalías de venas supracardinales
Vena cava inferior izquierda
Su prevalencia es del 0,2-0,5 % (3,11). Es el resultado embriológico de la regresión de la vena supracardinal derecha con persistencia de la vena supracardinal izquierda. Anatómicamente, la configuración venosa está invertida: las venas suprarrenales y gonadales izquierdas drenan directamente en la VCI, mientras que los vasos homólogos del lado derecho lo hacen en la vena renal derecha y esta en la VCI de localización izquierda (26). Comúnmente es asintomática y usualmente diagnosticada durante estudios preoperatorios (27).
Duplicación de vena cava
Su prevalencia es del 0,2-3 % (3,11) (Fig. 3). Es causada por la persistencia de ambas venas supracardinales. Se han descrito diversas variantes anatómicas: doble VCI derecha, doble VCI con vena renal derecha retroaórtica, doble VCI con continuación hemiácigos de la vena cava izquierda (28). Comúnmente es asintomática aunque es en una de las anomalías de VCI con mayor riesgo de fenómenos tromboembólicos, lo que justificaría la indicación de estudios flebográficos previos a la colocación de filtros de vena cava en pacientes con trombosis (7).
Anomalías del segmento renal
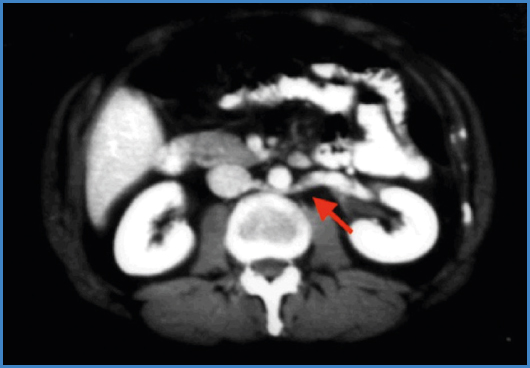
La configuración embriológica normal de la vena renal es producto de la anastomosis de las venas supracardinales por delante de la aorta y la regresión de su anastomosis homóloga por detrás de la aorta (27). La persistencia de ambas anastomosis conlleva a la configuración en “collar o anillo” con la aorta. Esta disposición denominada vena renal circumaórtica (o “anillo venoso aórtico”) es usualmente asintomática y ha reportado una incidencia del 14 % (27). Por otro parte, la regresión de la anastomosis anterior con persistencia de su homóloga posterior daría como resultado la variante retroaórtica (Fig. 4). En este caso, una única vena renal transcurre posterior a la aorta drenando en la VCI o vena iliaca común izquierda a nivel de L4-L5. Se ha reportado una incidencia del 3,4 % (27). La presencia de múltiples venas renales es la anomalía más frecuente de este segmento. Con una incidencia del 9 % en pacientes con hematuria de etiología desconocida (29), frecuentemente se localizan del lado derecho. Sin embargo las mayores complicaciones hemorrágicas se han reportado del lado contralateral (29,30).
DIAGNÓSTICO
Aunque en la mayoría de los casos la presencia de las anomalías de VCI es asintomática y diagnosticada a partir de hallazgos incidentales, las alteraciones hemodinámicas generadas pueden ocasionar una signo-sintomatología variada e inespecífica la cual debería ser diagnosticada y tratada adecuadamente. Fenómenos de reflujo, estasis venosa o compresión de estructuras vasculares pueden contribuir al desarrollo de patologías asociadas concomitantes, principalmente la insuficiencia venosa crónica y TVP, el tromboembolismo pulmonar (TEP) y el síndrome postrombótico (SPT), los síndromes congestivos pélvicos (SCP), o bien los síndromes compresivos (síndrome del cascanueces) (31-34,36).
La prevalencia asociada entre la anormalidad venosa y la trombosis venosa profunda, y el riesgo de tromboembolismo se ha descrito entre un 5 y 9,5 %, reportándose hasta en un 16,2 % en pacientes < 50 años con trombosis iliaca (31,32). Suelen presentarse en forma de episodios trombóticos espontáneos, recurrentes o bilaterales y con resistencia a los anticoagulantes (31). Ocasionalmente, la recurrencia de émbolos después de la colocación de un filtro de vena cava puede ser la primera indicación de la presencia de una duplicación venosa (36,37). Sin embargo, muchos autores no justifican que esta asociación sea lo suficiente como para desencadenar una TVP. La mayoría suelen se asintomáticas de por vida y pueden relacionarse con una multifactorialidad tanto de origen congénito como adquirido (31,32,38). Por lo expuesto, sería razonable considerar la indicación de TAC abdominal o angiorresonancia magnética nuclear como técnica de screening rutinaria en aquellos pacientes jóvenes con TVP o TEP y sin factor de riesgo identificado, aun considerando la posibilidad de combinar la existencia de una malformación venosa y la presencia de una trombofilia hereditaria (déficit de proteína C o S, déficit de antitrombina III, mutación del factor V, síndrome antifosfolipídico, etc.). Si el diagnóstico no es concluyente y la sospecha es alta, podría estar indicada la realización de una cavografía (38).
La ausencia infrarrenal como una anomalía suele cursar de forma asintomática y encontrarse únicamente en los familiares de primer grado una alta prevalencia de arterias renales accesorias sin relevancia clínica (39).
Se han reportado casos de síndrome congestivo pélvico asociados con agenesia y duplicación cava (33). Estas variantes anatómicas son capaces de producir una insuficiencia venosa centrípeta responsable de la dilatación y tortuosidad de las venas de los plexos útero-ováricos e hipogastrios, que es causante de la sintomatología crónica característica. Si bien esta asociación es poco frecuente, muchas veces estas anomalías suelen escaparse al diagnóstico clínico o ecográfico. Una flebografía pélvica (diagnóstica y terapéutica) podría ser esencial con el fin de confirmar o descartar una malformación asociada (33,40).
Las anomalías del segmento renal tales como la vena renal izquierda retroaórtica o circumaórtica son las observadas con mayor frecuencia. Constituyen el factor anatómico más predisponente para el desarrollo de entidades patológicas como el síndrome del cascanueces posterior y/o varicocele (41). La compresión de la vena renal izquierda entre la aorta y la columna vertebral produce un fenómeno de hiperpresión retrógrada que puede manifestarse clínicamente con hipertensión arterial, dolor en flanco o hematuria y es un diagnóstico diferencial con otras patologías urológicas (34,41). Se ha demostrado una significativa asociación entre la presencia de estas anomalías venosas y el desarrollo de varices pélvicas y varicoceles recidivantes (41).
Entre las anomalías de las venas cardinales posteriores, la presencia de un uréter circuncavo ocurre con muy poca frecuencia (1 % de la población general). Como consecuencia del atrapamiento del sector proximal del uréter por detrás del trayecto venoso, el dolor lumbar, la formación de cálculos renales, la hematuria y recurrentes infecciones usualmente pueden manifestarse (20).
Con referencia a su diagnóstico imagenológico, el avance tecnológico y su mayor accesibilidad ha incrementado el hallazgo incidental de estas anomalías. Muchos autores concuerdan que la mejor e inicial modalidad diagnóstica del sector retroperitonal es la angiotomografía computarizada con contraste endovenoso, resolución multiplanar y reconstrucción tridimensional (3,5). Debido a su alta resolución espacial y a su capacidad de análisis, la angiotomografía permite un examen anatómico global del eje vascular que demuestra no solamente las anomalías congénitas del sistema venoso cavo inferior y su diagnóstico diferencial, sino también las alteraciones hemodinámicas asociadas tales como dilatación de venas toracolumbares, abdominales y pélvicas, el desarrollo de colateralidad, la trombosis venosa y otro tipo de compresión vascular (31,41). La resonancia magnética nuclear (RMN) también es de gran utilidad con una excelente e inclusive mayor resolución anatómica. La ventaja de no utilizar radiaciones ionizantes y no producir efectos adversos severos relacionados al material de contraste utilizado (gadolinio) la hace especialmente recomendada en aquellos pacientes pediátricos o con deterioro renal (5,41). Ambos estudios proporcionan una evaluación rápida, precisa y no invasiva de la vena cava y de la vasculatura renal.
Históricamente, la flebografía o cavografía fue el examen diagnóstico por excelencia de las malformaciones vasculares venosas (6,30,40). Sin embargo, actualmente su principal indicación está dada en los casos que pruebas no invasivas sean negativas o no concluyentes y aún persista una sospecha alta en pacientes con antecedentes o clínica sugestiva sin otra causa etiológica identificable. Este estudio, a pesar de su metodología invasiva proporciona una observación y evaluación dinámica de la anatomía del eje venoso abdómino-pélvico, con la ventaja de ser un procedimiento diagnóstico y terapéutico permitiendo en un solo tiempo la resolución de la patología existente.
IMPLICACIONES QUIRÚRGICAS
El hallazgo de las anomalías del sector cavo inferior (la mayoría de las veces incidental) obliga a tener ciertos recaudos. Lesiones iatrogénicas significativas pueden producirse durante procedimientos convencionales o endovasculares (diagnósticos y terapéuticos) del sector abdominal o retroperitoneal con consecuencias desastrosas (6,9).
Primeramente la subestimación y el error diagnóstico deberían ser claves para evitar graves repercusiones en el momento de la toma de una decisión terapéutica. La confusión con linfomas y masas retroperitoneales o mediastínicas es bastante frecuente (43-51). La literatura ha reportado casos de mala interpretación de las anomalías del segmento renal y metástasis o recurrencias retroperitoneales en pacientes con cáncer testicular consecuentemente tratados con quimioterapia en forma innecesaria (44). Otras malas interpretaciones han sido observadas entre las anomalías de las venas ácigos y las disecciones aórticas o neoplasias mediastinales (44,45,47,48). Estos desaciertos diagnósticos o la falta de sospecha previa podrían tener graves implicaciones quirúrgicas. La presencia de una vena cava inferior izquierda o una vena renal retroaórtica no diagnosticada con anterioridad o mal interpretada con otras estructuras, puede complicar la reparación quirúrgica de un aneurisma aórtico o causar dificultad para la colocación de un filtro de cava infrarrenal (6,48). El conocimiento previo de estas anomalías es de gran importancia en la planificación de las cirugías convencionales del sector abdominal y retroperitoneal (reparación de aneurisma aórtico-abdominal, nefrectomías, canulaciones en el bypass cardiopulmonar) o de procedimientos endovasculares (colocación de filtros en vena cava, cateterismos cardiacos, embolización de venas gonadales, cateterización de vena renal) (6,21,43-48).
Las complicaciones intraoperatorias relacionadas con las variantes del segmento renal son las más frecuentes reportadas en la literatura durante una cirugía aórtica y urológica (6-9). Se han publicado casos de grandes hemorragias durante el reparo aneurismático de la aorta abdominal (6,9). Inclusive hallazgos intraoperatorios de anomalías venosas durante cirugías de emergencias también han sido informados (8). En general, el mayor riesgo de lesión es producido durante la disección y clampeo arterial. Brenner y cols. reportaron una serie de 31 pacientes con anomalías de VCI asociadas a patología aneurismática, 22 de ellos implicando el segmento renal (20 = vena renal izquierda retroaórtica, 2 = vena renal circumaórtica) reportando lesiones iatrogénicas en 10 de ellos, 2 nefrectomías e inclusive 2 muertes (6). Considerando estos hechos, la identificación en primer término de la vena renal izquierda y la VCI debería ser crucial. La visualización de una arteria renal izquierda o bien el hallazgo de una vena renal izquierda de pequeño calibre o ausente, debería hacernos sospechar la presencia de alguna malformación vascular. Ante esta situación, el control proximal puede ser bastante problemático con riesgo de presentar lesiones incluso fatales (30). Una disección minuciosa permitirá evitar la posibilidad de trauma.
Algunos autores consideran la presencia de anomalías venosas una contraindicación relativa para la nefrectomía del donante izquierdo debido a una potencial lesión y probable pérdida del injerto (52). Muchas veces la presencia de una vena renal izquierda retroaórtica puede pasar inadvertida hasta la completa disección. Sin embargo, su hallazgo no debería ser un factor limitante para llevar a cabo el trasplante. Incluso recientemente se han publicado casos de trasplante renal de venas renales circumaórticas o retroaórticas utilizando técnicas laparoscópicas con muy buenos resultados (53). En estos casos, el implante del órgano puede realizarse utilizando el tronco común venoso como un “parche tipo Carrel”, sin graves consecuencias (54). Este conocimiento anatómico y diagnóstico previo al trasplante solamente ratifica la importancia de una correcta planificación quirúrgica.
Recientemente, Nishimura y cols. publicaron el caso de un hallazgo de duplicación de vena cava inferior durante una cirugía de emergencia por un aneurisma inflamatorio de aorta abdominal (8). En este grupo de pacientes debe tenerse mucho cuidado durante la disección y posterior aortotomía dado que el proceso inflamatorio y la fibrosis asociada puede lesionar estructuras vasculares no visibles y adheridas a su pared con riesgo de hemorragias importantes.
Por otra parte, casos de pancreatitis posoperatoria con lesiones en las ramas principales circundantes de la aorta abdominal o bien lesiones ureterales por su falta de reconocimiento han sido asociados a la presencia de estas anomalías venosas (50).
Otra cuestión a tener en cuenta es la presencia concomitante con las neoplasias malignas. Se han reportado errores de estadificación tumoral asociados a duplicaciones y venas renales retroaórticas. En estos pacientes, la linfadenectomía radical es recomendada puesto que el drenaje linfático habitualmente es anómalo (48,50,51).
TRATAMIENTO
Las anomalías de VCI suelen permanecer asintomáticas de por vida, sin generar una repercusión clínica significativa o alguna limitación en la calidad de vida del paciente. Sin embargo, muchas de estas malformaciones predisponen a complicaciones venosas futuras que deberán ser tratadas posteriormente. Cambios hemodinámicos sustanciales pueden ser la causal de una mayor predisposición.
La alta prevalencia en personas jóvenes de malformaciones de VCI y episodios recurrentes de TVP es un factor importante a tener en cuenta dada la gravedad de la secuela postrombótica, y riesgo de TEP en estos pacientes. Escasa literatura con poca evidencia científica e incluso discrepancias terapéuticas han sido reportadas sobre el manejo adecuado de la TVP asociada con anomalías de VCI. Algunos autores proponen la anticoagulación de por vida, basándose en el riesgo de recurrencia, mientras que otros consideran que la decisión debería ser individualizada basándose en los factores de riesgo adicionales, el número de eventos de trombosis presentados, o riesgo de sangrado (41,55). La colocación de filtros en vena cava en los casos de duplicación también es recomendado como prevención de embolismo pulmonar en estos pacientes (56).
En los casos de síndromes congestivos pélvicos o compresivos asociados actualmente el tratamiento de elección es de tipo endovascular (40,41).
En los casos de uréteres retrocavos, la terapéutica consiste en el reposicionamiento quirúrgico a su posición anterior (57). Recientemente se han reportado casos solucionados por abordaje laparoscópico (58).
CONCLUSIONES
Las anomalías de VCI son el resultado de alteraciones de un complejo proceso embrionario que involucra partes de tres sistemas venosos.
Aunque estas malformaciones vasculares son poco frecuentes y con escasa o nula repercusión clínica, su conocimiento anatómico y fisiopatológico es de gran importancia teniendo en cuenta las implicaciones quirúrgicas asociadas con su presencia.
La sospecha clínica e imagenológica con un diagnóstico certero previo a cualquier procedimiento endovascular o a cielo abierto que involucre el sector abdominal y retroperitoneal es fundamental para evitar complicaciones mayores. Ante la presencia de estas anomalías venosas, una detallada planificación prequirúrgica y un correcto y minucioso manejo intraoperatorio durante la disección, exposición y reparo de estructuras vasculares relacionadas anatómicamente deberán ser considerados.