INTRODUCCIÓN
Como probablemente todo el mundo conozca, Jean Kunlin realizó en 1948 por primera vez el bypass de vena safena interna invertida para tratar una isquemia arterial del sector femoropoplíteo. Con los años, esta técnica se extendió y se divulgó por el mundo como un método eficaz de revascularización de las extremidades isquémicas. Sin embargo, ya en 1958, Charles Rob de Londres cuestionó las desventajas técnicas y hemodinámicas de la derivación con vena safena cuando se colocaba en una dirección inversa para obviar sus válvulas. Esta controversia estuvo siempre presente durante las décadas siguientes por simple cuestión de rivalidad entre países, escuelas quirúrgicas o protagonismo porque los resultados, como se demostraría en estudios posteriores, son similares siempre que se hagan bien.
Nosotros somos de la escuela quirúrgica del bypass in situ y lo preferimos, esencialmente, cuando se abordan troncos distales tibiales y la arteria peronea o pedia porque no suele generar disparidad de calibres, la vena permanece en su lecho con apenas movilización y, si se realiza con dos equipos simultáneos y entrenados, suele terminarse en tiempos quirúrgicos bastante satisfactorios. Además, se evitan riesgos de torsiones, permite llegar a zonas más distales y queda situado anatómicamente, lo que lo hace más fácil para su seguimiento posterior y control. En caso de que el vaso receptor sea la arteria tibial anterior, será necesaria la tunelización a través de la membrana interósea, lo que se logra rasgando digitalmente con ambas manos esa estructura y pasando luego con una pinza el cabo distal de la vena, evitando rotaciones. Un flush de sangre pulsátil constatará su posición correcta. Aunque la persistencia de posibles fístulas arteriovenosas a través de ramas venosas colaterales pueda ser una pequeña desventaja, muchas de ellas pueden localizarse y ligarse con anestesia local y son fácilmente detectables con eco Doppler sin que reporten importantes compromisos hemodinámicos. Por todo ello, nosotros preferimos el abordaje abierto de la vena safena interna.
TÉCNICA
La preparación del campo quirúrgico es esencial. Nosotros siempre mapeamos la vena safena interna antes de indicar este tipo de revascularización, y si la vena no tiene un tamaño óptimo (al menos, 2 mm), está flebítica o ha sido parcialmente utilizada para una revascularización coronaria o de extremidad, desestimamos de este tipo de procedimiento e intentamos extraerla del miembro contralateral o de venas accesorias (safena menor o cefálica del brazo) con el convencimiento de que la vena autológa es el mejor material sustitutivo. En estos casos extremos de salvamento de la extremidad, hacemos bypass invertidos para evitar el problema valvular y de lesión de la pared venosa en los intentos de preparación del injerto venoso. Igualmente, este tipo de cirugía en pacientes con isquemia crítica severa precisa, en nuestra opinión, de una buena prueba de imagen arteriográfica que nos defina perfectamente el mejor vaso receptor distal y que tenga continuidad, si es posible, con la arcada plantar. Siempre elegimos el mejor lecho arterial distal (más sano) y que nos permita rellenar el pie. No tenemos suficiente experiencia y fiabilidad con el mapeo arterial exclusivamente con eco Doppler, ya que, en estas situaciones de isquemia severa, incluso con lesiones necróticas, apenas se captan flujos distales y la apreciación es bastante subjetiva. Como creemos que es una cirugía crítica en la que el paciente se juega muchas veces la extremidad, para nosotros es fundamental tener una buena imagen arteriográfica. Estas exploraciones complementarias (ecografía de la vena safena interna y arteriografía de la extremidad) nos permiten tener bien planificada la intervención, las zonas de abordaje y la correcta disección de los vasos sin tener que hacer despegamientos cutáneos innecesarios, lo que conllevaría posteriormente mayores complicaciones de las heridas.
Una vez decidido el bypass in situ distal, solemos hacer el procedimiento con dos equipos quirúrgicos simultáneos: uno superior, que con una incisión oblicua alargada (unos 20-30 cm) en el tercio proximal del muslo se encarga de disecar y de liberar el cayado safenofemoral y la arteria femoral con su trípode de arteria femoral común, arteria femoral superficial y arteria femoral profunda. El otro equipo, mientras tanto, aborda la arteria receptora y realiza una incisión prolongada supramaleolar hasta la zona supragenicular de Hunter, ya que en esta zona son muy frecuentes las venas perforantes y las venas comunicantes. La disección de estos troncos arteriales distales (arterias tibiales, peronea o pedia) se facilita teniendo en cuenta el plano anatómico correcto y apreciando que la arteria siempre va a ir acompañada de sus venas paralelas, que se muestran con su típico color azulado. Además, en caso de duda, la palpación digital de la zona permite identificar el vaso arterial por su configuración tubular o la calcificación de la pared arterial. Siempre elegiremos la zona más sana y menos calcificada. Según el cirujano, se hace una incisión continua que exponga toda la vena para ligar o clipar las venas colaterales y evitar futuras fístulas (mi preferida) o se dejan puentes cutáneos en el muslo, pero siempre disecando completamente la vena para identificar esas potenciales ramas venosas colaterales.
Una vez disecados los vasos (proximal, distal y vena safena), procedemos a la heparinización sistémica y comenzamos con la desconexión del cayado de la vena safena mayor de la vena femoral común. Se pone habitualmente un pequeño disector curvo lo más próximo a la raíz y se corta la vena; luego, con una sutura de prolene 5/0, cerramos la boca femoral y aseguramos la hemostasia. Movilizamos la vena en su porción proximal y se prepara la zona de recepción arterial según la altura a la que caiga sin tensión. No es obligatorio hacer la anastomosis proximal en la arteria femoral común, aunque normalmente se haga en esta zona. Si la vena queda con tensión, es preferible hacerla en el inicio de la femoral superficial (obviamente, cuando esté permeable o con endarterectomía) o en la arteria femoral profunda. Lo importante aquí es constatar que se obtiene un buen flujo arterial de la zona dadora seleccionada. Una vez que esto es así, se prepara la boca anastomótica de la vena, y si tiene una válvula proximal, se abre y se limpian los velos, luego se procede a la anastomosis proximal y al finalizar se desclampa. Se verifica la hemostasia de la sutura y se comprueba el latido proximal; posteriormente, procedemos a realizar el sector distal. En primer lugar, mientras la vena está en su situación anatómica, ligamos o cerramos con un clip de hemostasia la porción final desechable de la vena, abrimos en oblicuo o bisturí una pequeña incisión e introducimos el valvulotomo sin movilizar la vena (Fig. 1). Nosotros solemos utilizar el valvulotomo de Lemaitre (Fig. 2). Es aconsejable comprobar el funcionamiento previo y exterior del dispositivo (despliegue y cierre de las cuchillas) y humedecer ligeramente la punta en suero. Luego lo introducimos en la vena, que está fija (solo abierta parcialmente), y vamos visualizando y ayudando a la progresión del catéter de abajo arriba. No conviene forzar esta maniobra y es preferible reconducir manualmente el catéter a través de la vena para que suba suavemente. Cualquier movimiento violento puede perforar la vena o desgarrarla, generalmente en las zonas de ramas. La vena se pinzará con los dedos del ayudante proximalmente para evitar que el valvulotomo pase la zona de anastomosis proximal y se introduzca en la arteria, lo que ocasionaría algún enganche o daño. Después de comprobar que se ha llegado a la zona proximal, se despliega el dispositivo y va traccionándose suavemente de arriba abajo comprobando cómo se desgarran las válvulas.

Figura 1. Realizada la anastomosis proximal, se procede a pasar el valvulotomo de abajo arriba (sin movilizar la vena) y observando en la retirada cuidadosa del catéter la rotura de las válvulas venosas y la progresiva restauración de flujo a través del injerto.
Antiguamente, los valvulotomos eran catéteres de diversos tamaños en función del calibre (diámetro) de la vena, pero actualmente los comercializados por Lemaitre son unas “cuchillas” que se expanden completamente y van adaptándose progresivamente en su tracción al diámetro de la vena sin generar traumatismos su pared. Esta maniobra conviene observarla directamente y debe verificarse que va obteniéndose un buen latido. En caso de dudas, vuelve a pasarse ligeramente por todo el trayecto. Al finalizar, tiene que percibirse la vena pulsátil y con buen flujo, que se confirma dejando salir brevemente la sangre por el extremo distal. Entonces, introducimos un poco de solución salina heparinizada, cerramos con un bulldog la vena distal y procedemos a preparar la arteria receptora. Se elige a priori la zona más sana, se pasa un pequeño dilatador por la arteria expuesta y se perfunde una pequeña cantidad de suero salino heparinizado, verificando la resistencia distal. Posteriormente, se desconecta y se libera la vena evitando pequeñas rotaciones que puedan dificultar el funcionamiento óptimo del injerto. Si hay dudas recomendamos pintar la pared anterior con un rotulador (Fig. 3). Se tuneliza visualmente y se comprueba el flujo, se preparan las bocas anastomóticas y se sutura con monofilamento prolene de 6/0 (Fig. 4). Al finalizar debe comprobarse el buen latido del bypass y la hemostasia de la sutura por si fuese necesario dar algunos puntos sueltos. Si el lecho arterial no es bueno o si existe alguna duda, nosotros recomendamos hacer una arteriografía intraoperatoria a través de alguna rama proximal de la vena para comprobar el funcionamiento del bypass y su salida distal (Fig. 5). No es conveniente cerrar las heridas si no se ha verificado una buena hemostasia de las anastomosis y del lecho expuesto, ya que si no se corre el riesgo de hematomas subcutáneos y posibles infecciones. En la zona proximal es recomendable poner un drenaje de succión de Redon para evitar hematomas. Preferiblemente, no neutralizamos la heparina para garantizar un mejor funcionamiento inicial, pero queda a discreción de cada cirujano. Al día siguiente siempre verificamos nuestros procedimientos con un eco Doppler de control y se optimiza la medicación (antiagregación simple y estatina) para garantizar una buena permeabilidad durante el seguimiento posoperatorio.
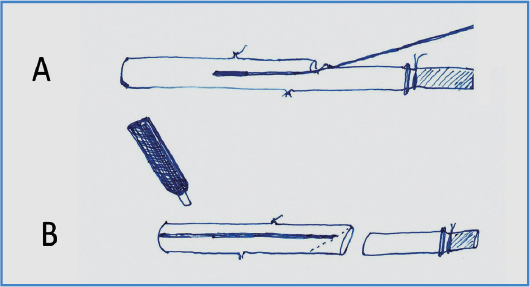
Figura 3. Pasos críticos para evitar mal rotaciones de la vena: A. El valvulotomo se pasa sin movilizar la vena de su lecho. B. Posteriormente, se pinta la cara anterior de la vena antes de la tunelización hacia la arteria receptora.
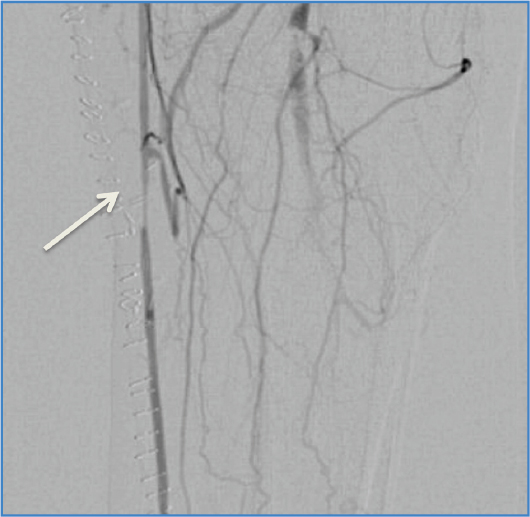
Figura 5. Importancia del control angiográfico perioperatorio, que muestra una fístula arteriovenosa y una estenosis espasmo posterior del bypass. El bypass in situ funcionaba, pero su latido no era óptimo. El cierre de la fístula y la dilatación de la zona estenótica optimizaron el resultado final.
















