Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.29 no.5 Cantabria 2009
Nefritis túbulo-intersticial aislada en paciente con lupus eritematoso sistémico
Tubulo-interstitial nephritis isolated in patient with systemic lupus erithematosus
Dirección para correspondencia
Sr. Director:
El lupus eritematoso sistémico (LES) es una enfermedad inflamatoria con afectación sistémica1. Al menos el 50% de los pacientes presentan signos de nefropatía durante su enfermedad, y cerca de la mitad de ellos presentan nefritis proliferativa difusa2. La nefritis túbulointersticial, como lesión histológica aislada, es poco frecuente en un paciente con LES; además, según nuestro conocimiento, hay pocos casos publicados en la literatura1-2.
Presentamos el caso de una mujer de 67 años de edad, diagnosticada de hipertensión arterial. Ingresó por sensación nauseosa, infección urinaria y anemia. Análisis: Hto 27,8%; Hb 9,5 g/dl. VSG 63 mm. Urea 182 mg/dl; creatinina 4,7 mg/dl; calcio 9 mg/dl; fósforo 4,2 mg/dl y proteínas totales 9 g/dl. Aclaramiento de creatinina (fórmula de Cockroft-Gault): 17,73 ml/min. Inmunoproteínas y complemento normal. Cadenas Kappa-s 774 mg/dl, cadenas Lambda 392 mg/dl. En el proteinograma se observó un pico de amplia base en región Gamma, con aumento de IgG (193%) y cadenas ligeras Kappa (191%) y Lambda (180%). Índice K/L = 1,97. Cadenas ligeras en orina: cadenas Kappa 13,7 mg/dl (0-0,7); cadenas Lambda 6,880 (0-0,39). Se realizó aspirado y biopsia de médula ósea, que resultó normal. THS: 4,85 µUI/ml, T4 libre 1,03 ng/fl; Ac. anti- TPO 22,5 UI/ml; Ac antitiroglobulina 115,3 UI/ml. PTH: 110 pg/ml. Orina (tira reactiva): proteínas 25 mg/l; sedimento: abundantes leucocitos. Marcadores tumorales: normales. Serología viral: negativa. Autoanticuerpos: ANA +, anti-ADN positivos.
Se realizó una biopsia renal percutánea (18 glomérulos valorables): glomérulos sin alteraciones significativas. Los túbulos presentan luces dilatadas y ocupadas por cilindros granulares que contienen detritus celulares. Existen focos de atrofia tubular y cilindros hialinos (figura 1). En el intersticio y vasos, abundantes infiltrados de linfocitos, y sobre todo de células plasmáticas que ensanchan el intersticio provocando colapso y desaparición de túbulos, así como erosión de las membranas basales e infiltración epitelial de los mismos (figura 2). En la inmunofluorescencia se objetivaron depósitos granulares a nivel de las paredes arteriales de complemento C'3 (++) y cilindros tubulares de IgA (++). Mediante técnicas inmunohistoquímicas, se advierten depósitos lineales a nivel de las membranas basales tubulares de cadenas ligeras kappa. El diagnóstico anatomopatológico fue nefritis túbulo-intersticial inflamatoria. Este cuadro morfológico aparece en el 10% de los pacientes que sufren discrasias de células plasmáticas, más frecuentemente en el mieloma con predominio de cadenas ligeras K.
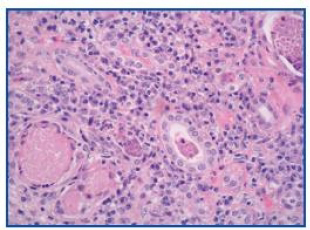
Figura 1. H-E (x400). Detalle del infiltrado linfoplasmocitario
que afecta a paredes tubulares y cilindros granulares con
algunos polimorfonucleares en las luces tubulares.

Figura 2. Plata de Jones (x200). Intersticio hipercelular
con infiltrado de linfocitos y células plasmáticas, que
provoca borramiento tubular. Se advierten
glomérulos sin alteraciones.
En la mayoría de los casos de LES, la afectación del glomérulo es la principal lesión histológica. La afectación aislada de túbulo e intersticio es rara.
Otras causas de nefritis túbulo-intersticial, tales como drogas o toxinas, fueron descartadas. La intensa presencia de daño túbulo-intersticial en ausencia de daño glomerular significativo promueve la teoría de complejos inmunes ligados a uno o más autoantígenos túbulo-intersticiales que no se expresan en el glomérulo. El mecanismo subyacente representa la formación in situ de complejos inmunes como resultado de la unión de autoanticuerpos circulantes con antígenos3. Aunque el mecanismo exacto es desconocido, es posible que su patogenicidad dependa de las características estructurales de la región de unión antígeno-anticuerpo, del isotipo y de la carga isoeléctrica3. Un estudio reciente describe cómo la unión de las células T CD4+ a antígenos en la membrana basal glomerular podría iniciar el daño glomerular que desencadenaría la glomerulonefritis. Es posible que un mecanismo similar pudiese participar en la patogénesis de la nefritis túbulo-intersticial, de forma que la inmunidad celular daña a antígenos tubulares iniciándose la afectación intersticial como en otras nefropatías intersticiales4.
El tratamiento de la nefritis túbulointersticial en el LES no está bien establecido, pero parece que no requiere terapia inmunosupresora, y podría responder con dosis moderadas de esteroides orales5.
M.J. Moyano Franco1, J. Amor Sánchez1, R. Ortega Ruano1, J. Armas Padrón2
1Servicio de Nefrología. 2Departamento de Anatomía Patológica. Hospital Universitario Virgen Macarena. Sevilla
Bibliografía
1. Austin HA. Clinical evaluation and monitoring of lupus kidney disease. Lupus 1998;7:618-21. [ Links ]
2. Ruiz-Irastorza G, Khamashta MA, Castellino G, Hughes GR. Systemic lupus eyrthematosus. Lancet 2001;357:1027-32. [ Links ]
3. Singh AK, Ucci A, Madias NE. Predominant tubulointerstitial lupus nephritis. Am J Kidney Dis 1996;27:273-8. [ Links ]
4. Weening JJ, D'Agati VD, Schawrtz MM, Seshan SV, Alpers CE, Appel GB, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. Kidney Int 2004;65(2):521-30. [ Links ]
5. Michail S, Stathakis C, Marinaki S, Revenas C, Nakapoulos L, Vaiopoulos G. Relapse of predominant tubulointerstitial lupus nephritis. Lupus 2003;12:728-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Jesús Moyano Franco,
Servicio de Nefrología
Hospital Universitario Virgen Macarena, Sevilla
medicimon@yahoo.es














