Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.31 no.1 Cantabria 2011
Evidencias clínicas sobre el uso de los fármacos anti-mTOR en el trasplante renal
Clinical evidence on the use of anti-mtor drugs in renal transplantation
D. Hernández, D. Martínez, E. Gutiérrez, V. López, C. Gutiérrez, P. García, C. Cobelo, M. Cabello, D. Burgos , E. Sola, M. González-Molina
Servicio de Nefrología. Hospital Regional Universitario Carlos Haya. Málaga
Este trabajo ha sido financiado en parte por el Ministerio de Ciencia e Innovación de España (SAF2007-60314).
Dirección para correspondencia
RESUMEN
Los fármacos inhibidores de la calcineurina (ICN) constituyen los pilares de la moderna inmunosupresión en el trasplante renal. Sin embargo, contribuyen significativamente a la pérdida crónica de los injertos renales y a la elevada morbimortalidad en esta población por sus efectos deletéreos sobre el injerto renal, el perfil cardiovascular y la patología tumoral. Los fármacos anti-mTOR, sirolimus (SRL) y everolimus (EVE), son potentes inmunosupresores con capacidad antiproliferativa y antimigratoria, propiedades que les confieren un potencial papel protector en la disfunción del injerto, en la optimización de la función renal y en la aparición de tumores. En efecto, ensayos clínicos controlados y estudios observacionales de conversión han demostrado el efecto beneficioso de estos fármacos en términos de función renal, sin incremento significativo de las tasas de rechazo agudo. En esta revisión se analizan las evidencias del empleo de los fármacos anti-mTOR en los siguientes aspectos clínicos de los pacientes con trasplante renal: 1) prevención de la disfunción inmunológica precoz y preservación de la función renal en el uso de novo y conversión precoz o tardía; 2) disfunción crónica del injerto renal; 3) efectos cardiovasculares; 4) diabetes de novo postrasplante, y 5) patología tumoral de novo.
Palabras clave: Trasplante renal, Fármacos anti-mTOR, Inhibidores de la señal de proliferación, Sirolimus, Everolimus.
ABSTRACT
The calcineurin inhibitor drugs (CNI) are the mainstays of modern immunosuppression in renal transplantation, but they contribute significantly to the chronic graft loss and the high morbidity and mortality in this population for their deleterious effects on renal graft, cardiovascular profile and malignancies. The anti-mTOR drugs, sirolimus (SRL) and verolimus (EVE), are potent immunosuppressants with antiproliferative and anti-migration properties. This confers them a potential protective role in graft dysfunction, the optimization of renal function and the appearance of malignancies. Indeed, clinical trials and observational studies have demonstrated that conversion from CNI to anti-mTOR-based maintanace therapy has beneficial effects on transplant outcomes in terms of renal function, without significant increase in acute rejection rates. In this review, we analyze the evidence of the use of anti-mTOR in the following clinical situations following renal transplantation: 1) Prevention of immune dysfunction and renal function preservation in de novo kidney transplantation and after early or late CNI withdrawal; 2) Chronic graft dysfunction, 3) Cardiovascular complications, 4) Diabetes de novo posttransplantation; and 5) De novo malignancies.
Key words: Renal transplantation, Anti-mTOR drugs, Proliferation signal inhibitors, Sirolimus, Everolimus.
Introducción
Los fármacos inhibidores de la calcineurina (ICN) constituyen los pilares de la moderna inmunosupresión, pero sus efectos deletéreos sobre el paciente y el injerto renal contribuyen a que las tasas de supervivencia del trasplante renal (TX) a largo plazo no hayan mejorado acorde a los buenos resultados obtenidos durante el primer año post-TX1.
Durante los últimos años, el advenimiento de nuevos inmunosupresores ha permitido diseñar estrategias terapéuticas encaminadas a minimizar el impacto negativo de los ICN sobre la disfunción crónica del injerto y la comorbilidad cardiovascular y tumoral. Sin duda, esto pudiera incrementar los resultados de supervivencia, especialmente en individuos longevos que reciben el TX de donantes de edad avanzada.
Los fármacos anti-mTOR, sirolimus (SRL) y everolimus (EVE), son potentes inmunosupresores con capacidad antiproliferativa y antimigratoria por bloqueo de la señalización intracelular que regula el crecimiento y la proliferación de las células T2. Esto les confiere un potencial papel protector en la disfunción del injerto renal, al mismo tiempo que pueden optimizar el perfil cardiovascular y reducir la aparición de tumores de novo. Sin embargo, sus efectos secundarios pudieran contrarrestar estos beneficios a más largo plazo (figura 1).
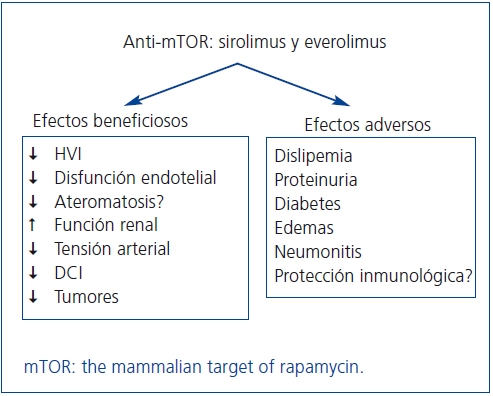
Figura 1. Potenciales beneficios clínicos y efectos adversos de los fármacos anti-mTOR
En esta revisión, analizaremos las evidencias del empleo los fármacos anti-mTOR en el campo del TX, profundizando en las evidencias de los siguientes aspectos clínicos: 1) prevención de la disfunción inmunológica precoz y preservación de la función renal en el uso de novo y conversión precoz o tardía; 2) disfunción crónica del injerto renal; 3) efectos cardiovasculares; 4) diabetes de novo post-TX, y 5) patología tumoral de novo.
Prevención de la disfunción inmunológica precoz y preservación de la función renal
Uso de novo
Estudios iniciales mostraron que el uso de SRL con y sin inducción, evitando ICN, se asociaba con una mejor función renal frente a regímenes con ciclosporina (CsA) con una similar tasa de rechazos agudos siempre que se asociara con micofenolato mofetil (MMF)3-11. Adicionalmente se observó que, además de optimizar la función renal, esta conducta de usar SRL en lugar de CsA se asociaba a una menor expresión de genes implicados en el desarrollo de la disfunción crónica del injerto (DCI) como el gen que codifica la proteína transforming growth factor (TGF-β) o el Monocyte chemotactic protein-1 (MCP-1)12.
Más recientemente, se ha observado que el tratamiento de inducción con timomoglobulina más el uso de novo de SRL se asocian con una mejor función renal frente a la terapia inmunosupresora convencional (prednisona, tacrolimus y MF), pero el precio a pagar puede ser una mayor tasa de efectos adversos y pérdidas de injertos con el empleo de SRL13. La proteína mTOR regula la diferenciación de las células T-memoria CD814. Asimismo, la combinación de timomoglobulina y SRL se asocia con un mayor grado de preservación y recuperación de los linfocitos T-memoria frente a los que reciben CsA15. Esto bien podría explicar una mayor tasa de disfunciones inmunológicas con el uso de novo de SRL frente a un ICN, especialmente tras la administración de anticuerpos policlonales.
Pero, ¿qué ocurre con EVE? En esta línea, una excelente revisión sobre el uso de este fármaco mostraba que el empleo de 1,5 o 3 mg de EVE más dosis plenas o reducidas de CsA confería una similar tasa de rechazos agudos y supervivencia del injerto que la terapia convencional con CsA y MMF, si bien se observó una menor proporción de rechazos severos utilizando 3 mg de EVE16. En cualquier caso, el empeoramiento de la función renal fue el denominador común en los ensayos clínicos que emplearon dosis más altas de EVE (3 mg/día), pese a la reducción de la CsA, lo que dejaba entrever la necesidad de combinar dosis bajas de un ICN y de un anti-mTOR17,18. En efecto, estudios controlados combinando dosis bajas de CsA y EVE han demostrado que la preservación de la función renal se acompaña de aceptables tasas de rechazos y supervivencia del injerto al primer año de seguimiento19-21, incluido aquellos enfermos con riesgo de función renal retrasada (estudio CALLISTO)22. Algo similar, en términos de preservación de la función renal y tasa de rechazos, ocurre cuando los pacientes son tratados con EVE (1,5 mg/día) y dosis bajas o estándar de tacrolimus (TAC), lo cual pudiera traducirse en una mayor supervivencia del injerto23. En cualquier caso, EVE disminuye la biodisponibilidad oral de TAC de una manera dosis-dependiente24. Por tanto, es mandatorio ajustar dosis y niveles de ambos fármacos cuando se lleven a cabo estrategias de minimización con esta combinación de inmunosupresores.
Con todo, un ensayo clínico muy potente (estudio SYMPHONY) demostró que el uso de SRL de novo sin ICN se asociaba con una alta tasa de disfunciones inmunológicas agudas y una peor función renal frente a otras pautas que incorporaban dosis plenas o reducidas de un ICN25. En cualquier caso, se emplearon dosis y niveles bajos de SRL, lo cual puede constituir un sesgo de la eficacia. Si a este hecho se le añade que el uso precoz o tardío de un anti-mTOR (SRL o EVE) se asocia con una alta tasa de complicaciones de la herida quirúrgica y que estos fármacos son un factor de riesgo independiente de las mismas26,27, su empleo de novo pudiera estar cuestionado. De hecho, la guías KDIGO (Kidney Disease Improving Global Outcomes) de práctica clínica en el trasplante renal desaconsejan el empleo de estos fármacos como inmunosupresión de inicio28. Por tanto, y de acuerdo conun nivel alto de evidencia: 1) el uso de novo de un anti-mTOR (dosis bajas) sin ICN se asocia con una mayor tasa de disfunción inmunológica y de complicaciones de la herida quirúrgica, por lo que no se recomiendan como inmunosupresión inicial, y 2) el uso combinado de dosis bajas de un ICN más un anti-mTOR confiere protección inmunológica, al menos a corto plazo.
Conversión precoz y tardía
A la luz de estos resultados, es posible que la indicación princeps de los fármacos anti-mTOR (SRL o EVE) radique en la sustitución del ICN en los primeros meses post-TX, una vez superada la tormenta inmunológica. Pero, ¿qué evidencias existen de esta actitud terapéutica? En consonancia con este razonamiento, estudios iniciales demostraron que la reducción o la eliminación de la CsA en terapia con SRL durante los primeros meses post-TX podía ofrecer una mejor función renal con una aceptable supervivencia del injerto pese a un ligero incremento en la tasa de rechazos agudos10. Esto fue refrendado en una revisión sistemática con su metanálisis correspondiente que incluyó seis ensayos clínicos controlados, en los que la retirada del ICN en terapia con SRL confería mejor función renal a pesar de un ligero aumento en la tasa de disfunción inmunológica29. Más recientemente, la conversión aleatorizada de CsA a SRL entre la segunda y la tercera semanas post-TX se asoció con una mejoría significativa de la función renal frente a la de los pacientes que continuaron con CsA (estudio SMART)30. Algo similar se ha observado con TAC. La retirada de este fármaco en los primeros meses post-Tx, bajo terapia con SRL, preservaba la función renal frente a una inmunosupresión potente (TAC más SRL) a los 2 años de seguimiento, sin incremento significativo de la proteinuria31. Es posible que este efecto beneficioso precoz se deba, al menos en parte, a la disminución de los índices de resistencia vasculares intrarrenales, como ha sido descrito previamente32.
Por otro lado, en regímenes terapéuticos sin esta combinación farmacológica inicial (TAC más SRL), la sustitución de CsA/TAC por SRL desde el sexto mes post-TX mejoró significativamente la función renal, en especial en aquellos enfermos que partían de un mejor filtrado glomerular (>40 ml/min). Asimismo,se observó una menor incidencia de tumores (estudio CONVERT)33. De manera similar, la conversión de CsA por SRL al tercer mes post-TX con retirada de esteroides al octavo mes se asoció con una mejoría significativa de la función renal (estudio CONCEPT)34. No obstante, esta mejoría en el filtrado glomerular no se acompañó de menos fibrosis intersticial en las biopsias de protocolo realizadas al año de seguimiento35.
Pero, ¿qué ocurre con EVE? En conversiones abruptas y precoces (séptima semanapost-TX) de CsA a EVE se evidencia un incremento significativo de la función renal con una aceptable tasa de rechazos agudos a los 6 meses de seguimiento36. Asimismo, estudios observacionales han mostrado que la conversión de un ICN a EVE preserva la función renal a los 6 meses de seguimiento, hecho este relevante si tenemos en cuenta que muchas conversiones se realizaron por deterioro crónico de la función del injerto37-39. Un reciente ensayo clínico en pacientes sin riesgo inmunológico, que recibieron inmunosupresión convencional durante 6 meses, demostró que los enfermos convertidos de CsA a EVE presentaron una menor tasa de rechazos y mejor función renal que aquellos que permanecieron en tratamiento con MMFo con CsA40. Finalmente, datos preliminares de un estudio controlado, multicéntrico español (estudio ERIC) muestran que la conversión de TAC a EVE tras 3 meses de TX se asocia con una tendencia a mejorar el GFR, con un ligero aumento en la tasa de rechazos agudos41. Por tanto, y a la luz de la evidencia disponible (nivel de evidencia moderado), podemos aducir que la conversión de un ICN a un anti-mTOR se asocia con estabilidad de la función renal, lo que puede contribuir a evitar la progresión de la DCI. Como indican las guías KDIGO, esta actitud terapéutica debería considerarse especialmente en individuos de bajo riesgo inmunológico28.
Disfunción crónica del injerto renal
La proteína mTOR intervienen en los mecanismos patogénicos de la progresión de la enfermedad renal crónica. Por tanto, SRL y EVE pueden desempeñar un papel relevante en la prevención de la DCI dadas sus acciones antiproliferativas (figura 2). Pero, ¿qué evidencias existen al respecto?
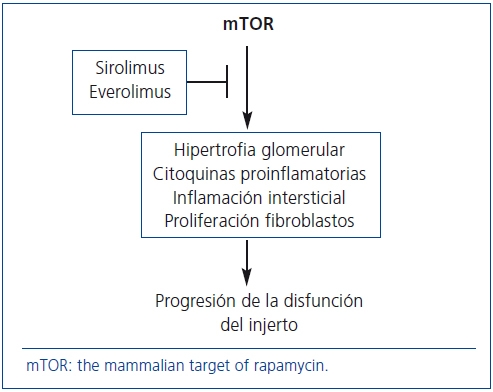
Figura 2. Mecanismos de acción de los fármacos anti-mTOR para frenar
la progresión de la disfunción crónica del injerto
En el modelo animal de rechazo crónico, la administración de EVE minimiza las lesiones histológicas inherentes a la DCI por mecanismos antiproliferativos o por estimulación de la apoptosis de células que participan en el remodelado tisular42. Asimismo, en la rata sensibilizada que recibe un injerto renal, la administración de EVE disminuye drásticamente el infiltrado celular de la respuesta alogénica y minimiza la fibrosis intersticial/atrofia tubular, lo cual puede contribuir a frenar la progresión de la DCI43.
En el terreno clínico, la retirada de CsA en terapia con SRL a los 3 meses post-TX puede prevenir la aparición de las lesiones de DCI y optimizar la función renal tras 3 años de seguimiento44. Un estudio aleatorizado en pacientes con DCI mostró que la administración de SRL reducía notoriamente la expresión intersticial y vascular de moléculas profibrogénicas frente a los que recibieron dosis reducidas de CsA más MMF. Esto se acompañó de una mejoría de la supervivencia de los injertos a los 2 años de seguimiento45. En esta línea, estudios observacionales de conversión tardía de un ICN a un anti-mTOR (SRL o EVE), principalmente por DCI, han mostrado sistemáticamente mejoría o estabilidad de la función del injerto renal37-39,46, pero se necesitan estudio controlados que confirmen estos hallazgos. A la luz de la poca evidencia existente, las guías KDIGO sólo «sugieren» (pero no recomiendan contundentemente) este cambio terapéutico en pacientes con DCI28. Por otra parte, los anti-mTOR preservan la producción de interferón-gamma, molécula con importante actividad antivírica47, lo cual puede prevenir también la aparición de nefropatía crónica por poliomavirus BK48.
Con todo, los fármacos anti-mTOR pueden generar proteinuria, especialmente en pacientes con daño renal previo49. Esta proteinuria es un predictor de disfunción endotelial y de mortalidad en pacientes con TX, lo que puede empeorar los resultados globales del TX a más largo plazo50. A la luz de lo expuesto, SRL y EVE pueden representar alternativas terapéuticas en pacientes con DCI y mínima o nula proteinuria, siempre que no se asocien con un ICN (nivel de evidencia bajo). Queda por dilucidar el momento exacto de la conversión para optimizar los resultados del TX.
Efectos cardiovasculares
En el corazón, SRL inhibe la proteína mTOR, la cual regula la síntesis proteica intracelular que interviene en el desarrollo de hipertrofia ventricular cardíaca ante estímulos de presión. La administración de SRL en el ratón sometido a una sobrecarga de presión cardíaca disminuyó en un 50% el crecimiento de las células miocárdicas con respecto al grupo control, y esto se acompañó de menor expresión de proteínas que intervienen en los mecanismos de la hipertrofia cardíaca como la S6 ribosomal51,52. Asimismo, en el modelo animal de enfermedad renal crónica, la administración de SRL disminuye el crecimiento de los miocardiocitos y revierte la fibrosis intermiocardiocítica53, hecho éste que pudiera optimizar el remodelado cardíaco. En humanos, estudios observacionales de pocos enfermos muestran que la conversión clínica de un ICN a SRL disminuye significativamente la masa ventricular izquierda (aproximadamente un 30%), independientemente de la tensión arterial54. En cualquier caso, se necesitan estudios longitudinales con un mayor número de enfermos para confirmar estos interesantes hallazgos.
Los fármacos anti-mTOR producen dislipemia de manera dosis-dependiente que puede contribuir al desarrollo de enfermedad cardiovascular post-TX55. Sin embargo, en el modelo animal de ateromatosis (ratones knockout para la apolipoproteína E), la administración de dosis crecientes de SRL fue capaz de reducir en más del 50% las lesiones ateromatosas de la aorta. Esto se acompañó de menor expresión de interleuquinas implicadas en el proceso ateromatoso (IL-10) frente al grupo control56. En esta línea, SRL preserva la función endotelial frente a CsA mantienendo la vasodilatación dependiente de acetilcolina y disminuyendo los niveles de endotelina-157,58. Estas acciones pueden explicar la prevención de la vasculopatía del injerto y la mejoría de la función renal en regímenes terapéuticos que utilizan fármacos anti-mTOR. La traducción clínica pudiera ser una menor rigidez arterial, como se observó en un estudio controlado, en el que la conversión de CsA a EVE se asoció con una menor velocidad de la onda de pulso frente a aquellos que continuaron con CsA59. Finalmente, la administración de anti-mTOR disminuye la incidencia de infección por CMV60,61, efecto que pudiera redundar en una menor aparición de efectos indirectos potencialmente provocados por esta infección oportunista como la cardiopatía isquémica o la enfermedad vascular periférica62,63. Estudios prospectivos futuros aclararán estos interesantes aspectos.
Diabetes de novo postrasplante
La proteína mTOR regula la proliferación de la célula beta e interviene en la cadena de señalización intracelular de la insulina. En pacientes estables con DCI, la conversión de CsA a SRL genera resistencia a la insulina expresada por una mayor expresión de los receptores insulínicos celulares (IRS-1 e IRS-2)64,65. En efecto, un estudio observacional del registro americano con miles de pacientes demostró que el riesgo de diabetes de novo post-TX era significativamente mayor en todas aquellas combinaciones farmacológicas que incluyeron SRL frente a otras asociaciones terapéuticas sin este fármaco66. De hecho, la administración de rapamicina en el modelo animal disminuye la sensibilidad a la insulina y reduce hasta un 50% la masa de células beta pancreática por una mayor apoptosis de las mismas, especialmente cuando existe predisposición a desarrollar diabetes mellitus, como ocurre en las ratas obesas67.
Por tanto, y aún con un bajo nivel de evidencia, los anti-mTOR pueden frenar el crecimiento ventricular izquierdo y la progresión de la ateromatosis, si bien pueden predisponer al desarrollo de diabetes post-TX, principalmente en enfermos predispuestos.
Patología tumoral de novo
En general, tras el TX existe un incremento en la incidencia de tumores y los ICN desempeñan un papel crucial en su desarrollo68. La proteína mTOR estimula la producción de factores de crecimiento (VEGF, PDGF-α, TNF-α) que incrementan la angiogénesis, la proliferación celular y el crecimiento tumoral (figura 3). De ahí que SRL y EVL puedan frenar potencialmente el desarrollo y el crecimiento de las células neoplásicas69. En esta línea, un estudio observacional del registro americano de más de 30.000 pacientes demostró que los tratamientos inmunosupresores que incluían SRL o EVE disminuían un 60% el riesgo de cáncer cutáneo y no cutáneo frente al tratamiento con ICN70. Un análisis por intención de tratar de un ensayo clínico aleatorizado demostró que la incidencia de carcinomas cutáneos y no cutáneos fue inferior en los pacientes que recibieron SRL frente a aquellos que recibieron CsA más SRL, pero el grupo control recibió una inmunosupresión más potente, lo cual constituye un sesgo importante para valorar el efecto antitmoral de los fármacos anti-mTOR71. Como se comentó previamente, en el estudio CONVERT se observó una menor incidencia de tumores en los pacientes que fueron convertidos de un ICN a SRL33. Por último, un ensayo controlado más reciente en enfermos con neoformaciones cutáneas no melanocíticas demostró que el tratamiento con SRL puede retrasar el desarrollo de nuevas neoplasias e inducir regresión de lesiones preexistenes frente a aquellos enfermos que recibieron CsA72 (nivel moderado de evidencia).
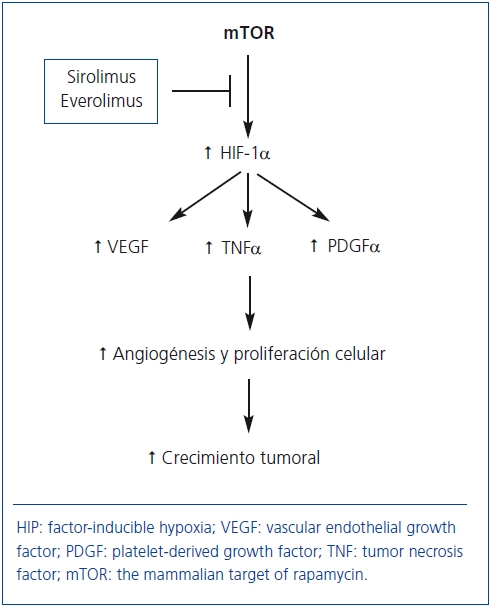
Figura 3. Potencial mecanismo de acción de los fármacos anti-mTOR
para inhibir el crecimiento tumoral
Al mismo tiempo, algunos virus como el herpesvirus o el de Epstein-Barr pueden ser responsables del incremento de neoplasias tras el TX. Los fármacos anti-mTOR pueden optimizar la respuesta específica linfocitaria (linfocitos T) antivírica medianteun incremento en los CD4 y CD8, mecanismo que puede explicar la menor incidencia de infecciones víricas con estos fármacos73. Obviamente, esto pudiera traducirse en una menor aparición de neoplasias de origen vírico. De hecho, en un estudio sorprendente de pacientes con TX y sarcoma de Kaposi, la sustitución de CsA por SRL se asoció con una desaparición de las lesiones histológicas tumorales a los 6 meses de seguimiento, efecto que pareció deberse a una disminución de la angiogénesis y del factor de crecimiento del endotelio vascular (VEGF)74. En esta línea, la guías KDIGO sugieren el empleo de fármacos anti-mTOR en enfermos sometidos a TX con esta patología28. En cualquier caso, se requieren estudios controlados que confirmen el beneficio de los anti-mTOR en el tratamiento de los procesos tumorales.
Referencias Bibliográficas
1. Meier-Kriesche HU, Schold JD, Srinivas TR, Kaplan B. Lack of improvement in renal allograft survival despite a marked decrease in acute rejection rates over the most recent era. Am J Transplant 2004;4:378-83. [ Links ]
2. Lieberthal W, Levine JS. The role of the mammalian target of rapamycin (mTOR) in renal disease. J Am Soc Nephrol 2009;20:2493-502. [ Links ]
3. Groth CG, Backman L, Morales JM, Calne R, Kreis H, Lang P, et al. Sirolimus (rapamycin)- based therapy in human renal transplantation: similar efficacy and different toxicity compared with cyclosporine. Sirolimus European Renal Transplant Study Group. Transplantation 1999;67:1036-42. [ Links ]
4. Kreis H, Cisterne JM, Land W, Wramner L, Squifflet JP, Abramowicz D, et al. Sirolimus in association with mycophenolate mofetil induction for the prevention of acute graft rejection in renal allograft recipients. Transplantation 2000;69:1252-60. [ Links ]
5. Tran HT, Acharya MK, McKay DB, Sayegh MH, Carpenter CB, Auchincloss H, et al. Avoidance of cyclosporine in renal transplantation: effects of daclizumab, mycophenolate mofetil, and steroids. J Am Soc Nephrol 2000;11:1903-9. [ Links ]
6. Vincenti F, Ramos E, Brattstrom C, Cho S, Ekberg H, Grinyo J, et al. Multicenter trial exploring calcineurin inhibitors avoidance in renal transplantation. Transplantation 2000;71:1282-7. [ Links ]
7. Flechner SM, Goldfarb D, Modlin C, Feng J, Krishnamurthi V, Mastroianni B, et al. Kidney transplantation without calcineurin inhibitor drugs: a prospective, randomized trial of sirolimus versus cyclosporine. Transplantation 2002;74:1070-6. [ Links ]
8. Grinyo JM, Gil-Vernet S, Cruzado JM, Caldés A, Riera L, Serón D, et al. Calcineurin inhibitor-free immunosuppression based on antithymocyte globulin and mycophenolate mofetil in cadaveric kidney transplantation: results after 5 years. Transpl Int 2003;16:820-7. [ Links ]
9. Lo A, Egidi MF, Gaber LW, Amiri HS, Vera S, Nezakatgoo N, et al. Comparison of sirolimus-based calcineurin inhibitor-sparing and calcineurin inhibitor-free regimens in cadaveric renal transplantation. Transplantation 2004;77:1228-35. [ Links ]
10. Hernández D, González-Posada JM. Evidencias en la inmunosupresión de mantenimiento en el trasplante renal. Nefrologia 2005;25:369-80. [ Links ]
11. Pascual J. Everolimus: immunosuppression with antilymphoproliferative therapy. Nefrologia 2004;24:112-23. [ Links ]
12. Flechner SM, Kurian SM, Solez K, Cook DJ, Burke JT, Rollin H, et al. De novo kidney transplantation without use of calcineurin inhibitors preserves renal structure and function at two years. Am J Transplant 2004;4:1776-85. [ Links ]
13. Glotz D, Charpentier B, Abramovicz D, Lang P, Rostaing 1, Rifle G, et al. Thymoglobulin induction and sirolimus versus tacrolimus in kidney transplant recipients receiving mycophenolate mofetil and steroids. Transplantation 2010;89:1511-7. [ Links ]
14. Araki K, Turner AP, Shaffer VO, Gangappa S, Keller SA, Bachmann MF, et al. mTOR regulates memory CD8 T-cell differentiation. Nature 2009;460:108-12. [ Links ]
15. Morelon E, Lefrançois N, Besson C, Prévautel J, Brunet M, Touraine JL, et al. Preferential increase in memory and regulatory subsets during T-lymphocyte immune reconstitution after Thymoglobulin induction therapy with maintenance sirolimus vs cyclosporine. Transpl Immunol 2010;23:53-8. [ Links ]
16. Pascual J. Everolimus in clinical practice renal transplantation. Nephrol Dial Transplant 2006;21(Suppl 3):iii18-23. [ Links ]
17. Lorber MI, Mulgaonkar S, Butt KM, Elkhammas E, Mendez R, Rajagopalan PR, et al. Everolimus versus mycophenolate mofetil in the prevention of rejection in de novo renal transplant recipients: a 3-year randomized, multicenter, phase III study. Transplantation 2005;80:244-52. [ Links ]
18. Vítko S, Margreiter R, Weimar W, Dantal J, Kuypers D, Winkler M, et al. Three-year efficacy and safety results from a study of everolimus versus mycophenolate mofetil in de novo renal transplant patients. Am J Transplant 2005;5:2521-30. [ Links ]
19. Tedesco-Silva H Jr, Vitko S, Pascual J, Eris J, Magee JC, Whelchel J, et al. 12-month safety and efficacy of everolimus with reduced exposure cyclosporine in de novo renal transplant recipients. Transpl Int 2007;20:27-36. [ Links ]
20. Salvadori M, Scolari MP, Bertoni E, Citterio F, Rigotti P, Cossu M, et al. Everolimus with very low-exposure cyclosporine a in de novo kidney transplantation: a multicenter, randomized, controlled trial. Transplantation 2009;88:1194-202. [ Links ]
21. Tedesco Silva H Jr, Cibrik D, Johnston T, Lackova E, Mange K, Panis C, et al. Everolimus plus reduced-exposure CsA versus mycophenolic acid plus standard-exposure CsA in renal-transplant recipients. Am J Transplant 2010;10:1401-13. [ Links ]
22. Dantal J, Berthoux F, Moal MC, Rostaing L, Legendre C, Genin R, et al. Efficacy and safety of de novo or early everolimus with low cyclosporine in deceased-donor kidney transplant recipients at specified risk of delayed graft function: 12-month results of a randomized, multicenter trial. Transpl Int 2010 May 24 [Epub ahead of print] [ Links ]
23. Chan L, Greenstein S, Hardy MA, Hartmann E, Bunnapradist S, Cibrik D, et al. Multicenter, randomized study of the use of everolimus with tacrolimus after renal transplantation demonstrates its effectiveness. Transplantation 2008;85:821-6. [ Links ]
24. Pascual J, Del Castillo D, Cabello M, Pallardó L, Grinyó JM, Fernández AM, et al. Interaction between everolimus and tacrolimus in renal transplant recipients: a pharmacokinetic controlled trial. Transplantation 2010;89:994-1000. [ Links ]
25. Ekberg H, Tedesco-Silva H, Demirbas A, Vítko S, Nashan B, Gürkan A, et al. Reduced exposure to calcineurin inhibitors in renal transplantation. N Engl J Med 2007;357:2562-75. [ Links ]
26. Albano L, Berthoux F, Moal MC, Rostaing L, Legendre C, Genin R, et al. Incidence of delayed graft function and wound healing complications after deceased-donor kidney transplantation is not affected by de novo everolimus. Transplantation 2009;88:69-76. [ Links ]
27. Hernández D, Rufino M, Armas S, González A, Gutiérrez P, Barbero P, et al. Retrospective analysis of surgical complications following cadaveric kidney transplantation in the modern transplant era. Nephrol Dial Transplant 2006;21:2908-15. [ Links ]
28. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant 2009;9(Suppl 3):S1-155. [ Links ]
29. Mulay AV, Hussain N, Fergusson D, Knoll GA. Calcineurin inhibitor withdrawal from sirolimus-based therapy in kidney transplantation: a systematic review of randomized trials. Am J Transplant 2005;5:1748-56. [ Links ]
30. Guba M, Pratschke J, Hugo C, Krämer BK, Nohr-Westphal C, Brockmann J, SMART-Study Group. Renal function, efficacy, and safety of sirolimusand mycophenolate mofetil after short-term calcineurin inhibitor-based quadrupletherapy in de novo renal transplant patients: one-year analysis of a randomizedmulticenter trial. Transplantation. 2010; 90 :175-83 [ Links ]
31. Morales JM, Grinyó JM, Campistol JM, García-Martínez J, Arias M, Paul J, et al. Improved renal function, with similar proteinuria, after two years of early tacrolimus withdrawal from a regimen of sirolimus plus tacrolimus. Transplantation 2008;86:620-2. [ Links ]
32. Lee PC, Lee CY, Hu RH, Lo C, Tsai MK, Lee PH. Intrarenal vascular resistance parameters in kidney transplant patients receiving calcineurin inhibitor-based or sirolimus-based regimens. Nephrol Dial Transplant 2010;25:1675-80. [ Links ]
33. Schena FP, Pascoe MD, Alberu J, del Carmen Rial M, Oberbauer R, Brennan DC, et al. Conversion from calcineurin inhibitors to sirolimus maintenance therapy in renal allograft recipients: 24-month efficacy and safety results from the CONVERT trial. Transplantation 2009;87:233-42. [ Links ]
34. Lebranchu Y, Thierry A, Toupance O, Westeel PF, Etienne I, Thervet E, et al. Efficacy on renal function of early conversion from cyclosporine to sirolimus 3 months after renal transplantation: concept study. Am J Transplant 2009;9:1115-23. [ Links ]
35. Servais A, Meas-Yedid V, Toupance O, Lebranchu Y, Thierry A, Moulin B, et al. Interstitial fibrosis quantification in renal transplant recipients randomized to continue cyclosporine or convert to sirolimus. Am J Transplant 2009;9:2552-60. [ Links ]
36. Holdaas H, Bentdal O, Pfeffer P, Mjørnstedt L, Solbu D, Midtvedt K. Early, abrupt conversion of de novo renal transplant patients from cyclosporine to everolimus: results of a pilot study. Clin Transplant 2008;22:366-71. [ Links ]
37. Ruiz JC, Sánchez A, Rengel M, Beneyto I, Plaza JJ, Zárraga S, et al. Use of the new proliferation signal inhibitor everolimus in renal transplant patients in Spain: preliminary results of the EVERODATA registry. Transplant Proc 2007;39:2157-9. [ Links ]
38. Fernández A, Marcén R, Galeano C, Caldés S, Amezquita Y, Villafruela J, et al. Complete switch to everolimus in long-term kidney transplants: evolution of the renal function. Transplant Proc 2009;41:2345-7. [ Links ]
39. Inza A, Balda S, Álvarez E, Zárraga S, Gaínza FJ, Lampreabe I. Conversion to everolimus in kidney transplant recipients with decreased renal function. Transplant Proc 2009;41:2134-6. [ Links ]
40. Bemelman FJ, De Maar EF, Press RR, Van Kan HJ, Ten Berge IJ, Homan van der Heide JJ, et al. Minimization of maintenance immunosuppression early after renal transplantation: an interim analysis. Transplantation 2009;88:421-8. [ Links ]
41. Sánchez-Fructuoso A, Ruiz JC, Hernández D, Sánchez-Plumed J, Fernández A, Pastor Rodríguez A, et al. Early everolimus introduction and calcineurine inhibitor withdrawal in renal transplant patients: a multicenter, randomized open-label study (The ERIC study) (abstract). Am J Transplant 2010;10(Suppl. 4):506. [ Links ]
42. Lutz J, Zou H, Liu S, Antus B, Heemann U. Apoptosis and treatment of chronic allograft nephropathy with everolimus. Transplantation 2003;76:508-15. [ Links ]
43. Koch M, Mengel M, Poehnert D, Nashan B. Effects of everolimus on cellular and humoral immune processes leading to chronic allograft nephropathy in a rat model with sensitized recipients. Transplantation 2007;83:498-50. [ Links ]
44. Mota A, Arias M, Taskinen EI, Paavonen T, Brault Y, Legendre C, et al. Sirolimus-based therapy following early cyclosporine withdrawal provides significantly improved renal histology and function at 3 years. Am J Transplant 2004;4:953-61. [ Links ]
45. Stallone G, Infante B, Schena A, Battaglia M, Ditonno P, Loverre A, et al. Rapamycin for treatment of chronic allograft nephropathy in renal transplant patients. J Am Soc Nephrol 2005;16:3755-62. [ Links ]
46. Sola E, López V, Gutiérrez C, Cabello M, Burgos D, González Molina M, et al. Evaluation of the efficacy and safety of conversion to sirolimus in 85 renal transplant recipients. Transplant Proc 2009;41:2137-8. [ Links ]
47. Egli A, Köhli S, Dickenmann M, Hirsch HH. Inhibition of polyomavirus BK-specific T-Cell responses by immunosuppressive drugs. Transplantation 2009;88:1161-8. [ Links ]
48. Benavides CA, Pollard VB, Mauiyyedi S, Podder H, Knight R, Kahan BD. BK virus-associated nephropathy in sirolimus-treated renal transplant patients: incidence, course, and clinical outcomes. Transplantation 2007;84:83-8. [ Links ]
49. Franz S, Regeniter A, Hopfer H, Mihatsch M, Dickenmann M. Tubular toxicity in sirolimus- and cyclosporine-based transplant immunosuppression strategies: an ancillary study from a randomized controlled trial. Am J Kidney Dis 2010;5:335-43. [ Links ]
50. Van Ree RM, Oterdoom LH, de Vries AP, Homan van der Heide JJ, Van Son WJ, Navis G, et al. Circulating markers of endothelial dysfunction interact with proteinuria in predicting mortality in renal transplant recipients. Transplantation 2008;86:1713-9. [ Links ]
51. McMullen JR, Sherwood MC, Tarnavski O, Zhang L, Dorfman AL, Shioi T, et al. Inhibition of mTOR signaling with rapamycin regresses established cardiac hypertrophy induced by pressure overload. Circulation 2004;109:3050-5. [ Links ]
52. Gao XM, Wong G, Wang B, Kiriazis H, Moore XL, Su YD, et al. Inhibition of mTOR reduces chronic pressure-overload cardiac hypertrophy and fibrosis. J Hypertens 2006;24:1663-70. [ Links ]
53. Siedlecki AM, Jin X, Muslin AJ. Uremic cardiac hypertrophy is reversed by rapamycin but not by lowering of blood pressure. Kidney Int 2009;75:800-8. [ Links ]
54. Paoletti E, Amidone M, Cassottana P, Gherzi M, Marsano L, Cannella G. Effect of sirolimus on left ventricular hypertrophy in kidney transplant recipients: a 1-year nonrandomized controlled trial. Am J Kidney Dis 2008;52:324-30. [ Links ]
55. Groth CG, Bäckman L, Morales JM, Calne R, Kreis H, Lang P, et al. Sirolimus (rapamycin)-based therapy in human renal transplantation: similar efficacy and different toxicity compared with cyclosporine. Sirolimus European Renal Transplant Study Group. Transplantation 1999;67:1036-42. [ Links ]
56. Elloso MM, Azrolan N, Sehgal SN, Hsu PL, Phiel KL, Kopec CA, et al. Protective effect of the immunosuppressant sirolimus against aortic atherosclerosis in apo E-deficient mice. Am J Transplant 2003;3:562-9. [ Links ]
57. Ramzy D, Rao V, Tumiati LC, Xu N, Miriuka S, Delgado D, et al. Role of endothelin-1 and nitric oxide bioavailability in transplant-related vascular injury: comparative effects of rapamycin and cyclosporine. Circulation 2006;114(1 Suppl):I214-9. [ Links ]
58. Joannides R, Etienne I, Iacob M, de Ligny BH, Barbier S, Bellien J, et al. Comparative effects of sirolimus and cyclosporin on conduit arteries endothelial function in kidney recipients. Transpl Int 2010 Jun 7. [Epub ahead of print]. [ Links ]
59. Seckinger J, Sommerer C, Hinkel UP, Hoffmann O, Zeier M, Schwenger V. Switch of immunosuppression from cyclosporine A to everolimus: impact on pulse wave velocity in stable de-novo renal allograft recipients. J Hypertens 2008;26:2213-9. [ Links ]
60. Webster AC, Lee VW, Chapman JR, Craig JC. Target of rapamycin inhibitors (sirolimus and everolimus) for primary immunosuppression of kidney transplant recipients: a systematic review and meta-analysis of randomized trials. Transplantation 2006;81:1234-48. [ Links ]
61. Fortun J, Martín-Dávila P, Pascual J, Cervera C, Moreno A, Gavaldá J, et al. Immunosuppressive therapy and infection after kidney transplantation. Transpl Infect Dis 2010 Jun 11. [Epub ahead of print]. [ Links ]
62. Sun Y, Pei W, Welte T, Wu Y, Ye S, Yang Y. Cytomegalovirus infection is associated with elevated interleukin-10 in coronary artery disease. Atherosclerosis 2005;179:133-7. [ Links ]
63. De Mattos AM, Prather J, Olyaei AJ, Shibagaki Y, Keith DS, Mori M, et al. Cardiovascular events following renal transplantation: role of traditional and transplant-specific risk factors. Kidney Int 2006;70:757-64. [ Links ]
64. Teutonico A, Schena PF, Di Paolo S. Glucose metabolism in renal transplant recipients: effect of calcineurin inhibitor withdrawal and conversion to sirolimus. J Am Soc Nephrol 2005;16:3128-35. [ Links ]
65. Di Paolo S, Teutonico A, Leogrande D, Capobianco C, Schena PF. Chronic inhibition of mammalian target of rapamycin signaling downregulates insulin receptor substrates 1 and 2 and AKT activation: A crossroad between cancer and diabetes? J Am Soc Nephrol 2006;17:2236-44. [ Links ]
66. Johnston O, Rose CL, Webster AC, Gill JS. Sirolimus is associated with new-onset diabetes in kidney transplant recipients. J Am Soc Nephrol 2008;19: 1411-8. [ Links ]
67. Fraenkel M, Ketzinel-Gilad M, Ariav Y, Pappo O, Karaca M, Castel J, et al. mTOR inhibition by rapamycin prevents beta-cell adaptation to hyperglycemia and exacerbates the metabolic state in type 2 diabetes. Diabetes 2008;57:945-57. [ Links ]
68. Kasiske BL, Snyder JJ, Gilbertson DT, Wang C. Cancer after kidney transplantation in the United States. Am J Transplant 2004;4:905-13. [ Links ]
69. Lieberthal W, Levine JS. The role of the mammalian target of rapamycin (mTOR) in renal disease. J Am Soc Nephrol 2009;20:2493-502. [ Links ]
70. Kauffman HM, Cherikh WS, Cheng Y, Hanto DW, Kahan BD. Maintenance immunosuppression with target-of-rapamycin inhibitors is associated with a reduced incidence of de novo malignancies. Transplantation 2005;80:883-9. [ Links ]
71. Campistol JM, Eris J, Oberbauer R, Friend P, Hutchison B, Morales JM, et al. Sirolimus therapy after early cyclosporine withdrawal reduces the risk for cancer in adult renal transplantation. J Am Soc Nephrol 2006;17:581-9. [ Links ]
72. Salgo R, Gossmann J, Schöfer H, Kachel HG, Kuck J, Geiger H, et al. Switch to a sirolimus-based immunosuppression in long-term renal transplant recipients: reduced rate of (pre-)malignancies and nonmelanoma skin cancer in a prospective, randomized, assessor-blinded, controlled clinical trial. Am J Transplant 2010;10:1385-93. [ Links ]
73. Barozzi P, Bonini C, Potenza L, Masetti M, Cappelli G, Gruarin P, et al. Changes in the immune responses against human herpesvirus-8 in the disease course of posttransplant Kaposi sarcoma. Transplantation 2008;86:738-44. [ Links ]
74. Stallone G, Schena A, Infante B, Di Paolo S, Loverre A, Maggio G, et al.Sirolimus for Kaposi's sarcoma in renal-transplant recipients. N Engl J Med 2005; 352:1317-23. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Domingo Hernández Marrero,
Servicio de Nefrología,
Hospital Regional Universitario Carlos Haya,
Avda. Carlos Haya s/n, 29010, Málaga
domingohernandez@gmail.com
dhmarrero@hotmail.com
Enviado a Revisar: 5 Jul. 2010
Aceptado el: 19 Jul. 2010














