Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.23 no.4 Madrid jul./ago. 2008
ORIGINAL
Relación entre las cantidades de cobre y zinc administradas a pacientes graves con nutrición parenteral total y los niveles de cobre y zinc en plasma y eritrocitos
Relationship between the amount of copper and zinc given to critically ill patients on total parenteral nutrition and plasma and erythrocyte copper and zinc levels
A. M. Menéndez1, A. Weisstaub2, H. Montemerlo1, S. Alloatti2, M. E. Guidoni1, F. Rusi1 y M. L. de Portela1,2
1Instituto Argentino de Educación e Investigación en Nutrición. Buenos Aires. Argentina. 2Cátedra de Nutrición. Facultad de Farmacia y Bioquímica, UBA. Buenos Aires. Argentina.
Dirección para correspondencia
RESUMEN
Objetivos: Evitar tanto las complicaciones por deficiencia de zinc y de cobre como los efectos adversos del exceso en pacientes graves que requirieron nutrición parenteral, estudiando la relación entre las cantidades de zinc y de cobre administradas en las mezclas de nutrición parenteral y los cambios en algunos indicadores bioquímicos de los pacientes, con respecto a zinc y cobre.
Pacientes y metodología: 29 pacientes graves, adultos, con pancreatitis o sometidos a cirugía mayor abdominal. Se determinó, al inicio y al final del tratamiento (5-21 días): cobre y zinc en las mezclas de nutrición parenteral administradas y en eritrocitos (GR), zinc en plasma y cobre en suero (Espectrometría de Absorción Atómica).
Resultados (promedio ± DE, rangos: entre paréntesis): los valores de zinc y cobre en las mezclas de nutrición parenteral fueron (μg/mL): zinc: 4,2 ± 1,7 (1,8 a 9,3); cobre: 0,94 ± 0,66 (0,1 a 3,1); zinc plasmático (μg/dl): inicio 80 ± 45 (29-205); final: 122 ± 56 (37-229); zinc eritrocitario (μg/dl): inicio: 2.300 ± 1.070 (790-5280); final: 2.160± 920 (790-4.440); cobre sérico (μg/dl): inicio: 124 ± 35 (62-211); final: 128 ± 41 (60-238); cobre eritrocitario (μg/dl): inicio: 72 ± 39 (4-183); final: 70 ± 41 (9-156). Los cambios porcentuales de los niveles de zinc eritrocitario correlacionaron con el zinc (mg/d) en las mezclas de nutrición parenteral (r = 0,38). Las variaciones de cobre sérico y eritrocitario correlacionaron positivamente con los valores de cobre administrado (mg/d) en las mezclas de nutrición parenteral (r = 0,31 y 0,26, respectivamente).
Conclusiones: Estos resultados evidenciaron que: 1) las determinaciones de zinc eritrocitario, cobre sérico o eritrocitario serían de utilidad para controlar los niveles de zinc y de cobre administrados en las mezclas de nutrición parenteral a los pacientes graves; 2) las dosis de zinc deberían ser menores a 8,1 mg/d, y 3) no sería aconsejable administrar dosis de cobre superiores a 1,2 mg/d.
Palabras clave: Zinc. Cobre. Nutrición parenteral. Paciente crítico.
ABSTRACT
Objectives: Complications resulting from zinc and copper deficiency, or adverse effects from excessive zinc and copper intake should be avoided during total parenteral nutrition (TPN). This study was conducted on critically ill patients requiring TPN to determine the relationship between the zinc and copper levels of the TPN mixtures, patients' clinical progression, and changes in plasma levels of zinc, serum levels of copper, and erythrocyte levels of zinc and copper.
Patients and methods: 29 adult critically ill patients following pancreatitis or after a major abdominal surgery were studied. Zinc and copper levels in TPN, plasmatic zinc levels, copper serum levels and erythrocyte levels of zinc and copper were determined at the onset and at the end of the treatment (5-21 days) (using Atomic Absorption Spectrometry).
Results: The mean ± standard deviation (and ranges in parenthesis) of zinc and copper levels in TPN were (μg/mL): zinc: 4.2 ± 1.7 (1.8 a 9.3); copper: 0.94 ± 0.66 (0.1 a 3.1). Biochemical parameters at the onset and at the end of the treatment were, respectively: (μg/mL): plasmatic zinc: 80 ± 45 (29-205) and 122 ± 56 (37-229); erythrocyte zinc: 2,300 ± 1,070 (790-5,280) and 2,160 ± 920 (790-4,440); serum copper (μg/dL): 124 ± 35 (62-211) and 128 ± 41 (60- 238); erythrocyte copper (μg/dl): 72 ± 39 (4-183) and 70 ± 41 (9-156). Plasmatic and erythrocyte zinc levels did not correlated neither at the onset nor at the end of the treatment. Changes in erythrocyte zinc levels correlated with daily administered zinc (mg/d) in the parenteral nutrition (r = 0.38). Serum copper and erythrocyte copper showed significant correlation at the onset (p = 0.0005) and at the end of treatment (p = 0.008). Changes of serum or erythrocyte copper levels showed a significant correlation with daily administered copper (r = 0.31 and 0.26, respectively).
Conclusions: These results show that: 1) determination of erythrocyte zinc and copper levels in these critically ill patients would help to control zinc and copper administration levels in TPN and avoid adverse effects; 2) TPN Zn levels should be less than 8.1 mg/d, and 3) TPN Cu levels higher than 1.2 mg/d would not be recommended.
Key words: Zinc. Copper. Parenteral nutrition. Critical patients.
Introducción
El zinc (Zn) y el cobre (Cu) son micronutrientes minerales esenciales que regulan numerosos procesos metabólicos y cuya deficiencia produce anormalidades fisiológicas y estructurales1, 2.
El Zn es esencial para la actividad de numerosas enzimas, de las cuales las más conocidas se relacionan con la utilización de la energía, la síntesis de proteínas y la protección oxidativa. Además, tiene un papel fundamental en la estabilización de macromoléculas de las membranas celulares, de ciertos receptores nucleares (de hormonas esteroides, tiroideas y retinoides) y en la regulación de la transcripción, uniéndose a proteínas nucleares. En general, todas esas funciones están relacionadas con la capacidad del Zn de estabilizar los sitios activos, uniéndose a la histidina y cisteína, formando complejos llamados "Zinc fingers"1, 3, 4.
El Cu es otro micronutriente mineral esencial que forma parte de cupro-proteínas (cupreínas) y enzimas cobre-dependientes que intervienen en reacciones oxidativas relacionadas con el metabolismo del hierro, de los aminoácidos precursores de neurotransmisores, del tejido conectivo y con la destrucción de radicales libres2, 5, 6.
La deficiencia severa de Zn presenta síntomas característicos (hiperqueratosis y paraqueratosis de la piel, esófago y estómago, dermatosis, alopecia, lesiones oculares, atrofia testicular, retardo del crecimiento y anorexia). En el caso de deficiencias marginales se observa disminución de la cicatrización de las heridas y alteraciones inespecíficas de la función inmunitaria3, 4. La deficiencia de Cu, en ratas y en el hombre, produce leucopenia con neutropenia, anemia microcítica hipocrómica (ferropénica), alteraciones de tejido conectivo, acromotipia, desmielinización y pancitopenia5, 6.
Las necesidades diarias de Zn y de Cu son discutidas. Las Ingestas Recomendadas, basadas en la técnica de balance y en el método factorial, han establecido que los adultos normales necesitan absorber para cubrir las pérdidas inevitables, en promedio por día, 2,2 mg de Zn y 300 μg de Cu7. Sin embargo, los requerimientos de Zn y Cu en pacientes graves que deben recibir nutrición parenteral total (NPT) son motivo de discusión, debido a la posibilidad de pérdidas incrementadas8, 9 y a que los mecanismos de homeostasis de estos micronutrientes están interrelacionados de modo no claro.
En el pasado, los pacientes que recibían NPT sin agregado de estos micronutrientes manifestaban alteraciones en los niveles plasmáticos y síntomas clínicos, indicativos de deficiencia aguda de Zn y/o de Cu10. Por ello, gran parte del avance en el conocimiento de las necesidades de Zn y Cu se debe a la administración de fórmulas para nutrición parenteral que no tenían incorporados estos micronutrientes o los tenían en cantidad insuficiente11, 12. Sin embargo, la falta de conocimientos hace que se agreguen en las mezclas para NPT en forma empírica.
Se debe tener en cuenta que, a pesar de estar demostrada su esencialidad y existir recomendaciones de cantidades a administrar, aún en la actualidad se puede presentar deficiencia con sintomatología clínica y bioquímica en individuos que reciben mezclas comerciales de NPT elaboradas sin oligoelementos debido a problemas de estabilidad físico-química.
Por otra parte, tanto el exceso de Zn como el de Cu pueden producir efectos adversos asociados con el deterioro del estado nutricional y alteraciones en la respuesta inmune7. En función de las evidencias clínicas se sugiere precaución en su administración en las fórmulas para nutrición parenteral puesto que podrían administrarse, en algunos casos, cantidades insuficientes para lograr la recuperación del paciente grave o, en otras situaciones, cantidades excesivas que pueden comprometer la evolución favorable del paciente grave o producir manifestaciones de toxicidad10, 13.
En este sentido se debe tener en cuenta que los componentes individuales utilizados para preparar las mezclas de NPT suelen estar contaminados con elementos traza no declarados en las etiquetas; esos contaminantes están presentes en concentraciones variables según el fabricante, componente, lote, etc., resultando una subestimación de las cantidades de Cu y Zn realmente administradas en relación a las prescriptas14. En trabajos previos hemos corroborado que los niveles de Zn y Cu en las mezclas de NPT son, en general, superiores a los prescriptos para pacientes graves15. Estos minerales provienen de contaminación no prevista y muy difícil de evitar y controlar por parte de la industria durante el proceso de fabricación de los componentes, pero no son determinados ni declarados en los productos utilizados en la preparación de las mezclas de NPT. Por lo tanto, es de suma importancia conocer el contenido real de Cu y Zn en las fórmulas de NPT y efectuar el seguimiento de los pacientes, con objeto de modificar los aportes en función de las necesidades. De este modo se podrían evitar tanto las deficiencias como los excesos, que pueden comprometer la evolución del paciente grave.
Objetivos
Estudiar, en pacientes graves que requirieron nutrición parenteral: 1) las cantidades de Cu y de Zn presentes en las bolsas de NPT, en relación a las prescriptas; 2) los cambios en los niveles plasmáticos de Zn, los niveles séricos de Cu y los niveles eritrocitarios de Cu y de Zn, y 3) La relación entre los cambios en los parámetros bioquímicos, las cantidades administradas de Zn y Cu y la evolución clínica de los pacientes.
Materiales y métodos
El trabajo se realizó de acuerdo a las Normas Eticas Internacionales. Los sujetos, o sus familiares a cargo, expresaron su consentimiento, de acuerdo a las Normas de Éticas del Comité de Docencia e Investigación de los Centros Asistenciales privados participantes.
Población
Se estudiaron 29 pacientes adultos, clínicamente graves, teniendo en cuenta los siguientes criterios de inclusión: 1) necesidad de recibir TPN durante un período corto (de 5 a 21 días) por no poder recibir alimentación por vía oral o enteral, y 2) ausencia de fístulas de más de 400 mL de débito diario. El profesional médico consideró evolución favorable cuando a los pacientes se les pudo retirar la NPT y reemplazarla por alimentación enteral u oral.
Las características de los pacientes figuran en la tabla I. Todas las patologías estaban relacionadas con el aparato digestivo y fueron: pancreatitis aguda (n = 5), pacientes postquirúrgicos (cirugía mayor abdominal):íleo post-cesárea (n = 1), oclusión intestinal (n = 3), íleo con úlcera perforada (n = 2), íleo con oclusión intestinal (n = 2), cáncer de páncreas (n = 8), cáncer de colon (n = 1), peritonitis con cáncer gástrico (n = 1), colestasis (n = 1), peritonitis (n = 1), fístula post-cirugía abdominal (n = 4).
Fórmulas de Nutrición Parenteral
Las fórmulas de NPT fueron indicadas por los médicos y se elaboraron con productos farmacéuticos para vía endovenosa, disponibles en el mercado argentino. La elaboración de la NPT se realizó de acuerdo a las siguientes normativas: Disposición de la Administración Nacional Argentina de Medicamentos, Alimentos y Tecnología Médica-ANMAT-2819/2004; Buenas Prácticas de Fabricación y Control de Especialidades Medicinales16; Disposición de la Administración Nacional Argentina de Medicamentos, Alimentos y Tecnología Médica-ANMAT 2592/200317 y el Sistema de Garantía de Calidad Certificado según Normas ISO 9001/200018.
En Argentina, el zinc y cobre se encuentran disponibles en: 1) envases con dosis individuales de sulfato de zinc, que contiene 0,4 mg/ml de Zn (Lab. Rivero) y envases de 1 mg/mL (Lab. FADA y Rivero). En cuanto al cobre son envases de sulfato de cobre con 0,4 mg/mL de Cu (Lab. FADA y Rivero). 2) Multidosis: envase de elementos traza que contiene 0,327 mg/mL de Zn y 0,076 mg/mL de Cu, además de hierro, selenio, cromo, molibdeno, manganeso, flúor, iodo (Tracutil®, Lab. Braun y Ritraz®, Laboratorio Rivero).
Determinaciones de laboratorio
Se determinó el contenido de Zn y Cu en 2 ó 3 bolsas de NPT de cada paciente, al comienzo (To) y al final (Tf) del tratamiento. Las muestras de la NPT fueron previamente mineralizadas por vía seca, durante 12 hs en mufla a 550 oC, hasta cenizas blancas, disueltas enácido nítrico p.a. y diluidas adecuadamente con agua ultrapura19.
Los indicadores bioquímicos determinados en los pacientes al comienzo (To) y al final (Tf) del tratamiento fueron: 1) en sangre entera, extraída en ayunas: Hemoglobina (Hb) (método de la cianometahemoglobina); 2) en eritrocitos (GR) (previamente lavados con solución isotónica y hemolizados con agua ultrapura): Zn y Cu; 3) en plasma: Zn (ZnPl), y 4) en suero: Cu (CuS).
Zn y Cu se determinaron por Espectrofotometría de Absorción Atómica utilizando un espectrofotómetro Varian, modelo SpectrAA-20, con llama de aire-acetileno. Para el Zn se utilizó: slit de 1,0 mm y longitud de onda de 213,9 nm; para Cu: slit de 1,0 mm y longitud de onda de 327,4 nm. Todo el material fue previamente lavado con ácido nítrico al 20% y enjuagado con agua desionizada20.
Análisis estadístico: Los datos descriptivos se expresaron como promedio ± desvío estándar (DE). Se aplicó análisis de regresión y correlación simple con un nivel de confianza de 95% cuando fue necesario21.
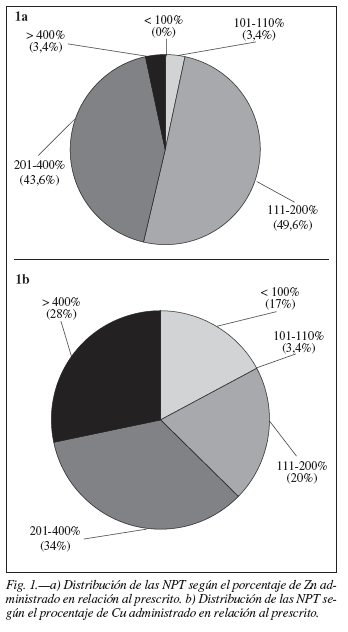
Resultados Contenido de Zn y Cu en las NPT Los valores de Cu y Zn en las fórmulas fueron, promedio± DE y rangos, en μg/mL: Cu: 0,94 ± 0,66 (rango: 0,1 a 3,1); Zn 4,2 ± 1,7 (rango: 1,8 a 9,3). En la tabla II se expresan los resultados de Zn y Cu en mg/día, en función de los volúmenes administrados de NPT, y en las figuras 1a) y 1b) se muestra la distribución de las fórmulas de NPT según el porcentaje de la cantidad administrada en relación a la prescripción médica de Zn y Cu, respectivamente.
Evolución de los pacientes: Fue favorable en 26 casos, que al finalizar la administración de NPT toleraron la nutrición enteral u oral. Tres pacientes fallecieron, luego de 5 a 18 días de recibir la NPT; sus patologías eran: un caso de cáncer de páncreas, uno de pancreatitis aguda y uno de fístula intestinal.
Parámetros bioquímicos: En la tabla III figuran los promedios y rangos de los parámetros bioquímicos, en relación al Zn, a To y Tf. Las figuras 2 y 3 muestran los valores individuales de Zn en plasma y en eritrocitos en los pacientes estudiados a To y Tf, pudiendo apreciarse una gran dispersión de los datos, tanto de ZnPl como de ZnGR. En dichas figuras se han señalado como valores de referencia los obtenidos en individuos normales de Buenos Aires (Argentina), con adecuación nutricional15. Los valores de ZnPl no correlacionaron con los de Zn GR ni a To ni a Tf. Sin embargo, los cambios en los niveles de ZnGR entre Tf y To (expresados como porcentaje del valor a To) presentaron correlación positiva con la cantidad de Zn administrada en la NPT (r = 0,38); la ecuación de regresión indica que cuando la cantidad administrada de Zn fue superior a 8,1 mg/día las variaciones de ZnGR fueron positivas.
Los niveles de Cu en suero y eritrocitos en los pacientes estudiados se muestran en la tabla IV. Los valores individuales de Cu sérico y eritrocitario a To y a Tf presentaron, al igual que los valores de Zn, una gran dispersión (figs. 4 y 5). Por otra parte, a diferencia del Zn, CuS correlacionó significativamente con CuGR, tanto a To (p = 0,0005) como a Tf (p = 0,008). Además, en las figuras 6 y 7 se observa que las variaciones de CuS y las de CuGR (entre Tf y To, expresadas en forma porcentual en relación a To) correlacionaron positivamente con los valores de Cu administrado (mg/d) en la NPT (r = 0,31 y 0,26, respectivamente). La ecuación de regresión indica que cuando la cantidad administrada de Cu en la NPT fue superior a 0,8 las variaciones en el CuS fueron positivas, pero las variaciones en los niveles en glóbulos rojos fueron positivas cuando las cantidades administradas fueron superiores a 1,2 mg/d.
Discusión
Los resultados del presente trabajo evidencian valores de Zn y de Cu en las mezclas de NPT más elevados que las cantidades prescriptas por el médico, de acuerdo a los valores teóricos del protocolo de elaboración. En las figuras 1 a) y 1 b) se puede apreciar la distribución de las fórmulas de NPT según el porcentajereal de Zn y de Cu en relación a la cantidad prescripta por el médico.
Con respecto al Zn, las mezclas de NPT contenían en 28 de los casos entre el 111% y 420% de lo prescripto. Sólo en 1 caso (3,4% del total) la cantidad administrada se encuadró dentro del margen de 10% de variabilidad aceptable según las Buenas Prácticas de Manufactura de la industria farmacéutica.
Con respecto al Cu, las mezclas administradas de NPT contenían en 5 casos (17%) una cantidad inferior al 100% de lo prescripto, de los cuales 3 se encontraban dentro del margen de variabilidad de 10% considerado aceptable según las Buenas Prácticas de Manufactura; sin embargo, en 24 de los casos la cantidad de Cu en las mezclas administradas de NPT oscilaba entre el 111% y 750 % de lo prescripto.
Estos resultados concuerdan con los de un estudio preliminar donde hemos encontrado valores de Zn y de Cu en las NPT superiores a las prescriptas y en algunos casos más elevadas a las descriptas en el presente trabajo15, 22. A consecuencia de dicho hallazgo, los profesionales del equipo de Nutrición comenzaron a reducir las prescripciones y dosis administradas de estos micronutrientes minerales a pacientes graves con NPT.
Se debe tener en cuenta que la concentración final de Zn y Cu en las mezclas de NPT representa la suma de la cantidad prescripta por el médico más la proveniente de la contaminación de cada uno de los componentes provistos por la Industria Farmacéutica para la preparación de la NPT. En un trabajo previo encontramos que el cloruro de sodio, sulfato de magnesio, sulfato de manganeso, cloruro de cromo y ácido selenioso contenían Zn como contaminante, pero no contenían Cu. La concentración de Zn en el gluconato de calcio y en el sulfato de cobre fue considerable, pero estas soluciones aportan escasa cantidad en la NPT, ya que se utilizan volúmenes pequeños15. Sin embargo, las mayores cantidades de Zn y Cu se hallaron en las soluciones de dextrosa, aminoácidos y de lípidos (MCT/LCT), cifras que resultan de importancia porque son soluciones utilizadas en grandes volúmenes en la preparación de la NPT. Por ello son los componentes que contribuyen con las mayores cantidades de Zn y Cu de contaminación en las mezclas de NPT administradas a los pacientes.
Otros autores también han encontrado contaminación importante de diversos minerales en las vitaminas, el agua destilada estéril y el sulfato de magnesio14. Sin embargo, en nuestro caso no encontramos cantidades detectables de Zn ni de Cu en el agua estéril ni en las soluciones de cloruro de potasio15.
En consecuencia, se debe tener en cuenta el riesgo de efectos adversos de dichos micro nutrientes al ser administrados en exceso en relación a la prescripción.
No hay acuerdo unánime en las distintas Sociedades Científicas, en relación a la prescripción de Zn y de Cu en pacientes graves que reciben NPT. La AMA desde el año 1979 recomienda como requerimiento intravenoso para los pacientes adultos alimentados por vía parenteral valores surgidos de estimaciones del método factorial23. Sin embargo, la American Society of Parenteral and Enteral Nutrition -ASPEN- estableció en el año 2001 cifras diferentes24, que para el Cu representan más de la tercera parte de las aconsejadas por la AMA y ESPEN25 para pacientes adultos (tabla V). Por otra parte, las dosis indicadas por los médicos en nuestro país para estos pacientes fueron mayores a las recomendadas por diferentes autores, especialmente para el Zn y Cu (tabla V), siendo la práctica habitual en Argentina preparar, para adultos, mezclas de NPT con 5 a 6,5 mg de Zn y 0,8 a 1,5 mg de Cu, sin aparentes efectos adversos. Algunos autores han considerado que la adición de 4,9 a 5,6 mg/d podría promover mejores niveles de Zn plasmáticos y balance positivo en pacientes graves26.
Se ha documentado que el exceso de Zn produce supresión de la respuesta inmune y deterioro del estado nutricional con respecto al Cu y al Fe. En el caso del cobre los efectos adversos comprobados incluyen alteraciones gastrointestinales, daño hepático, interacción con Zn, Fe y Mo, deterioro del estado nutricional con respecto al Zn y al Fe y disminución de la actividad fagocítica de los polimorfonucleares. Las cantidades administradas de zinc y cobre superiores a las prescriptas no traerían inconvenientes en pacientes clínicamente estables, pero el exceso de zinc podría producir efectos adversos en pacientes con enfermedades inflamatorias o insuficiencia renal. En el caso del exceso de cobre, se debe tener especial cuidado en pacientes con nutrición parenteral que presenten colestasis o compromiso hepático27, 28.
Por lo tanto, es importante utilizar indicadores bioquímicos que alerten acerca de posibles problemas. Sin embargo, la evaluación del estado nutricional con respecto a estos micronutrientes minerales no es fácil y constituye un campo de la Nutrición en pleno desarrollo, ligado al avance en el conocimiento de sus funciones bioquímicas29, 30. Las determinaciones de Zn y Cu en muestras biológicas tradicionales como suero, plasma y glóbulos rojos, son propuestas como los indicadores más comunes, pese a que, hasta la fecha, no existe un indicador bioquímico único que confirme el estado nutricional con respecto al Zn o al Cu. En el presente trabajo se decidió realizar las determinaciones de Zn plasmático, Cu sérico y Zn y Cu en eritrocitos, estudiando previamente los valores de referencia en individuos sanos de Buenos Aires15.
En la figura 2 se puede observar que al inicio de la NPT, los niveles de Zn plasmático fueron sumamente variables indicando la respuesta individual de redistribución del Zn corporal de cada paciente a consecuencia del estrés de su patología y, en algunos casos, de la cirugía. En el caso de pacientes graves, la presencia de infección, inflamación y daño tisular produce captación de Zn por el hígado, médula ósea y timo, disminuyendo el Zn en plasma por influencia del aumento de la IL-1 y IL-631-34. Por ello, su disminución puede deberse a dichas alteraciones metabólicas y no a riesgo de deficiencia clínica. Sin embargo, a pesar de las patologías y la gravedad de los pacientes estudiados, sólo 2 de ellos presentaron a To valores de ZnPl inferiores al rango de normalidad y el resto presentó valores normales (n = 18) o altos (n = 9); además, a Tf, solo un paciente, con cáncer de páncreas, presentó valores inferiores al rango de normalidad, manteniéndose en valores normales o altos en el resto. Estos resultados estarían indicando que no existió deficiencia de Zn previa a la administración de la NPT y que a Tf los niveles elevados de ZnPl podrían alertar acerca de posibles efectos adversos. Sin embargo, durante el tratamiento con NPT, no se evidenció correlación entre los cambios en los valores plasmáticos y el Zn administrado en la NPT y a Tf tres pacientes con valores altos normalizaron sus niveles plasmáticos pese a recibir cantidades superiores a las prescriptas (entre 6,2 y 9,2 mg/d).
La determinación de Zn en sangre entera o en eritrocitos refleja la "historia" nutricional en el período de vida media del eritrocito, por ser incorporado en el momento de la eritropoyesis35, 36. En la figura 3 se visualiza que al inicio de la NPT los niveles de Zn eritrocitario se encontraron dentro del rango normal en 9 pacientes y altos en 16. Estos valores indican que no existía deficiencia de Zn en los 3 meses anteriores a la administración de la NPT lo cual también puede ser corroborado por la relación entre el Zn eritrocitario y el plasmático que fue normal o elevada en todos los pacientes. Los valores de ZnPl no correlacionaron con ZnGR ni a To ni a Tf. Sin embargo, la ecuación de regresión de la variación de los niveles de ZnGR entre Tf y To indicó un punto de corte de 8,1 mg/día de Zn en la NPT, lo cual sugiere que no se debería superar esa cantidad en los pacientes graves. No obstante, nuestros resultados evidencian que las variaciones en los niveles de ZnGR fueron siempre positivas cuando los valores de Zn en la TPN fueron superiores a 10 mg/día, lo que indica que cantidades entre 8,1 y 10 mg/día podrían ser necesarias en algunos pacientes graves para promover mejores niveles de Zn eritrocitario y balance positivo13, 26.
Estos resultados evidencian que a pesar de que el contenido de Zn en las mezclas de NPT fue superior al prescripto, los parámetros bioquímicos no indicaron en estos pacientes un exceso de Zn. Se debe tener en cuenta que existen diversas situaciones en las cuales está elevado el requerimiento de Zn: el estrés metabólico, que puede aumentar el requerimiento de Zn en 2 mg más por día; las pérdidas elevadas de Zn en los 20 días posteriores a un trauma, y las pérdidas por fístulas, que pueden representar varias veces los requerimientos normales10.
Las figuras 4 y 5 muestran los valores individuales de Cu en suero y eritrocitos en todos los pacientes estudiados a To y a Tf. Estos resultados evidenciaron que al inicio del tratamiento el Cu sérico se encontró en el rango normal (45-157 μg/dL) en 25 pacientes y elevado en 4. A Tf; se normalizó en 3 pacientes y se incrementó a valores elevados en 6. En cuanto a los valores de Cu eritrocitario a To, se encontró en el rango normal (30-110 μg/dL) en 18 pacientes, con valores bajos en 4 y elevados en 6. A Tf: CuGR se normalizó en 2 pacientes, permaneciendo con valores altos en 4 y con valores bajos en 4.
A diferencia del Zn, el CuS correlacionó significativamente con CuGR, tanto a To (p = 0,0005) como a Tf (0,008). Las ecuaciones de regresión de las variaciones de los valores de Cu en suero y de Cu eritrocitario indican que las cantidades de Cu en la NPT deberían oscilar entre 0,8 y 1,2 mg/d (figs. 6 y 7). Sin embargo, la correlación no fue elevada y en la práctica existieron casos con variaciones negativas en los parámetros bioquímicos cuando el Cu administrado osciló entre 1,2 y 3 mg/d.
Es importante tener en cuenta que el exceso de cobre debe ser evitado en pacientes con alteraciones hepáticas, por lo cual en esos casos el médico suele suprimir en la prescripción la incorporación de este micronutrientes, lo cual ha dado lugar a casos publicados de deficiencia severa con anemia, neutropenia y trombocitopenia, incluso con enfermedad cardíaca progresiva con hipertensión portal y muerte del paciente luego de 19 días de NPT sin Cu37, 38. Por consiguiente, sería recomendable no suprimir la administración de Cu en la NPT sino reducir la dosis (teniendo en cuenta el aporte de la contaminación) y efectuar el seguimiento bioquímico que en el caso del Cu podría realizarse indistintamente a través de la determinación en suero o en eritrocitos, en función de la elevada correlación encontrada en este trabajo.
Estos resultados evidencian una amplia variación de los niveles plasmáticos y eritrocitarios de Zn y Cu en respuesta a diferentes cantidades administradas de dichos micronutrientes, lo que refleja la gran variabilidad de las necesidades en estos pacientes graves con diversas patologías. Por consiguiente, en algunos casos la cantidad administrada fue insuficiente para cubrir sus requerimientos, mientras que en otros casos fue elevada pese a que no hubo síntomas evidentes de efectos adversos.
Conclusiones
Los resultados obtenidos evidenciaron que:
1) Las mezclas de NPT aportaron una cantidad de Zn y Cu más elevada que la prescripta por el médico y que la cantidad agregada por el farmacéutico, de acuerdo a los protocolos de elaboración, debido a contaminación no prevista ni declarada en los componentes individuales. En consecuencia, los fabricantes deberían monitorear en forma periódica el contenido de Zn y Cu de los componentes primarios utilizados para la preparación de las mezclas de NPT e informarlos en los certificados de análisis del producto.
2) En los pacientes graves estudiados, las determinaciones de ZnGR y CuS o CuGR serían de utilidad para controlar, respectivamente, los niveles de zinc y de cobre administrados en la nutrición parenteral.
3) Las dosis de Zn deberían ser menores a 8,1 mg/día y no sería aconsejable administrar dosis de Cu superiores a 1,2 mg/día.
Financiación
Financiado por UBA, subsidio B 103.
Referencias
1. Rubio C, González Weller D, Martín-Izquierdo RE, Revert C, Rodríguez I, Harridson A. El zinc: oligoelemento esencial. Nutr Hosp 2007; 22(1):101-7. [ Links ] 2. O'Dell BL. Copper. En: Present Knowledge in Nutrition, ML Brown. Ed. Nutrition Foundation , 6a ed., Chap. 29: 261-267. Washington, DC; 1990. [ Links ] 3. Aggett PJ, Gomerford JG. Zinc and Human health. Nutr Rev 1995; 53:S16-S22. [ Links ] 4. King JC, Keen CL. Zinc. En: Modern Nutrition in health and disease. 8ª Ed. Shils ME, Olson JA & Shike M,. Vol 1, Lea & Fibiger eds , Cap. 10, 214- 230. Philadelphia, PA; 1994. [ Links ] 5. Turnlund JR. Copper. En: Modern Nutrition in health and disease. Shils ME, Olson JA & Shike M, eds. Vol 1, 8ª Ed; Lea & Febiger, Cap. 11, 231-241. Philadelphia, PA; 1994. [ Links ] 6. Sandstead HH. Requirements and toxicity of essential trace elements, ellustrated by zinc and copper. Am J Clin Nutr 1995; 61(Supl.): 621S-4S. [ Links ] 7. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Molybdenum, Nickel, Silicon, Vanadium and Zinc. Standing Committee on the Scientific Evaluation of Dietary References Intakes, Food and Nutrition Board & Institute of Medicine, National Academy of Sciences, Washington, DC, 2001. [ Links ] 8. Greene HL, Hambidge KM, Schanler R, Tsang RC. Guidelines for the use of vitamins, trace elements, calcium, magnesium, and phosphorus in infants and children receiving total parenteral nutrition: report of the Subcommittee on Pediatric Parenteral Nutrient Requirements from the Committee on Clinical Practice Issues of the American Society for Clinical Nutrition. Am J Clin Nutr 1988; 148:1324-42. [ Links ] 9. Okada A, Takagi Y. Trace element metabolism in parenteral and enteral nutrition. Nutrition 1995; 11:106-13. [ Links ] 10. Fleming CR. Trace elements metabolism in adult patients requiring total parenteral nutrition. Am J Clin Nutr 1989; 49(3): 573-9. [ Links ] 11. Sivasubramanian KN, Henkimn RL. Behavioral and dermatological changes and low serum zinc and Copper concentrations in two premature infants after parenteral alimentation. Journal Pediatric 1978; 93(5):847-851. [ Links ] 12. Sriram K, O'Hara JA, Strunk JR y cols. Neutropenia due to Copper deficiency in TPN. Journal Parenteral and Enteral Nutrition 1986; 10(5):530-532. [ Links ] 13. Braunschweig CA. Trace Elements and the Acute Phase Response: implications for Nutrition Support. En: Micronutrient in Critical Care, Postgraduate Course. Publications of American Society for Parenteral and Enteral Nutrition - ASPEN; 20th Clinical Congress; Washington, 1996; 9-20. [ Links ] 14. Pluhator-Murton MM, Fedorak RN, Audette R, Marriage BJ, Yascoff RW, Gramlich R. Trace Element Contamination of TPN.1.Contribution of component Solutions. JPEN 1999; 23:222-7. [ Links ] 15. MenéndezAM, Weisstaub AR, Montemerlo HJ, Rusi F, Guidoni ME, Piñeiro A, Pita Martín de Portela ML. Contenido de zinc y cobre en los componentes individuales de las mezclas para fórmulas pediátricas de nutrición parenteral total. Nutr Hosp 2007; 22 (5):545-51. [ Links ] 16. Disposición Administración Nacional de Medicamentos, Alimentos y Tecnología Médica -ANMAT- 2819/2004. Buenas Prácticas de Fabricación y Control de Especialidades Medicinales, Publicado en Boletín Oficial de Argentina, Nro. 30416, 07-jun-2004. [ Links ] 17. Disposición de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica -ANMAT- 2592/2003. Actividades de preparación, control, distribución y comercialización en jurisdicción nacional o con destino al comercio interprovincial de los medicamentos clasificados como Mezclas de Nutrición Parenteral Extemporánea. Boletin Oficial de Argentina, N 30.162, 02-Jun-2003. [ Links ] 18. ISO 9000-2000, Norma Internacional de la Organización Internacional de Normalización-Sistemas de Gestión de la Calidad-Requisitos. Secretaría General de ISO, Ginebra, Suiza, 2000. [ Links ] 19. Official Methods of Analysis of the AOAC 13th edition. Washington DC. Association of Official Analytical Chemists, 1980. [ Links ] 20. Perkin Elmer Corp. Analytical method for atomic absorption spectrophotometry. Perkin Elmer Corp. Norwalk C.T. 1971. [ Links ] 21. Sokal RR, Rohi FJ. Biometry: the principles and practice of statistics in biological research. WH Freeman and Company; San Francisco, 1969. [ Links ] 22. Menéndez AM, Montemerlo H, Weisstaub AR, Alloatti S, Russi F, Guidoni ME, Casavola C, Piñeiro A y Pita Martín de Portela ML. Niveles plasmáticos y eritrocitarios de zinc y cobre en pacientes críticos con nutrición parenteral y su relación con el contenido de las fórmulas: estudio preliminar. Nutr Hosp 2005; 20 (9):189-196. [ Links ] 23. American Medical Association, Departament of Foods and Nutrition. Guidelines for essencial trace element preparations for parenteral use: a statement by an expert panel. JAMA 1979; 241(19):2051-2054. [ Links ] 24. ASPEN Board. Guidelines for the Use of Parenteral and Enteral Nutrition in Adult and Pediatric Patients. JPEN 2002; 25:31SA. [ Links ] 25. Shenkin A. Trace elements and vitamins in parenteral and enteral nutrition. En: Basics in Clinical Nutrition. Sobotka L, Allison SP, Fürst P y cols. Edited for European Society for Clinical Nutrition and Metabolism- ESPEN. House Galén; 3rd. ed., Chap. 4.6; 169-174; Prague, Czech Republic, 2004. [ Links ] 26. Prelack O. Micronutrient Supplementation in the critical III Patients: Strategies for Clinical Practice J. Trauma 2001; 51(2): 601-20. [ Links ] 27. Bremmer I. Manifestations of copper excess. Am J Clin Nutr 1998; 67(Supl.):1069S-73S. [ Links ] 28. Turnlund JR, Jacob RA, Keen CL, Strain JJ, Kelley DS, Domek JM, Keyes WR, Ensunsa JL, Lykkesfeldt J, Coulter J. Long term high copper intake: effects on indexes of copper status, antioxidant status and immune function in young men. Am J Clin Nutr 2000; 79:1037-44. [ Links ] 29. Solomons NW. On the assesment of Zinc and Copper nutriture in man. Am J Clin Nutr 1979; 32:856-871. [ Links ] 30. Pita Martín de Portela ML. En: Aplicación de la bioquímica a la evaluación del estado nutricional. Pita Martín de Portela ML, Río ME y Slobodianik NH. López Libreros Editores, Cap IV: 96-120; Buenos Aires, 1997. [ Links ] 31. Beisel WR, Pekarek RS and Wannemacher RW. Homeostatic mechanisms affecting plasma Zinc levels in acute stress. Trace Elem in Humans Health and Dis 1976; 1:87-106. [ Links ] 32. Rink L, Kirchner H. Zinc-altered immune function and cytokine production. J Nutr 2000; 130:1407S-1411S. [ Links ] 33. Schroeder JJ, Cousins RJ. Interleukin 6 regulates metallothionein gene expression and Zinc metabolism in hepatocyte monolayer cultures. Proc Nat'l Acad Sci 1990; 87:3137-3141. [ Links ] 34. Gibson RS. Assessment of Zinc Status. En: Principles of Nutritiona Assessment. Oxford University Press. Chap 24.5. 542-553. New York & Oxford; 1990. [ Links ] 35. Ruz M, Cavan K, Bettger WJ, Gibson R Erythrocytes, erythrocytes membranes, neutrophils and platelets as biopsy materials for the assesment of zinc status in humans. Brit J of Nutr 1992; 68:5115-5127. [ Links ] 36. Gibson RS: Assessment of Copper Status. En: Principles of Nutritional Assessment. Oxford University Press. Chap 24.2. 520-26. New York & Oxford; 1990. [ Links ] 37. Turnlund JR. Human whole-body copper metabolism. Am J Clin Nutr 1998; 67(Supl.):960S-4S. [ Links ] 38. Fuhrman P, Herrmann V, Masidonski P, Eby, C. Pancytopenia after removal of Copper from Total Parenteral Nutrition. JPEN 2000; 24(6):361-6.
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Luz Pita Martín de Portela.
Cátedra de Nutrición.
Facultad de Farmacia y Bioquímica, UBA.
Junín 956, 2 p.
1113 Buenos Aires, Argentina.
E-mail: mportela@ffyb.uba.ar
Recibido: 18-VII-2007.
Aceptado: 2-X-2007.