Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.33 supl.1 Madrid 2016
Aspectos dietoterapéuticos en situaciones especiales del paciente oncológico. Prebióticos y probióticos, ¿tienen cabida en la terapia nutricional del paciente oncológico?
Dietary-therapeutic aspects of cancer patients in special situations. Prebiotics and probiotics, do they have a place in the nutritional therapy of cancer patients?
Ma José Sendrós Madroño
Unitat de Nutrició Clínica i Dietètica. Servei d'Endocrinologia i Nutrició. Hospital Universitari Germans Trias i Pujol. Badalona. Institut Català d'Oncologia. Badalona, Barcelona
Dirección para correspondencia
RESUMEN
La atención nutricional en el paciente oncohematológico debe formar parte del tratamiento global del paciente.
Las alteraciones debidas a la localización de la neoplasia y los efectos secundarios del tratamiento oncoespecífico muchas veces dificultan o impiden la alimentación oral. Esto puede dar lugar a una desnutrición y es de gran importancia su detección, valoración e intervención temprana.
El primer paso en la intervención nutricional es el consejo dietético.
Este artículo muestra qué aspectos deben tenerse en cuenta para poder elaborar un consejo dietético y la importancia de que este sea individualizado. Se describen como ejemplo cuatro situaciones especiales, donde es necesario trasladar las recomendaciones nutricionales a un plan dietético.
También se incide en el uso de los probióticos en pacientes inmunocomprometidos.
Palabras clave: Desnutrición. Plan nutricional. Consejo dietético. Situaciones especiales. Probiótico.
ABSTRACT
Nutritional care in onco-hematologic patients should be part of the overall treatment of the patient.
Disturbances resulting from tumor localization, especially in tumors of the digestive tract, and their treatments like chemotherapy and radiotherapy and side effects of surgery often prevent oral feeding. This can lead to malnutrition and it is of great importance detection, assessment and intervention.
The first step in nutritional intervention is dietary advice.
This article shows that aspects should be taken into account in order to develop a dietary advice and the importance of it to be individualized. Four special situations are where nutritional recommendations move to a dietary plan.
It also affects the use of probiotics in inmunocompromised patients.
Key words: Malnutrition. Nutritional plan. Dietary counseling. Special situations. Probiotic.
Introducción
La atención nutricional en el paciente oncohematológico debe formar parte del tratamiento global del paciente. Y una valoración nutricional sistemática y su posterior monitorización deberían ser una práctica regular (1).
Las alteraciones debidas a la localización de la neoplasia, especialmente en tumores del tracto digestivo, y los efectos secundarios de la cirugía, quimioterapia y radioterapia, muchas veces dificultan o impiden la alimentación oral.
Esto puede dar lugar a una desnutrición que genera unos cambios en la composición corporal y que puede agravarse debido a la caquexia cancerosa. Es de gran importancia la detección precoz de la desnutrición, su valoración y una intervención temprana, debido a la morbimortalidad que puede comportar (2). Se debe tener en cuenta que el paciente oncohematológico puede presentar situaciones inmunocomprometidas durante la administración de quimioterapia y especialmente durante el trasplante de progenitores hematopoyéticos. En dichas situaciones el riesgo de infecciones oportunistas es más elevado y deben extremarse las medidas higiénicas.
El primer paso en la intervención nutricional es el consejo dietético. Y aunque en muchos casos es necesaria la nutrición artificial, las medidas dietéticas no deben obviarse mientras el paciente es capaz de ingerir (3).
La finalidad del consejo dietético es asesorar sobre la composición, preparación, presentación y administración de los alimentos, para asegurar el mayor beneficio en la nutrición del paciente (4).
Se dispone de recomendaciones dietéticas para cada uno de los síntomas más prevalentes en estos pacientes (5,9,15-21,24,27), pero habitualmente los pacientes no refieren únicamente un síntoma, sino que suelen presentar una combinación de ellos. Además, el diagnóstico, tratamiento oncológico, comorbilidades, esfera psicosocial, hábitos dietéticos, y un estado general y nutricional determinados, comportan que cada paciente sea único y que sea necesaria una adaptación de estas recomendaciones para elaborar un consejo dietético individualizado.
¿Qué aspectos deben tenerse en cuenta en la realización del consejo dietético?
Para poder realizar un consejo dietético individualizado (1-9), debe establecerse un plan nutricional y posteriormente traducirlo a un plan de alimentación acompañado de un consejo higiénico-dietético. Se entiende como nutricional porque se ajusta a las necesidades nutricionales del paciente según su situación clínica; y dietético porque se traduce a un plan alimentario concreto para lograr cubrir las necesidades nutricionales.
La eficacia de las recomendaciones nutricionales y el consejo dietético han sido ampliamente estudiados por el grupo Ravasco (2005), que ha demostrado que pacientes con cáncer de cabeza y cuello que reciben consejo dietético y seguimiento pueden mejorar la calidad de vida en comparación con los que solamente reciben suplementos. Estos resultados se correlacionaron con los de otro estudio realizado con pacientes de cáncer de colon. Se concluye que esta efectividad depende de la capacidad de adaptar el consejo a las necesidades de cada paciente (3).
Para poder elaborar el plan dietético y que este sea adaptado y fácil de seguir, debemos disponer de la mayor información posible del paciente: su historia clínica, valoración nutricional y dietética y esfera psicosocial (4).
REVISIÓN DE LA HISTORIA CLÍNICA
Realizar una revisión de la historia clínica del paciente es fundamental para conocer qué hemos de tener en cuenta para elaborar el plan dietético. Deben conocerse los antecedentes patológicos, las comorbilidades relacionadas con la nutrición, el diagnóstico oncológico, su localización, así como los tratamientos realizados y/o pendientes de realizar y el motivo de ingreso. Todo esto es fundamental para realizar una valoración nutricional y una intervención nutricional adecuada.
La evolución clínica del paciente con cáncer depende de la eficacia del tratamiento sobre la enfermedad de base y de su remisión o curación. No se puede esperar un efecto importante de la dieta cuando la enfermedad clínica progresa o en pacientes en situación terminal, donde la dieta se enfocaría hacia el control de los síntomas.
La comunicación con enfermería, oncología, hematología, oncología radioterapéutica, cirugía y demás profesionales que intervienen en el tratamiento y seguimiento del paciente permite una atención integral en la que todos debemos seguir una línea común.
VALORACIÓN NUTRICIONAL Y DIETÉTICA
En la valoración nutricional y dietética es necesaria una exploración física y antropométrica. La pérdida de peso en el paciente oncológico es importante y frecuente, y se asocia con una menor supervivencia y tolerancia a los tratamientos (7). Se conoce que la pérdida de peso comporta unos cambios en la composición corporal; una pérdida del tejido adiposo o también la disminución de la masa muscular, sobre todo esta última es el factor que parece incidir en la morbi-mortalidad (8,9). De aquí la importancia de detectarla. También conviene observar si hay presencia de edemas o ascitis; esta exploración permitirá afinar en el diagnóstico nutricional y dar respuesta con el soporte nutricional más óptimo.
Debe prestarse especial atención a los condicionantes de la ingesta (falta de piezas dentales, mal encaje de prótesis dental, etc.) y a la aparición de síntomas que pueden tener gran repercusión sobre el estado nutricional y recogerlos en esta valoración, como son: anorexia, plenitud precoz, astenia, disgeusia, disfagia, diarrea, etc.
Es importante conocer la ingesta habitual. Los métodos más utilizados son el recordatorio de 24 horas, el registro dietético de varios días y el cuestionario de frecuencia de consumo de alimentos. En la práctica clínica pueden usarse por separado o conjuntamente. Para estimar la ingesta y poder realizar un cálculo nutricional adecuado es necesaria la intervención de personal entrenado y especializado en esta área. Será necesario cuantificar el cálculo estimado o ajustado de la ingesta, por lo que es importante tener un buen manejo en los métodos de estimación de la ingesta y de su cálculo nutricional. Con esta valoración dietética se establecerá el patrón alimentario que actualmente está realizando el paciente y permitirá detectar los desequilibrios alimentarios que pueden comportar un déficit nutricional (4).
ESFERA PSICOSOCIAL
Otra información que se ha de considerar en el paciente oncohematológico es la esfera psicosocial, que afectará tanto al paciente como a su entorno más cercano, pues el diagnóstico, tratamiento y los efectos secundarios son causas de una nueva adaptación. Y algunas de las reacciones más frecuentes como el miedo, la negación, la rabia, la ansiedad, la culpabilidad, el aislamiento, la dependencia y la tristeza (10) son sentimientos que pueden interferir en la alimentación normal del individuo y manifestarse como síntomas, como por ejemplo anorexia. Puede también aparecer depresión, que es diferente al sentimiento de tristeza y que también puede tener gran repercusión sobre el estado nutricional del individuo.
La enfermedad oncológica conlleva una serie de repercusiones socioeconómicas por la afectación de las relaciones sociales, la situación laboral, la formación y también el nivel económico. Habitualmente, el hecho de enfermar comporta una disminución del poder adquisitivo en el paciente, por la reducción de los ingresos derivados de: la baja laboral, del aumento de los gastos debido a nuevas necesidades como supresión de barreras arquitectónicas, cambios de domicilio, dietas, transporte, etc. (11) En la actualidad, a esta pérdida de poder adquisitivo se une la problemática socioeconómica de la crisis financiera. Esta se ha relacionado con cambios en los alimentos consumidos por la población, tanto desde el punto de vista cuantitativo como cualitativo, especialmente en grupos vulnerables. El precio de los alimentos influye en su elección y puede suponer una barrera para que las familias con bajos ingresos tengan acceso a alimentos más caros y más saludables (12), por lo que es necesario asesorar a las familias en situación de pobreza, o con escasos recursos, en conocimientos y habilidades, para que adquieran autonomía y capacitación en la elaboración de menús y recetas de acuerdo con el presupuesto familiar disponible (13).
Por tanto, no debe obviarse el entorno del paciente, con quién vive, quién prepara las comidas, dónde come y qué alimentos suele comprar. Conocer su cultura y religión es importante para poder respetar las costumbres alimentarias.
DIAGNÓSTICO NUTRICIONAL Y DIAGNÓSTICO DIETÉTICO
Con la valoración nutricional y la valoración dietética podremos extraer un diagnóstico nutricional (estado nutricional en el que se encuentra el paciente) y un diagnóstico dietético, que indicará los desequilibrios dietéticos que pueden comportar un déficit nutricional.
REQUERIMIENTOS NUTRICIONALES
Conocer los requerimientos nutricionales, basándose en la situación clínica, tratamientos oncológicos que esté recibiendo o pendiente de recibir y su actividad física actual, será necesario para establecer el plan nutricional. Y, en función de sus hábitos dietéticos, costumbres y síntomas, será traducido a un plan de alimentación junto con el consejo dietético.
EDUCACIÓN DIETÉTICA Y NUTRICIONAL
Una vez confeccionado el plan de alimentación y el consejo dietético, se debe explicar al paciente las características de este, las ventajas de su adhesión y el porqué de las limitaciones o supresión de ciertos alimentos. Es importante hacerlo de forma clara y con un lenguaje apropiado y disponer del tiempo necesario para responder a las dudas que puedan surgir. Generar un ambiente de confianza es fundamental para entender el entorno del paciente y poder valorar la mejor forma de explicar la pauta y ajustar el material necesario.
Es importante ofrecer al paciente la pauta dietética y nutricional bien definida, en papel o en soporte informático, para un mayor entendimiento. El material ha de estar adaptado al paciente, donde aparezcan las características de la dieta, el listado de alimentos aconsejados y desaconsejados, una estructura de menú diario, posibles intercambios de alimentos y recomendaciones en las cocciones y preparaciones (4).
¿Qué situaciones especiales requieren una adaptación de la pauta dietética y nutricional?
Las situaciones que requieren una adaptación de la pauta dietética y nutricional son las que presentan más riesgo de desnutrición. Generalmente pacientes oncohematológicos, debido a que la localización o el tratamiento dirigido interfieren directamente con el tracto digestivo.
A modo de ejemplo de cómo podemos realizar el manejo de estos consejos nutricionales e higiénico-dietéticos, se presentan tres localizaciones.
NEOPLASIAS DE CABEZA Y CUELLO
Los pacientes con cáncer de cabeza y cuello (14-22) tienen particular riesgo de desnutrición, y la mayor parte de ellos la presentan en algún momento de la enfermedad. Entre alguna de las causas, figuran las relacionadas con hábitos previos, como los dietéticos, el tabaquismo y/o el enolismo; también otras relacionadas con la presencia del propio tumor o por los tratamientos que deben realizar.
La disfagia es un síntoma frecuente. Puede ser consecuencia de la obstrucción del tracto digestivo superior por el tumor, por la afectación de estructuras musculares, óseas o nerviosas de la ablación quirúrgica y también por los efectos de la quimioterapia y/o radioterapia (14). La severidad en la dificultad de la deglución dependerá del tamaño, localización, de la extensión de la resección quirúrgica y su reconstrucción y también de los efectos secundarios de la terapia antineoplásica (15).
Cuando la lesión tumoral es oral, pueden mostrarse dificultades en la fase oral de la deglución, como un defectuoso sellado labial, insuficiente masticación, escaso control del bolo alimenticio, estasis oral y fuga prematura de los alimentos hacia la faringe.
Los pacientes con lesiones localizadas en orofaringe o faringe pueden mostrar un retraso o ausencia del reflejo de la deglución, deficiente contracción faríngea, deficiente inversión epiglótica, o elevación deficiente laríngea o una relajación o incoordinación del esfínter cricofaríngeo. Estas alteraciones pueden dar lugar a una penetración de los alimentos en la laringe o aspiración traqueal.
La evaluación e identificación de la disfagia y conocer la textura o viscosidad más segura para cada paciente es primordial para evitar las complicaciones nutricionales y respiratorias. Por ello, dentro de la valoración que se realiza al paciente, si se detecta un riesgo de presentar disfagia a líquidos, se debería hacer uso del Método de Exploración Volumen-Viscosidad (MECV-V), que permitirá reconocer la textura y viscosidad más segura. En muchos casos será necesario aumentar la consistencia de los líquidos mediante espesantes (16), gelificantes comerciales o espesantes naturales.
La disfagia a sólidos debe valorarse igualmente, ya que comporta la exclusión de cierto tipo de alimentos en aquellos pacientes que rechazan la modificación de la textura de la dieta a triturada. Se deberán dar opciones de cómo podemos sustituir dichos alimentos por otros más blandos y que aporten unos nutrientes similares (por ejemplo, dificultad con la carne, se podría sustituir por pescado blanco con salsa que pueda ser chafado con un tenedor).
Otro síntoma común en esta localización es la mucositis. Se produce por efecto de agentes quimioterápicos o por acción de la radioterapia. La severidad puede variar desde un ligero eritema o úlceras indoloras (mucositis de grado 1) hasta lesiones eritematosas, edematosas, ulceradas, que impiden por completo la alimentación oral (mucositis de grado 4). Estas alteraciones aparecen a la semana de iniciar la radioterapia y pueden persistir durante varias semanas tras finalizar el tratamiento. Suelen comportar una odinodisfagia y disminución en la toma de alimentos tanto sólidos como líquidos. Además, este cambio de la mucosa favorece la colonización por hongos, bacterias o virus, que en un paciente inmunodeprimido puede pasar al torrente circulatorio y producir una sepsis (20).
Las recomendaciones dietéticas van destinadas a favorecer la toma de alimentos para que no agraven las lesiones o provoquen mayor dolor al tomarlos. Asegurando también una correcta hidratación. Su prevención incluye medidas higiénicas y tratamiento de los problemas dentales (1).
La severidad de la mucositis y la tolerancia del paciente es lo que nos condicionará la textura de la dieta, por lo que será necesario poder adaptar los alimentos a la textura más apropiada en cada situación para asegurar un buen aporte nutricional.
Se comienza con una textura de fácil masticación, con una adecuada lubricación, evitando los alimentos irritantes de las mucosas. Cuando esta textura es difícil de tomar, la modificación de la textura es necesaria, triturar los alimentos puede facilitar la ingesta y, en ocasiones, incluso licuarla; pero, en muchas ocasiones, la alimentación convencional no es suficiente y puede sustituirse o complementarse con la alimentación básica adaptada (ABA), que es una alimentación elaborada por la industria farmacéutica, que está modificada en textura y sabor y es de fácil preparación. Además, mantiene un valor nutricional determinado y tiene un aspecto y sabor similares a la alimentación casera (3).
¿Qué pauta nutricional y consejo dietético realizaríamos?
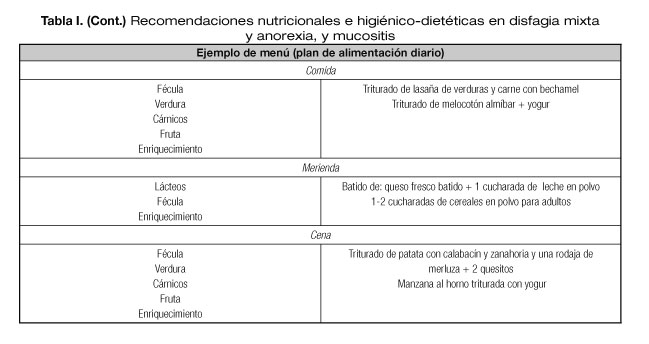
Con todo lo descrito en este apartado, podríamos encontrar un paciente que presente disfagia mixta, mucositis y anorexia. La recomendación nutricional irá dirigida a asegurar unos requerimientos calóricos y proteicos y el consejo higiénico-dietético será la traducción a alimentos para llegar al objetivo nutricional, modificando la textura para que esta sea más segura, enriquecimiento de la dieta para asegurar el máximo aporte calórico y proteico y medidas higiénicas para llevar a cabo en esta situación. Se adjunta un ejemplo de menú donde se establece una distribución diaria de grupos de alimentos (Tabla I). El cubrir las necesidades nutricionales dependerá de la cantidad de alimentos consumidos.
La radioterapia oral puede producir otros síntomas, como xerostomía, alteración de los sabores, trismus y lesiones neurales. Algunos de estos síntomas se resuelven durante los primeros meses, al finalizar el tratamiento, pero pueden persistir durante años, lo que comporta modificaciones en la dieta.
La xerostomía se produce por atrofia de las glándulas salivares, que da lugar a una disminución en la producción de saliva, por lo que esta se hace más escasa, adherente, viscosa y es ineficaz para facilitar la lubricación de los alimentos durante la masticación. El consejo dietético irá dirigido a facilitar la toma de los alimentos y a favorecer una secreción salival. Será necesario recurrir a cambios en las preparaciones culinarias, introduciendo salsas, caldos y favoreciendo que el alimento tenga una textura más blanda y jugosa, e incluso, en ocasiones, es necesario hacer un cambio en la textura y triturar los alimentos. Realizar ejercicios linguales, masticar piña natural o deshacer cubitos de hielo hechos con limón y agua puede favorecer la secreción de saliva (21,22). El empleo de ácidos no es posible cuando la xerostomía se acompaña de mucositis o de aftas orales.
Es importante extremar la higiene bucal para eliminar la secreción mucosa espesa que se acumula en la boca y que contribuye a aumentar la carga bacteriana oral y puede favorecer la aparición de caries.
La alteración del sabor puede darse de diferentes maneras: ageusia (pérdida de la sensación del gusto), hipogeusia (disminución de su percepción) y disgeusia (que es una distorsión del sabor). Estas percepciones o alteraciones de los sabores pueden provocar aversión a ciertos alimentos y una disminución de la ingesta. Es frecuente la aversión a las carnes rojas por la disgeusia, aunque las aversiones son generalmente individuales. Lo importante es que el alimento al que se presenta aversión sea sustituido por otro del mismo grupo. Si es la carne roja, se puede sustituir, por ejemplo, por carne blanca o por pescado o por huevos. En ocasiones, las combinaciones de sabores pueden ser efectivas para esconder esta distorsión, como usar compotas de frutas o salsas ácidas con la carne.
¿Qué pauta nutricional y consejo dietético realizaríamos?
En este caso podríamos encontrar un paciente que presente una xerostomía y disgeusia, y la recomendación nutricional será asegurar el aporte calórico y proteico y de micronutrientes. El consejo higiénico-dietético irá dirigido a facilitar la toma de alimentos, minimizando el rechazo por la distorsión del sabor que pueden ocasionar y favorecer una secreción salival. Se adjunta un ejemplo de menú donde se establece una distribución diaria de grupos de alimentos (Tabla II). En pacientes afectados de neoplasia de cabeza y cuello, el ajuste y seguimiento dietético y nutricional serán imprescindibles, pues, a lo largo de la enfermedad, requieren de modificaciones en la textura de la dieta y de asesoramiento en las distintas preparaciones culinarias. Pero en muchos casos, con estas medidas no es suficiente, y se debe recurrir al uso de suplementos de nutrición oral, y también a la nutrición artificial, colocando una sonda nasogástrica (SNG) o gastrostomía de alimentación.
Neoplasia esofagogástrica
La desnutrición es común en los pacientes afectados de neoplasia de esófago y suele afectar a alrededor del 80% de los pacientes (23). La disfagia a los sólidos es el síntoma más -prevalente al diagnóstico, junto con el dolor, astenia y anorexia, lo que contribuye a la disminución de la ingesta.
Los tratamientos realizados dependerán del estadiaje del tumor y de las comorbilidades asociadas. Se suele realizar radioterapia concomitante con quimioterapia, que puede ser radical o prequirúrgica. Estos tratamientos pueden afectar a la mucosa esofágica, produciendo esofagitis, pirosis y dolor retroesternal, que limitan la ingesta oral. Preferiblemente, siempre se intenta la vía oral, adaptando la textura de la dieta según el grado de disfagia, fraccionando las comidas y enriqueciéndolas. Al ser difícil cubrir las necesidades nutricionales con alimentos convencionales, el uso de suplementos de nutrición oral es habitual, pero en ocasiones se ha de recurrir a la colocación de una SNG o gastrostomía (24).
En el caso de la neoplasia gástrica, los síntomas más prevalentes en su diagnóstico son la anorexia, pirosis, las náuseas y vómitos o las hemorragias digestivas, pérdida de peso y desnutrición. Todo esto dificulta la dieta oral y son necesarias modificaciones en los alimentos, en las cocciones y, en ocasiones, en la estructura de la dieta.
El tratamiento también dependerá de la localización, estadiaje y comorbilidades asociadas. En ocasiones se inicia quimioterapia neoadyuvante con el fin de reducir la tumoración y que sea más efectiva la cirugía.
La cirugía, si se requiere de una gastrectomía parcial o total, puede provocar una dificultad en el control del paso de los alimentos al intestino e incluso en ocasiones se puede producir una inactivación o pérdida de la eficacia de las enzimas pancreáticas. Esto se traduce en síntomas como una saciedad precoz, con la imposibilidad de ingerir los volúmenes habituales tanto de sólidos como de líquidos, regurgitación y, en ocasiones, esteatorrea. También puede darse el síndrome de dumping, por el paso rápido y descontrolado de alimentos de alta osmolaridad al intestino delgado, provocando mareos, sudoración, palpitaciones, dolor cólico y diarreas. Este puede darse de forma precoz, a los 15-30 minutos tras la ingesta, o tardío. En cuanto al manejo nutricional en este síndrome, es importante limitar los hidratos de carbono simples y asegurar hidratos de carbono complejos en pequeños volúmenes en cada toma y el consumo de fibra soluble, porque retrasan el vaciado gástrico y enlentecen la absorción de hidratos de carbono; ejemplo: manzana, pera, cítricos, legumbres, patata, zanahoria, arroz, avena o cebada.
La pérdida del factor intrínseco, secundario a la gastrectomía, produce un déficit de vitamina B12 y sus niveles deben revisarse y monitorizarse periódicamente, y tratarse con su administración por vía intramuscular o subcutánea. Debe también tenerse en cuenta que la falta de acidez gástrica puede dificultar la absorción del hierro, así que su control periódico y administración puede ser necesario.
Con frecuencia la esteatorrea disminuye la absorción de la vitamina D y del calcio. En ocasiones, después de una gastrectomía total, la tolerancia a la lactosa disminuye; esto hace que se deban introducir otros lácteos o la leche sin lactosa (25).
Estos pacientes requieren de una adaptación a su nueva anatomía digestiva. Para poder asegurar un aporte nutricional posintervención y durante el tratamiento adyuvante de quimioterapia, en muchas ocasiones se coloca una enterostomía en el mismo acto quirúrgico para poder complementar la alimentación convencional
La valoración, intervención y seguimiento dietético y nutricional son importantes por todos los déficits que pueden comportar.
¿Qué pauta nutricional y consejo dietético realizaríamos?
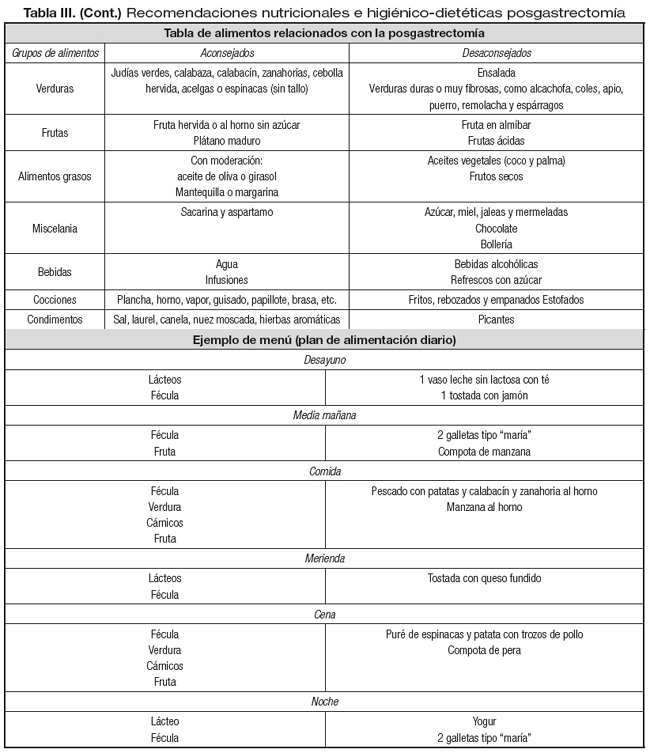
En este caso encontraríamos a un paciente al que se acaba de realizar una cirugía y como síntomas presenta: saciedad precoz, anorexia y, en muchas ocasiones, diarreas posprandiales. Las recomendaciones nutricionales irán dirigidas a cubrir los requerimientos calóricos y proteicos; asegurar el aporte en vitamina D y calcio; asegurar correctos niveles de vitamina B12 y de hierro; facilitar la digestión y minimizar el síndrome de dumping (limitando los hidratos de carbono simples y asegurando el aporte de hidratos de carbono complejos). El consejo dietético irá dirigido a asegurar un fraccionamiento de la dieta, con una introducción progresiva de los alimentos y unas cocciones suaves. Se adjunta una tabla con una relación de los alimentos y un ejemplo de menú con una distribución diaria (Tabla III).
Trasplante de progenitores hematopoyéticos
Este procedimiento terapéutico antineoplásico es muy agresivo, sobre todo en el tracto digestivo, y consiste en la administración de dosis elevadas de quimioterapia y, en ocasiones, radioterápia, seguido de la infusión endovenosa de células hematopoyéticas para restablecer la función de la médula ósea. Según el origen de las células se denomina trasplante de médula ósea (TMO), de cordón umbilical (TSCU) o de células de progenitores hematopoyéticos (TPH). En los últimos años, el 80% de los trasplantes son de TPH. En función del donante se diferencia el trasplante autólogo, cuando son células proceden del propio donante; alogénico, cuando proceden de donante total o parcialmente HLA compatible; y singénico, cuando proceden de un hermano genéticamente idéntico (26,27).
El paciente que es sometido a un TPH presenta, generalmente, buen estado nutricional al inicio y es durante el acondiciona-miento (quimioterápia y/o radioterapia) cuando presentan riesgo de desnutrición (27).
Los síntomas principales que se pueden presentar y que están relacionados con la nutrición son: mucositis, disgeusia, náuseas o vómitos, lo que comporta una importante anorexia; también aparecen trastornos del ritmo gastrointestinal en forma de diarrea. La presencia de enfermedad injerto contra huésped aguda o crónica puede prolongar la duración de los síntomas gastrointestinales. La presencia y gravedad de las complicaciones del TPH varían en función del tipo de trasplante y del régimen de acondicionamiento; habitualmente, los pacientes con más riesgo son los sometidos a trasplante alogénico no emparentado (26).
Estos pacientes están inmunocomprometidos, por lo que las infecciones oportunistas pueden ser una causa importante de morbi-mortalidad (26). Para disminuir la exposición a agentes microbianos derivados de alimentos y bebidas durante el periodo de neutropenia se indica la dieta de bajo contenido microbiológico. Su papel es todavía controvertido pues su uso, inicio, mantenimiento y restricciones dietéticas varían en la bibliografía y entre diferentes instituciones. A pesar del riesgo que existe de infección a través de diferentes alimentos, los estudios publicados no han podido demostrar una asociación directa entre la dieta de bajo contenido microbiano y una disminución en la tasa de infecciones en pacientes con neutropenia. Sin embargo, existen diferentes estudios microbiológicos donde se distinguen múltiples patógenos identificados en distintos alimentos, que son potencialmente peligrosos en pacientes neutropénicos (28).
La característica de la dieta, pretrasplante y postrasplante, y mientras pueda durar la neutropenia de grado 3-4 (neutrófilos < 1.000/mm3) deberá ser de bajo contenido microbiano. Se adaptará teniendo en cuenta las preferencias del paciente y los síntomas que presenta. Las modificaciones dietéticas irán dirigidas hacia una adaptación de la textura y enriquecimiento de la dieta.
Para la elaboración de este consejo dietético es importante seguir una buena higiene alimentaria (lavado de manos adecuado y frecuente), limpieza de utensilios e instalaciones, cocción completa de los alimentos (temperatura > 70 oC), cumplimiento de la cadena de frío y caliente) y evitar los alimentos con riesgo microbiológico (29).
¿Qué pauta nutricional y consejo dietético realizaríamos?
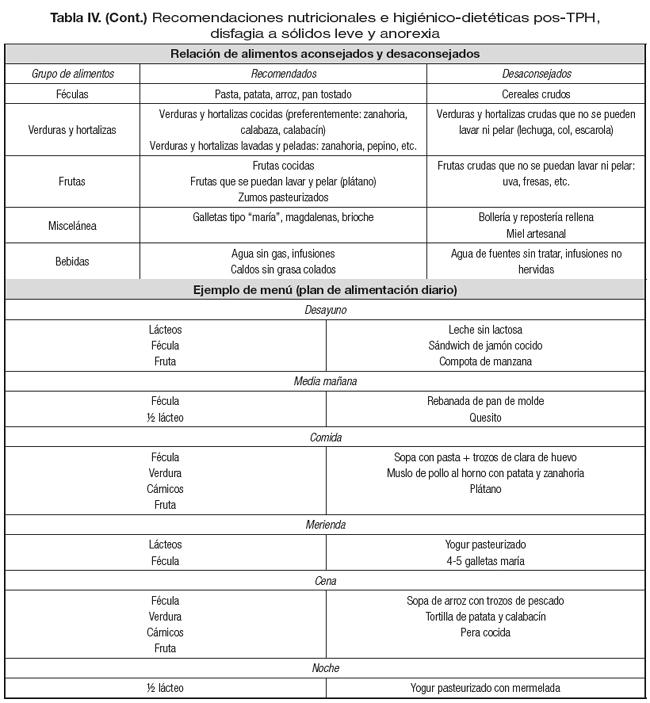
En este caso, podríamos encontrar un paciente que se marcha de alta después de un TPH. Como síntomas describe leve disfagia, tres deposiciones diarreicas y anorexia. El plan nutricional será asegurar los requerimientos nutricionales que serán hiperproteicos, asegurar el aporte en micronutrientes y minimizar las pérdidas electrolíticas. En los consejos dietéticos de cara al alta, tendremos en cuenta que tiene elevado riesgo de neutropenia, por lo que la dieta será de bajo contenido microbiano, y se deberán extremar las medidas higiénicas y evitar los alimentos de riesgo. La textura de los alimentos, que preferentemente debe ser de fácil masticación, y las cocciones o preparaciones sencillas, evitando el uso excesivo de grasa.
Se evitarán los alimentos con fibra y se asegurará una buena ingesta hídrica (Tabla IV).
Prebióticos y probióticos ¿tienen cabida en la terapia nutricional del paciente oncológico?
Los probióticos son definidos por la OMS (30) y por la International Scientific Association of Probiotics and Prebiotics (ISAPP) como "microorganismos vivos que cuando son administrados en la cantidad adecuada ejercen un efecto beneficioso sobre la salud del huésped". Los microorganismos no deben ser patógenos ni tóxicos y deben estar libres de efectos adversos. Las especies con más frecuencia usadas son lactobacillus y bifidobacterias, pues son especies reconocidas como organismos GRAS (Generally Recognized as Safe) y QPS (Quailfied Presumption of safety) por la Administración de Alimentos y Medicamentos (FDA) estadounidense y por la Autoridad Europea de Seguridad Alimentaria (EFSA).
Se denominan prebióticos a los compuestos no digeribles de los alimentos que producen efectos beneficiosos sobre el huésped, estimulando selectivamente el crecimiento y la actividad de un tipo o número limitado de bacterias del colon. Estructuralmente son oligosacáridos o polisacáridos de fructosa (FOS e inulina) o de galactosa (GOS). También se usa la lactulosa y el lactitol. El objetivo principal es favorecer el desarrollo de las bifidobacterias (31).
Los simbióticos son productos que contienen prebiótico y probióticos.
En una revisión sistemática llevada a cabo por la Multinational Association of Supportive Care in Cancer (MASCC) y la International Society of Oral Oncology (ISOO), para definir directrices en la práctica clínica para el uso de agentes para la prevención y tratamiento de la mucositis gastrointestinal, se sugiere que el uso del probiótico Lactobacillus spp puede ser beneficioso para la prevención de la diarrea por quimioterapia o radioterapia en pacientes afectados de tumores pélvicos (32). Este efecto beneficioso y el uso de probióticos también se muestra en un metaanalisis realizado por Hamad y cols. (33). No obstante, se ha cuestionado el empleo de probióticos en pacientes inmunocomprometidos debido a la existencia en la bibliografía de bacteriemia asociada a su administración. El mecanismo principal al que se atribuye este efecto adverso es el de la traslocación bacteriana intestinal y sepsis.
Van den Nieuwboer y cols. han publicado una revisión en 2015 donde se evalúa la seguridad del empleo de probióticos y/o simbióticos en pacientes inmunocomprometidos en comparación con un grupo control. Se evaluaron 57 estudios, que se habían realizado entre el 2008 y 2013 con una muestra de 4.914 pacientes (aproximadamente 2.500 por cada grupo). Concluyen que no aparecieron efectos adversos derivados de la administración de probióticos. En dos de estos estudios se utilizaron probióticos durante el periodo perioperatorio de cáncer colorrectal. Y su uso se asoció a una menor tasa de infección postoperatoria, sepsis o bacteriemia. Las especies más utilizadas fueron Lactobacillus acidophilus y Bifidobacterium longum. En casi la mitad de los estudios la cepa no se definió y la dosificación en ocasiones era insuficiente. La duración de los tratamientos realizados era en torno a los 3 meses. Esta revisión concluye que los probióticos pueden usarse con seguridad en pacientes inmunodeprimidos (34). Sin embargo, deben tenerse en cuenta ciertas limitaciones de los estudios analizados: el grupo de pacientes era muy heterogéneo y con diferentes tipos de inmunosupresión, así que la predisposición de las infecciones podía ser variable. Y los datos de seguridad de la administración son de un máximo de 3 meses, no de tratamientos crónicos.
Aunque los resultados son prometedores, para poder hacer uso de los probióticos con seguridad deberían conocerse bien las dosis y el tiempo de tratamiento más largo. Podríamos concluir con estos datos disponibles que se podría utilizar el Lactobacilus spp en la prevención de la diarrea en tumores pélvicos en tratamiento con quimio-radioterapia, pero se debería tener en cuenta que es un paciente con riesgo de neutropenia, por lo que su introducción debería considerarse de manera individualizada.
Agradecimientos
Al Institut Català d'Oncologia (ICO), por su modelo integrativo en la atención del paciente oncohematológico y del cual yo formo parte en el hospital Universitari Germans Trias i Pujol. A los profesionales de los servicios de Oncología Médica, Oncología Radioterápica, Hematología, Servicio de Soporte Integral (Cuidados Paliativos, Psicooncología, Trabajo social...) y de la planta de hospitalización, por su compañerismo y colaboración en la mejora del soporte nutricional de estos pacientes. También al Servicio de Endocrinología y Nutrición del hospital, pero en especial al equipo de la Unidad de Nutrición Clínica y Dietética de este servicio: dietistas-nutricionistas y endocrinólogos, con quienes comparto diariamente parte de mi actividad. Gracias a todos ellos también he podido llevar a cabo este artículo.
Bibliografía
1. Álvarez Hernández J, Muñoz Carmona D, Planas Vila M, Rodríguez Rodríguez I, Sánchez Rovira P, Seguí Palmer MA. Documento de consenso. Nutr Hosp 2008;1(1):13-4. [ Links ]
2. Martín Peña G, Dieta y cáncer. Soporte Nutricional en el paciente oncológico. 2a ed. Madrid: You & Us; 2004. [ Links ]
3. Hernández J., Munoz D, Planas M, Rodríguez I, Rovira P, Segui MA. Documento de consenso. En: Sociedad Española de Oncología Médica (SEOM), Sociedad Española de Nutrición Enteral y Parenteral (SEMPE), Sociedad Española de Oncología Radioterápica (SEOR). Guía multidisciplinar sobre el manejo de la nutrición en el paciente con cáncer. España. 2008. pp. 23-101. [ Links ]
4. Segurola Gurrutxaga H, Pérez-Portabella Maristany C, Parri Bonet A. Preparación, confección y seguimiento de una prescripción dietética. Nutrición y dietética clínica. En: Salas-Salvadó J, Bonada A, Trallero R, Saló ME, Burgos R, editores. 3a ed. Barcelona: Elsevier Masson; 2014. [ Links ]
5. Gómez Candela C, Sastre Gallego A. Soporte nutricional en el paciente oncológico. 2a ed. Madrid: You & Us; 2004. [ Links ]
6. Yavuzsen T, Davis MP, Walsh D, LeGrand S, Lagman R. Systematic review of the treatment of cancer-associated anorexia and weight loss. J Clin Oncol 2005 Nov 20;23(33):8500-11. [ Links ]
7. Tsai S. Importance of Lean Body Mass in the Oncologic Patient. Nutr Clin Pract October 2012;27: 593-8. [ Links ]
8. Valenzuela-Landaeta K, Rojas P,Basfi-fer K. Evaluación nutricional del paciente con cáncer. Nutr Hosp 2012;27(2):516-23. [ Links ]
9. De Cáceres ML, Ruiz F, Germà J, Busques CC. Manual para el paciente oncológico y su familia. Madrid: Pfizer; 2007. Disponible en: http://fecma.vinagrero.es/documentos/pacientes.pdf; Disponible en: http://www.seom.org/en/informacion-sobre-el-cancer/publicaciones/2118-manual-para-el-paciente-oncologico-y-su-familia. [ Links ]
10. Model de treball social en l'atenció oncològica. Treball social de l'Institut Català d'Oncologia. Ministeri de Sanitat i Seguretat Social. Institut Català d'Oncologia. Barcelona: Generalitat de Catalunya; 2004. [ Links ]
11. Lo YT, Chang YH, Lee MS, Wahlqvist ML. Health and nutrition enconomics: diet costs are associated with diet quality. Asia Pac J Clin Nutr 2009;18(4):598-604. [ Links ]
12. Serra Majen L, Castro-Quezada I. La alimentación en tiempos de crisis. Decálogo de Consenso de Cádiz de la Sociedad Española de Nutrición Comunitaria (SENC) y la ONG Nutrición Sin Fronteras (NSF). Nutr Clin Med 2014; VIII(2):35-46. [ Links ]
13. Daniel A. de Luis Román, Rubio Herrera MA, Cabrerizo García L. Nutrición en cirugía de tumores de cabeza y cuello. En: Manual de Nutrición y Metabolismo. Madrid: Díaz Santos; 2006. [ Links ]
14. Serrano Aguayo P, Romero Ramos H, Parejo Contreras J. Soporte nutricional en el paciente con cirugía maxilofacial agresiva por cáncer de lengua. En: Apoyo nutricional en el paciente oncológico. Casos Clínicos. Editor Botella Romero F, editor. Madrid: ENE Ediciones; 2004. [ Links ]
15. Carrión Bolorino S, Roca Fontbona M, Arreola García V, Clavé i Civit P. Disfagia. En: En Salas-Salvadó J, Bonada A, Trallero R, Saló ME, Burgos R, editores. Nutrición y dietética clínica. 3a ed. Elsevier Masson: Barcelona; 2014. pp. 489-501. [ Links ]
16. Joaquim CL, Puig R, Sendrós MJ. Recomendaciones dietético-nutricionales en oncología. Barcelona: Nestlé Health Science; 2012. [ Links ]
17. De Cáceres ML, Ruiz F, Seguí MA. Recetas de cocina y de autoayuda para el enfermo oncológico. Barcelona: Ediciones Mayo; 2005. [ Links ]
18. Libran A. Cómo cuidar alimentando. Badanola: Content' Ed Net Communications; 2011. [ Links ]
19. Puiggros Llop M, Giribés Veiga L, Simats Oriol G. Mucositis. En: Salas-Salvadó J, Bonada A, Trallero R, Saló ME, Burgos R, editores. 3a ed. Barcelona: Elsevier Masson; 2014. pp. 483-8. [ Links ]
20. Pibernat A, Pons N. Alteraciones del gusto. En: Salas-Salvadó J, Bonada A, Trallero R, Saló ME, editores. Nutrición y dietética clínica. 2a ed. Barcelona: Doyma; 2009. pp. 453-5. [ Links ]
21. Sendrós MJ, Dieta y alteraciones del gusto y la salivación. En Salas-Salvadó J, Bonada A, Trallero R, Saló ME, Burgos R, editores. Nutrición y dietética clínica. 3a ed. Barcelona: Elsevier Masson; 2014. pp. 479-82. [ Links ]
22. Burgos Peláez R, Puiggrós Llop C, Planas Vilá M. Cáncer de esófago. Esofaguectomía parcial. Fiebre en el curso del tratamiento con NPT. En: Apoyo nutricional en el paciente oncológico. Casos clínicos. Botella Romero F, editor. Madrid: ENE Ediciones SL; 2004. pp. 103-7. [ Links ]
23. Calañas-Continente A, Moreno Fernandez J. Soporte nutricional en el paciente con cirugía de estómago y/o esófago. En: Manual de Nutrición y Metabolismo. Madrid: Díaz Santos. España; 2006. pp. 399-421. [ Links ]
24. Saló i Solà ME. Dieta en la cirugía gástrica y sus complicaciones. En: Salas-Salvadó J, Bonada A, Trallero R, Saló ME, editores. Nutrición y dietética clínica. 2a ed. Barcelona: Doyma; 2009. pp. 533-43. [ Links ]
25. Gómez-Candela C, Canales Albendea MA, Palma Milla S, de Paz Arias R, Díaz Gómez J, Rodríguez-Durán D, et al. Intervención nutricional en el paciente oncohematológico. Nutr Hosp 2012;27,3:669-80. [ Links ]
26. García Fernandez E, Valero MA, León M. Soporte nutricional en el paciente hematológico. Trasplante de médula ósea. Manual de nutrición y metabolismo. Madrid: Ediciones Díaz Santos; 2006. [ Links ]
27. Arribas Hortigüela L, Sánchez-Migallón Montull JM, Dancho Gómez A. Dieta de bajo contenido microbiano. En: Salas-Salvadó J, Bonada A, Trallero R, Saló ME, Burgos R, editores. Nutrición y dietética clínica. 3a ed. Barcelona: Elsevier Masson; 2014. [ Links ]
28. Guía per a la prevenció i el control de les toxiinefccions alimentàries. Generalitat de Catalunya. 2a ed. Barcelona: Departament de Salut; 2006. [ Links ]
29. WGO. Probiótiocos y prebióticos. En: Guías Mundiales de la Organización Mundial de Gastroenterología. Octubre 2011. Disponible en: www.worldgastroenterology.org/probiotics-prebiotics.html. [ Links ]
30. Oliveira Fuster G, Gonzalez-Molero I. Prebióticos y prebióticos. Nutr Hosp 2007;22(supl.2):26-34. [ Links ]
31. Gibson RJ, Keefe DM, Lalla RV, Bateman E, Blijlevens N, Fijlstra M, et al. Mucositis Study Group of the Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology (MASCC/ISOO) Systematic review of agents for the management of gastrointestinal mucositis in cancer patients. Support Care Cancer 2013 Jan;21(1):313-26. [ Links ]
32. Hamad A, Fragkos KC, Forbes A. A systematic review and meta-analysis of probiotics for the management of radiation induced bowel disease. Clin Nutr 2013 Jun;32(3):353-60. [ Links ]
33. Van den Nieuwboer M, Brummer RJ, Guarner F, Morelli L, Cabana M, Claasen E. The administration of probiotics and synbiotics in immune compromised adults: is it safe? Benef Microbes. 2015 Mar;6(1):3-17. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ma José Sendrós Madroño.
Unitat de Nutrició Clínica i Dietètica.
Servei d'Endocrinologia i Nutrició.
Hospital Universitari Germans Trias i Pujol.
Carretera de Canyet, s/n.
08916 Badalona, Barcelona
e-mail: msendros@iconcologia.net