INTRODUCCIÓN
La enfermedad renal crónica (ERC) es un problema de salud pública en aumento a nivel mundial 1, cuya prevalencia supera el 10% de la población. En los países con menores ingresos la ERC presenta un mayor incremento, mientras que en las poblaciones en riesgo de desarrollarla (con hipertensión arterial, síndrome metabólico y diabetes) supera el 50% 2,3.
Existe una fuerte asociación entre ERC y malnutrición calórico-proteica (MCP) y una correlación directa entre esta última y la morbimortalidad del paciente 4. Aunque la MCP es una condición poco apreciada en los inicios de la ERC, su prevalencia ronda el 20-25% y se incrementa a medida que la insuficiencia renal progresa, constituyéndose en un fuerte predictor de resultados adversos. La MCP se asocia con la activación de citoquinas pro-inflamatorias combinada con estados hipercatabólicos y descenso del apetito, entre otras causas 5. Esta alteración del apetito conduce a una ingesta calórico-proteica inadecuada que puede agravarse por restricciones en la dieta prescrita, más aún si el seguimiento y la supervisión del estado nutricional del paciente por parte del equipo de salud es inadecuado.
Muchos pacientes con ERC reducen espontáneamente el consumo de nutrientes a medida que disminuye la función renal 6. La falta de un aporte adecuado de energía puede deberse a múltiples causas tales como anorexia, náuseas, anemia, dietas restrictivas, comorbilidades asociadas, edad y factores psicosociales 6.
La manipulación de la ingesta proteica es el punto principal del tratamiento nutricional de pacientes con ERC y su objetivo es reducir la carga de toxinas urémicas para disminuir la toxicidad de la uremia y retrasar la indicación de ingreso a diálisis. Existe consenso respecto al beneficio de la restricción proteica progresiva que permita retrasar la progresión del fallo renal y la necesidad de diálisis, siempre que se provea un aporte adecuado de energía 7,8,9.
Durante décadas se utilizaron las dietas restringidas en proteínas para disminuir la acumulación de productos de desecho y la presencia de complicaciones como acidosis metabólica, alteración del metabolismo óseo-mineral, insulinorresistencia, proteinuria y deterioro de la función renal, así como para aliviar también los síntomas urémicos 10,11.
La dieta controlada en proteínas considera un aporte de 0,6-0,8 g/kg/día y un 50% de las proteínas deben ser de alto valor biológico 3. Dicha restricción en el aporte proteico debe ir acompañada de un adecuado aporte calórico para lograr un balance neutro de nitrógeno. Se recomiendan 35 kcal/kg/peso en menores de 60 años y 30 kcal/kg/peso en mayores de 60 años 12. Para lograr estos objetivos nutricionales, el paciente debe estar incorporado a un programa de educación dietética y realizar controles frecuentes por parte de un equipo especializado 13.
El síndrome urémico deriva de la retención de moléculas y toxinas resultantes del catabolismo de las proteínas exógenas. Una forma de proteger la función renal residual y ralentizar la progresión de la enfermedad renal es reducir la hiperfiltración e hipertrofia glomerular, reduciendo la ingesta proteica. La dieta muy baja en proteínas proporciona 0,3-0,6 g/kg/día, dependiendo del estadio de la enfermedad renal (3b a 5). La suplementación de dicha dieta con una mezcla de aminoácidos esenciales y cetoanálogos tiene como ventaja la reducción más marcada de los compuestos urémicos y, consecuentemente, de los síntomas urémicos. Además de mejorar la sensibilidad a la insulina, esta dieta permite controlar la presión arterial, reducir la proteinuria, corregir la acidosis metabólica y los trastornos óseos y minerales, enlentecer la progresión del daño renal, retrasar el inicio de la diálisis y preservar el estado nutricional 14,15.
A pesar de la importancia de la restricción proteica, este no es el único aspecto en el plan de cuidado del paciente con ERC. Otras características del tratamiento nutricional incluyen un aporte calórico adecuado, modificaciones del sodio y del fósforo, así como el origen animal o vegetal de la fuente proteica o lipídica. Los suplementos juegan un importante rol para obtener efectos nutricionales beneficiosos y seguros. En este sentido, los aminoácidos esenciales y los cetoácidos son los suplementos más utilizados en pacientes con ERC y regímenes de baja ingesta proteica para prevenir la malnutrición 16.
La suplementación de la dieta controlada en proteínas con aminoácidos esenciales y cetoanálogos permite que el paciente se beneficie con una mayor variedad y palatabilidad en la selección de alimentos, ya que no debería considerar que el 50% de las proteínas ingeridas sean de alto valor biológico. El logro de los objetivos de dicho tratamiento demanda un seguimiento individual o periódico por parte del equipo de salud, con nutricionistas capacitados en el área renal 17. Sin embargo, algunos autores plantean la necesidad de realizar más estudios para fortalecer las evidencias clínicas del impacto de los cetoanálogos y de las dietas restringidas en proteínas en el paciente con ERC 18.
El objetivo del presente estudio fue observar la evolución clínica de un grupo de pacientes con ERC en los estadios 3b y 4 seguidos durante un año y tratados con una dieta controlada en proteínas y suplementada con aminoácidos esenciales y cetoanálogos de aminoácidos esenciales.
MATERIAL Y MÉTODOS
DISEÑO DEL ESTUDIO
El estudio fue de tipo retrospectivo, descriptivo de una intervención de pacientes seguidos durante un año de tratamiento por ERC estadios 3b y 4. Se realizó en servicios de Nefrología de nueve ciudades de Argentina por profesionales que integran el grupo RIANA (Red Interdisciplinaria de Atención Nutricional Ambulatoria) de enero de 2015 a mayo de 2017. Se incluyeron pacientes adultos mayores de 21 años de edad con ERC que al momento del ingreso presentaron los estadios 3b o 4. Se constató que hubieran completado un año de seguimiento por parte de un equipo que garantizara la atención del paciente (un médico nefrólogo responsable del paciente y un nutricionista con asistencia semanal) 19. Se consideraron criterios de exclusión los pacientes con ERC en estadio 5, en tratamiento sustitutivo (hemodiálisis o diálisis peritoneal), oncológicos, inmunodeprimidos, embarazadas, mujeres en periodo de lactancia y aquellos que no cumplieron con las indicaciones médicas y nutricionales, tales como controles y adherencia a la dieta propuesta.
El seguimiento nutricional consistió en adecuar un plan nutricional cuyo aporte de calorías se ajustara a los requerimientos del paciente, resultando en un aporte proteico de 0,4-0,6 g/kg/día más la incorporación de un comprimido de alfacetoanálogos de aminoácidos esenciales (Ketosteril(r) Fresenius-Kabi, Alemania) cada 5 kg de peso ideal. Junto con el plan de alimentación controlado en proteínas, el paciente recibió material educativo con menús hipoproteicos ejemplificados y cuantificados para combinar con alfacetoanálogos en el tratamiento de la ERC. Se realizaron seguimiento nutricional y control antropométrico semanal y control médico mensual.
Teniendo en cuenta los registros, las variables se estudiaron y analizaron a los 0, 3, 6, 9 y 12 meses.
Función renal
Se consideraron los siguientes indicadores: filtrado glomerular (FG), creatinemia (valores de referencia de creatinina: 0,7-1,3 y 0,6-1,1 mg/dl para hombres y para mujeres, respectivamente) y uremia (valores de referencia: 4,7-23,4 mg/dl). La estimación del FG (eFG) se realizó mediante la ecuación MDRD-4 20.
Estado nutricional
Para la evaluación de esta variable se utilizaron los siguientes indicadores: índice de masa corporal (IMC) (peso [kg]/talla2 [m]; valor normal: 18-25 kg/m2), albúmina (valor de referencia: 3,4-5, 4 g/dl) y anemia (indicador: Hb < 11 g/dl).
Equilibrio mineral fosfocálcico
Para su evaluación, se utilizaron los siguientes indicadores: calcemia (valor de referencia: 8,5-10,5 mg/dl para hombres y mujeres) y fosforemia (valor de referencia: 2,5-5,6 mg/dl).
Equilibrio hidroelectrolítico
Se evaluaron sodio (136-146 mmol/l) y potasio (3,5-5, 1 mmol/l). Las determinaciones se realizaron con los siguientes métodos: Jaffé automatizado (creatinina), cinético UV automatizado (uremia y fósforo sérico), electroforesis (hemoglobina y albúmina), método colorimétrico automatizado (calcio sérico) y electrodo ion selectivo (potasio).
ANÁLISIS ESTADÍSTICO
El análisis de los datos obtenidos se realizó con el software SPSS versión 18. Se evaluó la normalidad de los datos y se expresaron como media y desviación estándar o mediana y rango intercuartílico, según correspondiera. Se compararon las medias al año y al inicio del estudio mediante la prueba t de Student pareada o la prueba de Wilcoxon de rangos signados, según correspondiera.
En cada uno de los cinco puntos de evaluación clínica, se compararon las medias de FG, IMC y de las concentraciones séricas de urea, potasio, calcio, fósforo y albúmina. Para las variables cuya distribución fue compatible con la normal se usó la prueba de ANOVA de medidas repetidas, mientras que para aquellas con distribución distinta de la normal se usó la prueba de Friedman. Cuando se encontró significancia estadística, la comparación de a pares post hoc se realizó a través de la prueba t de Student pareada o la prueba de Wilcoxon de rangos signados, según correspondiera, en ambos casos usando la corrección de Bonferroni.
RESULTADOS
Se estudiaron 33 pacientes con ERC. El 67% correspondió al sexo masculino y la edad promedio fue de 59,7 años (r: 24-87). Se realizó diagnóstico de glomerulopatía (n = 8), diabetes (n = 7), hipertensión (n = 5), vejiga neurogénica (n = 3), poliquistosis (n = 3), riñón senil (n = 6) y etiología desconocida (n = 1). Todos los pacientes sostuvieron una dieta con un aporte promedio de proteínas de 0,55 ± 0,20 g/kg/día y un aporte calórico de 34 ± 4,51 kcal/kg/día. En promedio, los pacientes consumieron 11,87 comprimidos de Ketosteril(r) por día (r: 9-14).
Los resultados correspondientes a FG y nitrógeno ureico (UN) se presentan en la Tabla I. El FG al inicio del tratamiento fue 24,57 ± 6,64 ml/min/1,73 m2, con un aumento significativo luego de un año (29,26 ± 10,33 ml/min/1,73 m2; p = 0,006) (n = 33). La Figura 1 muestra la evolución del FG a lo largo del año en las cinco evaluaciones trimestrales. El aumento fue significativo entre los tres y los 12 meses (25,51 ± 8,57 y 29,26 ± 10,33; p = 0,006).
Tabla I. Filtrado glomerular y nitrógeno ureico en los cinco cortes estudiados

FG: filtrado glomerular (ml/min/1,73 m2); NU: nitrógeno ureico (mg/dl). Los resultados se expresan como medias e intervalos de confianza del 95%. *Valor de p correspondiente a ANOVA de medidas repetidas. †Valor de p < 0,05 con respecto a tres meses. ‡Valor de p < 0,05 con respecto a cero meses.
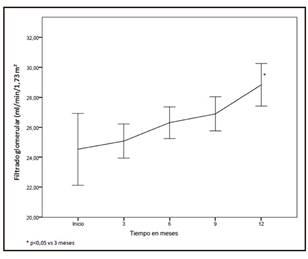
Figura 1. Filtrado glomerular en los cinco cortes estudiados. Los resultados se expresan como medias e intervalos de confianza del 95%.
El nivel de la uremia disminuyó significativamente entre el valor del inicio (x = 95,97 ± 31,69 g/l) y el control final al año (77,03 ± 19,04 g/l) (p = 0,001). La Figura 2 ilustra la evolución de la urea a lo largo del año en los cinco cortes estudiados. La diferencia fue significativa entre el inicio y los seis, nueve y 12 meses (p = 0,02, 0,038 y 0,012, respectivamente).

Figura 2. Nitrógeno ureico en los cinco cortes estudiados. Los resultados se expresan como medias e intervalos de confianza del 95%.
El IMC se mantuvo sin cambios significativos a lo largo del estudio (inicio: 26, 63 ± 4,08 kg/m2; luego de un año: 26,78 ± 3,98 kg/m2).
El nivel de albuminemia fue 3,53 ± 0,64 g/l al inicio y 4,00 ± 0,53 g/l al final del estudio; sin embargo, la diferencia no fue significativa (p = 0,079).
No se observaron cambios significativos durante la revisión de resultados de Hb al inicio y al final (x: 11,28 ± 1,68 versus 11,81 ± 1,43 g/l). Tampoco se registraron cambios significativos en la calcemia inicial y final (x: 9,35 ± 0,60 y 9,12 ± 0,54 mg/dl) ni en la fosforemia (x: 4,3 ± 1,15 y 4,12 ± 0,60 mg/dl). Por su parte, el valor de la potasemia inicial fue 4,53 ± 0,46 mEq/l y 4,38 ± 0,45 mEq/l a los 12 meses (NS).
DISCUSIÓN
Numerosas revisiones y metaanálisis de los últimos años analizaron resultados que permitieron precisar la eficacia del uso de dietas con bajo contenido proteico suplementadas con cetoácidos y aminoácidos esenciales en diferentes grados de la ERC 5,11,12.
Nuestros resultados muestran un aumento significativo del FG, una disminución significativa de la uremia y mantenimiento de los valores de índice de masa corporal, albuminemia, sodio, fósforo y potasio.
Otros estudios mostraron que el uso de aminoácidos esenciales y cetoanálogos disminuyó la velocidad de progresión de la ERC en un importante número de pacientes. A diferencia del nuestro, incorporaron pacientes grados 3 a 5 21. En un trabajo prospectivo, aleatorizado, doble ciego con placebo realizado en Nueva Delhi, India, en 34 pacientes en periodo de prediálisis se evaluó si una intervención con cetoanálogos y aminoácidos esenciales combinada con una dieta muy baja en proteínas versus una dieta con 0,6 g/kg/día más placebo retardaba la progresión de la ERC y mantenía el estado nutricional 14. Se demostró que en los pacientes que recibieron 0,3 g/kg/día de proteínas más una tableta de Ketosteril(r) durante nueve meses el FG se mantuvo sin cambios significativos (28,1 ± 8,8 antes y 27,6 ± 10,1 ml/min/1,73 m2 al finalizar el estudio), mientras que en el grupo control disminuyó de 28,6 ± 17,6 a 22,5 ± 15,9 ml/min/1,73 m2 (p = 0,015) 14. Cabe destacar que para sostener nutricionalmente una dieta muy baja en proteínas es necesario suplementarla con cetoanálogos y aminoácidos esenciales 22.
Una reciente revisión 15 incluye resultados de Subhramanyam y cols., quienes evaluaron un grupo de pacientes con ERC grados 3 a 5 con dieta baja en proteínas (0,6 g/kg/día) suplementada con una tableta de Ketosteril(r)/10 kg de peso y otro grupo con 0,3 g/kg/día de proteínas y una tableta de Ketosteril(r)/5 kg de peso. En el primer grupo, el clearance de creatinina aumentó significativamente mientras que la uremia disminuyó, como en nuestro caso. Estos autores no utilizaron el FG como parámetro de evaluación como se hizo en nuestro trabajo.
En otro estudio, pacientes con ERC grados 4 y 5 que recibieron Ketosteril(r) y dieta baja en proteínas mostraron un enlentecimiento del 57% en la tasa de progresión de la ERC 23.
También se han estudiado otros aspectos de la intervención con cetoanálogos en pacientes en prediálisis. Como en nuestro caso, los autores hacen referencia en sus resultados al mantenimiento del estado nutricional en pacientes con dietas bajas o muy bajas en proteínas suplementadas con cetoanálogos, atribuyéndoles un efecto anabólico o anticatabólico, especialmente a leucina e isoleucina 18,19,20,21,22,23,24,25,26.
También se ha abordado el mantenimiento del equilibrio de minerales y proteínas séricas con este tratamiento dietético nutricional, mostrando, como en nuestro caso, que se pueden sostener los niveles de calcio, fósforo y albuminemia 15,26.
La selección estricta del paciente, el monitoreo nutricional y la consejería dietética con clínicos nefrólogos y nutricionistas que trabajen en contacto permanente junto con los pacientes para sostener la propuesta dietética se torna fundamental a largo plazo para obtener buenos resultados 15,17.
La debilidad de nuestro estudio es que se trata de un estudio retrospectivo descriptivo. La falta de un grupo control no permite diferenciar la fuerza de la intervención a través de una dieta baja en proteínas o la de los cetoanálogos. Sin embargo, la revisión bibliográfica permite inferir la importancia de los dos factores en la obtención de los resultados que mostramos.
En la mayoría de los estudios se mostró una disminución de la velocidad de la caída o mantenimiento del FG. En nuestro estudio hallamos una mejoría significativa que debería corroborarse con la incorporación de un mayor número de pacientes.














