INTRODUCCIÓN
La desnutrición es considerada una de las complicaciones tardías de la enfermedad renal crónica (ERC). Un subanálisis del estudio Modification of Diet in Renal Disease (MDRD) demostró que la progresión de la ERC estaba asociada a una disminución de la ingesta espontánea de proteínas. De hecho, los pacientes en prediálisis tienen una ingesta de proteínas espontánea menor de 0,7 g/kg/día, que está por debajo de las recomendaciones mínimas 1. Este hecho se mantiene en los pacientes en hemodiálisis (HD), que no solo ingieren menos proteínas, sino también menos calorías de las recomendadas 1,2.
En el paciente con ERC estadio V, las altas necesidades de calorías y proteínas (en torno a 1,2 g/kg/día de proteínas y 35 kcal/kg/día) 1,2 y las limitaciones propias de la dieta (para controlar el peso, el nivel de potasio o de fósforo) 3 y la falta de educación de los pacientes en cuanto a su nutrición hacen que el seguimiento de las recomendaciones dietéticas por su parte sea muy complejo. En pacientes estables con ERC en HD, generalmente se observa una dieta con un déficit calórico, un exceso de grasas saturadas y un defecto en hidratos de carbono 3,4. Por este motivo, cada vez más estudios comparan las recomendaciones típicas de la dieta de pacientes con ERC con las de un patrón de dieta mediterránea 5,6.
Muchos trabajos han puesto de manifiesto que la desnutrición implica un aumento de la morbimortalidad de los pacientes con ERC, que se plasma en un aumento de los ingresos hospitalarios, de la estancia media y de las complicaciones infecciosas y en un aumento de la mortalidad, fundamentalmente de causa cardiovascular 7. En los últimos años, el término protein-energy wasting (PEW) (pérdida de músculo y tejido graso), o su traducción al castellano, síndrome de desgaste proteico-energético (SDP), se ha propuesto para definir la desnutrición en el paciente con ERC. Diferentes trabajos han demostrado que el SDP se asocia a complicaciones mayores y aumenta las hospitalizaciones y la morbimortalidad 8. Para su diagnóstico, hay que tener en cuenta cuatro tipos de parámetros distintos que se muestran en la Tabla 1 9, y que no siempre están disponibles en la práctica clínica diaria, de ahí las controversias en su utilidad.
Tabla I Criterios diagnósticos del síndrome de desgaste proteico-energético (SDP)
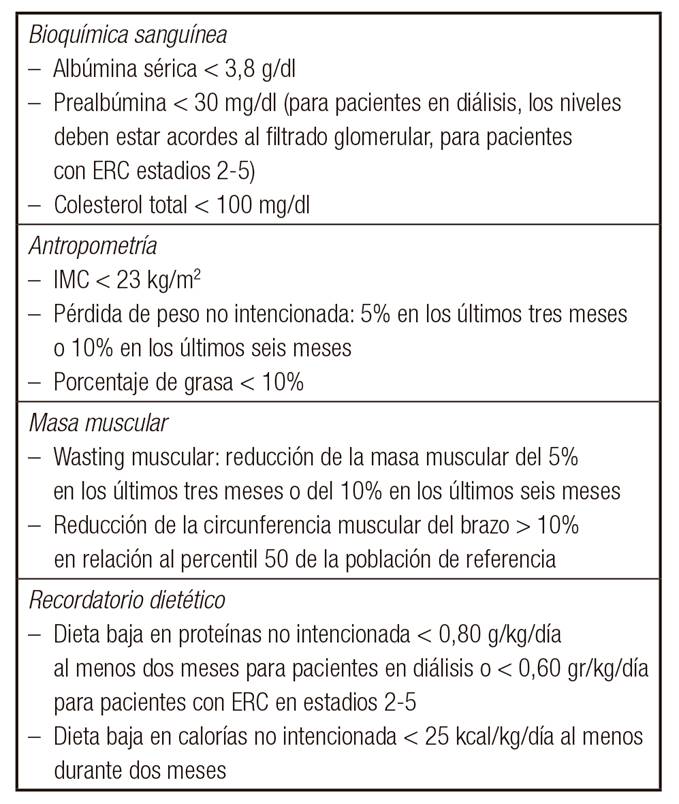
ERC: enfermedad renal crónica; IMC: índice de masa corporal.
El objetivo de la intervención dietética es preservar la función renal y mejorar la calidad de vida de estos pacientes. Por ello, en temas como el que nos atañe, en el que las recomendaciones son de baja calidad, los documentos de consenso o de expertos pueden agregar un valor añadido al trabajo clínico. Por medio de esta revisión y actualización, el grupo de trabajo Grupo Andaluz de Revisión e Investigación en Nutrición (GARIN) pretende definir su posición con respecto al tratamiento dietético de los pacientes con ERC basada en la lectura crítica de literatura y también en la experiencia de los miembros del grupo. Por lo tanto, el objetivo de esta revisión es definir unos puntos clave en las características de la dieta en el paciente adulto con enfermedad renal en sus distintos estadios evolutivos.
MATERIAL Y MÉTODOS
El comité científico está formado por ocho especialistas en Endocrinología y Nutrición que forman parte del grupo GARIN, todos con amplia experiencia clínica y en investigación en el área. Los principales objetivos fueron generar un documento de recomendaciones para el tratamiento dietético de los pacientes con enfermedad renal basado en una revisión de la evidencia más sólida disponible hoy en día, complementar dicha revisión con la experiencia del grupo GARIN en aquellos puntos en los que la evidencia sea insuficiente y presentar la información de una manera práctica, relevante y útil para las especialidades a las que va dirigida. El tipo de paciente que se incluye dentro de esta revisión son los adultos con enfermedad renal; se excluyen los menores de 18 años y aquellos en tratamiento con nutrición enteral o parental.
La selección de la información comenzó con una revisión de las guías de práctica clínica de distintas sociedades 10,11,12,13,14,15,16,17. Sobre las preguntas establecidas para la revisión se realizó una búsqueda en PubMed con una combinación de términos MeSH: enfermedad renal, wasting, nutrición, dietoterapia, fósforo, potasio, proteínas, cribado, grasa, diabetes, suplementos orales y NOT nutrición parenteral, nutrición enteral, niños o recién nacidos, que dio lugar a 417 publicaciones. La búsqueda se limitó a artículos en inglés y español, sin límite en la fecha de publicación.
Para seguir una metodología de elaboración estructurada y rigurosa y para llevar a cabo una evaluación interna que asegure la calidad de este documento se usó el método GRADE-ASPEN 11. Los artículos se distribuyeron entre los miembros del comité científico y se evaluaron según la escala Grading of Recommendations Assessment, Development and Evaluation (GRADE) como se usa en la guía ASPEN. Los artículos se incluyeron o excluyeron por el comité usando una escala cualitativa basada en los criterios GRADE para graduar la evidencia (limitaciones, asociación débil o fuerte, etc.). Finalmente, se incluyeron 96 artículos.
Las distintas preguntas se comentaron en una reunión presencial por todos los miembros del grupo. Tras esta reunión hubo una segunda ronda de discusión y corrección vía internet. En aquellas partes en las no había consenso se realizó una segunda reunión para discutirlas presencialmente. En el caso de que no se consiguiese un acuerdo de al menos el 75% (a favor o en contra), se llegó a la conclusión de que no había suficiente evidencia científica para dar una recomendación. Los criterios para hacer una recomendación se muestran en la Tabla 2.
CUESTIONES
¿Qué aporta el término PEW o SDP?
La desnutrición calórica-proteica es un problema muy frecuente entre los pacientes en HD 1 que se estima entre el 18 y el 75% 18. El descubrimiento en los últimos 15 años de los mecanismos fisiopatológicos que desencadenan este proceso, tales como la anorexia, el aumento del catabolismo proteico y la inflamación, ha generado la necesidad de una nueva denominación por la Sociedad Renal Internacional de Nutrición y Metabolismo (ISRNM): protein-energy wasting syndrome (PEW) 18,19,20. Este término no presenta una traducción fácil al castellano y, desde el Grupo de Trabajo en Nutrición de la Sociedad Española de Nefrología (S.E.N.), proponen la utilización del término "síndrome de desgaste proteico energético" (SDP) 19). Dado que no es fácil su puesta en práctica, todavía no se ha descrito la prevalencia SDP en pacientes en HD en España.
Distintos estudios con cohortes grandes y pequeñas han puesto de manifiesto la relación entre el término SDP 19 y el aumento de la morbilidad y la mortalidad, así como el descenso de la calidad de vida de los pacientes 21,22,23,24,25. El concepto SDP va más allá de la simple desnutrición. Es el resultado de múltiples mecanismos inherentes a la enfermedad renal: inflamación, comorbilidades, alteraciones hormonales, la propia diálisis, la toxemia urémica, así como la disbiosis intestinal que existe en el paciente nefrópata 5,26. La terminología de SDP evita la inclusión de términos como desnutrición o catabolismo, con el fin de no dar más importancia a uno de los componentes. Y es que, en estas alteraciones, tanto la desnutrición como el catabolismo muscular confluyen y están fisiopatológicamente relacionados, por lo que es difícil diferenciar uno del otro en la práctica clínica. Así, SDP implica tanto la pérdida acelerada de proteínas (músculo) como de energía (grasa). Dada la dificultad que entraña su empleo en la práctica clínica, no todos los estudios de investigación usan la misma definición de SDP. Para definir SDP existen cuatro grupos de parámetros a evaluar: bioquímica, análisis corporal, masa muscular-fuerza muscular e ingesta dietética 18,25. La ISRNM define SDP si se cumple al menos un parámetro en tres de los cuatro grupos 9, siendo imprescindible tener al menos un parámetro bioquímico para el diagnóstico. Estos criterios son inicialmente atractivos por su ámbito multifactorial, pero cuando tratamos de aplicarlos a la práctica clínica diaria resultan confusos y, además, algunos de ellos pueden ser cuestionables y difícilmente medibles de forma estandarizada. Además, no está claro si han demostrado validez diagnóstica o pronóstica mayor que otros valorados individualmente o que otras definiciones de desnutrición.
Así, por el momento no existe un consenso para el uso de la definición de SDP como criterio definitorio de desnutrición, pues su aplicación en la práctica clínica es complicada, ya que datos como la masa muscular, la composición corporal o el recordatorio dietético no se pueden usar en todos los centros, bien por falta de instrumentos o de tiempo/personal o por dificultad para establecer puntos de corte definidos en comparación con parámetros poblacionales.
Recomendaciones
El término SDP es un predictor de mortalidad independiente, por lo que en aquellos centros que dispongan de técnicas para medir composición corporal (plicometría, impedanciometría, DEXA) y fuerza muscular y que tengan personal entrenado y disponible para realizar el recordatorio dietético se puede usar la definición de SDP de la ISRNM. En el resto de centros, la valoración subjetiva global (VSG) 27, la albúmina plasmática (< 3,8 g/dl) y/o el índice de masa corporal (IMC < 18,5 kg/m2), así como la pérdida involuntaria de peso (> 10% indefinida en el tiempo o > 5% en los últimos tres meses) 28 pueden usarse como criterios de desnutrición, aunque actualmente no podemos formular una recomendaciones al respecto.
Otra alternativa, en nuestra opinión, demasiado estricta (y por tanto, muy específica pero poco sensible) para diagnosticar la desnutrición podría ser la que propone la European Society for Clinical Nutrition and Metabolism (ESPEN): pérdida de peso no intencionada (> 10% indefinida en el tiempo o > 5% en los últimos tres meses) combinada con IMC < 20 kg/m2 si son menores de 70 años o < 22 kg/m2 si son mayores de 70 años, y un índice de masa magra < 15 kg/m2 en mujeres o < 17 kg/m2 en hombres 29. Aunque en la actualidad no podemos hacer recomendaciones al respecto (Anexo 1).
¿Existe un grupo de pacientes con ERC en el que se da mayor riesgo de desnutrición y en el que hay que hacer un seguimiento más estricto?
El objetivo del cribado es identificar adultos con ERC en riesgo de desnutrición, debido a que la desnutrición proteica-energética y el SDP son predictores fuertes de morbimortalidad en pacientes con ERC y, más concretamente, en pacientes en HD. No hay ningún parámetro que dé un diagnóstico inequívoco del estado nutricional del paciente con ERC. Sin embargo, las entrevistas dietéticas son la mejor manera de detectar de forma precoz la reducción de la ingesta, pues nos avisan del riesgo de desnutrición antes de que los parámetros bioquímicos o antropométricos comiencen a cambiar 1,3. Si se objetiva alguna anormalidad analítica habría que adelantar la intervención dietética 1,30.
En el estudio Contrast se demuestra cómo, a pesar del cumplimiento de las guías, la albúmina y el IMC caen durante el seguimiento. Esto es más acusado en varones, diabéticos y pacientes con patología cardiovascular 31. En un subanálisis del estudio Hemo, los grupos de pacientes mayores de 50 años presentaban una ingesta de proteínas menor a la recomendada, lo que se asoció a peores marcadores nutricionales (albúmina, creatinina, colesterol total o índice de catabolismo proteico normalizado [nPCR]) 32.
Existen distintos cribados validados en estos pacientes, como el Nutrition Impact Symptoms (NIS) o la valoración subjetiva global generada por el paciente (VSG-GP). El primero tiene mayor fuerza de predicción de mortalidad y no solo de desnutrición. No hay ningún parámetro que dé un diagnóstico inequívoco del estado nutricional del paciente con ERC 33,34,35.
Recomendaciones
Sugerimos que en pacientes estables y bien nutridos en diálisis, se debe realizar un despistaje de desnutrición cada 3-6 meses si el paciente tiene menos de 50 años o cada 1-3 meses si son mayores o llevan en diálisis más de cinco años. En pacientes hospitalizados y en aquellos con nutrición artificial, sugerimos que el seguimiento debe ser cada 48-72 horas, hasta la estabilización del paciente.
Sugerimos que el seguimiento nutricional debe hacerse con encuestas dietéticas, peso (y evolución en el tiempo), nPCR, albúmina y colesterol y/o prealbúmina.
El seguimiento debe ser más estrecho en personas mayores (> 65 años), con diabetes y en pacientes con patología cardiovascular, aunque no podemos hacer recomendaciones basadas en pruebas al respecto.
Proponemos un algoritmo de cribado en la Figura 1, aunque no podemos hacer recomendaciones al respecto (Anexo 2).
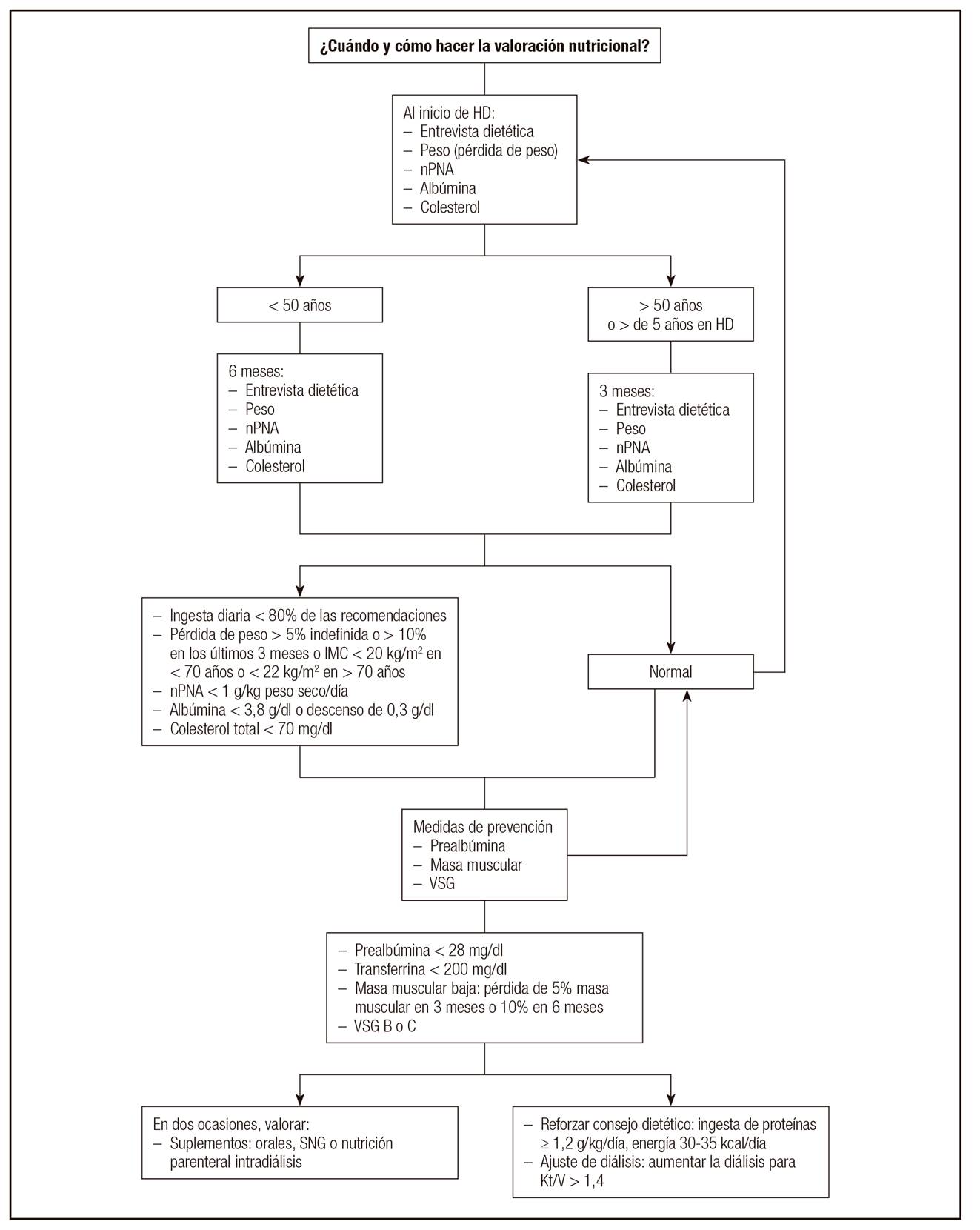
Figura 1 Algoritmo de cribado del grupo GARIN. HD: hemodiálisis; nPNA: índice de catabolismo proteico; IMC: índice de masa corporal; VSG: valoración subjetiva global; SNG: sonda nasogástrica; Kt/V: índice de diálisis.
Anexo 2 ¿Existe un grupo de pacientes con ERC en el que se da mayor riesgo de desnutrición y en el que hay que hacer un seguimiento más estricto?


ERC: enfermedad renal crónica; PEW: protein energy wasting; HD: hemodiálisis; nPCR: índice de catabolismo proteico; Kt/V: índice de diálisis; IMC: índice de masa corporal; nPNA: nPCR; VSG-GP: valoración subjetiva global generada por el paciente; GNRI: geriatric nutritional risk index.
Niveles de actuación terapéutica
La actuación terapéutica debe ser individualizada y atendiendo al grado de ERC que presente el paciente y a sus comorbilidades. En cuanto a la terapia médica nutricional, nuestro grupo propone tres niveles diferentes de actuación.
Los requerimientos proteicos de los pacientes con ERC son controvertidos, debido a que la mayoría de los estudios tienen pocos pacientes y su duración es demasiado corta (con una media de menos de diez días) 1.
En los grados 1 y 2 de la ERC las recomendaciones son las mismas que las de la población general 45,46,47,73.
En los grados 3 y 4 las recomendaciones en la ingesta de proteínas son de 0,6-0,8 g/kg de peso/día, siendo al menos el 50% de alto valor biológico para intentar disminuir la progresión de la enfermedad y para mantener o mejorar unos niveles de albúmina adecuados 36,37,38,,39,40,41. En cuanto a energía, se recomiendan entre 30-35 kcal/kg/día para mantener un peso adecuado. Las recomendaciones de grasas, fibra y minerales se muestran en la Tabla 3 42.
En el grado 5 o en la terapia de sustitución renal los requerimientos cambian, debido a que la diálisis induce una pérdida de nutrientes (glucosa, aminoácidos, vitaminas y elementos traza) en primer lugar por el contacto con la membrana de diálisis y, en segundo lugar, porque la diálisis en sí misma es un proceso catabólico responsable del catabolismo proteico (fragmentación de albúmina, liberación de citoquinas proinflamatorias, etc.). Muchos autores recomiendan que, dado que durante los días de no diálisis el estrés catabólico se reduce o incluso puede reemplazarse por una respuesta anabólica, la ingesta podría ser un 10% menor los días libres de diálisis. Durante una semana típica de tres días de diálisis, la ingesta se reduce espontáneamente en torno al 40% en el último día del periodo largo sin diálisis 1. Así, en HD se recomienda una ingesta proteica de 1,1-1,3 g/kg de peso/día para mantener un balance nitrogenado neutro, con al menos el 50% de proteínas de alto valor biológico 1). En cuanto a las recomendaciones de ingesta de energía en pacientes con ERC estable en hemodiálisis, son de al menos 30-40 kcal/kg de peso/día, ajustado a la edad, género y la actividad física, para mantener un peso adecuado 3,43,44.
Nivel 1
Recomendación de dieta mediterránea y dieta pobre en sal según recomendaciones de la Organización Mundial de la Salud (OMS). En estos estadios, una intervención dietética para bajar peso produce un incremento en el filtrado glomerular independiente del tipo de dieta llevada a cabo durante un tiempo medio de dos años 45,46,47.
Recomendaciones
Recomendamos la pérdida de peso en aquellos pacientes con sobrepeso u obesidad, pues mejora la función renal. La pérdida de peso tiene una mayor repercusión en el filtrado glomerular en pacientes con enfermedad renal preestablecida.
No podemos hacer recomendaciones de un tipo de dieta sobre otra para la pérdida peso, aunque en nuestro contexto aconsejamos que seguir un patrón de dieta mediterránea sería lo más apropiado (Anexo 3A).
Nivel 2
Pacientes en estadio III-IV. Son incontables los trabajos publicados a favor de los beneficios de la restricción proteica en la uremia con los que se han demostrado de forma convincente las ventajas renoprotectoras de la misma. Por ello, se recomienda una ingesta proteica moderada, de en torno a 0,8 g/kg/día 36,38,39,40,41,56,57. Se ha sugerido recientemente que la mitad de las proteínas de la dieta puedan ser aportadas en forma de proteínas vegetales. Las proteínas de origen vegetal pueden ser beneficiosas por la menor biodisponibilidad del fósforo y, consecuentemente, por la menor elevación asociada de fósforo sérico y factor de crecimiento fibroblástico 23 (FGF-23). Además, las dietas vegetarianas disminuyen la producción de toxinas urémicas, que han sido implicadas en la progresión de la ERC 4,36,38,39,41,54-57).
En estudios recientes se ha puesto de manifiesto que en personas con obesidad mórbida la cirugía bariátrica disminuye la proteinuria y la albuminuria y aumenta el filtrado glomerular más que la pérdida de peso producida por métodos convencionales 50,51,52,53.
Recomendaciones
Recomendamos dietas de restricción proteica moderada de en torno a 0,8 g/kg/día.
Sugerimos que, en este estadio, el 50% de las proteínas de la dieta sean de alto valor biológico (Anexo 3B).
Sugerimos que no se recomiende la pérdida de peso en pacientes con sobrepeso con ERC. Sin embargo, en pacientes con IMC > 30 kg/m2, sugerimos una pérdida de peso moderada de al menos el 5% (idealmente, del 10%).
Aconsejamos que en pacientes con IMC > 40 kg/m2, la cirugía bariátrica es una opción a tener en cuenta, ya que es el único tratamiento que ha demostrado el mantenimiento de la pérdida de peso y la mejora del filtrado glomerular y la microalbuminuria, aunque no podemos hacer recomendaciones basadas en la evidencia al respecto.
Nivel 3: pacientes en diálisis
La terapia nutricional en el paciente con ERC debe ser individualizada. El primer objetivo es mantener el estado nutricional mientras se adecua la ingesta dietética a la función renal para reducir la acumulación de toxinas metabólicas 3,44,59. La mayoría de los estudios muestran que existe una relación inversa entre el IMC y la mortalidad de pacientes en HD, en DP y en aquellos con ERC, que es independiente de los factores demográficos del paciente, de sus comorbilidades y de otros marcadores nutricionales. Existe una relación en J entre el IMC y la mortalidad, en la que a medida que aumenta el IMC, disminuye la mortalidad, hasta un IMC de 35 en el que comienza a incrementarse de nuevo 48,49,59,60.
Recomendaciones
Recomendamos que la ingesta diaria de proteínas y calorías para pacientes en HD sea de 1,1-1,2 g/kg/día y de 30-40 kcal/kg peso respectivamente. En pacientes en DP las recomendaciones de calorías son similares o ligeramente inferiores (30-35 kcal/kg), aunque las de proteínas son ligeramente superiores 1,20 g/kg/día.
Sugerimos que no se recomiende la pérdida de peso en pacientes con sobrepeso debido a que existe una relación inversa entre el IMC y la mortalidad en pacientes con ERC. Sin embargo, en pacientes con IMC > 30 kg/m2, sugerimos una pérdida de peso moderada de al menos el 5% (idealmente, del 10%) (Anexo 3C).
¿Debemos recomendar el consumo de fibra en el paciente renal?
Se recomienda aumentar la ingesta de fibra en pacientes con ERC, pues la ingesta de fibra en pacientes con enfermedad renal crónica está asociada con una disminución de la inflamación, tanto en PCR como en IL-6 y 8, y con una disminución de la mortalidad por todas las causas, incluidos el infarto de miocardio, la insuficiencia cardiaca congestiva, el ictus y el cáncer 61,62,63.
Las recomendaciones de ingesta de fibra en estos pacientes deben ser similares a las de la población general (en torno a 20-35 g/día). La microbiota intestinal es la suma de organismos simbióticos que viven en la luz intestinal y se ve influenciada por la nutrición, el metabolismo, la función inmune y la fisiología del huésped. En estos pacientes existe una disregulación en la microbiota intestinal, en la que la ratio entre bacterias que fermentan proteínas (proteolíticas) frente a las que fermentan carbohidratos (sacarolíticas) está alterada. Las bacterias sacarolíticas (bifidobacterias y Lactobacillus) fermentan preferentemente hidratos de carbono, dando lugar a ácidos grasos de cadena corta como acetato, propionato y butirato. Estas sustancias son beneficiosas para el organismo al actuar como nutrientes de las células intestinales y ejercer un efecto trófico e inmunomodulador sobre el epitelio colónico. Las bacterias proteolíticas (Clostridium y Bacteroides) producen sustancias tóxicas como son el amonio, thioles, phenoles e índoles. En personas normales, estas toxinas urémicas se excretan por vía renal una vez absorbidas de la luz intestinal. No ocurre así en el enfermo renal, en el cual estas sustancias se acumulan. Este peculiar medio interno provoca una alteración en la función y en la estructura gastrointestinal, perpetuando así la disbiosis intestinal. La disponibilidad de nutrientes, en concreto, la ratio carbohidratos/nitrógeno, es el más importante regulador del metabolismo bacteriano, ya que modula el grado de fermentación sacarolítica/proteolítica. En un entorno colónico con una ratio alta de nitrógeno/carbohidratos, propia de una dieta con poca fibra, se promueve la fermentación de proteínas que conducen a un aumento de las toxinas urémicas 62,63. Dado que la principal fuente de carbohidratos en el colon es la fibra, está más que justificado un aumento de la ingesta de la misma para intentar revertir esta situación, pero debe hacerse con precaución ya que aumentar la fibra supone tomar fruta, verdura o legumbres, que también están restringidas en esta población 65,66).
Recomendaciones
Nivel 1. Recomendamos que la ingesta de fibra en estos pacientes debe ser similar a la de la población general, es decir, una ingesta total de fibra (soluble e insoluble) en torno a 20-35 g/día.
Nivel 2. Sugerimos que estos pacientes deben alcanzar al menos las recomendaciones para la población general (en torno a 20-35 g/día).
Nivel 3. Recomendamos que la ingesta de fibra en estos pacientes debe ser superior a la actual y similar a la de la población general. La suplementación dietética con fibra fermentable mejora el perfil de lípidos y el estado oxidativo, lo que disminuye el estado inflamatorio sistémico de los pacientes de hemodiálisis, pero no podemos hacer recomendaciones al respecto (Anexo 4).
¿Qué podemos decir en cuanto a las grasas en el paciente renal?
Múltiples estudios han demostrado que en el riesgo de desarrollar síndrome metabólico influye más la calidad de las grasas ingeridas que la cantidad. De hecho, la ingesta de ácidos grasos saturados promueve el desarrollo de enfermedades cardiovasculares. Sin embargo, la dieta rica en ácidos grasos poliinsaturados n-6 (PUFA) de origen vegetal, concretamente el ácido linoleico, se ha asociado con la mejora de la insulino-sensibilidad, con la disminución del riesgo de síndrome metabólico y DM-2 y con la inflamación (disminuyendo las concentraciones de IL-6) 67. Los PUFA n3 presentes en el pescado (ácido eicosapentaenoico y ácido docosahexaenoico) también se han asociado con efectos favorables sobre el síndrome metabólico, como es el descenso de triglicéridos, y con menor evidencia en la mejora de la insulino-sensibilidad 68. Además, existe una asociación independiente entre las dietas bajas en ácido linoleico/ricas en grasas saturadas y algunos componentes del síndrome metabólico en pacientes con ERC, como son la grasa abdominal, la hipertrigliceridemia, la hipercolesterolemia y la elevación de la presión arterial 8,45,47,69.
El consenso español sobre las grasas y aceites en la alimentación de la población española adulta promovido por la Federación Española de Sociedades de Nutrición, Alimentación y Dietética (FESNAD) no es partidario de establecer un umbral de ingesta de AGS, debido a que su ingesta es nociva solo en función del alimento que los contiene, desaconsejándose alimentos que los contienen en exceso, como la mantequilla y algunos derivados cárnicos, bollería y fritos comerciales 70). Los AGM son beneficiosos o neutros para el riesgo cardiovascular según su fuente dietética (aceite de oliva virgen extra frente a otras grasas) y no se establecen tampoco limitaciones de ingesta 69,72. Los AGP n-6 son cardioprotectores frente al consumo de grasas saturadas y el nivel recomendable de ingesta (5-10% de la energía) no siempre se cumple en la población española, que debería aumentar el consumo de sus fuentes vegetales (aceites derivados). Finalmente, las dietas bajas en grasa (altas en hidratos de carbono, particularmente aquellas con un alto índice glicémico) carecen de efecto preventivo cardiovascular, mientras que las altas en grasa de origen vegetal, como la dieta mediterránea, son protectoras, razón por la que en España no parece necesario establecer un dintel superior de ingesta de grasa 45,47,67,73,74.
En la población general, la suplementación farmacológica con omega 3 reduce la respuesta proinflamatoria, tiene propiedades antitrombóticas, mejora el perfil lipídico y mejora la función endotelial; sin embargo, estos beneficios en pacientes con ERC no están claros 67,68,71,72,75.
Recomendaciones
- Nivel 1:
Sugerimos aplicar las recomendaciones dietéticas para la prevención de enfermedades cardiovasculares en la comunidad, como el incremento de la ingesta de PUFA de origen vegetal en lugar de grasas saturadas.
Sugerimos no establecer limitaciones de ingesta de AGM ya que son beneficiosos o neutros para el riesgo cardiovascular según su fuente dietética (aceite de oliva virgen frente a otras grasas).
Sugerimos aumentar el consumo de pescado ≥ 2-3 veces/semana para cumplir con la recomendación de al menos 250 mg/día de omega 3, sobre todo pescado grasos según las recomendaciones actuales, dado que parece que no deteriora la función renal y podría aportar beneficios cardiovasculares en estos estadios.
- Nivel 2:
Aconsejamos el consumo de pescado ≥ 2-3 veces/semana como fuente de omega 3 para estos pacientes, aunque en la actualidad no podemos establecer recomendaciones basadas en la evidencia al respecto.
Aconsejamos aumentar el consumo de aceite de oliva virgen extra en los pacientes con disminución de la ingesta pues puede tener un valor añadido en esta población, aunque actualmente no podemos establecer recomendaciones basadas en la evidencia al respecto.
- Nivel 3:
Recomendamos realizar una dieta baja en grasas saturadas (< 7% de las grasas saturadas, con trans la mínima posible) y rica en ácidos grasos poliinsaturados (menos del 10% del total de calorías).
Aconsejamos el consumo de pescado ≥ 2 -3 veces/semana como fuente de omega 3, pero actualmente no podemos hacer recomendaciones basadas en la evidencia al respecto.
Sugerimos el consumo de aceite de oliva virgen extra, que es fuente de ácido oleico y componentes minoritarios como grasa para cocinar y en crudo.
Son necesarias más investigaciones para recomendar una suplementación farmacológica con omega 3 en pacientes en HD (Anexo 5).
Utilidad del concepto de carga de P
Una dieta donde predominen las comidas rápidas y las carnes procesadas como fuentes proteicas determinará un mayor aporte y absorción de fósforo que una dieta de similar contenido de fósforo de origen natural, con predominio de alimentos frescos y no procesados 4,16,76,77,78,79,80,81. La retención de fósforo ocurre desde estadios tempranos de ERC, probablemente en el estadio 1 y en forma definitiva en el estadio 2, y aparece en forma de hiperfosfaturia y posteriormente hiperfosfatemia en estadios 4-5. La restricción dietética de fósforo debe ser iniciada cuando los niveles séricos de PTH comienzan a elevarse (estadio 2) y/o cuando los niveles de fósforo están elevados 77. Como la ingesta proteica es un importante componente del tratamiento de los pacientes con ERC y los alimentos ricos en proteínas son fuentes de fósforo orgánico, una forma más adecuada de controlar el fósforo es intentar controlar el fósforo inorgánico, que es el componente principal de varios aditivos que se utilizan en el procesamiento alimentario 82.
La ratio fósforo/proteína tiene la ventaja de que es independiente del tamaño de la porción del alimento. Además, se concentra en el fósforo y en las proteínas, ambos importantes en el manejo nutricional del paciente con ERC. La ratio es elevada para los alimentos que tienen una alta cantidad de fósforo en aditivos, pero con igual cantidad de proteína. Permite la ingesta de alimentos con una ratio adecuada que, si solo se considerara el valor absoluto del fósforo, se excluirían de la dieta del enfermo renal crónico. Pone atención sobre los alimentos con excesiva cantidad de fósforo y con poca cantidad de proteína 1,79. La desventaja es que no informa sobre la biodisponibilidad o la absorción intestinal del fósforo en diferentes tipos de alimentos.
La composición de la dieta debe ser mixta con aporte de proteínas de origen animal y vegetal. El porcentaje de absorción de P debe ser tenido en cuenta ya que permite introducir con moderación ciertos alimentos que tradicionalmente se han excluido de la dieta y que podrían ser útiles por sus efectos cardiosaludables. Los frutos secos, las legumbres y los cereales tienen una elevada ratio fósforo/proteína. Sin embargo, el fósforo de las legumbres y los frutos secos es en forma de ácido fítico y los humanos no tenemos la enzima fitasa, por lo que se asocia a una menor absorción intestinal (< 50%), aunque hay que tener en cuenta el elevado aporte de potasio 77.
En pacientes con ERC grado III-V, el contenido de fósforo de la dieta debe ser de 800-1.000 mg, preferiblemente con alimentos con una ratio fósforo/proteína menor de 16 mg/g de proteína, ya que se ha comprobado un mayor riesgo de muerte en el grupo de pacientes en HD con una relación fósforo/proteína total de la dieta por encima de 16 mg/g 16,76,77,80,83.
Recomendaciones
Sugerimos utilizar el concepto ratio fósforo/proteína en el ajuste de la dieta del paciente con ERC.
Recomendamos educar a los pacientes para conocer y controlar las fuentes de P inorgánico en los alimentos.
Sugerimos una dieta rica en proteínas de origen vegetal por su menor absorción de fósforo.
Recomendamos que en todos los niveles hay que priorizar la utilización de alimentos naturales por su menor absorción de fósforo. Los alimentos procesados deben limitarse al máximo en pacientes con ERC grado 3-5.
Sugerimos que en pacientes con ERC grado 3-5, el contenido de fósforo de la dieta debe ser de 800-1000 mg (Anexo 6).
¿Qué podemos recomendar para pacientes con DM e ERC?
Aunque la DM está asociada con mayor riesgo de mortalidad, la presencia de ERC aumenta aún más los índices de mortalidad, lo que indica que la ERC por sí misma es un factor independiente de riesgo. En aproximadamente un tercio de los pacientes con DM hay un estado de burnout de la diabetes en el que se observan episodios frecuentes de hipoglucemias que hacen necesario disminuir o quitar la medicación hipoglucemiante. La hipoalbuminemia y la hipotensión intradialítica son los mayores predictores de hipoglucemia intradialítica en pacientes con DM en HD 59.
Goraya y cols. defienden que el eje riñón-intestino cada vez se pone más de manifiesto y explican que los pacientes con ERC tienen un intestino enfermo con una traslocación de endotoxinas y bacteriana que tiene como consecuencia el aumento de la inflamación y de las enfermedades cardiovasculares. Sugieren la utilización de dietas ricas en proteínas de origen vegetal (50% del total de proteínas) porque mejoran la acidosis metabólica y bajan la presión arterial al reducir la flora intestinal proinflamatoria y el peso 80. En los pacientes diabéticos con ERC estadio III-IV, la ingesta de proteínas debe ser de 0,8 gr/kg/día, comparado con dietas ricas en proteínas (20% de las calorías totales en forma de proteínas o 1,3 g/kg/día), ya que la dieta baja en proteínas enlentece la disminución del filtrado glomerular. Las dietas ricas en proteínas se han asociado a un aumento de la albuminuria, mayor daño renal y mortalidad cardiovascular 36,84,85,86. No se recomienda bajar el consumo de proteínas por debajo de 0,8 gr/kg/día porque no afecta ni al control glucémico ni al riesgo cardiovascular ni al curso de la enfermedad renal 54.
Recomendaciones
Sugerimos la utilización de dietas ricas en proteínas de origen vegetal (50% del total de proteínas) porque mejoran la acidosis metabólica, reducen la progresión de nefropatía y bajan la presión arterial.
Sugerimos que una dieta rica en omega 3 puede ser beneficiosa en esta población y el consumo de pescado ≥ 2-3 veces/semana como fuente de omega 3.
Sugerimos que en los pacientes diabéticos con ERC estadio III-IV, la ingesta de proteínas debe ser de 0,8 gr/kg/día (Anexo 7).
¿Qué podemos aportar en cuanto a la suplementación nutricional?
La suplementación nutricional mediante la administración oral o parenteral especialmente en el momento de la diálisis puede compensar la ingesta inadecuada de proteínas y de energía y mejorar el anabolismo proteico neto en los pacientes en hemodiálisis crónica 3,43,87,88,89,90. Pero la vía oral parece ser preferible debido al menor coste, a que sus efectos anabólicos persisten una vez que la infusión ha cesado y a que la nutrición parenteral intradiálisis produce una mayor elevación de las concentraciones de glucemia e insulina sérica y una mayor reducción de las concentraciones de ghrelina 91,92. Este suplemento puede frenar el impacto catabólico de la hemodiálisis que predispone a la pérdida proteica y que contribuye a la activación de los mediadores de la inflamación. Además, el incremento de la ingesta de proteínas y calorías coincidiendo con los tres días semanales de la HD favorece un balance proteico positivo que no solo frena el catabolismo propio de estos enfermos, sino que también tiene un beneficio anabólico para el músculo en el periodo posdiálisis 43,87. Así, el uso de suplementos orales en HD aumenta la ingesta total (energía y proteínas) e incrementa las concentraciones de albúmina, sin efectos adversos en los electrolitos 3. En estudios retrospectivos ha demostrado reducir ingresos hospitalarios 89 y la mortalidad 43. Así, el uso de suplementos orales se asocia con un incremento de la ingesta dietética diaria y con un aumento de la albúmina, sin diferencias entre suplementos estándares o específicos 92.
Recomendaciones
- Sugerimos el uso de los suplementos nutricionales orales cuando no se alcancen las recomendaciones nutricionales tanto en diálisis como en prediálisis a pesar de que la evidencia es baja respecto a la mejoría de parámetros clínicos o de morbimortalidad.
- Sugerimos el uso de un suplemento oral intradiálisis en pacientes desnutridos en hemodiálisis (Anexo 8).
¿Qué podemos aportar en cuanto al control del potasio?
El potasio es uno de los cationes intracelulares más importantes y es esencial para el mantenimiento de distintas funciones corporales como la función neuromuscular normal, preservar el volumen celular y regular el pH sanguíneo. La hiperpotasemia se ha asociado con un incremento del riesgo y de todas las causas de muerte cardiovascular, con arritmias y con progresión a estadios finales de enfermedad renal crónica. Incluso en personas sin alteración de la función renal, las alteraciones del potasio se han asociado con mayores índices de mortalidad 93. Las recomendaciones de ingesta de fibra y de dieta baja en grasas saturadas entraban en conflicto con las recomendaciones de ingesta de potasio. Por ello, cada vez es más importante pasar de las recomendaciones tradicionales de nutrientes individuales a un manejo integral de la dieta 94.
Las dietas basadas en vegetales aumentan la cantidad de fibra que reduce la inflamación y mejora la supervivencia 93. A pesar de que el aumento de la ingesta de frutas y vegetales aumenta la ingesta total de potasio, esto no tiene por qué traducirse en un aumento del potasio plasmático. En distintos estudios recientes, en pacientes con ERC estadio 4 la toma de frutas y vegetales corrigió la acidosis metabólica y redujo la tensión arterial sin aumento de la incidencia de hiperpotasemia (65,66). En diálisis, la ingesta dietética no es el principal factor patogenético de la hiperpotasemia. Además, las dietas ricas en vegetales ayudan a corregir la acidosis metabólica y aumentan el tránsito intestinal. La capacidad del colon de secretar potasio es inversa a la función renal residual, y ello contribuye al mantenimiento de la homeostasis del potasio 65,94,95,96.
Recomendaciones
Sugerimos una dieta rica en frutas y vegetales en nivel 1 y 2.
En pacientes en diálisis sugerimos una dieta rica en fruta y vegetales, en la que el exceso de potasio se puede limitar por las técnicas de cocinado (Anexo 9).