INTRODUCCIÓN
El síndrome de intestino irritable (SII) es un trastorno funcional gastrointestinal caracterizado por la presencia de dolor abdominal crónico o recurrente asociado a gases, diarrea y/o estreñimiento, que afecta a un 20% de los niños en edad escolar 1. Además del impacto económico que genera en atención médica también afecta negativamente a la calidad de vida 2,3,4.
Teniendo en cuenta la relación entre la ingesta de alimentos y el empeoramiento de los síntomas en el SII, son varias las restricciones dietéticas que se han llevado a cabo con resultados no concluyentes 5,6. En general, la evidencia científica apoya que una dieta baja en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP) 7,8 puede ser implementada como una de las estrategias claves de tratamiento para el manejo de los pacientes adultos con SII 9,10,11. Los FODMAP se encuentran principalmente en alimentos saludables como las frutas, las verduras y algunos cereales. Por otro lado, existe una inmensa variedad de productos alimenticios procesados, que abarcan desde productos "sin azúcar", en los que se incluyen chicles, caramelos, bebidas, zumos, bollería y galletas, hasta cereales, panadería repostería y cárnicos, a los que se les han añadido fructosa, polioles o lactosa como aditivos 12.
Estos carbohidratos de cadena corta, que se absorben de manera incompleta en el tracto gastrointestinal 13,14,15, pueden inducir alteraciones en el intestino, como alteración de la motilidad gastrointestinal 16, aumento de la fermentación 17, hipersensibilidad visceral 18 y disregulación del eje neuroentérico 19. Sin embargo, su restricción dietética puede tener un efecto perjudicial sobre la microbiota intestinal 20,21. Al ser compuestos no digeribles y fermentados en el colon, tienen efecto prebiótico en la medida en que determinan una estimulación selectiva del crecimiento o actividad de una o varias de las especies de la microbiota intestinal, lo que otorga un efecto beneficioso en la salud del huésped 22. Otros efectos beneficiosos gastrointestinales que pueden ser producidos por el consumo de FODMAP incluyen el aumento del volumen del bolo fecal, la mejoría de la absorción de calcio y el aumento de la producción de ácidos grasos de cadena corta 12.
Teniendo en cuenta que el consumo de frutas y verduras es deficitario en la población pediátrica y que no existen muchos estudios de intervención nutricional para el SII en esta población, se valoró realizar una intervención inicial basada en la educación nutricional dirigida a los niños con SII para optimizar su dieta.
PACIENTES Y MÉTODOS
PACIENTES
El estudio fue autorizado por el Comité Ético de Investigación Clínica del Principado de Asturias. Se realizó en el Área de Gestión Clínica de Pediatría del Hospital Universitario Central de Asturias (HUCA), desde febrero de 2016 hasta marzo de 2017.
Como criterios para incluir pacientes se aplicaron los criterios diagnósticos Roma IV para SII en niños y adolescentes 23, junto a un examen físico normal y ausencia de señales de alarma, a los niños de cuatro a 14 años de edad atendidos en la Unidad de Digestivo Infantil (Tabla 1).
Tabla I Criterios de Roma IV para el diagnóstico de SII

*Los criterios deben cumplirse durante los dos últimos meses antes del diagnóstico.
Se consideraron los siguientes síntomas o signos de alarma: dolor persistente en el cuadrante superior o inferior derecho, disfagia, vómitos persistentes, pérdida de sangre gastrointestinal, diarrea nocturna, antecedentes familiares de enfermedad inflamatoria intestinal, dolor que despierta al niño del sueño, artritis, enfermedad perianal, pérdida de peso involuntaria, desaceleración del crecimiento lineal, retraso de la pubertad, fiebre de origen desconocido.
Aquellos pacientes con anemia, enfermedad inflamatoria intestinal, celiaquía, úlcera péptica y síndrome de intestino corto no fueron incluidos en el estudio.
PROCEDIMIENTO
Valoración nutricional al inicio y a los dos meses: se tomaron medidas antropométricas de peso, talla y se calcularon el índice de masa corporal (IMC = peso actual/talla actual2 [m]) y su puntuación Z (Z-score = dato medio - mediana de referencia [P50]/desviación estándar). Para medir el peso y la estatura, se utilizaron escalas calibradas con los participantes llevando ropa interior y sin zapatos. El Z-score de IMC se calculó con el programa de antropometría de la Organización Mundial de Salud, WHO AnthroPlus 24).
Los hábitos alimentarios se valoraron de forma cualitativa mediante recuerdo dietético de 24 horas y encuestas de frecuencia de consumo de alimentos.
Intervención nutricional: los pacientes recibieron educación dietética-nutricional oral y escrita. Se les instruyo sobre alimentación y estilo de vida saludable mediante educación alimentaria individualizada basada en las recomendaciones del Plato para Comer Saludable de la Escuela de Salud Pública de Harvard 25.
Encuesta de síntomas gastrointestinales: el efecto del tratamiento nutricional respecto a la mejoría de los síntomas se evaluó de forma prospectiva utilizando un cuestionario al inicio y a los dos meses de la intervención dietética. Se utilizó el cuestionario sobre calidad de vida pediátrica para síntomas gastrointestinales (PedsQL(tm) síntomas GI, disponible en: http://pedsql.org) adaptado a diferentes rangos de edad (5-7 años, 8-12 años y 13-18 años), tras obtener el permiso para su utilización por Mapi Group (Health Reserach & Commercialization). Dicho cuestionario consta de diez apartados, y cada uno de ellos es un posible síntoma gastrointestinal de SII (dolor y molestia de estómago, malestar de estomago al comer, límites de comida y bebida, dificultad al tragar, acidez y reflujo, nauseas y vómitos, gases e hinchazón, estreñimiento, sangre en heces y diarrea).
ANÁLISIS ESTADÍSTICO
Los datos fueron analizados con el programa SPSS 20.0 (Statistical Package for the Social Sciences, IBM). Se aplicaron los estadísticos básicos para la descripción de la muestra. Se comprobó la normalidad de los datos mediante pruebas de Kolmogorov-Smirnov y Shapiro-Wilk. Para analizar las diferencias en las variables cuantitativas se aplicaron pruebas t para datos pareados. Para analizar las diferencias entre variables binarias se aplicaron pruebas de McNemar. Para analizar las diferencias entre visitas para variables ordinales se utilizaron pruebas de Wilcoxon. Se consideraron estadísticamente significativos valores de p < 0,05.
RESULTADOS
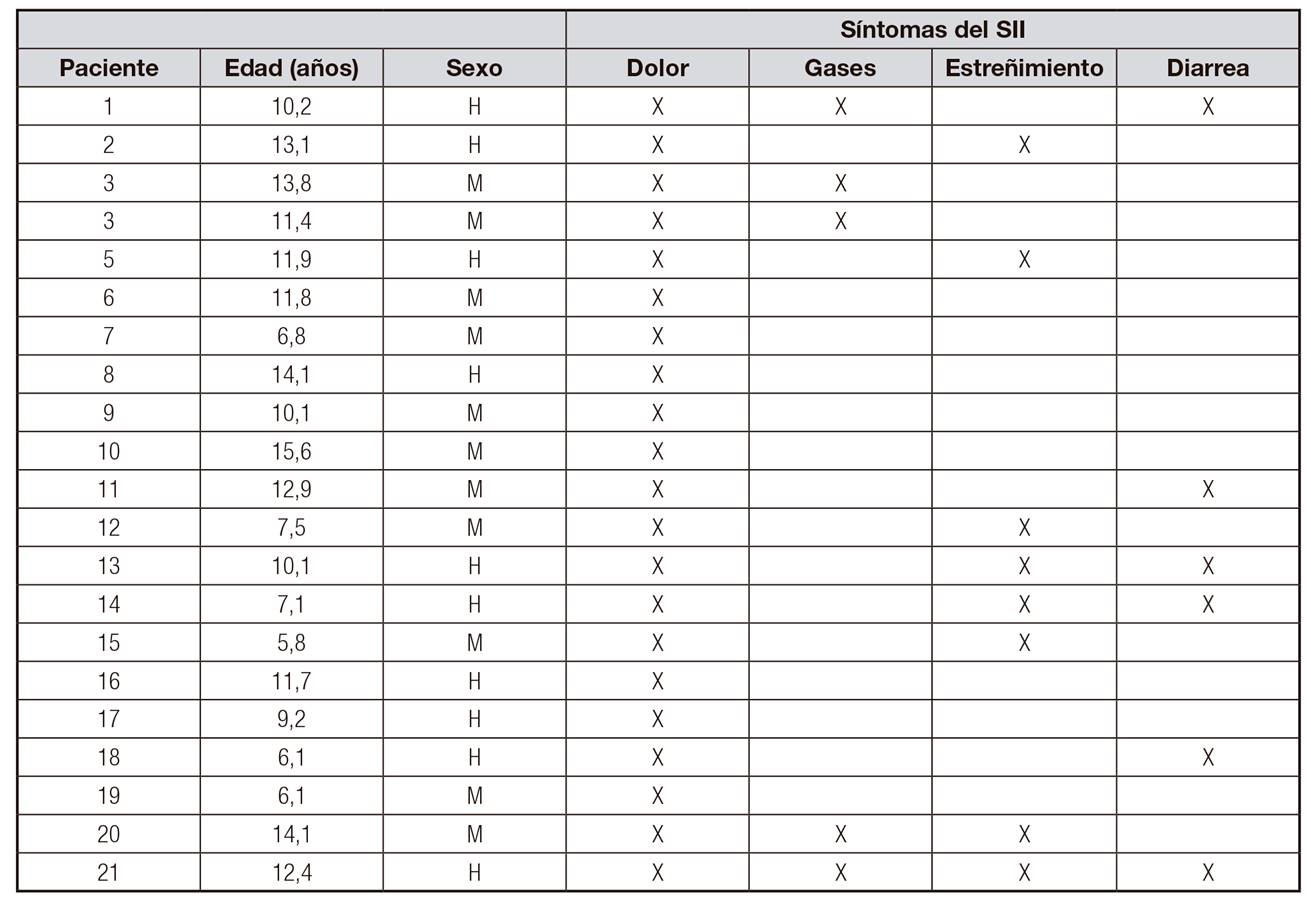
Un total de 26 pacientes fueron diagnosticados de SII según criterios de Roma IV para SII en niños y adolescentes por los pediatras de la Unidad de Gastroenterología y Nutrición Pediátrica del HUCA y derivados al dietista-nutricionista para entrar en el estudio. Dos de ellos no continuaron, uno por vivir fuera de Asturias y otro por diagnosticársele enfermedad de Crohn, por lo que inició tratamiento con nutrición enteral específica. De los 24 pacientes restantes, tres no volvieron a la segunda visita. La muestra final se compuso de 21 pacientes, de los cuales 12 (54,14%) fueron niñas y nueve (42,86%) fueron niños. La edad media de la población de estudio fue de 10,6 años, con rango desde los cinco hasta los 14 años.
Todos los pacientes al inicio del estudio presentaban dolor abdominal, asociando gases en cinco pacientes, estreñimiento en ocho y diarrea en siete. Solo uno presentaba únicamente dolor sin asociación a otro síntoma específico (Tabla 2). Respecto al número de síntomas referidos, 16 niños (76,2%) presentaban entre uno y dos síntomas, tres pacientes (14,3%) referían tres síntomas y solo dos pacientes (9,5%) tenían todos los posibles síntomas asociados al SII.
En la Tabla 3 se describen los resultados relativos a síntomas gastrointestinales característicos del SII al inicio y tras la primera intervención nutricional. En el primer cuestionario PedsQL(tm) para síntomas gastrointestinales realizado al inicio del estudio, la media de puntuación fue de 74,87. Una vez realizada la intervención nutricional, se observó un aumento de 8,07 puntos (IC 95%: -13,41 a -2,73; p = 0,005). Respecto a los diez diferentes apartados, se consiguieron mejorías significativas en seis de los síntomas, que fueron dolor abdominal, gases e hinchazón, estreñimiento y diarrea, así como malestar en las comidas y sensación de náuseas.
Tabla III Resultados de la escala de síntomas gastrointestinales (PedsQL(tm)) al inicio (PedsQL(tm) 1) y tras la intervención nutricional (PedsQL(tm) 2)

Con respecto al estado nutricional según los datos antropométricos de los pacientes, se observa una disminución significativa de la puntuación Z-score del IMC entre la primera y la segunda visita. En la Figura 1 se muestra la media de puntuación de Z-scorede IMC al inicio y tras la intervención nutricional.
En la Figura 2 se recogen los datos de frecuencia de consumo de alimentos analizados en ambas visitas. El patrón alimentario de la población del estudio se caracterizó por una elevada ingesta de azúcares simples a expensas de cereales refinados, bebidas azucaradas, dulces y bollería. Tras la intervención nutricional se consiguió una disminución en el consumo de estos alimentos manufacturados (p < 0,001), con la consiguiente mejora de los hábitos dietéticos.
Utilizando las pruebas de rangos con signo de Wilcoxon, se observó que de los 21 pacientes del estudio, once (p = 0,022) aumentaron el consumo de fruta tras la intervención nutricional (Fig. 3) y 19 (p < 0,001), el de verduras (Fig. 4).
DISCUSIÓN
El SII es una causa significativa de morbilidad y los tratamientos disponibles tienen una eficacia clínica variable. En pacientes adultos, se ha demostrado que los FODMAP desencadenan los síntomas en el SII 26 y que la dieta baja en FODMAP tiene una base de evidencia substancial para ser eficaz en el tratamiento de sus síntomas 27, pero faltan datos que estudien los resultados con otros enfoques dietéticos más prácticos. Además, apenas se dispone de estudios en niños.
En pacientes pediátricos, solo se ha llevado a cabo un estudio por Chumpitazi y cols. Este estudio cruzado doble ciego incluyó a niños, con edades comprendidas entre 7 y 17 años, diagnosticados mediante los criterios de Roma III para SII. Tras una semana de referencia como base, se asignaron una dieta baja en FODMAP o una dieta típica de la infancia estadounidense (TACD), seguida de un periodo de lavado de cinco días antes de pasar a la otra dieta. En los 33 niños que completaron el estudio se produjo menos dolor abdominal durante la dieta baja en FODMAP frente a la dieta típica (p < 0.01). En comparación con la semana de referencia, los niños tuvieron menos episodios diarios de dolor abdominal durante la dieta baja en FODMAP pero más episodios durante la TACD (p < 0.01). Con estos resultados se observó que una dieta baja en FODMAP parece mejorar los síntomas gastrointestinales en los niños con SII. No obstante, se apreció que los pacientes respondedores a la dieta presentaban una microbiota basal diferente, enriquecida en taxones bacterianos de las familias Bacteroides, Ruminococcaceae y Faecalibacterium prausnitzii, con mayor capacidad sacarolítica. Por tanto, concluye que las investigaciones futuras podrían determinar si la evaluación del microbioma intestinal conduciría a una dieta baja en FODMAP personalizada o a otra intervención dietética en los pacientes con SII 28.
Una revisión Cochrane reciente sobre las intervenciones dietéticas para el dolor abdominal recurrente en la infancia concluye que se requieren ensayos futuros de dietas bajas en FODMAP y otras intervenciones dietéticas para facilitar las recomendaciones basadas en la evidencia 29. En este sentido, el presente trabajo utiliza la alimentación saludable como primer enfoque terapéutico, en lugar de la dieta restrictiva baja en FODMAP. Esta intervención dietética dirigida a mejorar el patrón alimentario actual y la sintomatología digestiva asociada al SII consiguió mejorar de forma significativa la puntuación de calidad de vida en la escala de síntomas gastrointestinales. La mejoría observada fue principalmente a expensas de la mejora de los síntomas característicos del SII, que son dolor abdominal, gases e hinchazón, estreñimiento y diarrea.
El presente estudio también analiza la asociación entre la calidad de la dieta de los pacientes pediátricos y los síntomas asociados al SII. Los malos hábitos que se están adquiriendo de forma progresiva en la sociedad actual son debidos a un aumento en el consumo de alimentos manufacturados junto con una ingesta escasa de fruta, verdura y cereales integrales. Se sigue una dieta rica en proteínas y grasas de origen animal y se ha disminuido considerablemente el consumo de hidratos de carbono complejos 30. Esta falta de fibra puede condicionar el estreñimiento que se relaciona con el SII, así como con el dolor asociado al mismo. Los azúcares añadidos contribuyen a una dieta densa en energía pero pobre en nutrientes, aumentando el riesgo de desarrollar obesidad, enfermedades cardiovasculares, hipertensión, cáncer relacionado con la obesidad y caries dental 31.
Debido a una mayor disponibilidad de frutas y zumos de frutas concentrados y al uso extensivo de jarabe de maíz alto en fructosa (42%-55% de fructosa) como edulcorante en una gran cantidad de alimentos y bebidas procesadas 32, la ingesta de fructosa ha aumentado de forma considerable. En las últimas cuatro décadas, la proporción de energía de los edulcorantes calóricos ha aumentado aproximadamente el 22% de la ingesta diaria total de calorías, de las cuales más del 80% se atribuye al aumento del consumo de refrescos y bebidas azucaradas. Al mismo tiempo, el tipo de fructano de la dieta ha cambiado 33,34,35. Su uso generalizado es atribuible tanto a los beneficios tecnológicos únicos en la fabricación de alimentos, ya que mejoran la palatabilidad y estabilidad de estos, como a la nutrición, utilizándose para "alimentos funcionales" 33. La ingesta de polioles también ha aumentado al utilizarse como aditivos alimentarios de productos "sin azúcar" para reducir la ingesta energética 34,35,36,37.
Con respecto a la calidad de la dieta, la intervención dietética practicada en nuestro estudio consiguió que los niños mejoraran sus hábitos alimentarios y estilos de vida. Este cambio de hábitos consistió en disminuir considerablemente el consumo de alimentos procesados ricos en azúcares simples, grasas de mala calidad y exceso de sodio. A su vez, también se consiguió que aumentara el consumo de frutas, verduras y cereales integrales. Cabe destacar que el consumo de estos alimentos saludables en la población a estudio era muy escaso, incluso nulo.
Por otra parte, también se consiguió una mejora en el estado nutricional de los pacientes en el seguimiento, observándose una pérdida de peso significativa en los pacientes con sobrepeso y obesidad. Esta mejora del estado nutricional disminuye el riesgo de obesidad y otras enfermedades no transmisibles asociadas al síndrome metabólico.
Una dieta baja en FODMAP debe implantarse en situaciones apropiadas con la educación adecuada, preferiblemente por un profesional sanitario capacitado. La conciencia de los riesgos de la dieta baja en FODMAP es primordial debido a los riesgos psicológicos y nutricionales de una dieta restrictiva 27. Realizar una dieta restrictiva también puede resultar en una reducción simultánea en la ingesta de fibra si los productos de trigo integral o las frutas y hortalizas altas en FODMAP no se reemplazan por alternativas adecuadas 16. El riesgo de insuficiencia nutricional es una preocupación, particularmente si esta se realiza de forma autónoma o se sigue a largo plazo 38, ya que puede afectar al crecimiento y desarrollo de la población pediátrica, así como a la adquisición de buenos hábitos alimentarios imprescindibles en la edad infantil.
Otra de las razones por la que no está indicada una dieta baja en FODMAP como primera línea de actuación en los pacientes con SII es que esta incluye un efecto sobre el número y las especies de la microbiota gastrointestinal, que se sabe que está en disbiosis en los pacientes con SII 39, y por tanto, de la salud intestinal. No se conocen los efectos de esta dieta sobre la microbiota en el contexto de SII.
Por estas razones, y teniendo en cuenta el patrón alimentario y el estilo de vida actual de la población pediátrica, creemos que un enfoque dietético dirigido a mejorarlo sería fundamental antes de imponer una restricción de alimentos saludables ricos en FODMAP.
Todos fueron vistos por la misma dietista-nutricionista, por lo que la educación dietética fue igual en todos los casos. Aún así, no podemos excluir el sesgo del grado de motivación conseguido en cada paciente, que es dependiente de la forma de ser de cada niño y, a su vez, es muy influyente en el nivel de adherencia y cumplimiento del enfoque dietético. La intervención dietética solo es eficaz si los pacientes son capaces de cumplir con las recomendaciones. Esto se basa no solo en la motivación del paciente, sino también en el nivel de apoyo y el detalle proporcionado en la documentación aportada. Además, solo se examinaron los pacientes que asistieron a la cita de revisión, lo que podría conducir también a un sesgo de verificación como resultado de la experiencia de los tres pacientes que no asistieron. A estos se les llamo por teléfono y refirieron que no acudían porque ya no presentaban síntomas gastrointestinales asociados al SII y no veían necesario volver a la consulta. Una de las principales limitaciones del estudio lo constituye el pequeño tamaño muestral del mismo.
Las nuevas guías de práctica clínica para el manejo dietético del adulto con SII de la sociación dietética británica (BDA) concluyen que a pesar de la falta de evidencia, es recomendable que los profesionales evalúen los hábitos alimentarios de los pacientes con SII y proporcionen consejos sobre cómo lograr una dieta equilibrada saludable, lo que va en consonancia con los resultados de nuestro estudio. Además, se recomienda simplificar el algoritmo dietético del SII a dos actuaciones, una primera línea (alimentación saludable) y una segunda línea (dieta baja en FODMAP), proporcionando asesoramiento dietético por un dietista 40. Por último, recomiendan evitar el uso a largo plazo de esta dieta estricta.
En resumen, en el presente estudio se ha demostrado que antes de realizar una dieta restrictiva en alimentos saludables, como las frutas y las verduras, es preciso incidir en la importancia de disminuir el consumo de productos manufacturados ricos en azúcares simples. Creemos que el tratamiento dietético con alimentación saludable podría ser parte del abordaje de primera línea de los pacientes pediátricos con SII para mejorar su situación clínica, sin la necesidad de llegar a hacer una dieta restrictiva baja en FODMAP que puede resultar deficitaria, perjudicial para la microbiota y compleja de llevar a cabo si no se realiza una enseñanza adecuada.