INTRODUCCIÓN
Desde la década de 1970, la prevalencia mundial de la obesidad casi se ha triplicado (1). Sobrepeso y obesidad se relacionan con una menor esperanza de vida y con riesgo de padecer comorbilidades como resistencia a la insulina, diabetes tipo 2, dislipemia, enfermedad cardiovascular, hipertensión, osteoartritis, esteatosis hepática no alcohólica y ciertos tipos de cáncer (2,3). La obesidad responde a una etiología compleja y diversa, que incluye factores biológicos y ambientales que contribuyen al consumo de una dieta alta en calorías y una baja actividad física, lo que conduce a un desequilibrio energético (2). Sin embargo, la patogénesis de la obesidad también se ha asociado con el sistema inmune y la microbiota intestinal (comunidad de microorganismos que residen en el intestino). Concretamente, obesidad, diabetes y resistencia a la insulina se han relacionado con un “bajo grado” de inflamación o inflamación crónica, caracterizada por una producción anormal de citoquinas inflamatorias y con aumentos de mediadores inflamatorios de fase aguda como la proteína C reactiva (4-6). La causa de esta inflamación no está clara aún, pero numerosas investigaciones han propuesto que un estado de disbiosis (cambios en la microbiota intestinal), así como el lipopolisacárido bacteriano (LPS, componente de la pared bacteriana de bacterias Gram-negativas) podrían estar implicados en la progresión de obesidad y diabetes (5).
Cambios en la microbiota podrían afectar a la permeabilidad intestinal llevando a una endotoxemia metabólica, caracterizada por modestos incrementos de LPS bacteriano circulante (6). El LPS bacteriano incrementa la liberación de citoquinas proinflamatorias como son el factor de necrosis tumoral alfa (TNF-α) e interleuquinas 1 y 6 (IL-1 e IL-6) (2,5). Estos mediadores inflamatorios pueden producir una inflamación local y sistémica en el intestino delgado y colon (5,6). Además, la permeabilidad de la barrera celular en el intestino se encuentra deteriorada en casos de diabetes y obesidad, debido a esta endotoxemia metabólica y a la reducción de la expresión de proteínas de unión celular (zonula occludens) (6). La debilidad en las uniones celulares da lugar a aumentos en la permeabilidad intestinal y al paso de LPS bacteriano a la circulación sistémica.
Hoy en día, la industria alimentaria se encuentra en una continua búsqueda de nuevos productos con propiedades beneficiosas para la salud. En el contexto anteriormente descrito, la inclusión en la dieta de nutrientes con propiedades antiinflamatorias puede ser una estrategia prometedora para prevenir o reducir el “bajo grado” de inflamación asociado a la obesidad y otras enfermedades. El suero de leche, un subproducto de la industria láctea, es considerado como una fuente de nutrientes con reconocidas propiedades biológicas (antiinflamatorio e inmunomodulador, antioxidante, antimicrobiano, antihipertensivo, anticancerígeno, saciante, etc.) (7,8). Las propiedades antiinflamatorias del lactosuero se deben principalmente a su fracción proteica: beta-lactoglobulina (β-LG), alfa-lactoalbúmina (α-LA), lactoferrina (LF), glicomacropéptido, así como a péptidos bioactivos liberados tras su digestión (9-11). Sin embargo, la concentración de proteínas del lactosuero puede verse afectada por el tipo de suero (ácido o dulce), origen de la leche (vaca, oveja, cabra, etc.), época del año, periodo de lactación, alimentación animal, etc. (8). El efecto de la lactosa (azúcar de la leche) sobre el sistema inmune también ha sido establecido (12), aunque existen pocas publicaciones al respecto. Este disacárido es fermentado por bacterias ácido-lácticas en el intestino, generándose ácidos grasos de cadena corta (AGCC). Estos metabolitos tienen efectos en el mantenimiento de la homeostasis intestinal y efectos antiinflamatorios, por su implicación en la activación del sistema inmune y regulación de citoquinas proinflamatorias (11,13). Diferentes células del sistema inmune y células epiteliales pueden producir citoquinas proinflamatorias; de hecho, IL-8 y TNF-α tienen un marcado papel en la progresión de la inflamación intestinal (14). Modelos de inflamación intestinal in vitro, empleando células RAW 264.7 estimuladas con LPS y células intestinales Caco-2, han demostrado ser adecuados para simular el ambiente de inflamación intestinal (15) que ocurriría in vivo.
Con base en estos antecedentes, el principal objetivo de este estudio fue investigar el efecto antiinflamatorio de diferentes tipos de lactosuero mediante el uso de un modelo de inflamación in vitro. Los objetivos secundarios fueron evaluar en qué fase de la digestión in vitro (de boca a colon) el efecto antiinflamatorio del lactosuero era mayor y en qué medida se preservó la integridad de la permeabilidad intestinal tras la inflamación inducida.
MATERIAL Y MÉTODOS
MUESTRAS DE LACTOSUERO
El lactosuero usado en el presente trabajo fue obtenido tras la elaboración de quesos con diferentes tipos de leche: vaca, oveja, cabra y una mezcla de los tres anteriores (60 % vaca: 20 % oveja: 20 % cabra) (Palancares Alimentación S.L., Murcia, España). Las muestras fueron desnatadas previamente mediante centrifugación a 3.000 g, 15 minutos (Eppendorf™ Centrifuge 5804R, Alemania), liofilizadas (Telstar® LyoQuest, España) y preservadas de la luz y humedad hasta su análisis. La composición nutricional de estos tipos de lactosuero ha sido descrita previamente (16), siendo el lactosuero caprino el que más cantidad de lactosa presentaba, y el de origen ovino, el que menos. Sin embargo, el mayor contenido proteico fue encontrado en el lactosuero procedente del queso de oveja.
DIGESTIÓN IN VITRO DEL LACTOSUERO: SIMULANDO LA DIGESTIÓN DESDE LA BOCA HASTA EL COLON
Se llevó a cabo un modelo de digestión in vitro estandarizada internacionalmente que imitaba la digestión de boca, estómago e intestino delgado (17). Tras la digestión gastrointestinal se llevó a cabo una fermentación in vitro durante 24 h, con la intención de mimetizar el ambiente colónico usando heces humanas (18,19). Este experimento fue aprobado por el Comité Ético de la Universidad de Murcia (España) (ID: 1964/2018), además de contar con el consentimiento informado de los voluntarios, previamente a la donación de heces.
CONDICIONES DE CULTIVO DE LAS LÍNEAS CELULARES: CACO-2 Y RAW 264.7
Se realizó un modelo in vitro de inflamación intestinal inducida usando el cocultivo con dos líneas celulares: línea de adenocarcinoma de colón humano Caco-2 y macrófagos murinos RAW 264.7, previamente descrito por otros autores (15,20). Las líneas celulares empleadas fueron obtenidas de la Colección Europea de Cultivos Celulares Autenticados (European Collection of Authenticated Cell Cultures [ECACC], Salisbury, Gran Bretaña) (n.° 86010202 y TIB-71 para Caco-2 y RAW 264.7, respectivamente). El experimento fue realizado entre los pases 29 a 35. Las Caco-2 fueron sembradas en placas con insertos semipermeables durante 21 días antes del experimento de inflamación in vitro con una densidad de 0,5 x 106 células/pocillo (24 mm diámetro y 0,4 µm tamaño de poro) (Transwell®, Corning® Costar®, Sigma-Aldrich, España). Previamente fueron mantenidas en recipientes estériles ventilados (75 cm2) (Transwell®, Corning Costar®, Sigma-Aldrich, España) con medio DMEM (Gibco™ BRL Life Technologies, Escocia), cuya composición fue: 4,5 g/l glucosa, 10 % (v/v) suero fetal bovino, 100 µg/ml estreptomicina, 100 U/ml penicilina, 2 % glutamina y 1 % piruvato, a 37 °C, 7,5 % CO2 y 95 % de humedad relativa (Thermo Scientific, Estados Unidos). Cuatro días antes del experimento, se descongeló la línea RAW 264.7 y fue mantenida en el mismo medio de cultivo mencionado anteriormente. El día de antes del experimento estas células fueron sembradas en placas de seis pocillos (8 x 105 células/pocillo) e incubadas toda la noche para asegurar su adherencia. Se realizó un análisis de detección de Mycoplasma (21) para asegurar la esterilidad celular. Este experimento fue autorizado por el Comité de Bioseguridad en Experimentación de la Universidad de Murcia (España) (CBE: 122/2018).
MODELO IN VITRO DE INFLAMACIÓN INTESTINAL: COCULTIVO DE LAS LÍNEAS CELULARES CACO-2 Y RAW 264.7
Para determinar la capacidad antiinflamatoria de los diferentes tipos de lactosuero, en todas las fases de la digestión (D: digerido; F: fermentado), se llevó a cabo un modelo in vitro capaz de simular una inflamación intestinal, usando las líneas celulares Caco-2 y RAW 264.7. Se utilizaron las muestras de lactosuero de diferentes especies digeridas y fermentadas en fases anteriores, previamente esterilizadas (filtros de nylon de 0,22 µm). Las concentraciones finales de suero ensayadas fueron de un 1 % p/v para las muestras digeridas (digestión oral + gástrica + intestinal) y de un 0,01 % p/v para las muestras fermentadas. Durante tres días antes del experimento y 3 h consecutivas, la línea Caco-2 fue incubada con 1 ml de los diferentes tipos de muestras. El día del experimento se llevó a cabo el mismo procedimiento (incubación con lactosuero 3 h) (Fig. 1). A continuación, se retiraron las muestras, se añadió en su lugar medio de cultivo (1,5 ml), y los insertos con filtros semipermeables donde estaban alojadas las Caco-2 se colocaron sobre las placas de los macrófagos RAW 264.7, realizándose el co-cultivo (Caco-2 situadas en la cámara apical y RAW 264.7 en la cámara basolateral). Inmediatamente después, se añadieron 1,5 ml de una mezcla o “coctel” inflamatorio al compartimento basolateral del co-cultivo para estimular a las RAW 264.7 durante cuatro horas. La mezcla inflamatoria estaba formada por: 10 µg/ml de TNF-α recombinante humano (Sigma-Aldrich®, España) y 1 mg/ml de lipopolisacárido (LPS de Escherichia coli 0127: B8, Sigma-Aldrich®, España). Finalmente, el medio del compartimento apical que contenía las citoquinas proinflamatorias secretadas por la línea Caco-2 fue retirado para el análisis de IL-6, IL-8 y TNF-α. Paralelamente, fueron realizados un control positivo (CP: células Caco-2 y RAW 264.7 estimuladas con LPS + TNF-α), un control negativo (CN: medio de cultivo células Caco-2 y RAW 264.7) y un blanco (medio de cultivo y células Caco-2). El experimento fue realizado con tres réplicas biológicas.
DETERMINACIÓN DE LA RESISTENCIA ELÉCTRICA TRANSEPITELIAL (RETE)
La integridad de la monocapa formada por las Caco-2 se evaluó mediante la determinación de resistencia eléctrica transepitelial RETE) (Millicell® ERS, Millipore, Bedford, Estados Unidos). El análisis RETE (Ω.cm2) consiste en una técnica cuantitativa, no invasiva y ampliamente aceptada, además de ser un buen indicador de la confluencia celular. Las mediciones de la RETE fueron realizadas antes del experimento (tiempo 0 h) y tras la incubación con la mezcla inflamatoria (4 h). Valores de resistencia menores de 500 Ω.cm2 fueron excluidos (20). Los resultados fueron expresados como porcentaje de valores de RETE relativos a los valores previos a la inflamación. Las determinaciones fueron realizadas por triplicado.
ANÁLISIS DE MARCADORES PROINFLAMATORIOS: INTERLEUQUINAS Y TNF-α
Tras la inflamación in vitro se determinó la concentración de las interleuquinas humanas IL-6 e IL-8 y del TNF-α mediante el método magnetic-bead panel MILLIPLEX® MAP (Millipore Corporation, Billerica, MA 01821, Estados Unidos), siguiendo las recomendaciones del fabricante. Los resultados fueron expresados como porcentaje respecto al control positivo. Los análisis fueron realizados por triplicado.
ANÁLISIS ESTADÍSTICO
Para comparar el efecto antiinflamatorio y RETE (%) de los diferentes tipos de lactosuero (vaca, oveja, cabra y mezcla) a lo largo de la digestión in vitro y posterior fermentación se realizó un análisis de la varianza (ANOVA) de una vía, y posteriormente se llevó a cabo el test de Tukey de comparaciones múltiples (SPSS v.21.0). Las diferencias fueron consideradas significativas para valores de p < 0,05.
RESULTADOS
EFECTO DEL LACTOSUERO DIGERIDO Y FERMENTADO SOBRE LA INTEGRIDAD CELULAR
La integridad de la monocapa celular se analizó antes y después de la inflamación. Tras 4 h de inflamación inducida, no se encontraron diferencias significativas entre los valores de RETE del lactosuero digerido de todas las especies y los fermentados de vaca y oveja, al compararlos con ambos controles (Fig. 2). Sin embargo, las muestras fermentadas procedentes de lactosuero caprino y mezcla mostraron diferencias significativas con el CN, siendo similares estadísticamente al CP. Podría deducirse, a la vista de estos resultados, que todos los tipos de lactosuero digerido (vaca, oveja, cabra y mezcla), así como con el lactosuero de vaca y oveja fermentados, mostraron un efecto protector de la integridad de la monocapa celular, con valores de preservación respecto a valores preinflamatorios que oscilaron entre 99,38 ± 12,98 % y 89,39 ± 3,91 %. No obstante, las células incubadas con lactosuero FC y FM mostraron bajos valores de resistencia, que fueron similares al control positivo, lo que se podría traducir en disminuciones de la integridad celular e incrementos de permeabilidad de la monocapa celular.
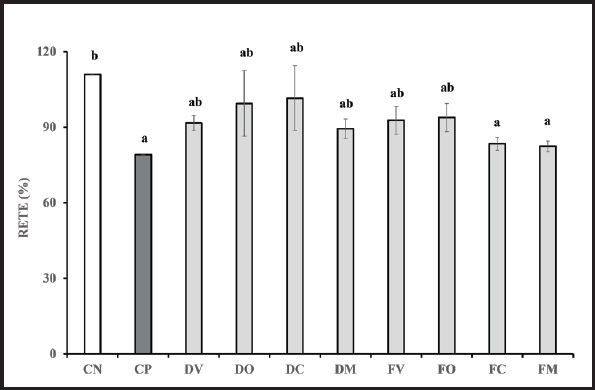
Figura 2. Resistencia eléctrica transepitelial (RETE). Resultados expresados como media ± DE de tres réplicas. Valores RETE expresados como % de preservación respecto a valores preinflamatorios. Las letras a y b denotan diferencias estadísticamente significativas entre los diferentes tipos de muestras (p < 0,05). DV: digeridos de lactosuero de vaca; DO: digeridos de lactosuero de oveja; DC: digeridos de lactosuero de cabra; DM: digeridos de lactosuero mezcla; FB: muestras fermentadas de lactosuero de vaca; FO: muestras fermentadas de lactosuero de oveja; FC: muestras fermentadas de lactosuero de cabra; FM: muestras fermentadas de lactosuero mezcla; CN: control negativo; CP: control positivo.
EFECTO ANTIINFLAMATORIO DEL LACTOSUERO DIGERIDO Y FERMENTADO
Para determinar el efecto antiinflamatorio de los diferentes tipos de lactosuero a lo largo de la digestión se analizó la secreción de IL-6 y 8, además de TNF-α. Los valores de IL-6 se encontraron por debajo del umbral de detección. Sin embargo, sí pudieron determinarse los valores de IL-8 (Fig. 3). Como puede observarse, la secreción de IL-8 tras 4 h de inflamación inducida fue inhibida por todos los tipos de lactosuero, D y F, respecto al CP (p < 0,05). Merece la pena remarcar que DM provocó menor inhibición de IL-8 que DO y todas las muestras fermentadas. Sin embargo, no se encontraron diferencias estadísticamente significativas cuando la secreción provocada por DM se comparó con DV y DC. Fue notable que todos los tipos de lactosuero fermentado mostraron potencial de inhibir la secreción de IL-8, con valores similares al CN, y significativamente menores que todos los digeridos (p < 0,05). Asimismo, tras la incubación con FV, FO y FM se observaron niveles casi inexistentes de IL-8.

Figura 3. Producción de interleuquina 8 (IL-8). Resultados expresados como media ± DE de tres réplicas. Valores de IL-8 expresados como % respecto al CP (100 %). Las letras a, b, c y d denotan diferencias estadísticamente significativas entre los diferentes tipos de muestras (p < 0,05). DV: digeridos de lactosuero de vaca; DO: digeridos de lactosuero de oveja; DC: digeridos de lactosuero de cabra; DM: digeridos de lactosuero mezcla; FB: muestras fermentadas de lactosuero de vaca; FO: muestras fermentadas de lactosuero de oveja; FC: muestras fermentadas de lactosuero de cabra; FM: muestras fermentadas de lactosuero mezcla; CN: control negativo; CP: control positivo.
TNF-α se analizó para determinar el potencial antiinflamatorio de los diferentes tipos de suero lácteo tras la digestión y fermentación simuladas (desde la boca al colon) (Fig. 4). Los porcentajes de inhibición de TNF-α expresados con respecto al CP fueron muy similares a los obtenidos en el caso de IL-8. Todos los tipos de lactosuero, D y F, inhibieron fuertemente la secreción de este marcador (p < 0,05), lo que podría demostrar el poder antiinflamatorio de todos los tipos de lactosuero, tanto a nivel de intestino delgado como de colon. No obstante, sí se encontraron diferencias al comparar los tipos de suero entre ellos y las diferentes fases de digestión. Los porcentajes de inhibición de TNF-α tras la incubación de las células con sueros digeridos no mostraron diferencias estadísticamente significativas al compararlas entre ellos. Sin embargo, sí pudo observarse una tendencia ascendente tras la incubación con DM, como ocurría en el caso de IL-8. Por otro lado, en el caso de la incubación con sueros fermentados, FV, FO y FM dieron lugar al mayor efecto antiinflamatorio, mostrando los menores valores de TNF-α, similares al CN (7,87 % ± 0,6, 0,84 % ± 1,45 y 6,55 % ± 2,96, respectivamente). Sin embargo, FC inhibió en menor medida TNF-α con mayores valores de secreción (29,75 % ± 6,63), remarcando la tendencia observada en el caso de IL-8.
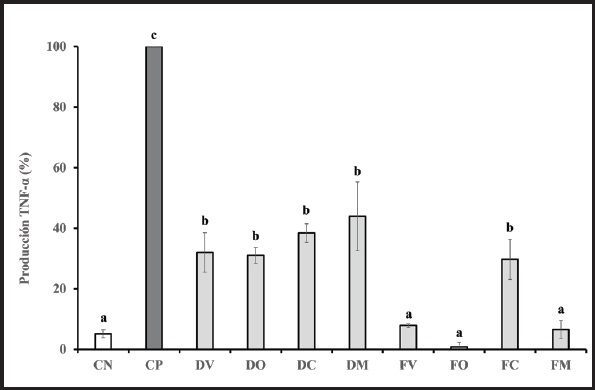
Figura 4. Producción de factor de necrosis tumoral alfa (TNF-α). Resultados expresados como media ± DE de tres réplicas. Valores TNF-α expresados como % respecto al CP (100 %). Las letras a, b y c denotan diferencias estadísticamente significativas entre los diferentes tipos de muestras (p < 0,05). DV: digeridos de lactosuero de vaca; DO: digeridos de lactosuero de oveja; DC: digeridos de lactosuero de cabra; DM: digeridos de lactosuero mezcla; FB: muestras fermentadas de lactosuero de vaca; FO: muestras fermentadas de lactosuero de oveja; FC: muestras fermentadas de lactosuero de cabra; FM: muestras fermentadas de lactosuero mezcla; CN: control negativo; CP: control positivo.
DISCUSIÓN
Durante la digestión in vitro, las proteínas del lactosuero son hidrolizadas enzimáticamente en estómago e intestino delgado por la acción de la pepsina, tripsina y quimotripsina, generando péptidos con efectos en el sistema inmune (8,22-24). Además, la degradación proteica prosigue en el colon, donde peptidasas microbianas (25) generan péptidos con efectos antiinflamatorios e inmunomoduladores (26,27). Se ha determinado que, durante la fase fermentativa, la degradación de β-LG en péptidos, mediada por la actividad peptidasa de Lactobacilus paracasei, reduce la estimulación de linfocitos, de IL-4 y de alfa-interferón, mientras estimula la producción de citocinas antiinflamatorias como IL-10 (26).
Además de los péptidos generados en la hidrólisis proteica, la lactosa contenida en el lactosuero tiene un efecto significativo como antiinflamatorio, aunque de forma indirecta. Bacterias como Lactobacillus sp. y Bifidobacterium sp. fermentan la lactosa, pudiendo transformarse enzimáticamente en galactooligosacárido (28). Además, la fermentación de este disacárido por la microbiota intestinal da lugar a AGCC (principalmente acético, propiónico y butírico) con probados efectos antiinflamatorios. Estos metabolitos han sido asociados a múltiples actividades biológicas, como son la regulación de la homeostasis energética y del metabolismo de la glucosa, efectos saciantes, antiinflamatorios y efectos protectores sobre la barrera intestinal (reducen la permeabilidad intestinal) (29).
Las uniones intercelulares estrechas (zonula occludens o uniones oclusivas) son una estructura de barrera formada por proteínas cuya función es la de mantener la permeabilidad celular, regulando el paso de agua y solutos entre las células epiteliales. Alteraciones en la permeabilidad de esta barrera intestinal se han asociado con enfermedades inflamatorias intestinales, cáncer, etc. (30). Tras producirse la inflamación, las células incubadas con lactosuero (D y/o F) mantuvieron estas uniones, preservándose la permeabilidad celular. Fue significativo que los sueros FC y FM dieran lugar a pobres preservaciones de la permeabilidad celular. Además, la escasa integridad celular encontrada tras la incubación con suero FC mostró coherencia con los resultados de TNF-α, ya que fue inhibido levemente, lo que indica que este tipo de suero, en esta fase digestiva, no sería un candidato adecuado para proteger el epitelio intestinal ni como antiinflamatorio. Previamente se han relacionado altas concentraciones de butirato en el lumen intestinal con una regeneración del epitelio y reducciones de la inflamación intestinal (31,32). Los niveles de butirato en las muestras empleadas en este estudio fueron determinados previamente, y en el caso de FC y FM fueron significativamente menores que en otras muestras (16), lo que podría explicar estos hallazgos. En línea con estos resultados, el efecto protector del suero de leche sobre la permeabilidad celular ha sido determinado por otros autores. Concretamente, un suplemennto dietético basado en proteínas de lactosuero tanto digerido como sin digerir estimuló la proliferación de células epiteliales intestinales humanas, además de que el suplemento digerido mantuvo la integridad celular intestinal, según se determinó mediante un análisis de la RETE (33).
El papel de la citoquina IL-8 en el sistema inmune se relaciona con la activación y el reclutamiento de neutrófilos, linfocitos T y basófilos, dependiendo su activación de varios estímulos como son LPS, IL-1 y/o TNF-α (34). Nuestro estudio ha demostrado la capacidad de diferentes tipos de lactosuero de inhibir IL-8 tras una inflamación aguda in vitro. Sin embargo, se han observado diferentes grados de inhibición, dependiendo del grado de hidrólisis de las proteínas de suero y de la presencia de otros metabolitos como los AGCC. El papel de las proteínas y péptidos como antiinflamatorios ha sido demostrado ampliamente. Un estudio determinó que hidrolizados de proteína de suero aislada, nativa y presurizada (comparables con los fermentados de este estudio) inhibieron la secreción de IL-8 por células Caco-2, aumentando el efecto con la dosis (24). Además, se ha determinado la actividad antiinflamatoria de los aminoácidos producidos tras la digestión gastrointestinal (35). Concretamente, histidina redujo la secreción de IL-8, dependiendo su efecto de la dosis y mostrando efecto inhibitorio con cantidades bajas (36).
En lo que respecta a las muestras fermentadas, los resultados sugieren mayor actividad antiinflamatoria que con las digeridas. Esta actividad puede estar mediada por el efecto sinérgico o aditivo de péptidos, aminoácidos libres y AGCC que caracterizan a este tipo de muestras y las diferencian de las digeridas. Muy pocos trabajos han probado el efecto antiinflamatorio del suero de leche fermentado. Como se señaló anteriormente, un estudio determinó el efecto inhibitorio sobre IL-8 de un aislado de proteína de suero presurizado y no presurizado, y fue el presurizado el que mostró más efecto antiinflamatorio. El tratamiento hiperbárico del suero puede ser comparado con el proceso de fermentación, ya que se produce un grado de hidrólisis proteica similar, afectándose la estructura secundaria y terciaria de estas (24). Autores como Voltolini y cols. investigaron el efecto de AGCC como el propionato de sodio sobre la expresión de citoquinas inflamatorias. Se halló que este redujo la expresion de genes de IL-6 e IL-8 mediada por FFAR2 (37). Nuestros resultados podrían demostrar, en línea con otros estudios (33), que la capacidad antiinflamatoria del lactosuero se debe al efecto sinérgico de todos sus componentes a través del proceso digestivo: proteínas que generan péptidos y aminoácidos, azúcares que sirven de sustrato fermentativo para producir AGCC, etc.
En relación al TNF-α, el efecto inhibitorio de las muestras de suero fermentadas fue similar al de IL-8, siguiendo un patrón de inhibición semejante. La razón es debida a que su estimulación está relacionada, siendo necesario TNF-α para estimular el nivel de expresión de mRNA de IL-8 en las Caco-2 (15). En general, ha quedado demostrado el poder antiinflamatorio de los diferentes tipos de lactosuero a través de la digestión, un efecto que está mediado por su composición nutricional. Se demostró el poder antiinflamatorio de un suplemento nutricional formulado a base de proteínas de suero, fibra, grasas, vitaminas y minerales usando un modelo similar de inflamación celular. Este estudio halló que, a las 4 h de incubación con el suplemento (digerido y no digerido), se redujo la secreción de TNF-α (33). Como en el caso de IL-8, el efecto antiinflamatorio de los fermentados puede explicarse por su composición. Un estudio in vivo determinó que la composición de aminoácidos de la dieta se relacionaba con una modulación de la respuesta inmune, mostrando reducciones en TNF-α (38). En relación al efecto de los AGCC, Bailón y cols., en su estudio de inflamación in vitro, determinaron que el butirato producía descensos en la producción de TNF-α (39). Además, el efecto antiinflamatorio de los AGCC parece depender de la dosis y del tiempo, ya que células tratadas con diferentes concentraciones de AGCC y tiempos de incubación mostraron inhibiciones de IL-6, IL-8 y TNF-α (40). Merece la pena mencionar que, a pesar del fuerte efecto inhibitorio general encontrado en las muestras de suero fermentadas, el lactosuero de origen caprino tuvo efectos menos positivos. Estudios anteriores (16) ponen de manifiesto que este tipo de suero tiene menor concentración de ácido butírico que otras muestras fermentadas, lo que probablemente explicaría este efecto.
CONCLUSIONES
Ha quedado demostrado el potencial antiinflamatorio del lactosuero de diferentes especies tras la digestión y fermentación. El lactosuero tiene un efecto protector sobre la integridad y permeabilidad celular, aunque este efecto es menor en la fermentación colónica de suero de origen caprino y mezcla. El lactosuero fermentado tuvo el mayor efecto antiinflamatorio debido a su propia composición: péptidos, aminoácidos y AGCC, teniendo estos componentes un efecto sinérgico. Sin embargo, el suero fermentado de cabra no mostró ese grado de inhibición, quizás debido a su baja concentración en AGCC. En general, el suero de leche, sobre todo tras su fermentación en colon, podría ser una estrategia nutricional útil para preservar la barrera intestinal y mitigar el bajo grado de inflamación que caracteriza a desordenes metabólicos y a la obesidad.















