INTRODUCCIÓN
A nivel mundial, más de 1.600 millones de personas padecen obesidad (Organización Mundial de la Salud [OMS], 2021) y esta cifra se incrementará para el año 2030 debido a los estilos de vida que favorecen el desarrollo de esta enfermedad (15). La obesidad se caracteriza por una acumulación excesiva de tejido adiposo (TA), que se acompaña de un incremento en el número y tamaño de los adipocitos, así como de la secreción de moléculas inflamatorias, tales como el factor de necrosis tumoral alfa (TNF-α), la interleucina-1βeta (IL-1β) y el interferón gamma (IFN-γ). Esto, a su vez, va a estimular la activación de macrófagos M2 a M1, los últimos caracterizados por secretar citoquinas proinflamatorias que inducen un estado inflamatorio crónico de bajo grado y un aumento del estrés oxidativo, lo que finalmente se asocia con resistencia a la insulina (11,32).
Se ha descrito ampliamente que estas alteraciones metabólicas pueden favorecer el desarrollo de comorbilidades como diabetes mellitus tipo 2, síndrome metabólico y enfermedades cardiovasculares (2). Además, estas enfermedades en seres humanos, a nivel sérico, se han asociado con niveles bajos de retinol, β-caroteno, vitaminas E y C, zinc y selenio (4,12,20,23,30,33).
Diversos estudios han demostrado que el suplemento individual de vitaminas y minerales en modelos in vivo e in vitro de obesidad puede disminuir los niveles de estrés oxidativo, como es el caso de la vitamina C (18), la vitamina E (14) y la vitamina B2 (26). Por otro lado, el suplemento de vitamina C (9), de vitamina E (14) y de vitamina B6 (34) se ha asociado con efectos antiinflamatorios. Otros efectos que se han observado son la disminución del tejido adiposo con la administración de vitamina D (4) y efectos hipoglucemiantes, dislipidemias y aumento de la sensibilidad a la insulina con la administración de vitamina E (1,35,31). Igualmente, con la administración de la vitamina B1 se han reportado efectos hipoglucemiantes (24) y con la vitamina B2 se ha observado disminución de la proliferación de adipocitos (16), así como la participación de la vitamina B6 en la regulación de rutas metabólicas asociadas con los carbohidratos (3).
Los multivitamínicos también incluyen en su fórmula minerales como selenio, cromo, vanadio y magnesio, de los que se ha reportado que pueden disminuir potencialmente el riesgo de desarrollar resistencia a la insulina y diabetes tipo 2 (28). Por ejemplo, el selenio, el vanadio y el cromo pueden reducir la lipemia y glicemia coadyuvando en la regulación de los niveles de insulina en personas con obesidad o síndrome metabólico (19).
Por todo lo anterior, la hipótesis del presente estudio analiza el posible efecto coadyuvante de las vitaminas y minerales presentes en un multivitamínico en la regulación de los niveles de estrés e inflamación, glucosa y perfil lípidos, así como su impacto en la disminución de la resistencia a la insulina y el tejido adiposo. Para ello, se utilizará un modelo de obesidad inducida con dieta de cafetería en ratas, a las que se les coadministrará un suplemento multivitamínico para analizar su efecto sobre los niveles de glucosa, HbA1c, insulina, marcadores inflamatorios (TNF-α, y IL-6), estrés oxidativo y perfil de lípidos por métodos colorimétricos, así como el porcentaje de tejido adiposo y los índices Homeostasis Model Assessment (HOMA) y Quantitative Insulin Sensitivity Check Index (QUICKI).
MATERIALES Y MÉTODOS
CONSIDERACIONES ÉTICAS
El presente estudio se aprobó por el Comité Interno del Cuidado y Uso de los Animales de Laboratorio (CICUAL) de la Unidad de Ciencias de la Salud de la Universidad Veracruzana, región Xalapa, Veracruz, México, con el número de registro CICUAL-UCS-004. Todos los procedimientos se apegaron a la NOM-062-ZOO-1999 sobre el cuidado y manejo de los roedores.
DISEÑO DE ESTUDIO E INDUCCIÓN DE OBESIDAD CON DIETA DE CAFETERÍA
Se utilizaron 35 ratas macho de la cepa Wistar de 28 días de edad (Laboratorio de Bioquímica y Neurotoxicología, Facultad de Bioanálisis, Universidad Veracruzana, Xalapa, Veracruz, México). Los animales se alojaron individualmente en cajas transparentes de acrílico de 58 x 36 x 20 cm en ciclo invertido de 12 horas luz/oscuridad; las cajas fueron colocadas a una distancia de 5 cm para disminuir el estrés causado por el aislamiento. Las ratas se dividieron aleatoriamente en cuatro grupos: 1, control (C, dieta estándar, n = 10); 2, multivitamínico (M, dieta estándar más multivitamínico, n = 9); 3, obesas (O, dieta de cafetería, n = 9) y 4, obesas más multivitamínico (OM, dieta de cafetería más multivitamínico, n = 7). Todos los grupos experimentales tuvieron alimento y agua filtrada ad libitum durante 26 semanas. El suplemento multivitamínico utilizado fue Vitálica Kids® (Bomuca S.A. de C.V. México), el cual se administró vía intubación gástrica. Se empleó una cánula curva de calibre 18 g 1 ml/2.335,5 g/día para administrar el suplemento multivitamínico a los grupos 2 y 4, durante 26 semanas. Al inicio del experimento, se obtuvo una muestra sanguínea de cada rata con cuatro horas de ayuno y se determinaron los niveles séricos basales de glucosa, colesterol y triglicéridos. El peso y la talla se midieron semanalmente y los criterios utilizados para considerar a las ratas obesas fueron un peso mayor a 458,7 g (Cossio-Bolaños y cols., 2013), índice de masa corporal (IMC) > 0,7 e índice de Lee > 0,3 (Novelli y cols., 2007).
Al término del experimento y con ocho horas de ayuno, las ratas se eutanasiaron con sobredosis de pentobarbital sódico (120 mg/kg) de acuerdo a lo establecido en la NOM-062-ZOO-1999. Las muestras sanguíneas se obtuvieron por punción cardiaca y el suero y plasma se conservaron a -80 °C para las determinaciones bioquímicas. Finalmente, se extrajo el tejido adiposo (TA) visceral, epididimal y subcutáneo y se pesó para calcular el IMC e índice de Lee.
CUANTIFICACIÓN DE GLUCEMIA, LIPEMIA Y SENSIBILIDAD A LA INSULINA
Los niveles séricos de glucosa, colesterol total, triglicéridos, HDL-colesterol y LDL-colesterol se cuantificaron por ensayos enzimáticos con kits comerciales (BioSystems S.A., Barcelona) y los valores de VLDL-colesterol se calcularon al dividir VLDL-colesterol = TG/5. El porcentaje de hemoglobina glicosilada (HbA1C) fue determinado a través de un kit comercial (Abbot, Green Oaks, Ill, Estados Unidos). Los niveles de insulina sérica se cuantificaron por ELISA con un kit comercial (RAB0904, Sigma Aldrich, St. Louis, MO, Estados Unidos). La sensibilidad a la insulina se determinó con el kit QUICKI (1/log glucosa [mg/dl] + insulina [µUI/ml]) y el HOMA-IR, con la fórmula glucosa (mg/dl) x insulina (µUI/ml)/2.430, de acuerdo con estudios previos publicados (Cacho y cols., 2008; Katz y cols., 2000).
DETERMINACIÓN DEL ESTADO INFLAMATORIO
Los niveles de TNF-α (RAB0479, Sigma Aldrich, St. Louis, MO, Estados Unidos) y de IL-6 (RAB0312, Sigma Aldrich, St. Louis, MO, Estados Unidos) se cuantificaron por ELISA siguiendo las instrucciones del fabricante.
DETERMINACIÓN DE ESTRÉS OXIDANTE Y ESTADO ANTIOXIDANTE
El estado antioxidante se determinó mediante la actividad de catalasa (CAT) por el método descrito por Sinha (21) y el contenido de glutatión (GSH), utilizando un kit comercial (CS0260, Sigma Aldrich, St. Louis, MO, Estados Unidos). Los niveles plasmáticos de malondialdehído (MDA) para determinar el nivel de estrés oxidante se analizaron siguiendo las instrucciones del kit comercial STA-330 (Cell Biolabs, INC, San Diego, CA, Estados Unidos).
ANÁLISIS ESTADÍSTICO
Los datos se presentan como media ± error estándar y la normalidad y homogeneidad de la muestra se realizaron con las pruebas de Shapiro-Wilks y Levene, respectivamente. Los grupos se compararon con ANOVA de dos vías y análisis post-hoc de Tuckey con el software SigmaPlot 12.0. Un valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOS
EFECTO DEL MULTIVITAMÍNICO EN EL PESO, PORCENTAJE DE TEJIDO ADIPOSO E IMC EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la tabla II se muestra que, al final del experimento, no se encontró diferencia significativa entre el peso del grupo obeso con dieta de cafetería más multivitamínico y el grupo obeso con dieta de cafetería. Sin embargo, el grupo obeso con dieta de cafetería incrementó un 10,61 % su peso en comparación con el grupo control dieta estándar (p < 0,001) y 13,05 % con relación al grupo dieta estándar más multivitamínico (p < 0,05) y un incremento del 8,51 % en el grupo obeso con dieta de cafetería con multivitamínico en comparación con el grupo control dieta estándar (p < 0,05). Con relación al IMC, fue similar entre el grupo obeso con dieta de cafetería más multivitamínico y el grupo obeso con dieta de cafetería, sin diferencias significativas. El índice de Lee no tuvo diferencia significativa entre el grupo obeso con dieta de cafetería más multivitamínico y el grupo obeso con dieta de cafetería. Sin embargo, el grupo obeso con dieta de cafetería tuvo un incremento del 10,6 % en comparación al grupo control con dieta estándar (p < 0,001) y un 8,95% con el grupo dieta estándar más multivitamínico (p < 0,05). Este valor de significación se observó en el índice de Lee, el cual se incrementó un 3,33 % en el grupo obeso con dieta de cafetería en comparación con el grupo control con dieta estándar (p < 0,001) y el grupo dieta estándar más multivitamínico (p < 0,05).
Tabla I. Composición de dieta control y dieta tipo cafetería (100 g de dieta).

Ingredientes dieta de cafetería: pastelitos rellenos sabor chocolate; galletas tipo waffle rellenas de chocolate, galletas saladas, galletas de chocolate rellenas con crema y polvorones; papas fritas; paté de hígado de cerdo y alimento estándar. Cada uno administrado a libre demanda cada 24 horas, excepto el paté, que se dispuso 10 g diariamente.
Tabla II. Efecto del suplemento multivitamínico sobre variables físicas.
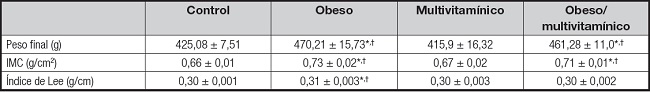
Los datos expresados corresponden al valor de la media ± error estándar de la media por grupo.
*p < 0,05 vs. multivitamínico;.
†p < 0,001 vs. control..
Control: n = 10; obeso: n = 9; multivitamínico: n = 9; obeso más multivitamínico: n = 7.
En la figura 1 se muestra que el suplemento multivitamínico disminuyó el TA visceral en el grupo obeso con dieta de cafetería más multivitamínico en comparación con el grupo control dieta estándar (p < 0,05) (Fig. 1B). Sin embargo, en el grupo dieta estándar más multivitamínico se incrementó significativamente el TA visceral en un 0,76 ± 0,28 % en comparación con el grupo control con dieta estándar (p < 0,05). En cuanto al TA total, este se incrementó significativamente en un 7,75 ± 0,64 % en el grupo obeso con dieta de cafetería en comparación con el grupo control con dieta estándar (p < 0,05), mientras que en el grupo dieta estándar más multivitamínico el TA se incrementó 1,92 ± 0,54 % en comparación con el grupo control dieta estándar (p < 0,05) (Fig. 1A). El TA epididimal se incrementó un 0,74 ± 0,15 % en el grupo obeso con dieta de cafetería en comparación con el grupo control con dieta estándar (p = 0,037) y se observó que el TA subcutáneo se incrementó 1,89 ± 0,2 % en el grupo obeso con dieta de cafetería en comparación con el grupo control dieta estándar (p < 0,001) (Fig. 1C y D). Sin embargo, en el grupo dieta estándar más multivitamínico también se observó que el TA subcutáneo se incrementó significativamente en 1,08 ± 0,20 % en comparación con el grupo control dieta estándar (p < 0,05).
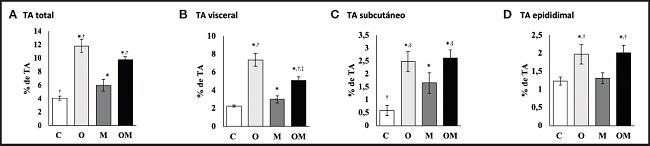
Figura 1. Efecto del suplemento multivitamínico sobre tejido adiposo. Los datos expresados corresponden a la media ± error estándar de la media por grupo. T: tejido adiposo; C: grupo control dieta estándar; O: grupo obeso con dieta de cafetería; M: grupo dieta estándar más multivitamínico; OM: grupo obeso con dieta de cafetería más multivitamínico. *p < 0,05 vs. control dieta estándar; †p < 0,05 vs. dieta estándar más multivitamínico; ‡p < 0,05 vs. obeso con dieta de cafetería; §p < 0,001 vs. control dieta estándar. C: n = 10; O: n = 9; M: n = 9; OM: n = 7.
EFECTO DEL MULTIVITAMÍNICO EN LOS NIVELES DE GLUCEMIA EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la figura 2 se muestra que los niveles séricos de glucosa aumentaron en los tres grupos de manera significativa con relación al grupo control. Sin embargo, en el grupo obeso con dieta de cafetería más multivitamínico los niveles de glucosa disminuyeron significativamente un 24,20 % comparados con el grupo obeso con dieta de cafetería (p < 0,05). Es importante mencionar que, en el grupo con dieta estándar más multivitamínico, los niveles de glucosa se incrementaron significativamente un 52,65 % con relación al grupo control dieta estándar (p < 0,05). Con relación al porcentaje de HbA1c, los resultados muestran un incremento significativo en los tres grupos experimentales, dieta estándar más multivitamínico, obeso con dieta de cafetería y obeso con dieta de cafetería más multivitamínico, si los comparamos con el grupo control con dieta estándar. En el grupo obeso con dieta de cafetería más multivitamínico se observó una disminución significativa de un 0,8 ± 0,05 % en comparación con el grupo obeso con dieta de cafetería (p < 0,05). Además, en el grupo con dieta estándar más multivitamínico los niveles de HbA1c se incrementaron en 2,02 ± 0,24 % en comparación con el grupo control con dieta estándar (p < 0,05) (Fig. 2B).

Figura 2. Efecto del suplemento multivitamínico sobre marcadores metabólicos. Se presenta la media ± EE. C: grupo control dieta estándar; O: grupo obeso con dieta de cafetería; M: grupo dieta estándar más multivitamínico; OM: grupo obeso con dieta de cafetería más multivitamínico. *p < 0,001 vs. control dieta estándar; †p < 0,05 vs. control dieta estándar; ‡p < 0,05 vs. obeso con dieta de cafetería; §p < 0,005 vs. dieta de cafetería más multivitamínico; ¶p < 0,05 vs. obeso con multivitamínico. C: n = 10; O: n = 9; M: n = 9; OM: n = 7.
EFECTO DEL SUPLEMENTO MULTIVITAMÍNICO EN EL PERFIL DE LÍPIDOS EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la figura 2, de la C a la H se presentan los resultados con los marcadores del perfil de lípidos, que mostraron un incremento significativo entre el grupo obeso con dieta de cafetería y el grupo control con dieta estándar (p < 0,05). Sin embargo, en el grupo obeso con dieta de cafetería, la administración del multivitamínico disminuyó significativamente los lípidos totales, el colesterol total, el VLDL-colesterol y los triglicéridos en comparación con el grupo obeso con dieta de cafetería (p < 0,05). En el grupo con dieta estándar más multivitamínico se observó una disminución significativa en los niveles de HDL-colesterol en comparación con el grupo control con dieta estándar y el grupo con obesidad con dieta de cafetería (p < 0,05) (Fig. 2D).
EL SUPLEMENTO MULTIVITAMÍNICO MEJORA EL ESTADO ANTIOXIDANTE Y DISMINUYE EL ESTRÉS OXIDATIVO EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la figura 3, los resultados muestran un aumento en los niveles de estrés oxidativo al incrementarse significativamente la lipoperoxidación en el grupo obeso con dieta de cafetería 11,22 ± 0,32 µM de MDA y en el grupo dieta estándar más multivitamínico 10,25 ± 1,06 µM de MDA en comparación con el grupo control (p < 0,05). En contraste, el grupo obeso con dieta de cafetería más multivitamínico disminuyó la lipoperoxidación en un 33,68 % (3,65 ± 0,04 µM de MDA) en comparación con el grupo obeso con dieta de cafetería (p < 0,05). La actividad de catalasa se incrementó de manera significativa en el grupo obeso con dieta de cafetería en comparación con el grupo control con dieta estándar (p < 0,05), mientras que en los grupos administrados con el multivitamínico no hubo diferencia significativa con relación al grupo control con dieta estándar (p < 0,05), aunque sí se observó una disminución con relación al grupo obeso con dieta de cafetería en un 4,21 ± 0,47 % (p < 0,05). En la figura 3C se muestra que los niveles de glutatión total se mantuvieron elevados significativamente en los tres grupos (p < 0,001 y p < 0,005) en relación al grupo control con dieta estándar. Sin embargo, en el grupo obeso con dieta de cafetería más multivitamínico, los niveles de glutation disminuyeron en 3,05 ± 0,24 nmoles en comparación con el grupo obeso con dieta de cafetería. Finalmente, el grupo con dieta estándar más multivitamínico incrementó sus valores de GSH total en 14,84 ± 0,97 nmoles en comparación con el grupo control dieta estándar 8,06 ± 0,52 nmoles (p < 0,001).
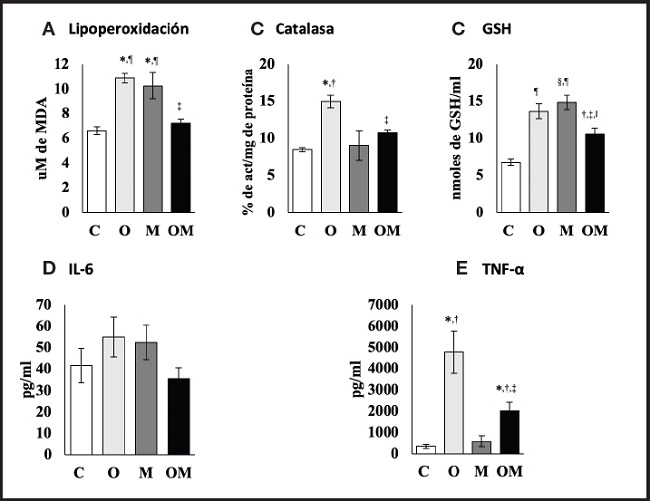
Figura 3. Efecto del suplemento multivitamínico sobre estrés oxidativo y citoquinas proinflamatorias. Los datos expresados corresponden a la media ± error estándar de la media por grupo. GSH: glutatión reducido; TNF-α: factor de necrosis tumoral alfa; IL-6: interleucina 6. Se presenta la media ± EE. C: grupo control dieta estándar: O: grupo obeso con dieta de cafetería; M: grupo dieta estándar más multivitamínico; OM: grupo obeso con dieta de cafetería más multivitamínico. *p < 0,05 vs. control dieta de cafetería; †p < 0,05 vs. dieta estándar más multivitamínico; ‡p < 0,05 vs. obeso con dieta de cafetería; §p < 0,005 vs. obesos con dieta de cafetería más multivitamínico; ¶p < 0,001 vs. control dieta estándar; IIp < 0,005 vs. control dieta estándar. C: n = 10; O: n = 9; M: n = 9; OM: n = 7.
EFECTO DEL MULTIVITAMÍNICO EN LOS NIVELES DE INFLAMACIÓN EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la figura 3E se muestra que los niveles de IL-6 no se modificaron de manera significativa en los tres grupos, si los comparamos con el grupo control dieta estándar, aunque en el grupo obeso con dieta de cafetería más multivitamínico sus niveles estuvieron muy cercanos al control con dieta estándar. Con relación a los niveles de TNF-α, el grupo obeso con dieta de cafetería incrementó sus niveles en un 93 % (4.436,91 ± 898,04 pg/ml) comparado con el grupo control dieta estándar (p < 0,05), mientras que el grupo obeso con dieta de cafetería más el multivitamínico mostró niveles altos de TNF-α (2.031,84 ± 394,34 pg/ml) si lo comparamos con el grupo control con dieta estándar (p < 0,05). Sin embargo, al compararlo con el grupo obeso con dieta de cafetería se observó una disminución significativa de un 42,50 % (2.747,94 ± 601,98 pg/ml, p < 0,05).
EL MULTIVITAMÍNICO MEJORA LA SENSIBILIDAD A LA INSULINA EN RATAS OBESAS CON DIETA DE CAFETERÍA
En la figura 4A, los resultados muestran que los niveles de insulina se incrementaron significativamente en el grupo obeso con dieta de cafetería (38,07 ± 4,51 µIU/ml) y el grupo obeso con dieta de cafetería más multivitamínico (20,08 ± 1,95 µIU/ml) en comparación con el grupo control con dieta estándar (p < 0,05). Al comparar el grupo obeso con dieta de cafetería y el grupo obeso con dieta de cafetería más multivitamínico, se observa una disminución de un 48,26 % (17,99 ± 2,56 µIU/ml) en los niveles de insulina, en comparación con el grupo obeso con dieta de cafetería (p < 0,05). De igual manera, los niveles de insulina se incrementaron significativamente entre el grupo con dieta estándar más multivitamínico y el grupo control dieta estándar (p < 0,05). Con relación al índice HOMA-IR (Fig. 4B), este aumentó significativamente en los tres grupos (p < 0,05) con relación al grupo control con dieta estándar. En contraste, en el grupo obeso con dieta de cafetería más el multivitamínico, el índice HOMA-IR disminuyó en un 55,28 % (2,54 ± 0,45) en comparación con el grupo obeso con dieta de cafetería (p < 0,05); resultados similares se observaron en el grupo con dieta estándar más multivitamínico. El índice QUICKI (Fig. 4C) también disminuyó significativamente en los tres grupos experimentales en comparación con el grupo control con dieta estándar (p < 0,05).
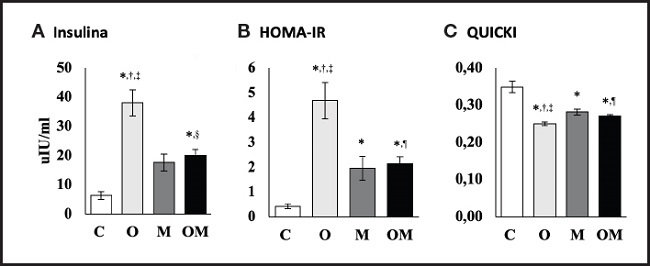
Figura 4. Efecto del suplemento multivitamínico sobre resistencia a la insulina. Los datos expresados corresponden a la media ± error estándar de la media por grupo. C: grupo control dieta estándar; O: grupo obeso con dieta de cafetería; M: grupo dieta estándar más multivitamínico; OM: grupo obeso con dieta de cafetería más multivitamínico. *p < 0,001 vs. control dieta estándar; †p < 0,001 vs. dieta estándar más multivitamínico; ‡p < 0,005 vs. obeso con dieta de cafetería más multivitamínico; §p < 0,001 vs. obeso con dieta de cafetería; ¶p < 0,05 vs. obeso con dieta de cafetería. C: n = 10; O: n = 9; M: n = 9; OM: n = 7.
DISCUSIÓN
Los resultados de este estudio muestran que la coadministración de un multivitamínico en ratas obesas con dieta de cafetería no modifica las variables físicas de peso, IMC e índice de Lee. No se hallaron estudios similares para comparar los resultados, sin embargo, sí se encontraron estudios en los que se administraron vitaminas o minerales de manera individual utilizando modelos animales, con resultados similares al nuestro (1,4,13,24).
En este estudio, las ratas obesas con dieta de cafetería más suplemento multivitamínico tuvieron una disminución en el porcentaje de tejido adiposo visceral en comparación con el grupo obeso con dieta de cafetería; al respecto, una de las vitaminas presentes en la formulación del multivitamínico es la vitamina E. Se ha reportado que cuando se administra en un modelo de obesidad, puede inhibir la maduración y el tamaño de los adipocitos debido a la disminución de lípidos y colágeno (1). Además, el gammatrienol, una de las isoformas de la vitamina E, se asocia con la oxidación de ácidos grasos, además de inhibir la maduración de los adipocitos (35), lo que puede asociarse con la disminución del porcentaje de tejido adiposo visceral en nuestro modelo. Además, la vitamina A puede actuar sobre el tejido adiposo y disminuir los niveles de glucocorticoides por acción de la actividad 11β-HSD1 y la regulación de la esteroil CoA desaturasa, que tiene actividad lipogénica (13). Por otro lado, la vitamina D inhibe la activación de factores de transcripción adipogénica y la acumulación de lípidos durante la fase de diferenciación (4).
En relación al metabolismo de la glucosa, los resultados mostraron en el grupo obeso con dieta de cafetería que la coadministración de multivitamínico disminuye los niveles de glucosa, HbA1C e insulina en comparación con el grupo obeso con dieta de cafetería. Al respecto, la administración de tiamina se ha asociado con la reducción en los niveles de glucosa, al ser este cofactor de la ruta de las pentosas (24). Se ha reportado que los niveles de HbA1C disminuyen cuando los niveles de glucosa sérica se mantienen en niveles normales (24). En contraste, en el grupo con dieta estándar más multivitamínico se incrementaron el tejido adiposo, los triglicéridos, la glucosa, la HbA1C y la insulina si lo comparamos con el grupo control con dieta estándar. Estos resultados pueden asociarse a que el multivitamínico contiene 500 mg/100 ml de fructosa y sacarosa, respectivamente, y estudios previos han reportado que la administración de una solución con sacarosa al 40 % (400 mg/100 ml) u otros carbohidratos en modelos animales, incrementan significativamente estas mismas variables (8,22,25). Estos cambios se han asociado con el incremento en el perfil de lípidos debido a la formación de acetil CoA a partir de glucosa, que se utiliza para la formación de lípidos que se almacenan en el hígado y en el tejido adiposo. Sin embargo, la coadministración del suplemento multivitamínico en el grupo con obesidad disminuye significativamente el porcentaje de grasa visceral, el tejido adiposo, los niveles séricos de colesterol total y los lípidos totales y triglicéridos con relación al grupo con obesidad. Es posible que estos efectos se asocien con las vitaminas E y D y la tiamina, ya que se ha reportado que la vitamina E participa en procesos lipolíticos en adipocitos (1). La vitamina D estimula la producción de VLDL e inhibe la utilización de esta lipoproteína circulante (13). La tiamina funge como cofactor en el ciclo de Krebs y de la enzima piruvato descarboxilasa y se asocian con procesos lipolíticos (24). En contraste, observamos que en el grupo administrado solo con el multivitamínico, en comparación con el grupo control, los niveles de colesterol total, lípidos totales, triglicéridos y LDL se incrementaron, lo que podría deberse a la formación de acetil CoA debido al incremento en la ingesta de carbohidratos presentes en la formulación del multivitamínico (8,22). En este mismo grupo sin obesidad y administrado solo con el multivitamínico se observó la disminución en los niveles de HDL, lo que puede asociarse con la resistencia a la insulina, que a su vez puede inducir síntesis hepática de triglicéridos a partir de ácidos grasos liberados por los adipocitos. Por lo tanto, los triglicéridos contenidos en el HDL son utilizados como sustrato para la lipoproteinlipasa endotelial y la lipasa hepática, seguido de la eliminación por vía renal de la fracción de apolipoproteína A1 restante de HDL (7).
Como era de esperar, en el grupo con obesidad más suplemento multivitamínico se observó una disminución de los niveles de lipoperoxidación. Al respecto, se ha reportado que las vitaminas y minerales presentes en el multivitamínico coadyuvan en el fortalecimiento del estado antioxidante. Por ejemplo, la vitamina E puede detener la cadena de lipoperoxidación al inhibir los sistemas generadores de radicales libres como iNOS y NADPH oxidasa (1,14,27); la vitamina A neutraliza al radical 1O2 (5); y la vitamina C neutraliza a los radicales O2-, OH˙, algunos hidroperóxidos lipídicos y la formación de ONOO- (18) y actúa, además, sobre el tocoferoxilo para transformarlo en vitamina E (6). En contraste, el grupo sin obesidad al cual le se administró el multivitamínico tuvo un incremento en la lipoperoxidación y en el contenido total de glutatión, probablemente debido al incremento en los niveles séricos de lípidos y carbohidratos, lo cual se ha reportado previamente (8,22). Además de las vitaminas, los minerales presentes en el multivitamínico se han asociado con el fortalecimiento de los sistemas antioxidantes. Es el caso del hierro, que forma parte del núcleo activo de la catalasa, lo que permite que esta enzima cumpla con su función antioxidante (10); y el selenio, que forma parte del núcleo activo del glutatión (3), por lo que los minerales presentes en el multivitamínico coadyuvan en el equilibrio de los sistemas de óxido reducción.
En individuos con sobrepeso y obesidad, se ha reportado un aumento en marcadores del estado inflamatorio. Estas observaciones correlacionan con el aumento significativo en los niveles de TNF-α en todos los grupos experimentales, aunque los niveles de IL-6 no se modificaron significativamente. Es importante mencionar que, en el grupo obeso con dieta de cafetería, la coadministración del multivitamínico disminuyó los niveles de TNF-α, mientras que en el grupo control con dieta estándar el multivitamínico mantuvo niveles similares al grupo control con dieta estándar. Al respecto, se sabe que la vitamina E puede inhibir a NFκB y, a su vez, la secreción de citoquinas proinflamatorias en los adipocitos y macrófagos M1 presentes en el tejido adiposo (1,35).
Se ha reportado que las vitaminas D y E, presentes en el multivitamínico, disminuyen los niveles de insulina y promueven la expresión de genes promotores de insulina, además de disminuir la apoptosis de las células β pancreáticas (4), mientras que la vitamina E estimula la sensibilidad a la insulina, al evitar que los sustratos del receptor de la insulina sean oxidados por los radicales libres (35). En nuestro estudio encontramos que el multivitamínico disminuye los niveles de insulina en el grupo obeso con el multivitamínico, lo que sugiere que estas vitaminas podrían estar participando. De esta forma, al disminuir los niveles de glucosa e insulina en el grupo con obesidad más multivitamínico, la resistencia a la insulina y la sensibilidad a la misma se ve modificada, por lo que el índice HOMA disminuyó y el QUICKI aumentó significativamente en el grupo con obesidad más suplemento multivitamínico. Esto contrasta con el grupo al que solo se le administró el suplemento multivitamínico, que aumentó los niveles de insulina y el índice HOMA con respecto al grupo control sin obesidad. Es probable que la ingesta de azúcares provenientes del multivitamínico haya favorecido que los tejidos periféricos disminuyan la sensibilidad a la insulina como se ha reportado previamente (22).
Por lo tanto, el efecto de las vitaminas y minerales que contiene el suplemento multivitamínico podría estar incidiendo en dos vías asociadas con el desarrollo de resistencia a la insulina: primero, al disminuir el estrés oxidativo, y segundo, al disminuir el estado inflamatorio. Al momento de este estudio, no se encontraron reportes en la literatura que utilicen un suplemento multivitamínico, por lo que el resultado observado en este estudio puede deberse a la acción en conjunto de todas las vitaminas y minerales, las cuales lograron disminuir los niveles de insulina, el índice HOMA y la sensibilidad a la insulina. No obstante, una de las principales limitaciones de este estudio fue que el multivitamínico utilizado contenía 500 mg/ml de azúcares añadidos, lo que pudo haber alterado las variables analizadas. Otra limitante fue la no cuantificación de los niveles de vitaminas con el fin de ajustar la suplementación de las mismas.
CONCLUSIÓN
Las vitaminas y los minerales presentes en el multivitamínico, al administrarse simultáneamente en ratas obesas con dieta de cafetería, coadyuvan en la disminución del tejido adiposo, la resistencia a la insulina, la inflamación, el estrés oxidativo y los niveles de glucosa en comparación con el grupo obeso con dieta de cafetería. Sin embargo, los azúcares añadidos en el multivitamínico también pueden incrementar el tejido adiposo y el perfil de glucosa y lípidos en comparación con el grupo control con dieta estándar, por lo que estudios futuros se encaminarán para analizar multivitamínicos sin azúcares añadidos.














