INTRODUCCIÓN
El fallo intestinal (FI) se define como la pérdida de la función para tener la absorción adecuada de los nutrimentos, el agua y los electrolitos. Requiere de la suplementación intravenosa de líquidos y/o nutrición parenteral (NP) para mantener la salud y/o el crecimiento. Desde el punto de vista funcional, el FI se clasifica en tres tipos según la gravedad, la duración de la afección y los trastornos metabólicos presentes. El FI tipo I (FI-I) es autolimitado y de rápida resolución, suele ocurrir después de una cirugía o enfermedad crítica y el tratamiento se enfoca en recuperar la homeostasis, superar la fase aguda y resolver el origen que la condicionó. El FI tipo II (FI-II) es una condición aguda prolongada (semanas a meses), frecuente en pacientes previamente sanos y asociado a complicaciones infecciosas y metabólicas complejas que los mantiene inestables. El tratamiento se centra en resolver la sepsis y corregir la disfunción orgánica y el FI. El tipo III (FI-III) es crónico (meses o años) y se presenta en pacientes metabólicamente estables que pueden estar en casa con NP. Además, se presenta posterior a la resección intestinal múltiple o enfermedad sistémica o gastrointestinal severa, y también, como resultado de enfermedad terminal por cáncer intraabdominal o pélvico. Cuando se asocia con enfermedad benigna es reversible y el 20-50 % de los pacientes logra el retiro de la NP (1-3).
Esta condición es un tipo raro de fallo orgánico y la incidencia de cada uno de los tipos es difícil de cuantificar, ya que no se tienen registros claros. En Europa, se estima una incidencia anual de nueve y dos casos por millón de habitantes de FI-II y de FI-III, respectivamente (4), y fue incluido como enfermedad rara (ORPHA:294422) (5). Existen guías internacionales para el manejo del FI para el paciente hospitalizado y ambulatorio (6,7). La eficacia de la atención nutricional ha sido ampliamente documentada e incluso recientemente considerada como un derecho humano (8). En el ámbito hospitalario, es importante tomar en consideración el proceso de atención nutricia para el tamizaje, la evaluación, la intervención y el monitoreo constante de los pacientes (9).
El soporte nutricional debe estar acompañado de la reposición hidroelectrolítica en función de las pérdidas que se producen en problemas como diarrea, fístulas, fiebre. Se debe vigilar el aporte de líquidos, glucosa y electrolitos, especialmente al inicio de la NP, para evitar complicaciones como el síndrome de realimentación (3). Las guías internacionales recomiendan una prescripción individualizada y el uso de la calorimetría indirecta o de ecuaciones de predicción de gasto energético en reposo (GER) para el cálculo de requerimientos y del aporte nutrimental que los cubra (10).
Por otro lado, el monitoreo de las medidas antropométricas y bioquímicas es un indicador que determina la eficacia de la intervención nutricia. Además de las mediciones tradicionales como el peso, el índice de masa corporal (IMC) o las circunferencias corporales, la composición corporal es estimada con la bioimpedancia eléctrica multifrecuencia, que tiene buena correlación con los estándares de referencia (11) e incluso algunos de sus parámetros, como el ángulo de fase (AF), han sido considerados indicadores pronósticos (12). El objetivo del presente estudio fue evaluar las características de una cohorte de pacientes hospitalizados con FI y su asociación con los desenlaces clínicos de mortalidad, estancia intrahospitalaria (EIH) e indicadores nutricionales (riesgo nutricio, riesgo de realimentación, composición corporal y gasto energético en reposo).
MATERIALES Y MÉTODOS
Se realizó un estudio de cohorte histórica en un hospital de referencia de tercer nivel de enero de 2019 a junio de 2022. Se incluyeron pacientes adultos de ambos sexos, hospitalizados con diagnóstico de FI y con soporte nutricio con NP. El estudio fue aprobado por el comité institucional de ética e investigación en humanos (n.º 1705). Se garantizó la confidencialidad y seguridad de la información privada de los sujetos incluidos en el estudio creando una base de datos electrónica protegida mediante la codificación de las variables.
La atención nutricional estuvo a cargo de un equipo multidisciplinario de soporte nutricio y se registraron las variables relacionadas: tamizaje nutricional y riesgo de realimentación y evaluación nutricional (variables antropométricas, bioquímicas, clínicas, requerimientos y prescripción nutricional) (13). Se obtuvieron del expediente electrónico los datos clínicos para establecer la fisiopatología y causa del FI, considerando los diagnósticos médicos establecidos, así como seguimiento, EIH y mortalidad.
El tamizaje nutricional (NRS-2002, Nutritional Risk Screening 2002) se realiza en las primeras 24 horas de ingreso por personal capacitado para determinar la presencia de riesgo nutricio (≥ 3 puntos) (14).
El riesgo de realimentación se evalúa al ingreso según el algoritmo que considera la pérdida de peso involuntaria, el IMC, la baja o nula ingesta energética, las concentraciones bajas de electrolitos y el diagnóstico (15).
En cuanto a las variables antropométricas, se registraron el peso y la talla con una báscula y estadímetro digital y se calculó el IMC (peso/talla2). Los datos de composición corporal fueron medidos con equipo de bioimpedancia eléctrica multifrecuencia (InBody S10; InBody Co., Ltd., Seúl, Corea). Se trata de un método no invasivo basado en el paso de corriente alterna a través del cuerpo y sus interacciones con células y tejidos; produce lecturas de resistencia y de reactancia, con las cuales se calculan variables como el AF, la relación de agua extracelular (AEC) y agua corporal total (ACT), así como diversos valores de composición corporal útiles en la práctica clínica (16). Para esta medición, el paciente se mantiene en decúbito, se le colocan electrodos en ambas manos y pies y el equipo registra las mediciones completas en aproximadamente un minuto.
Con respecto a las variables bioquímicas, se registraron al ingreso y a los 21 días (en los pacientes que continuaban con NP) los valores de las pruebas de función hepática, química sanguínea, proteína C reactiva (PCR) y electrolitos séricos. Dichos análisis de llevaron a cabo en el laboratorio central a través de ensayos colorimétricos enzimáticos como glucosa hexoquinasa para la medición de glucosa, las pruebas de funcionamiento hepático con la técnica UVP5P y la PCR con inmunoturbidimetría.
El método de hexoquinasa usa suero de la muestra obtenida, la cual se desproteiniza con hidróxido de bario y sulfato de zinc; la glucosa que contiene la muestra reacciona con ayuda de la enzima hexoquinasa para formar glucosa-6-fosfato (G6F). Posteriormente, la glucosa 6-fosfato deshidrogenasa actúa sobre la G6F en presencia de la nicotinamida adenina dinucleótido fosfato (NADP+) para formar dihidronicotinamida adeninda dinucleótido fosfato (NADPH) o NADH y 6-fosfogluconato. La cantidad de NADPH o NADH se mide con una absorbancia de 340 nm, siendo esta la cantidad proporcional de glucosa contenida en la muestra (17).
La técnica UVP5P, también conocida como IFCC, actúa cuando, por ejemplo, la alaninotransferasa (ALT) cataliza la reacción entre la L-alanina y el 2 oxoglutarato formando piruvato y L-glutamato. El piruvato es, consecuentemente, reducido por NADH por la lactato deshidrogenasa (LDH) para formar L-lactato y NAD+; la proporción oxidada de NADH es equivalente a la actividad catalítica de ALT y se determina midiendo la reducción de la absorbancia (18). Por último, el ensayo de inmunoturbidimetría se basa en la aglutinación de la PCR con partículas de látex que se unen con anticuerpos monoclonales anti-PCR y, como resultado, se forman agregados que se miden por turbidimetría (19).
La calorimetría indirecta es un método no invasivo llevado a cabo con el paciente en decúbito. Se le coloca una mascarilla que cubre la nariz y la boca, en reposo durante 30 minutos, para estimar a través del intercambio respiratorio de oxígeno (O2) y dióxido de carbono (CO2) los valores del GER y el cociente respiratorio (RQ = VCO2/VO2), a fin de establecer la proporción de sustratos oxidados (hidratos de carbono, proteína y lípidos) (20). Se utilizó para ello el monitor metabólico Quark Ergo (Cosmed, Rome, Italy).
Para la prescripción nutricional se obtuvieron los valores de la indicación de la NP (energía, macronutrimentos totales por kg de peso actual y porcentaje de distribución). Se consideraron el GER y la energía prescrita y se calculó el porcentaje de adecuación (21).
ANÁLISIS ESTADÍSTICO
Las variables cualitativas se presentan en frecuencias y porcentajes y se analizó la distribución de las variables cuantitativas con la prueba de Kolmogorov-Smirnov. Los datos con distribución normal se presentan en media y desviación estándar (DE) y, en caso contrario, como mediana y rango intercuartil (RIC). Para la comparación de las variables cualitativas se utilizó la prueba de Chi-cuadrado y para las cuantitativas con distribución normal, la prueba t de Student para muestras relacionadas, t de Student para muestras independientes o Anova de una vía, según el caso. Para las variables no paramétricas se emplearon las pruebas de Wilcoxon, U de Mann-Whitney o Kruskal-Wallis, según el caso. Se usó el paquete estadístico SPSS versión 22 para Windows (22).
RESULTADOS
Fueron elegibles 734 ingresos hospitalarios de pacientes que recibieron soporte nutricio con NP. Se excluyeron 18 que no tuvieron diagnóstico de FI y 19 por motivos de reingresos hospitalarios. Finalmente, se incluyeron 697, la mediana de edad fue de 56 (41-68) años y 327 fueron mujeres (46,8 %), con IMC de 22,4 (18,3-25,9). El diagnóstico fue: FI-I en 577 (82,8 %) pacientes, FI-II en 96 (13,8 %) y FI-III en 24 (3,4 %). Fallecieron 157 (22,5 %) pacientes durante el internamiento, de 59 (45-69) años vs. 55 (39-67) años en los que sobrevivieron (p = 0,033). La figura 1 muestra la clasificación de los pacientes de acuerdo a los diferentes tipos de FI, así como la proporción de pacientes que murieron en cada grupo, sin diferencia significativa entre ellos (p = 0,283).
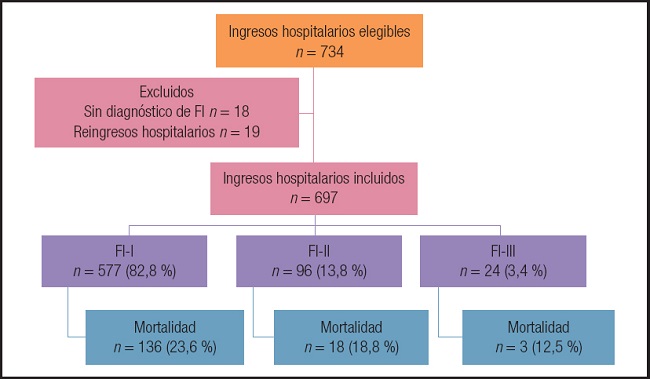
Figura 1. Diagrama del estudio. Se muestra la clasificación de los pacientes hospitalizados incluidos en el estudio en los diferentes tipos de fallo intestinal (FI) y la mortalidad en cada grupo (FI-I: fallo intestinal tipo I; FI-II: fallo intestinal tipo II; FI-III: fallo intestinal tipo III).
Los pacientes al ingreso tuvieron elevado riesgo nutricio (92,4 %) y de realimentación (65,6 % alto y muy alto). La tabla I muestra las características de los pacientes al ingreso de acuerdo con los diferentes tipos de FI; en ella se observan diferencias significativas entre los grupos con respecto a la duración de la NP, la estancia hospitalaria y el IMC. Del total de pacientes, la causa más frecuente de FI fueron las neoplasias malignas, en 180 pacientes (25,1 %), y como mecanismo fisiopatológico, los desórdenes de la motilidad, en 289 pacientes (40,4 %). En la figura 2 se muestran las diferencias en la causa o condición que origina el FI (p = 0,008) y la fisiopatología (p < 0,001) asociada entre los tipos de FI.
Tabla I. Características al ingreso hospitalario de los pacientes con fallo intestinal.
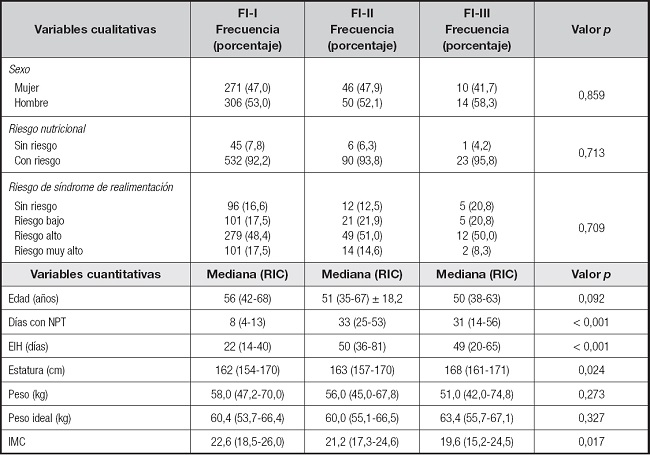
Las variables cualitativas se analizaron con la prueba de Chi-cuadrado, mientras que las variables cuantitativas se analizaron con la prueba de Kruskal-Wallis. FI: fallo intestinal; RIC: rango intercuartil; IMC: índice de masa corporal; NPT: nutrición parenteral total; EIH: estancia intrahospitalaria.
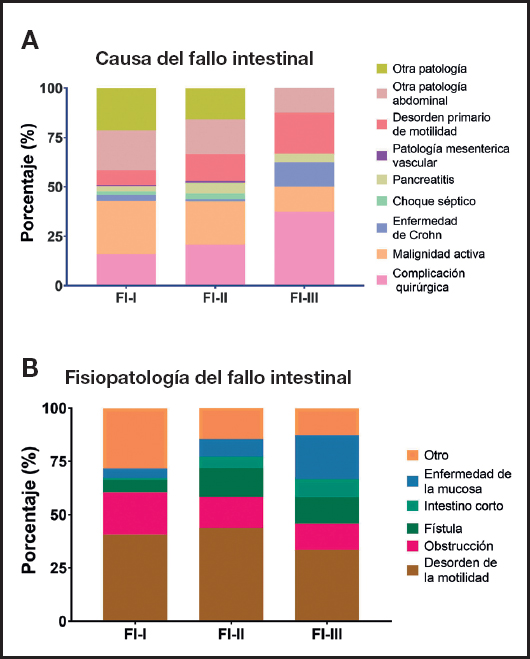
Figura 2. Comparación de la causa (A) y fisiopatología (B) del fallo intestinal entre los diferentes grupos de los pacientes del estudio. Se muestra la comparación realizada con la prueba de Chi-cuadrado, que evidenció que existen diferencias significativas (p = 0,002 y p < 0,001, respectivamente) (FI-I: fallo intestinal tipo I; FI-II: fallo intestinal tipo II; FI-III: fallo intestinal tipo III).
En la tabla II se muestra la comparación de las variables bioquímicas al ingreso y después de 21 días con NP en aquellos pacientes que continuaban alimentándose por esta vía, independientemente del tipo de FI. Se documentó que ALT, aspartato aminotranferasa (AST), fosfatasa alcalina (FA), glucosa y nitrógeno ureico (BUN) aumentaron, mientras que bilirrubinas, creatinina y PCR disminuyeron en este periodo. En cuanto a los resultados de composición corporal la tabla III y la figura 3 muestran que el peso y la grasa visceral de los pacientes con FI-I son significativamente menores que en aquellos que tuvieron más de 21 días con NP (F-II/III); en contraste, aquellos con FI-I tienen mayor retención hídrica y menor AF.
Tabla II. Comparación de los parámetros bioquímicos a la admisión hospitalaria y a los 21 días de estancia hospitalaria en los pacientes con fallo intestinal.
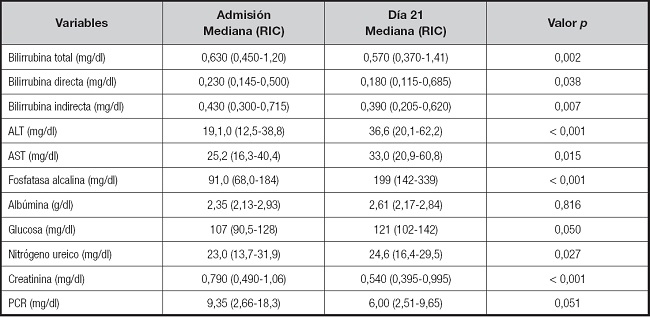
Las variables se analizaron con la prueba de Wilcoxon. RIC: rango intercuartil; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; PCR: proteína C reactiva.
Tabla III. Comparación de la composición corporal de los pacientes con fallo intestinal.
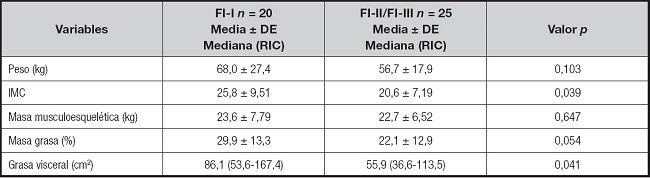
Las variables con distribución normal se analizaron con una prueba t para muestras independientes mientras que las de distribución no paramétricas se analizaron con la prueba U de Mann-Whitney. DE: desviación estándar; RIC: rango intercuartil; IMC: índice de masa corporal.
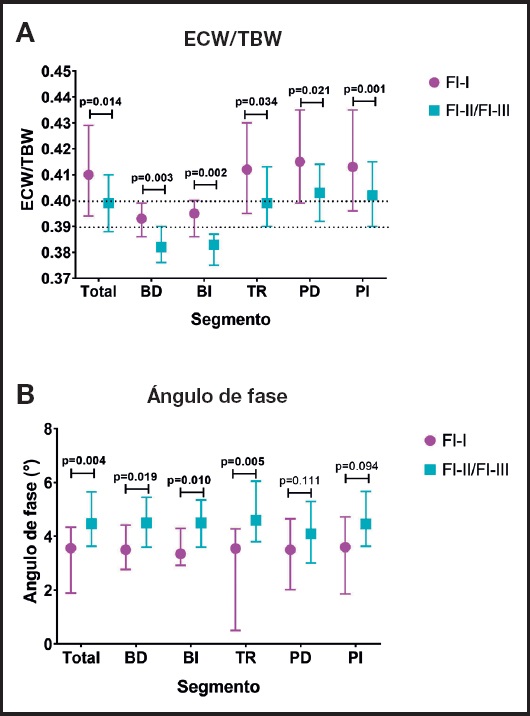
Figura 3. Comparación de la composición corporal segmentada en pacientes con fallo intestinal tipo I (FI-I) y tipo II-III (FI-II/III). A. Relación entre agua corporal extracelular (AEC) y total (ACT). B. Ángulo de fase total y por segmento corporal. Las variables con distribución normal se analizaron con la prueba t para muestras independientes, mientras que las de distribución no paramétrica se analizaron con la prueba U de Mann-Whitney (FI-I: fallo intestinal tipo I; FI-II: fallo intestinal tipo II; FI-III: fallo intestinal tipo III; BD: brazo derecho; BI: brazo izquierdo; TR: tronco; PD: pierna derecha; PI: pierna izquierda).
Por último, aunque la energía prescrita por kg peso es similar entre los grupos, cuando se comparó con el GER estimado por calorimetría indirecta para identificar el porcentaje de adecuación, es decir, si la prescripción de energía en la NP correspondía con lo que el paciente requería según este método, se encontraron datos interesantes. La tabla IV muestra las diferencias entre los pacientes con FI-I vs. F-II/III. En estos últimos, se prescribió mayor aporte de energía y macronutrimentos; utilizan en mayor proporción proteína para la producción de energía, es decir, como sustrato oxidado. Asimismo, el porcentaje de adecuación con relación a su GER, gramos totales y por kg de peso de cada uno de los macronutrimentos, fue significativamente mayor también.
Tabla IV. Comparación de gasto energético y prescripción nutricia.
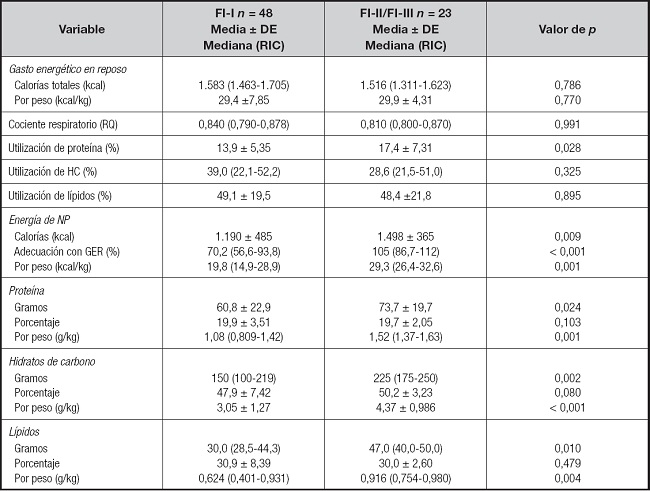
Las variables con distribución normal se analizaron con la prueba t para muestras independientes, mientras que las de distribución no paramétrica se midieron con la prueba U de Mann-Whitney. FI-I: fallo intestinal tipo I; FI-II: fallo intestinal tipo II; FI-III: fallo intestinal tipo III; DE: desviación estándar; RIC: rango intercuartil; HC: hidratos de carbono; GER: gasto energético en reposo; NP: nutrición parenteral.
DISCUSIÓN
La determinación de la epidemiología del FI es compleja, ya que está relacionada con otras patologías y la resolución puede ser variable. La atención y el seguimiento de estos pacientes requieren la intervención de diversos profesionales de la salud y el soporte nutricio con NP es parte indispensable del tratamiento (23). Se estima que aproximadamente el 2 % de los pacientes en los hospitales recibe NP y alrededor del 60 % corresponde a FI aguda (24). Se ha buscado ampliar el conocimiento de esta condición y la colaboración en estudios multicéntricos (25-28), en especial, del FI-III por su rareza, de ahí nuestro interés en documentar la experiencia en su atención, al colaborar en algunas de estas iniciativas por pertenecer a una institución de referencia nacional de enfermedades relacionadas que la condicionan.
La distribución de los tipos de FI encontrada en este estudio estuvo acorde a lo reportado en la literatura con estudios multicéntricos como los mencionados y con otros reportes de experiencia local (29), en los que la proporción y mortalidad de los pacientes con FI-I fueron mayores que las de FI-II, mientras que la menor correspondió a los clasificados como FI-III, relacionada con la estabilidad que tienen los pacientes por definición y las patologías que la originan. Sin embargo, fue menor a la mortalidad reportada por Enríquez-Sánchez y cols., ya que en pacientes con FI-I fue del 55,6 %; con FI-II, del 25,8 %; y con FI-III, del 50 % (30).
Otro estudio realizado por Reitman Blaser y cols. reportó resultados similares a los nuestros, con mortalidad alrededor del 20 % en pacientes con FI aguda (24). Estas diferencias se pueden explicar por la experiencia clínica en el tratamiento del FI, ya que al ser una patología que requiere un manejo multidisciplinario, no siempre es factible que las instituciones cuenten con los recursos humanos y materiales para su tratamiento. Por ello, las estrategias para identificarlo están justificadas, para generar evidencia que contribuya a mejorar su atención y gestión en las instituciones de salud (3), que contribuya en la atención oportuna y adecuada, o bien la referencia a la institución que corresponda.
Encontramos diferencias en la EIH. En el caso del FI-I, en la mayoría de los casos se autolimita, por lo que el paciente puede reiniciar alimentación por vía oral o enteral con duración menor de la NP y egreso más temprano. Los pacientes con FI-II tuvieron una mayor EIH y días con NP, lo que puede deberse a que son pacientes inestables con procesos infecciosos complejos como sepsis abdominal, lo que alarga el proceso de recuperación. Por otro lado, los pacientes con FI-III, a pesar de tratarse de una condición crónica, suelen ingresar por un periodo corto para recibir tratamiento de alguna complicación relacionada con la administración en casa de la NP (infecciones asociadas al catéter, desequilibrio hidroelectrolítico, etc.) o de la enfermedad que condicionó el FI (31).
Los desórdenes en la motilidad (específicamente, diarrea o pseudobstrucción crónica idiopática) corresponden a la fisiopatología más común en los tres tipos de FI. Sin embargo, en los FI-I y FI-II la causa fue la malignidad activa, y en el FI-III las complicaciones quirúrgicas correspondieron a las más frecuentes, lo que puede explicarse por recibir pacientes referidos de otros centros hospitalarios del país para su manejo. Aunque estos resultados difieren de un estudio previo de nuestro grupo de investigación (32), esto se puede deber a que el tamaño de muestra fue menor, en un periodo más corto y con criterios diferentes de inclusión en relación al número de pacientes con respecto a los del presente estudio. Reitman Blaser y cols. publicaron resultados similares en pacientes con FI aguda en los cuales la fisiopatología más común fueron los desórdenes de la motilidad (24).
En el caso de los pacientes con FI-III, al tener un mayor tiempo de afectación y enfermedades que la condicionan más complejas de resolver, el impacto en el estado nutricional es más grave, con menor peso corporal e IMC que los otros tipos. Además, a pesar de que la prescripción de NP en casa cubra sus requerimientos nutricionales, la presencia de estomas de alto gasto, diarrea crónica o fístulas enterocutáneas contribuye a las pérdidas nutrimentales que condicionan un balance energético negativo a largo plazo, o bien, hacen que el apego a la prescripción no sea el óptimo por ser pacientes ambulatorios. Los pacientes con FI-I y FI-II, sin embargo, son pacientes con un diagnóstico más reciente y previamente el tracto gastrointestinal era funcional, por lo que la desnutrición es aguda o menos grave.
De la misma forma, se mostró que el IMC fue diferente entre aquellos pacientes que tenían FI-I, con porcentaje de masa grasa y área de grasa visceral menores en los pacientes con FI-II/III, pero no así en masa muscular, que es lo que usualmente se ve comprometido durante las estancias hospitalarias mayores. Estos resultados son similares a lo encontrado por Kopczynska y cols. (33). Interesantemente, el AF de los pacientes con FI-I fue menor, con retención hídrica, probablemente en relación a las patologías que llevaron a su hospitalización, lo que puede relacionarse, según algunos estudios, con sarcopenia y desenlaces clínicos adversos, como el incremento en la mortalidad (34-36).
En aquellos pacientes con calorimetría indirecta, el porcentaje de adecuación fue del 70 % en los pacientes con FI-I en comparación con el FI-II/III, donde fue del 105 %, probablemente en relación con el tiempo que requieren la NP y la estabilidad metabólica (37).
Se encontraron entre los valores basales y a los 21 días cambios significativos en algunas variables bioquímicas, como la reducción de la PCR, puede que por mejoría en este periodo de las enfermedades de base y, por lo tanto, en la inflamación. Además del incremento en glucosa, BUN, AST, ALT y FA, siendo las relacionadas con las pruebas de funcionamiento hepático las que han sido descritas por el ayuno (38), disbiosis, sobrealimentación y uso a largo plazo de la NP, aunque aún no parecen relevantes clínicamente al momento de la medición, deben ser monitoreadas periódicamente durante su uso para evitar otras complicaciones relacionadas (39).
A pesar de las limitaciones del estudio por tratarse de una cohorte histórica y no contar en todos los pacientes con mediciones de composición corporal por bioimpedancia y calorimetría indirecta, además de llevarse a cabo durante la pandemia, cuando atendimos pacientes con COVID-19, incluso algunos meses de forma exclusiva, la información presentada puede ser útil para conocer de esta condición que afecta a muchos de los pacientes que atendemos en la práctica clínica, y por ser prácticamente nula la evidencia en nuestro país.
La identificación de la fisiopatología y la causa, así como el adecuado tamizaje nutricional, ayudarán a elaborar el diagnóstico y la intervención nutricia correspondientes, el inicio del apoyo nutricio con NP y el monitoreo adecuado, con evaluación de la eficacia y la seguridad para la actualización de las estrategias, hasta cumplir con los objetivos de atención médica y nutricional planteados. De esta manera, el manejo del FI podrá contribuir a los objetivos de reducir su severidad, proporcionar soporte hidroelectrolítico y nutricional adecuado, prevenir y tratar las complicaciones de la enfermedad de base y mejorar la calidad de vida de nuestros pacientes (4).
CONCLUSIONES
Los pacientes con FI tienen riesgo nutricio y de síndrome de realimentación elevados. Las neoplasias malignas (FI-I/II) y las complicaciones quirúrgicas (FI-III) fueron las causas más frecuentes de FI y la fisiopatología en los desórdenes de la motilidad. Los pacientes con FI-I son los atendidos con mayor frecuencia. Por ser autolimitada, la desnutrición documentada es menos grave, reciben NP por periodos más breves, con porcentajes de adecuación menores y EIH más corta, aunque con mayor mortalidad en comparación con los otros tipos de FI. Su reconocimiento es relevante para optimizar su manejo multidisciplinario y evitar las complicaciones relacionadas.














