INTRODUCCIÓN
En las dos últimas décadas ha aumentado mucho tanto el número de órganos trasplantados con éxito como la supervivencia de los receptores del trasplante, lo cual ha dado lugar a un aumento de las complicaciones del mismo, entre las que destacan, por su elevada frecuencia, la osteoporosis (OP) y las fracturas por fragilidad.
La OP es el trastorno más común del metabolismo óseo y aproximadamente la mitad de las mujeres y uno de cada cinco hombres es probable que experimenten una fractura osteoporótica a lo largo de su vida.
La patogenia de la OP surge de un desequilibrio entre la capacidad de los osteoclastos para la resorción de hueso y la capacidad de los osteoblastos para su formación. Existen múltiples factores clínicos que favorecen dicho desequilibrio y que constituyen factores de riesgo de OP. Algunos ejemplos son los cambios hormonales después de la menopausia, la edad avanzada, el tratamiento con glucocorticoides u otras endocrinopatías como hipertiroidismo, hiperparatiroidismo o enfermedades causantes de inflamación sistémica crónica (1,2).
Los marcadores de remodelado óseo son un reflejo de estos procesos de formación y resorción ósea y en nuestro estudio hemos determinado algunos de los más utilizados.
La principal consecuencia de la OP son las fracturas óseas, las cuales se asocian con un aumento de las tasas de morbilidad y mortalidad. Las fracturas vertebrales son el tipo más común de fractura osteoporótica y tienen consecuencias importantes, como son un mayor riesgo de fracturas posteriores y una reducción en la calidad de vida (3).
La prevalencia de la OP entre los candidatos a trasplante pulmonar (TP) es alta, su patogenia es multifactorial y está favorecida por la alteración del metabolismo óseo previa al TP, la utilización de terapias inmunosupresoras como corticosteroides y la deficiencia de vitamina D (4-6). También son factores de riesgo establecidos el sexo, la edad, el tabaco, el consumo de alcohol y el índice de masa corporal (IMC) (7).
El vínculo entre los esteroides sistémicos y la OP está bien establecido. Los glucocorticoides afectan al hueso mediante varios mecanismos: reducen la vida útil de los osteoblastos y los osteoclastos, inducen la apoptosis y reducen el reclutamiento de estas células por parte de las células progenitoras. También disminuyen la absorción de calcio y modifican su excreción, por efectos directos sobre el riñón (8).
La OP es una enfermedad caracterizada por un descenso en la densidad mineral ósea (DMO), lo cual origina una mayor debilidad de los huesos y altera su microarquitectura, incrementando en consecuencia el riesgo de fractura.
La National Osteoporosis Foundation (NOF) recomienda la absorciometría de rayos X de energía dual (DXA) para la detección precoz y el tratamiento de la OP, particularmente la DXA de la columna vertebral y la cadera, porque estas son las localizaciones de fractura más frecuentes (9). Los dispositivos para calcular la DMO suelen integrar información que permite comparar el resultado de la DMO de un paciente con los datos de la DMO de la población joven normal (T-score) y estas comparaciones se expresan como unidades de desviación estándar (DE) de la media.
El T-score se calcula con la diferencia entre la DMO medida de un paciente y la DMO media de la población normal joven, emparejadas por género y etnia, y luego dividiendo la diferencia entre la DE de la DMO de la población normal joven. Es decir, T-score = (DMO del paciente - DMO media de la población joven normal) / (DE de la DMO de la población joven normal).
En 1994, la Organización Mundial de la Salud (OMS) definió la masa ósea baja y la OP de la siguiente manera: en caso de que el T-score esté en el rango de 0 a -1 DE, el sujeto tiene una masa ósea normal; en caso de que el T-score esté en el rango de -1 a -2,5 DE, el sujeto es osteopénico (masa ósea baja); si el T-score es inferior a -2,5 DE, el sujeto es osteoporótico; y si la puntuación T es inferior a -2,5 DE y hay antecedente de fractura por fragilidad, el sujeto se diagnostica de OP grave.
Sin embargo, posteriormente se observó que, en contraste con la definición de la OMS, se producían fracturas relacionadas con la OP, incluso cuando el T-score era mayor que -2,5 (por ejemplo, el T-score es -2,0) y estas observaciones clínicas llevaron a la OMS y a la NOF a adoptar el riesgo de fracturas por fragilidad ósea a diez años (FRAX), que estima la probabilidad de riesgo de fractura de los pacientes incorporando la DMO del cuello femoral y nueve factores clínicos de riesgo de fractura: edad, sexo, fractura por fragilidad previa después de los 50 años, antecedentes de uso de corticosteroides (5 mg o más durante tres meses o más), antecedentes parentales de fractura de cadera, artritis reumatoide, OP secundaria (por ejemplo, diabetes tipo 1, osteogénesis imperfecta en adultos, hipertiroidismo de larga duración, hipogonadismo, menopausia prematura, malabsorción crónica, enfermedad hepática crónica o hiperparatiroidismo), fumador actual o consumo excesivo de alcohol e IMC (10,11).
MATERIAL Y MÉTODOS
Se trata de un estudio observacional y retrospectivo, realizado en colaboración entre el Servicio de Neumología y el Servicio de Bioquímica Clínica del Hospital Universitario Miguel Servet de Zaragoza.
Los participantes fueron reclutados consecutivamente entre los pacientes que cumplían los criterios de inclusión para TP y que acudieron derivados a la consulta de Neumología para valoración entre el 1 de enero de 2010 y el 31 de marzo de 2021. Se clasificaron en dos categorías de acuerdo con su enfermedad pulmonar diagnosticada: enfermedad pulmonar obstructiva crónica (EPOC) y enfermedad pulmonar intersticial difusa (EPID).
El protocolo de estudio se ajustó a los principios de la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación Clínica de Aragón (CEICA).
Se incluyeron, finalmente, 59 pacientes seleccionados con enfermedad pulmonar terminal: 21 diagnosticados de EPOC y 38 diagnosticados de EPID.
CRITERIOS DE INCLUSIÓN
Se debe considerar el TP en adultos con enfermedad pulmonar crónica en fase terminal que cumplan con todos los criterios generales siguientes:
Alto riesgo (> 50 %) de muerte por enfermedad pulmonar en dos años, si no se realiza TP.
Alta probabilidad (> 80 %) de sobrevivir al menos 90 días después del TP.
Alta probabilidad (> 80 %) de sobrevivir cinco años después del TP, desde una perspectiva médica general, si existe una función adecuada del injerto.
CRITERIOS DE EXCLUSIÓN
Los pacientes en los que está contraindicado el TP (Anexo 1), además de los pacientes con patologías que pudieran alterar el metabolismo óseo: hiperparatiroidismo primario, mieloma múltiple, tirotoxicosis o terapia con hormona tiroidea, insuficiencia hepática o insuficiencia renal (creatinina sérica > 2,5 mg/dl).
DISEÑO DEL ESTUDIO
Se recogió información clínica de todos los pacientes, la cual incluía datos demográficos en el momento de la valoración, así como exposición actual y pasada a glucocorticoides, consumo de tabaco, régimen farmacológico y factores de riesgo, generalmente aceptados para la OP. Estos datos fueron confirmados por la revisión de su historial médico.
Además, en el momento de la valoración para TP, se les realizó espirometría, test de la marcha de seis minutos, ecocardiografía, cateterismo cardiaco, densitometría ósea y analítica de sangre que incluía vitamina D y marcadores de remodelado óseo.
Las muestras de sangre se extrajeron a primera hora de la mañana tras ayuno nocturno, en tubos con gel separador, y se determinaron en suero los siguientes parámetros: el calcio y el fósforo se determinaron en un autoanalizador AU 5800 (Beckmann Coulter Miami, FL, Estados Unidos); la fosfatasa alcalina ósea (BAP) y el propéptido carboxi-terminal del procolágeno tipo I (PICP) se determinaron mediante enzimoinmunoensayo manual con posterior lectura espectrofotométrica (kit Microvue BAP EIA y kit Microvue PICP EIA, Quidel Corporation, San Diego, CA, Estados Unidos, respectivamente); la osteocalcina se determinó también mediante enzimoinmunoanálisis manual (N-MID Osteocalcina, USA Immunodiagnostic Systems Inc., Estados Unidos); y la vitamina D se determinó en el analizador Architect i1000 SR (Abbott Diagnostics, Estados Unidos).
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se utilizó el programa IBM SPSS Statistics versión 26.0.
En primer lugar, se empleó el test de Kolmogorov-Smirnov (K-S) para estudiar la distribución de las variables cuantitativas. En el caso de que siguieran una distribución normal (K-S, p > 0,05), se emplearon para su descripción la media y la desviación estándar, y en el caso de que las variables cuantitativas no siguieran una distribución normal (K-S, p ≤ 0,05), se emplearon para su descripción la mediana y el rango intercuartílico.
Para la comparación entre los dos grupos de los distintos parámetros estudiados se utilizó la prueba t de Student o el test de Welch cuando se trataba de una distribución normal, dependiendo respectivamente de si las varianzas en ambos grupos eran homogéneas o no. El test U-Mann Whitney se empleó cuando alguno de los dos grupos presentaba una distribución no normal.
Para la descripción de las variables cualitativas dicotómicas se emplearon las frecuencias por grupo y para la comparación de dichas variables entre los dos grupos se empleó el test de la Chi-cuadrado.
RESULTADOS
En el estudio se incluyeron 59 pacientes, de los cuales 21 formaban parte del grupo diagnosticado de EPOC y 38, del grupo de EPID. No se encontraron diferencias entre los grupos en cuanto a edad ni sexo. En cuanto a los factores de riesgo cardiovascular y su repercusión, solo se apreció mayor prevalencia de dislipemia (DLP) en el grupo de pacientes con EPOC (p < 0,05).
Tampoco se encontraron diferencias entre ambos grupos en el consumo de tabaco ni en su IMC, antecedentes de hipertensión arterial (HTA), diabetes mellitus (DM), ni infarto agudo de miocardio (IAM), según se muestra en la tabla I.
Tabla I. Datos descriptivos de variables sociodemográficas y datos clínicos en el grupo con EPOC y en el grupo de pacientes con EPID. Análisis entre los grupos.

EPOC: enfermedad pulmonar obstructiva crónica; EPID: enfermedad pulmonar intersticial difusa; K-S: Kolmogorov-Smirnov; IMC: índice de masa corporal; HTA: hipertensión arterial; DM: diabetes mellitus; DLP: dislipemia; IAM: infarto agudo de miocardio. p: nivel de significación estadística en comparación entre los dos grupos. Los datos descriptivos son media ± desviación estándar y mediana (rango intercuartílico). El texto en negrita indica resultados estadísticamente significativos (p < 0,05).
*Valor estadísticamente significativo; deberá utilizar un test no paramétrico para su análisis (U de Mann-Whitney).
En el grupo de pacientes con EPOC, solo cuatro de ellos no habían recibido tratamiento con corticoides inhalados. De los restantes, 14 habían recibido dosis intermedias, dos pacientes habían recibido dosis altas y uno de ellos, dosis bajas. Respecto a los pacientes EPID, 19 pacientes (50 %) habían recibido tratamiento con dosis de corticoides orales, con probable repercusión ósea (12).
Con respecto a la función pulmonar de nuestros pacientes, se observó un menor volumen espiratorio forzado el primer segundo (FEV1) en pacientes con EPOC que en el grupo con EPID, tanto al valorarla en litros como en porcentaje, respecto a la población de referencia (p < 0,01). No se encontraron diferencias en cuanto a la capacidad vital forzada (FVC), pero el grupo de EPOC presentaba menor cociente FEV1/FVC (p < 0,01). En el test de la marcha se observó en el grupo EPID una mayor distancia recorrida (p < 0,01). Estos resultados aparecen reflejados en la tabla II.
Tabla II. Datos descriptivos de los principales parámetros espirométricos y distancia caminada en el 6MWT en el grupo EPOC y en el grupo EPID. Análisis entre los grupos.
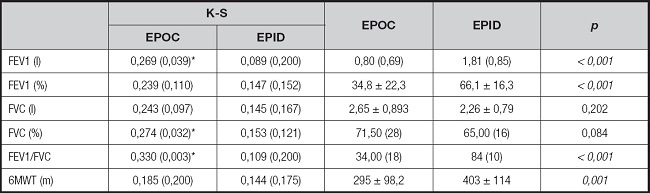
K-S: Kolmogorov-Smirnov; FEV1: volumen espiratorio forzado el primer segundo; FVC: capacidad vital forzada; 6MWT: test de la marcha de seis minutos. p: nivel de significación estadística en comparación entre los dos grupos. Los datos descriptivos son media ± desviación estándar y mediana (rango intercuartílico). El texto en negrita indica resultados estadísticamente significativos (p < 0,05).
*Valor estadísticamente significativo; deberá utilizar un test no paramétrico para su análisis (U de Mann-Whitney).
Analizando los resultados de la DMO en el grupo que tenía EPOC, se obtuvieron resultados normales para T-score en tres pacientes, siete de ellos tenían T-score concordante con OP y once pacientes, concordante con osteopenia. En el grupo con EPID hubo 17 pacientes con T-score normal, tres pacientes con OP y 18 pacientes con osteopenia. También se pudo comprobar que en el grupo EPOC existía mayor prevalencia de OP (p < 0,05), así como mayor prevalencia de T-score disminuido (pacientes con osteopenia más pacientes con OP [p < 0,05], según se muestra en la figura 1.
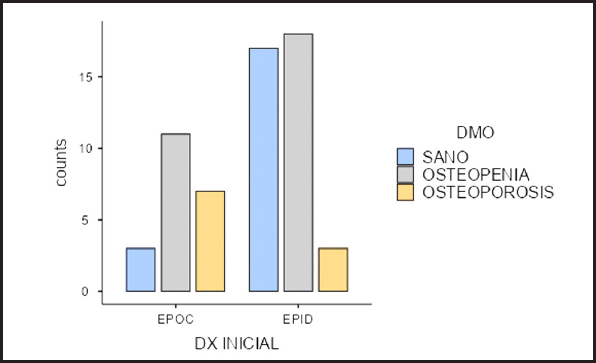
Figura 1. Frecuencia de pacientes con osteoporosis y osteopenia en el grupo con EPOC y en el grupo con EPID.
El T-score fue menor en el grupo EPOC, comparado con el grupo EPID, tanto en el T-score de cadera (p < 0,01), como en el T-score total de fémur (p < 0,01) y el T-score vertebral L1-L4 (p < 0,01). Estos resultados quedan recogidos en la tabla III.
Tabla III. Datos descriptivos (media y desviación estándar, mediana y rango intercuartílico y frecuencias) de los principales parámetros de la densitometría ósea (T-score), del FRAX y de osteopenia, osteoporosis y T-score disminuido en el grupo EPOC y en el grupo EPID. Análisis entre los grupos.
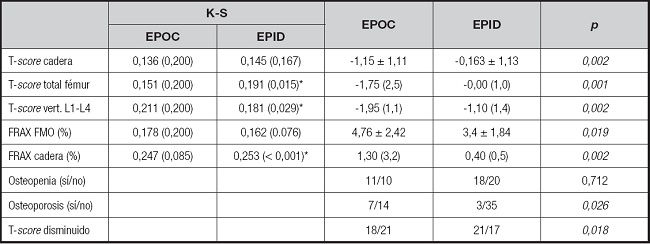
K-S: Kolmogorov-Smirnov; vert.: vertebral; FRAX: riesgo de fractura en diez años; FMO: fractura mayor osteoporótica. Los datos descriptivos son media ± desviación estándar y mediana (rango intercuartílico). El texto en negrita indica resultados estadísticamente significativos (p < 0,05).
*Valor estadísticamente significativo; deberá utilizar un test no paramétrico para su análisis (U de Mann-Whitney).
En cuanto al FRAX, se observó un mayor riesgo de fractura mayor osteoporótica en diez años (p < 0,05) y de fractura de cadera en diez años (p < 0,01) en el grupo de pacientes con EPOC (Fig. 2).
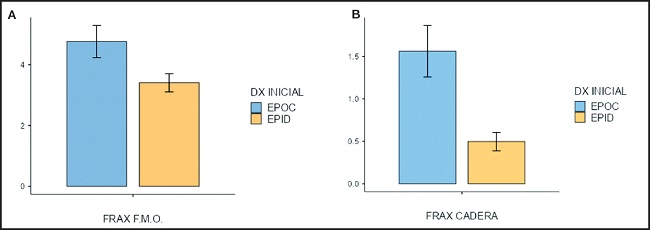
Figura 2. A. Riesgo de fractura en diez años (FRAX) para fractura mayor osteoporótica (F.M.O.) en pacientes con EPOC y con EPID. B. FRAX para fractura de cadera en diez años en pacientes con EPOC y pacientes con EPID.
Respecto a los marcadores de remodelado óseo, se encontró mayor concentración de hormona paratiroidea (PTH) (p < 0,05) y mayor concentración de osteocalcina (p < 0,01) en el grupo de pacientes con EPOC. También se encontró en este grupo una menor concentración de vitamina D (p < 0,05). No se apreciaron diferencias estadísticamente significativas en cuanto a BAP, concentración de calcio, de fósforo ni de PICP, según se muestra en la tabla IV.
Tabla IV. Datos descriptivos (media y desviación estándar, mediana y rango intercuartílico) de los parámetros de remodelado óseo en el grupo EPOC y en el grupo EPID. Análisis entre los grupos (t de Student y U de Mann-Whitney).
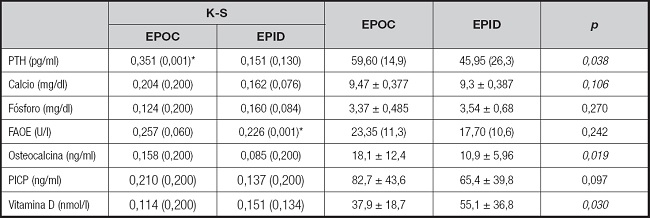
K-S: Kolmogorov-Smirnov; PTH: hormona paratiroidea; FAOE: fosfatasa alcalina ósea específica; PICP: propéptido C-terminal del protocolágeno tipo I. Los datos descriptivos son media ± desviación estándar y mediana (rango intercuartílico). El texto en negrita indica resultados estadísticamente significativos (p < 0,05).
*Valor estadísticamente significativo; deberá utilizar un test no paramétrico para su análisis (U de Mann-Whitney).
DISCUSIÓN
La OP y las fracturas por fragilidad se encuentran entre las complicaciones más frecuentes en los pacientes candidatos a TP. La prevalencia de la OP entre los candidatos en espera de TP se ha estimado previamente entre el 35 % y el 61 % (13,14). Entre nuestros pacientes, un 66 % padecía OP u osteopenia. Hay que destacar también que un 85,7 % de los pacientes con EPOC presentaban disminución del T-score.
En nuestro estudio, el T-score fue menor en el grupo de pacientes con EPOC, al compararlo con el grupo con EPID, tanto para el T-score de cadera como para el T-score total de fémur y para el T-score vertebral L1-L4.
En otros estudios también se ha apreciado que el grupo de pacientes con EPOC presentaba menor DMO, menor concentración de vitamina D y mayor riesgo de fracturas que la población sana (15,16).
También se han comparado los pacientes con EPID sin tratamiento previo con corticoides con la población sana, observando que los primeros tenían menor DMO (17). Asimismo, Amany y cols. (18) hallaron disminución de la DMO tanto en los pacientes EPOC como EPID, la cual se incrementaba si habían recibido tratamiento con corticoides.
A pesar de que se ha insistido mucho en la importancia de la realización de DXA en los pacientes con enfermedad pulmonar terminal, existe un porcentaje muy reducido de los mismos a los que se les realiza esta exploración complementaria (19) y la bibliografía aportada con respecto a la comparación entre la DMO de los pacientes con EPOC y EPID es bastante escasa.
En nuestro estudio también se observó en el grupo EPOC mayor riesgo de fractura mayor osteoporótica y de fractura de cadera en diez años (p < 0,01). En este sentido, en algunos estudios se ha señalado la relevancia del FRAX en pacientes con EPOC, así como su posible importancia para valorar suplementación con vitamina D en algunos pacientes (20,21). Sin embargo, Ogura-Tomomatsu y cols. (22) no encontraron asociación entre los valores de la DMO, el FRAX y las fracturas vertebrales en pacientes con EPOC.
Además, aunque las fracturas óseas se asocian con un aumento en las tasas de morbilidad y mortalidad (3), no se ha encontrado bibliografía referente al FRAX en pacientes con EPID.
La afectación ósea que padecen los pacientes del grupo EPOC parece tener poca relación con el tratamiento con corticoterapia inhalada, ya que solo dos pacientes recibían dosis elevadas, que son las únicas con efectos potenciales sistémicos, según la bibliografía actual (23). Sin embargo, en los pacientes con EPID, un 50 % de los mismos recibían corticoterapia oral a dosis que podrían influir en la DMO y en el FRAX (24).
Además, existe bibliografía en la que se ha asociado la concentración de PTH con la severidad de los pacientes afectos de EPOC (25). En nuestro estudio, el grupo de pacientes con EPOC tuvo mayor concentración de PTH, posiblemente asociado a las concentraciones más bajas de vitamina D observadas.
En este sentido, varios estudios han demostrado que las personas con enfermedad pulmonar tienen deficiencia de vitamina D (26,27-29), la cual provoca disminución del calcio en sangre e hiperparatiroidismo secundario, que puede inducir OP, y que su adecuada suplementación reduce el riesgo de fracturas osteoporóticas (30).
El déficit de vitamina D observado está influido por múltiples factores, como la alteración de la síntesis cutánea de vitamina D por la edad y los efectos tóxicos del tabaco, la escasa exposición a la luz solar debido a la movilidad restringida, el aumento del catabolismo de la vitamina D por los glucocorticoides, su secuestro en los adipocitos, la absorción intestinal reducida y la activación hepática y renal deficiente de los precursores de la vitamina D (31,32), además de un aumento en su catabolismo, relacionado con la inflamación (27).
El hecho de que el déficit de vitamina D sea más acusado en los pacientes con EPOC hace que se recomiende un seguimiento atento de la concentración de vitamina D en estos pacientes. Actualmente, se recomienda que todos los pacientes hospitalizados debido a exacerbaciones sean evaluados para detectar una deficiencia de vitamina D, que habrá de seguirse de suplementación, si fuera necesario, ya que dicha suplementación ha demostrado disminuir los episodios de exacerbación y, por tanto, de hospitalización (33). Nuestros resultados apoyan más si cabe esta recomendación. Un 33 % de los pacientes EPOC incluidos recibían suplementación en el momento de la valoración para TP.
Hasta ahora se ha estudiado poco sobre el papel que desempeña la osteocalcina en la enfermedad pulmonar, pero existe algún estudio en el que se ha encontrado disminuida en los pacientes con EPOC respecto a los pacientes sanos (34). En nuestro estudio, los niveles de osteocalcina en EPID eran inferiores a los que presentaban los pacientes con EPOC, por lo que parece lógico el planteamiento de estudios relacionados con la concentración de osteocalcina en pacientes con EPID.
Los marcadores bioquímicos del remodelado óseo han contribuido a un mejor conocimiento de la fisiología ósea y la patogenia de las enfermedades metabólicas óseas y pueden aportar información adicional y complementaria a la suministrada por la DMO en el estudio de estos pacientes, siendo útiles para valorar las posibilidades terapéuticas y controlar su eficacia.
Sin embargo, nuestro estudio presenta algunas limitaciones, ya que se trata de un estudio retrospectivo con un número limitado de pacientes. Además, en relación a los resultados referidos a la comparación entre pacientes con EPOC y pacientes con EPID en cuanto a DMO, FRAX y vitamina D y respecto a los marcadores de remodelado óseo, no existe mucha bibliografía para su comparación. Por ello, resulta necesario llevar a cabo un estudio longitudinal con mayor número de pacientes para mejorar y ampliar conocimientos en nuestra propia línea de trabajo.
CONCLUSIÓN
Dos terceras partes de los pacientes con enfermedad pulmonar terminal presentaron osteopenia u OP. Se debe incidir en la importancia del estudio óseo en los pacientes pretrasplante pulmonar para optimizar tanto el diagnóstico como la intervención terapéutica.
Los pacientes con EPOC presentaron mayor prevalencia de OP y un mayor FRAX que el grupo con EPID.
Los marcadores bioquímicos del remodelado óseo pueden aportar información complementaria a la suministrada por la DMO y pueden ser útiles para valorar las posibilidades terapéuticas y controlar su eficacia.
La suplementación con vitamina D puede estar indicada en pacientes EPOC, especialmente en aquellos con FRAX elevado.















