La desnutrición debe definirse como un desequilibrio entre la ingesta de energía y/o de nutrientes y sus requerimientos, que provoca cambios medibles en la composición y en la función del organismo con repercusión pronóstica. Tiene una alta prevalencia, de entre el 20 y el 80 %, en el contexto de la enfermedad inflamatoria intestinal (EII). Es mucho más frecuente en la enfermedad de Crohn que en la colitis ulcerosa, especialmente en las formas fistulizantes, en las que requieren cirugía y cuando existe comorbilidad. La desnutrición multiplica por 3,5 la mortalidad hospitalaria por EII e incrementa la estancia en un 55 %. La nutrición parenteral (NP) aumenta dicha estancia en un 105 %, con el consiguiente aumento del coste (57 % y 113 %, respectivamente) (1).
El sobrepeso y la obesidad han ido creciendo a lo largo de las últimas décadas, con porcentajes del 20 al 40 % en el primer caso y del 15 al 40 % en el segundo. Esto representa en sí mismo un factor de riesgo de EII, de manera que un IMC mayor de 30 kg/m2 a los 18 años incrementa en 2,5 veces el riesgo de EII en años posteriores. Además, este tipo de desnutrición también empeora el pronóstico, disminuyendo la eficacia de los tratamientos biológicos y de la cirugía (2).
Debe realizarse un cribado de desnutrición en el paciente con EII. Las guías recomiendan hacerlo en el momento del diagnóstico y periódicamente después, dado el riesgo de desnutrición que conlleva esta patología. También recomiendan determinar el estado nutricional del paciente antes de la cirugía para optimizar el tratamiento nutricional perioperatorio, incluido el paciente obeso con EII (3,4).
La composición corporal se define como la cuantificación in vivo de los componentes corporales, las relaciones cuantitativas entre dichos componentes y los cambios cuantitativos de los mismos relacionados con factores influyentes (5). Entre los datos que aporta están la masa magra, la masa grasa y su distribución, la cantidad y calidad de músculo esquelético, el agua intra y extracelular y la masa celular corporal. La masa muscular forma parte de los criterios fenotípicos de la estrategia GLIM (Global Leadership Initiative on Malnutrition) utilizados para diagnosticar la desnutrición y puede determinarse mediante procedimientos técnicos (bioimpedancia, absorciometría de rayos X de energía dual —DEXA—, tomografía computarizada y ecografía) o clínicos (antropometría: perímetros muscular braquial y de la pantorrilla). Además, debe determinarse la presencia de sarcopenia, es decir, la combinación de masa y fuerza muscular disminuidas (6-8).
La sarcopenia es importante en el contexto de la EII, con prevalencias del 59 % en la enfermedad de Crohn y del 27,3 % en la colitis ulcerosa frente a un 8,3 % en los sujetos sanos. Debe tenerse presente que el IMC no es apropiado para estimar la sarcopenia pues un 40 % de los pacientes con sarcopenia presentan un IMC normal y un 20 % un IMC de sobrepeso u obesidad. La sarcopenia hace más probable la necesidad de tratamiento y de cirugía e influye negativamente en el pronóstico posquirúrgico, aumentando el riesgo de complicaciones 9,2 veces (solo 1,1 veces en caso de baja masa muscular) (9).
En el curso de la EII, los pacientes tienden a ganar masa grasa, especialmente grasa visceral, y a perder densidad mineral ósea y masa muscular al tiempo que crece la prevalencia de sarcopenia (10,11) (Fig. 1).
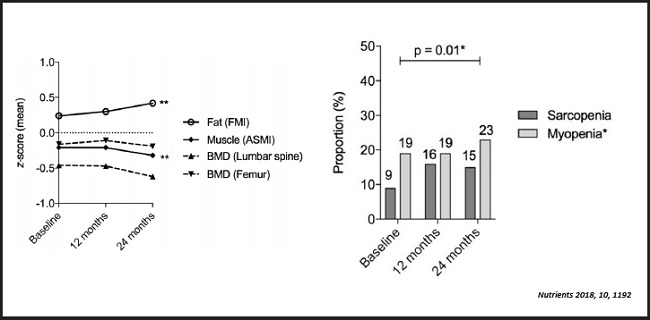
Figura 1. Evolución de la composición corporal en pacientes con enfermedad inflamatoria intestinal. Modificado de: Bryant, et al. Nutrients 2018;10(9):1192 (FMI: índice de masa grasa; ASMI: índice de músculo esquelético apendicular; BMD: densidad mineral ósea. Los autores definieron miopenia como un ASMI ≥ 1 DE por debajo de la media para edad y sexo, y sarcopenia como ASMI y fuerza de prensión > 1 DE por debajo de las medias correspondientes a edad y sexo).
Las guías clínicas recomiendan tratar la desnutrición en la EII dado que empeora el pronóstico del paciente, la calidad de vida, la tasa de complicaciones y la mortalidad. Recomiendan también la pérdida de peso en todo paciente obeso con EII que vaya a tratarse con fármacos biológicos a fin de optimizar la respuesta a estos medicamentos. El objetivo es prevenir la aparición de desnutrición en los pacientes con riesgo, tratarla en los casos con desnutrición relacionada con la enfermedad, ya sea aguda o crónica, y modificar en sentido positivo el curso de la enfermedad (3,4).
En relación a la dieta oral, las guías refieren que una dieta rica en frutas, verduras y ácidos grasos de tipo n-3, y baja en ácidos grasos de tipo n-6, se asocia a un menor riesgo de padecer EII. Al mismo tiempo, los alimentos ultraprocesados y los emulsificantes podrían estar relacionados con un mayor riesgo de EII, por lo que cabría recomendar su exclusión. No existe ninguna dieta capaz de fomentar la remisión en los pacientes con EII activa. En los pacientes con enfermedad de Crohn estenosante y síntomas obstructivos, es aconsejable adaptar la textura de la alimentación oral o instaurar una alimentación enteral mediante sonda situada distal a la estenosis (4).
Cuando la nutrición médica está indicada en la EII, el primer paso debe ser la administración de suplementos orales como adyuvantes de la nutrición oral. Esta medida es eficaz puesto que consigue una mayor ingesta de calorías y proteínas, y tiene efectos positivos sobre la masa muscular y el peso (12). Si esto resulta insuficiente, está indicada la nutrición enteral (NE). La NE exclusiva está indicada en los niños y adolescentes con enfermedad de Crohn activa leve como tratamiento primario para inducir la remisión (alternativa a los corticosteroides). Sin embargo, el tratamiento primario con terapia nutricional, NE o NP, no se recomienda ni en los adultos ni en los menores con colitis ulcerosa. En la EII activa debe emplearse la NE estándar, con dieta polimérica y contenido graso moderado, tanto si se usa de modo primario para inducir remisión, como si se administra como tratamiento nutricional. En estos pacientes no deben emplearse ni fórmulas ni sustratos específicos, ya se trate de NE o NP (4,13).
Los efectos positivos de la NE exclusiva sobre la EII se deben a que disminuye la inflamación local al reducir la diversidad del microbioma, restaura la función de barrera del intestino y modifica la presentación de antígenos, disminuyendo las citocinas inflamatorias y aumentando las antiinflamatorias (14) (Fig. 2).
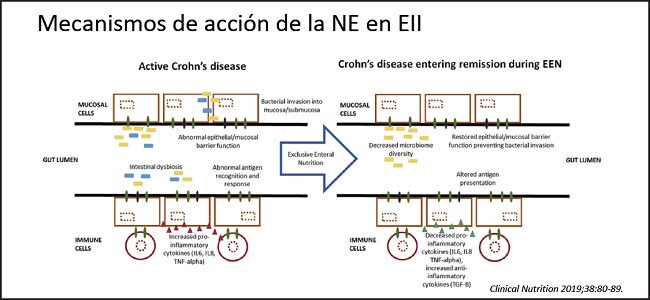
Figura 2. Mecanismos de acción de la nutrición enteral en la enfermedad inflamatoria intestinal. Modificado de: Ashton JJ. Clin Nutr 2019;38(1):80-9.
La intervención nutricional preoperatoria ha demostrado que es capaz de reducir las complicaciones posquirúrgicas. En este contexto, los estudios disponibles muestran que el beneficio se observa solamente con la NE y no la NP, aunque ello podría deberse al número de estudios y su calidad. La NE exclusiva parece también ayudar a evitar la recurrencia endoscópica de la enfermedad a los 6 meses de la intervención quirúrgica (15,16).














