INTRODUCCIÓN
El osteosarcoma (OS) y el condrosarcoma (CS) son lesiones ósea malignas mesenquimales (1,2,3) que se ubican principalmente en huesos de extremidades (4-9). Debido a la baja prevalencia del osteosarcoma craneofacial (OSCF) y el condrosarcoma craneofacial (CSCF), existe información limitada sobre sus características epidemiológicas e imagenológicas (4,10). No se han reportado características imagenológicas individuales y concretas del OSCF y CSCF, ni se han establecido diferencias de relevancia que faciliten su diagnóstico precoz. El propósito de la presente revisión es analizar las características epidemiológicas e imagenológicas del OSCF y CSCF.
EPIDEMIOLOGÍA DEL OSTEOSARCOMA Y CONDROSARCOMA CRANEOFACIAL
El osteosarcoma (OS) y condrosarcoma (CS) tienen altas tasas de mortalidad y ocupan el séptimo lugar de las lesiones malignas más comunes en pacientes pediátricos (11). El OS y CS tienen un comportamiento agresivo y son altamente destructivos (4,10). Pueden ser asintomáticos al inicio de su presentación, y a menudo se detectan como masas agrandadas cuando se encuentran en una etapa clínica avanzada (3,10), pudiendo estar acompañados de fracturas patológicas (12). Su sobrevida a 5 años varía entre 50-70% (1).
Osteosarcoma
El OS se origina en el tejido membranoso, y sus células producen una matriz ósea neoplásica (4,12). Es la lesión ósea maligna más común del esqueleto y se presenta en todo el cuerpo (4,10,13,14), ocupando el segundo lugar de las lesiones óseas malignas, después de los tumores de la médula ósea, como el mieloma múltiple y el linfoma (5,11). El OS no tiene etiología previa en el 85% de los casos, denominándose OS primario (12). En otros casos, su etiología es incierta y se presenta a partir de patologías, síndromes y factores predisponentes, denominándose OS secundario (5,12,13). Las patologías asociadas a OS secundarios son: osteomielitis (5,10), displasia fibrosa (5,6,15), osteocondromas múltiples hereditarios (13), osteoblastomas malignizados y retinoblastoma. También el OS se ha asociado al síndrome de Li-Fraumeni (5,13), síndrome de Rothmund-Thomson (13), o la enfermedad de Paget (5,10,12,13), además a otros factores predisponentes como radioterapia y traumatismos (10).
El OS tiene subtipos histológicos dependiendo de su origen celular que son el fibroblástico y osteoblástico, siendo este último el más prevalente (2,4). Otros subtipos histológicos del OS no especificados por la Organización Mundial de la Salud (OMS) son: telangiectásico convencional, parosteal, perióstico y de células pequeñas (4,5). La OMS clasifica al OS según su ubicación en el hueso afectado (6) en intramedular, superficial o yuxtacortical y extraóseo (2,4). Los OS maxilares generalmente son de ubicación intramedular (6,12,16).
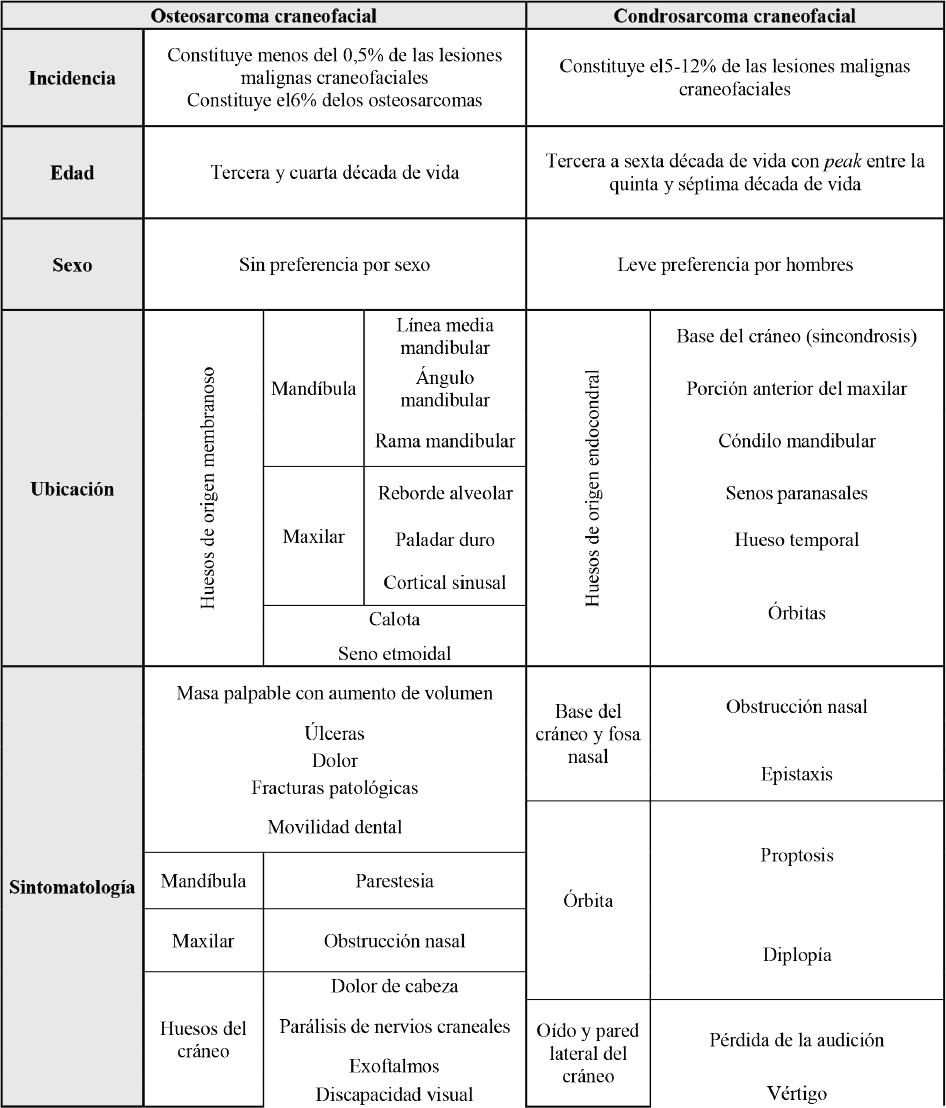
El osteosarcoma craneofacial (OSCF) es raro, con una prevalencia menor al 0,5% de las lesiones malignas craneofaciales (4,10) y el 6% de todos los OS (1,4,5,11,14). El OSCF tiene mayor preferencia por adultos (13) entre la tercera y cuarta década de vida (4,5,10, 11,14). El OS no tiene preferencia por sexo (4,5,10,11,14), sin embargo, el sarcoma de Ewing, que es una variedad del OS, se presenta entre la primera y segunda década de vida y tiene preferencia por hombres (17,18).
El OSCF se ubica en cualquier hueso del territorio craneofacial (2), con preferencia por huesos de origen membranoso, y su ubicación más común es la mandíbula (71,4%), en línea media, ángulo mandibular y en el maxilar (28,6%), en reborde alveolar, paladar duro y cortical sinusal (6,10,16). El OSCF también se ubica en calota (5) y seno etmoidal (4,16).
Los síntomas del OSCF varían según el sitio de la lesión (5), y el principal signo clínico es una masa dura con aumento de volumen del sitio afectado (10,11,14). Pueden presentarse úlceras, pero con baja frecuencia (11). Las fracturas patológicas se observan en un 5-10% de los pacientes, y pueden estar acompañadas de dolor (12,15), el cual puede presentarse al inicio del diagnóstico o durante el tratamiento (12). Las lesiones en los huesos del cráneo pueden causar dolor de cabeza, parálisis de nervios craneales, exoftalmos, discapacidad visual o hipertensión craneal (5). Se menciona también obstrucción nasal, causada generalmente por lesiones de evolución sinusal (4,10). En lesiones de mandíbula es posible la parestesia, por el compromiso del nervio alveolar inferior (11). La movilidad dental se presenta en maxilar y mandíbula, y puede ser un signo inicial causado por la destrucción ósea (6).
Condrosarcoma
El CS se origina en el tejido endocondral, y sus células producen una matriz de cartílago (8,19,20). El CS se presenta en todo el cuerpo (8,9,19-21), ocupando el tercer lugar de las lesiones óseas malignas, después de los tumores de la médula ósea y el OS (8). El CS se presenta sin etiología previa en el 20% de los casos, denominándose CS primario (2,8,9). En otros casos, su etiología es incierta y se presenta a partir de lesiones benignas cartilaginosas, denominándose CS secundario (8,20). Las lesiones benignas cartilaginosas del CS secundario son encondroma, osteocondroma y condromatosis sinovial (8). También el CS se ha asociado a otras lesiones como OS, fibrosarcoma, leucemia, displasia fibrosa y enfermedad de Paget (1).
El CS tiene subtipos histológicos: convencional, desdiferenciado, mesenquimatoso, mixoide y de células claras (1,3). De estos subtipos, el mesenquimatoso es el más agresivo y menos común (19,21). El CS mesenquimatoso corresponde al 25% de todos los CS (19), el 1% de CS de huesos largos, planos y periféricos (22) y el 0,1% de CS en el territorio craneofacial (22,23).
El condrosarcoma craneofacial (CSCF) es raro (23) y tiene una prevalencia entre el 5-12% del total de los CS (1,7). El CSCF se presenta en la tercera y sexta décadas de vida (9,20,23), con un peak entre la quinta y séptima (20), con leve preferencia por hombres (1,9), son relación hombre-mujer de 1,2:1 (20).
El CSCF se ubica en cualquier hueso del territorio craneofacial (2), con preferencia por huesos de origen endocondral. Sus ubicaciones más comunes son las sincondrosis de la base del cráneo (1,7), la porción anterior del maxilar, cartílago nasal en la cavidad y tabique nasal, cartílagos laríngeos y tiroideos (9,19,20). Otras ubicaciones del CSCF son cóndilo mandibular (8,9), senos paranasales, hueso temporal (7,8) y órbitas (22).
El CSCF es de crecimiento acelerado y localmente agresivo (19,20). Su principal característica es el aumento de volumen (9,19). La presencia de dolor es inusual en su etapa inicial (19,21), aunque una lesión de mayor tiempo de evolución puede ser dolorosa (1,20). Las lesiones de base de cráneo y de fosa nasal pueden causar obstrucción nasal y epistaxis (19,21). Las lesiones de órbitas pueden causar proptosis y la diplopía (22). Asimismo, las lesiones de los oídos y la pared lateral del cráneo pueden causar pérdida de audición, vértigo y parálisis facial (7). La tabla 1 muestra un resumen de la epidemiología del OSCF y CSCF.
APORTE DE LAS HERRAMIENTAS IMAGENOLÓGICAS EN EL ESTUDIO DEL OSTEOSARCOMA Y CONDROSARCOMA CRANEOFACIAL
Radiografía convencional
En la radiografía convencional frecuentemente se detectan indicios imagenológicos que pueden llevar a la sospecha del OSCF y CSCF (12,24). Para el diagnóstico del OSCF y CSCF, muestra información acerca de cambios en la morfología ósea, densidad ósea (15) e indicios de fracturas patológicas (25). La radiografía convencional tiene limitaciones para el diagnóstico como las distorsiones de la imagen (26) y superposición de estructuras (10,24).
Tomografía computarizada médica y tomografía computarizada de haz cónico
La tomografía computarizada (TC) es el primer estudio imagenológico solicitado para el diagnóstico del OSCF y CSCF (10), y permite una evaluación tridimensional (1). La TC es útil para evaluar presencia de multilocularidad, afectación de la cortical ósea (12) y de estructuras adyacentes a la lesión (9). También, muestra la presencia de calcificaciones del OSCF y CSCF (1,10). Ante la sospecha de metástasis, es recomendable evaluar con TC, para detectar la presencia de posibles lesiones pulmonares (7,10,12,15,27). La evaluación del OSCF y CSCF debe realizarse con y sin medio de contraste. En TC, el medio de contraste yodado es administrado por vía intravascular o endocavitaria (15,28). El medio de contraste altera la densidad de los tejidos, cavidades o lesiones y se usa para evaluar el comportamiento vascular, es decir la perfusión de diferentes lesiones (28,29).
La tomografía computarizada de haz cónico (CBCT, del inglés cone-beam computed tomography) de uso odontológico, tiene baja capacidad para discriminar entre tejidos blandos (26) y no permite evaluar perfusión con medio de contraste endovenoso. Por lo anterior, se no se indica para estudiar OSCF y CSCF, aunque entregar información preliminar, como la detección de posibles fracturas patológicas (25,26,30).
Resonancia magnética
La resonancia magnética (RM) usa un campo magnético y ondas de radiofrecuencia para evaluar componentes anatómicos y funcionales (31). Tiene ventajas en comparación con la TC, porque permite un mejor rendimiento en la evaluación de tejidos blandos (1,5,12,32), definiendo de mejor forma la médula ósea (27), y el sitio apropiado de la biopsia (1). En RM el medio de contraste a base de gadolinio (27,33) permite evaluar el aumento de la vascularidad intra lesional y del tejido adyacente (29), logrando una mejor delimitación de la lesión (27,28). Una desventaja de la RM, es que no puede usarse en pacientes con dispositivos médicos metálicos, ya que éstos producirían artefactos en la imagen (31). Otra desventaja, es que no logra captar la afectación cortical y las lesiones de origen cortical. Por lo anterior, se requieren estudios imagenológicos adicionales como radiografías, TC y tomografía por emisión de positrones (PET, del inglés positron emission tomography) (27). En la obtención de imágenes de RM se usan distintas secuencias de trabajo, tales como: secuencia de supresión grasa o (STIR del inglés short time inversion recovery), T2*, gradiente de difusión o (DWI, del inglés diffusion weighted imaging) y (FLAIR, del inglés fluid attenuated inversion recovery), ponderadas en T1 y T2 que entregan información diferenciada de la lesión (31). La intensidad de señal de la lesión es baja a intermedia en T1 y alta en T2. Cuando el OSCF y CSCF están asociados a hemorragia y necrosis, en conjunto con la matriz interna, muestran una intensidad de señal heterogénea (1,32). Al administrar medio de contraste en imágenes ponderadas de T1, la lesión se resalta, observándose hiperintensa (28), permitiendo una mejor visualización de los márgenes de la lesión y la infiltración a tejidos adyacentes (15). Las imágenes ponderadas en T2, con y sin medio de contraste, muestran la mayor parte de la lesión hiperintensa (28). Las secuencias de DWI y T2*, muestran la celularidad del tumor, calcio y hemorragia (1).
Estudios imagenológicos nucleares
Los estudios imagenológicos nucleares son técnicas de medicina nuclear que muestran procesos funcionales o biológicos a nivel celular (34). Generalmente se inyecta un agente de imagen por vía intravenosa (31), que es un compuesto molecular llamado radiotrazador (36). El radiotrazador se absorbe por los tejidos del cuerpo y luego es captado por la gammagrafía ósea (GO), tomografía computarizada por emisión de fotón único (SPECT del inglés single photon emission computed tomography) o PET (35,36). Los estudios imagenológicos nucleares en lesiones malignas muestran información sobre la proliferación celular, angiogénesis, hipoxia, aumento metabólico, inflamación, entre otros (37).
Gammagrafía ósea: La GO, generalmente usa el radiotrazador tecnecio-99-metilen difosfonato (Tc99m-MDP) que es absorbido por las zonas óseas con aumento metabólico (33,34,38). En el OS se observa una captación intensa homogénea y en el CS una captación intensa sin especificar una homogeneidad (39). No se encontró información específica de GO acerca de la captación y homogeneidad del OSCF y CSCF (40). La GO es útil para determinar la ubicación de metástasis óseas y extensión de lesiones intraóseas (5,15). En lesiones asintomáticas e iniciales, su especificidad suele ser alta (41).
Tomografía computarizada por emisión de fotón único: La SPECT, generalmente usa el radiotrazador tecnecio-99-metil hemametil-proline-amina-oxina (Tc99m-HMPAO) (33), que muestra una captación intensa en la zona de la lesión que indica el aumento del metabolismo (5). La SPECT tiene buena sensibilidad, siendo útil en la localización de metástasis y respuestas al tratamiento del OSCF y CSCF (33,38). Sus limitaciones son el ruido en las imágenes obtenidas, baja resolución espacial, y baja capacidad de distinguir estructuras con similar densidad, requiriendo de la TC o RM (42).
Tomografía computarizada por emisión de positrones: La PET generalmente usa el radiotrazador fluorodesoxiglucosa F-18 (FDG), que muestra áreas con mayor metabolismo de glucosa (8,31,39). La FDG incrementa su concentración celular al ser absorbida por células malignas, producto de su mayor metabolismo (37). Por lo anterior, la PET puede evitar métodos invasivos como biopsias (37) y es útil para determinar el estadio de la lesión a través de los sistemas de estadificación TNM (tamaño, nodos linfáticos, metástasis) (15,35), o los sistemas de Enneking (32) y de Pittsburgg (7). También la PET es útil para detectar los cambios metabólicos en respuesta al tratamiento del OSCF y CSCF (1,35). Sin embargo, por la baja resolución espacial de la PET, se requiere de otros estudios imagenológicos, como TC o RM (27,39). La PET/TC, es similar a la PET (15), pero con alta resolución espacial y especificidad (1), aunque su desventaja es la baja discriminación entre tejidos blandos (31). La PET/RM combina la diferenciación de tejidos de la RM con la información funcional o biológica celular de la PET (28) y facilita la evaluación neurovascular circundante de la lesión (1).
ASPECTOS IMAGENOLÓGICOS PARA EL DIAGNÓSTICO DE OSTEOSARCOMA Y CONDROSARCOMA CRANEOFACIAL
Las características imagenológicas del OSCF y CSCF varían dependiendo de la ubicación, destrucción ósea (8,10), composición de la matriz de la lesión e infiltración al tejido blando (10,19). Se han observado reacciones periósticas, que son el depósito continuo de tejido nuevo neoplásico, que producen la elevación del periostio de la cortical ósea (11). Las reacciones periósticas se forman cuando la cortical ósea reacciona a agresiones producidas por lesiones benignas, malignas, infecciones, agresivas y no agresivas (42) (Figura 1).
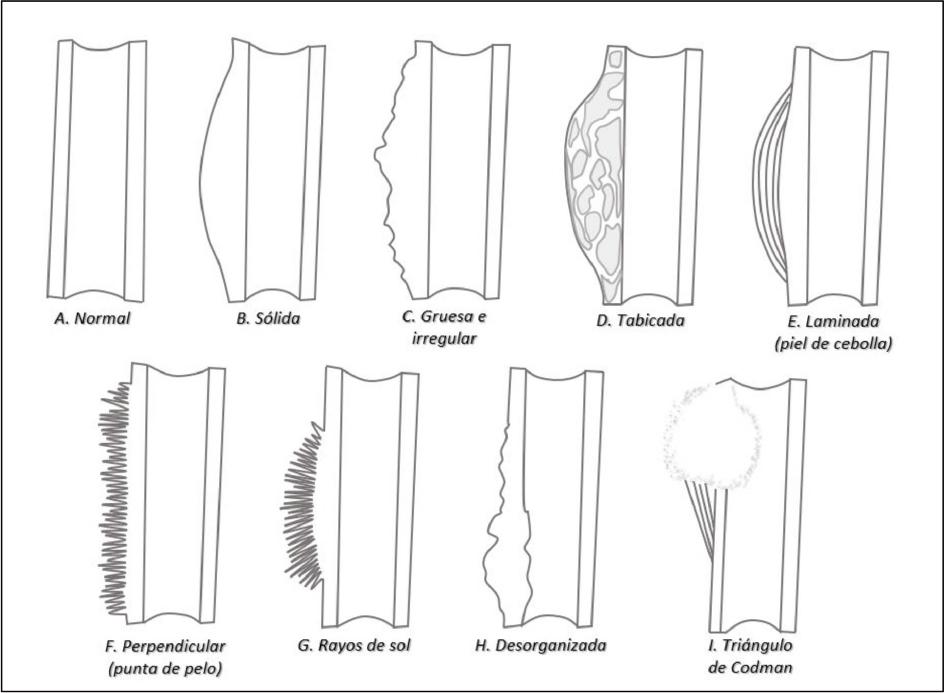
Figura 1. Reacciones periósticas presentes en lesiones agresivas y no agresivas. A. Normal, B. Engrosamiento homogéneo de la cortical, asimétrico con respecto a cortical contralateral, C. Aumento de volumen de contorno irregular, D. Aumento de volumen de contorno heterogéneo con diferentes densidades a nivel cortical, E. Aumento de volumen con crecimiento en láminas de disposición paralela, F. Crecimiento en forma de ribete perpendicular a la superficie, G. Crecimiento en forma de ribete perpendicular al centro de la lesión, H. Deformación de la cortical con infiltración y aumento de volumen hacia el exterior, I. Triángulo de Codman (triángulo irregular entre el periostio elevado y la cortical subyacente) (Adaptada de Rana et al, 2009).
Imagenología del osteosarcoma craneofacial
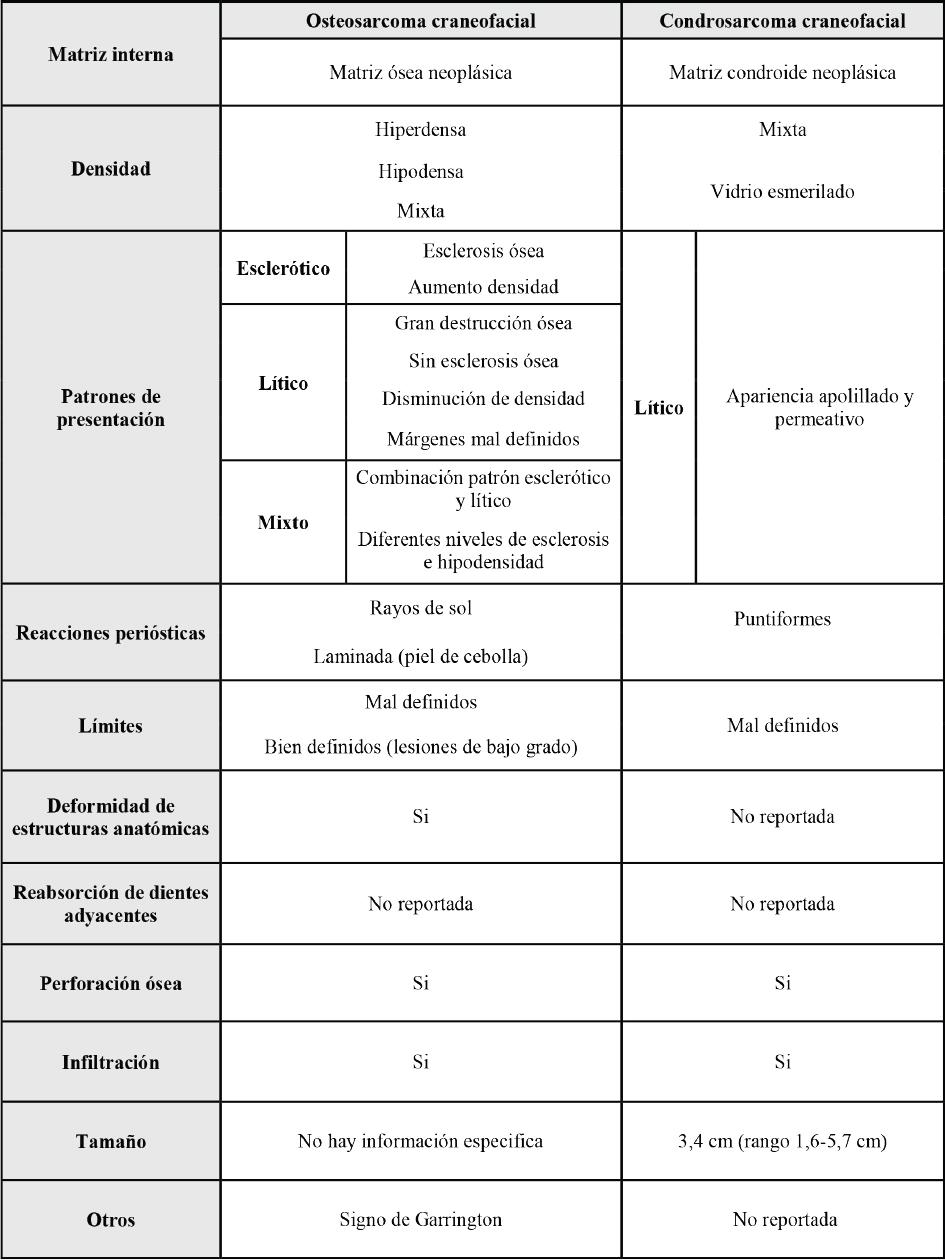
En TC del OSCF se ha observado una masa heterogénea, con o sin aumento de volumen, que estaría formada por una matriz ósea neoplásica, que puede variar entre densidades hipodensas, mixtas e hiperdensas, por la aparición de calcificaciones (1,6,11,15). En base a las densidades observadas, se han descrito tres patrones de presentación: 1) patrón esclerótico (15,43), también denominado osteoblástico (6) u osteogénico, 2) patrón lítico también denominado osteolítico puro (6,11,15,43) y 3) patrón mixto (11,43). El patrón esclerótico es el más común, y se produce por la presencia de áreas de calcificación que generan un aumento de la densidad y la ausencia de áreas de baja densidad en la lesión (4,16). El patrón lítico es altamente destructivo y no presenta calcificaciones (10,16), además, muestra una disminución de la densidad con áreas hipodensas difusas, márgenes mal definidos, erosión cortical variable e infiltración en el hueso normal adyacente (16). Por otra parte, en el patrón mixto se ha observado ambos patrones combinados señalados previamente, con diferentes niveles de calcificación e hipodensidad (1,11,15).
Independiente de los patrones de presentación del OSCF, en la mayoría de los casos se han observado márgenes mal definidos (6,10,16), sin embargo, en OSCF de bajo grado -poco agresivo-, se ha descrito la presencia de lesiones con márgenes bien definidos (16). En OSCF de alto grado -altamente agresivo-, se ha observado la ruptura de la cortical ósea y el borramiento del reborde alveolar (11,16). Además, se ha descrito un crecimiento exofítico originado de la cortical ósea en lesiones del sector anterior mandibular (14).
En el OS, las reacciones periósticas ocurren en el 80% de los casos (15), mientras en el OSCF no son comunes, aunque pueden presentarse en mandíbula (1). En el OSCF se han observado reacciones periósticas en rayos de sol (Figura 1-G), que son formaciones de espículas óseas irregulares perpendiculares en la periferia de la lesión (6,11,15,16), como también la reacción laminada (o piel de cebolla) (Figura 1-E), con menos frecuencia (10). Las reacciones periósticas se observan en los patrones de presentación esclerótico y mixto.
Una manifestación temprana del OSCF es el signo de Garrington, que es el ensanchamiento simétrico del espacio periodontal (43), pudiendo estar presente en uno o varios dientes y usualmente es un hallazgo imagenológico incidental (6,11). Este signo es producto de infiltración de la lesión en el espacio periodontal. La infiltración del OSCF puede extenderse a huesos vecinos y estructuras adyacentes como órbita, nasofaringe y bóveda de cráneo (4,10).
Las imágenes de RM del OSCF, tienen una intensidad de señal variada (1). El OS de alto grado suele ser isointenso en T1, hipointensos en T2 y resaltar homogéneamente con márgenes definidos en las imágenes con contraste (5). No se encontró información del tamaño del OSCF (4,5,10,14).
Imagenología del condrosarcoma craneofacial
En la TC del CSCF se ha observado una masa de densidad mixta (1,19,22). Además, el interior de la masa contiene áreas líticas de baja densidad con múltiples calcificaciones dispersas (19) en forma de parches, consolidadas y lineales (8,9,22). Las múltiples calcificaciones visibles en los estudios imagenológicos se corresponden con la matriz condroide (1), que en el CS lo forma el tejido cartilaginoso neoplásico (8,9,22), en relación con hueso remanente o espículas óseas atrapadas, y tiene forma de anillo (19) y arco (1).
En el CSCF se ha descrito únicamente un patrón de presentación lítico (1,21,23) que tiene apariencia apolillada y permeativa en lesiones de mayor tiempo de evolución (1). El patrón de presentación lítico, se ha observado en CSCF del reborde alveolar de maxilar (21,23).
El CSCF tiene límites mal definidos (19,22) y también se ha observado adelgazamiento, erosión (19), perforación y destrucción de las corticales óseas (8). En el CSCF, las reacciones periósticas pueden ser escasas (20) y se describe un patrón puntiforme (8,16). El CSCF puede infiltrarse en profundidad dentro del trabeculado óseo, sin causar una notoria reabsorción ósea (19). También puede extenderse a estructuras anatómicas vecinas (8,19,22).
En la RM, el CSCF se ha observado como una masa lobulada con una intensidad de señal de baja e intermedia en imágenes ponderadas de T1 (22). La mayoría de las lesiones muestran una intensidad de señal T2 marcadamente hiperintensa (8), característica presente en elementos no mineralizados (1,22). La señal marcadamente hiperintensa se debe al alto contenido de agua del cartílago. También se ha observado un realce periférico del tabique nasal, que muestra haces fibrovasculares que rodean los nódulos cartilaginosos (1). El tamaño promedio del CSCF en la mayor dimensión axial es de 3,4 cm (rango 1,6-5,7 cm) (7). La tabla 2 muestra un resumen de características imagenológicas del OSCF y CSCF en TC.
RECIDIVA Y METÁSTASIS DEL OSTEOSARCOMA Y CONDROSARCOMA CRANEOFACIAL
Osteosarcoma craneofacial
El OSCF tiene altas tasas de recidiva local (5), siendo en mandíbula de 39-70% y en maxilar del 15-53% (14). La proximidad de las lesiones con estructuras vitales suele ser el motivo de muerte (11). El compromiso de nodos linfáticos es poco frecuente (15). En el OSCF, las metástasis a distancia también son poco frecuentes (11,14), y afectan al pulmón (4,5,10), cerebro (5) y otros huesos (4,10).
Condrosarcoma craneofacial
El CSCF presenta principalmente recidiva local y es agresivo debido a su cercanía con estructuras vitales de la cabeza y cuello (19). Un riesgo de recidiva local es la dificultad para obtener márgenes de seguridad amplios durante la resección quirúrgica (44). El compromiso de nodos linfáticos es poco frecuente. El CSCF de subtipo mesenquimatoso es altamente agresivo, con tendencia a recidiva tardía y metástasis (19). En general en el CSCF, la metástasis suele ocurrir en enfermedad avanzada o cuando hay frecuentes recidivas (9), y los órganos afectados son pulmón, tejido blando profundo, otros huesos y cerebro (9,19,22).
DISCUSIONES
La presente revisión analizó las características epidemiológicas e imagenológicas del OSCF y CSCF, algo fundamental para una mejor y más acertada presunción diagnóstica. No se encontró estudios comparativos, ni resultados específicos de las características imagenológicas del OSCF y CSCF.
En relación con la prevalencia, la del OSCF es muy baja, constituyendo menos del 0,5% de las lesiones malignas craneofaciales (5), y el 6% de los OS (4,5,10,11). No se encontraron datos concretos de la prevalencia del CS. La prevalencia del CSCF, debería ser más baja que la del OSCF (1,8). Solo el subtipo mesenquimatoso del CSCF presenta información de la prevalencia y es cercana al 0,1% (22,23), pero corresponde a datos epidemiológicos antiguos. Se requiere, por lo tanto, investigación que aporte información epidemiológica actualizada al respecto.
En relación con la histología, se ha mencionado un subtipo de OS condroblástico (2,3) lo que es controversial, ya que las células neoplásicas condroblásticas deberían originar un CS y no un OS. Se requieren investigaciones con marcadores celulares para concluir al respecto.
En relación con la ubicación, el OSCF y CSCF pueden ubicarse en todos los huesos del territorio craneofacial (1,4,8,11). En base al origen embriológico -membranoso o endocondral-, si la lesión se ubica en huesos de origen membranoso aumenta la probabilidad de diagnóstico de OSCF (14). Si la lesión se ubica en zonas de origen endocondral, aumenta la probabilidad de diagnóstico de CSCF (2,3). Por lo tanto, el origen embriológico de la lesión es el primer paso hacia la presunción diagnóstica. En maxilar pueden presentarse OSCF y CSCF producto de su doble origen embriológico, es decir, membranoso en reborde alveolar posterior y parte del paladar duro, y endocondral en zona anterior (6,9,16,19,20). El CSCF puede presentarse en la zona anterior del maxilar por residuos de cartílago o por elementos cartilaginosos derivados de la formación de la fosa nasal (19). Por otra parte, en mandíbula, a nivel de cuerpo y parte de rama mandibular, al ser de origen membranoso, pueden presentar OSCF. El cóndilo mandibular, al ser de origen endocondral, presenta CSCF (8,9). Asimismo, la cavidad y tabique nasal, cartílagos laríngeos y tiroideos, al ser de origen endocondral presentan CSCF (9,19,20).
Con respecto a la edad, en las lesiones malignas de origen membranoso, el OS de huesos largos se presenta en niños, y adultos jóvenes (14), mientras que el OSCF se presenta en adultos (13). Respecto a las lesiones malignas de origen endocondral es al revés, puesto que el CS de huesos largos se presenta en adultos en edades avanzadas (19,21) y el CSCF se presenta generalmente en niños y adultos jóvenes (9,19,20,21). Por lo tanto, las lesiones malignas en adultos entre la tercera o cuarta década de vida (13), tienen más probabilidad de ser un OSCF que un CSCF, lo que es apoyado por varios autores (4,5,10,14). Debido a que el CSCF se presenta en un amplio rango de edad, que comprende entre la segunda y sexta décadas de vida, superponiéndose con la edad del OSCF (9,19,20,21), la edad por si sola, no es un elemento diferenciador entre OSCF y CSCF. Además, el CSCF tiene una incidencia máxima entre la quinta y séptima década de vida (20), lo que amplía considerablemente el rango de edad de presentación, sin especificar un peak de prevalencia claro.
En relación con sarcoma de Ewing, éste es una variedad del OS con características peculiares ya que se ubica en el territorio craneofacial en el hueso frontal, parietal, etmoides y en los maxilares (18). También se le distingue por su reacción perióstica en punta de pelo (42) y sintomatología clínica, pudiendo confundirse con una lesión inflamatoria (17).
Respecto de la preferencia por sexo, en el OSCF no habría preferencia por sexo (2,4,5,10,11,14), aunque algunos autores han señalado una leve preferencia por hombres (6,16). El CSCF tiene una leve preferencia por hombres (22), aunque existe controversia respecto a su preferencia por sexo en el subtipo mesenquimatoso del CSCF, ya que la literatura señala una preferencia por mujeres (19,21,22).
En relación con signos, síntomas, y su detección, tanto en OSCF como en CSCF, las lesiones tempranas son indoloras (11,19,21). En la mandíbula, el OSCF y CSCF pueden percibirse tempranamente por el paciente, mostrándose como una masa de consistencia dura y crecimiento rápido. Sin embargo, en lesiones de la cortical sinusal y de la parte anterior del maxilar, en relación con seno maxilar y piso de fosa nasal, por su anatomía que forma cavidades, es probable que la lesión crezca, invada cavidades, e incluso pueda metastatizar, antes de ser percibida por el paciente (43). Por otro lado, la fractura patológica está presente en el OSCF (9,10,11,14), sin embargo, en el CSCF, no se reporta su análisis o prevalencia.
Con respecto a las herramientas imagenológicas usadas para diagnosticar OSCF y CSCF, las radiografías y CBCT son insuficientes para evaluar tejidos blandos (26) (25,26). En OSCF y CSCF, el medio de contraste es indispensable para evaluar su avance en el tejido adyacente y el compromiso vascular (28,29), razón por la que la TC y RM con medio de contraste son importantes. Además, la RM es eficaz en la evaluación de tejidos blandos (27,31). Por otro lado, los estudios de GO, SPECT y PET contribuyen en la estadificación de la lesión (27,33,38,41), muestran los lugares del cuerpo con aumento de actividad metabólica, que representan áreas sospechosas de metástasis (1,28). Por lo tanto, se recomienda estudiar el OSCF y CSCF con GO, SPECT y PET, en búsqueda de metástasis en otros huesos fuera del territorio craneofacial (5,15,31,33).
Con respecto a las características imagenológicas, los márgenes infiltrantes con afectación de la cortical ósea son sugerentes de extrema agresividad, por lo tanto, de una posible malignidad, favoreciendo el diagnóstico de OSCF y CSCF (6,10,16,19,22). La presentación imagenológica de OSCF y CSCF puede ser similar cuando tienen una imagen de densidad mixta (1,4,16,21,23), diferenciándose sólo por su ubicación. Por otra parte, el OSCF tiene un patrón de destrucción ósea lítica, al igual que las lesiones agresivas del CSCF, con una imagen hipodensa, debido a la ausencia de calcificaciones (10,16). Una lesión ósea maligna asociada a neoformación ósea periférica en rayos de sol, con láminas osificadas y proliferativas, inclina el diagnóstico hacia OSCF (6,15,16). Sin embargo, la reacción en rayos de sol también puede observarse en el CSCF, siendo rara esta presentación (20). La reacción en rayos de sol se asocia al diagnóstico de lesión maligna, pero no es especifica de OSCF y CSCF, ya que puede observarse en otras patologías de comportamiento agresivo, como el fibroma osificante (45,46). Además, las lesiones inflamatorias agresivas pueden tener imágenes similares al OSCF y CSCF, en especial cuando no hay formación de espículas óseas, como en la osteomielitis (47-49) y osteorradionecrosis (50,51). Por otro lado, el signo de Garrington se ha descrito como un signo de sospecha inicial del OSCF (7,13), mientras que para el CSCF no se ha mencionado información al respecto.
Con respecto a recidiva y metástasis, el OSCF y CSCF son más propensos a recidiva local que a la metástasis (19,44), por la dificultad de lograr una completa eliminación de la lesión (11,44). El diagnóstico de OSCF y CSCF no sólo debe enfocarse en la región comprometida, sino en el análisis de cuerpo completo, en búsqueda de compromiso de nodos linfáticos y de metástasis a distancia. El compromiso de nodos linfaticos regionales puede presentarse en OSCF y CSCF (4,10), pero es más probable en el CSCF mesenquimatoso (19). Las metástasis a distancia para OSCF y CSCF son poco frecuentes, y pueden afectar a pulmones (4,5,10) y a otros huesos (4,10). La presente revisión recopila características epidemiológicas e imagenológicas del OSCF y CSCF. Es importante investigar al OSCF y CSCF en busca de criterios epidemiológicos e imagenológicos actualizados que permitan una mejor y más acertada presunción diagnóstica.
CONCLUSIONES
En el OSCF y CSCF no hay acuerdo sobre edad predominante. Sin embargo, el OSCF se presenta entre la tercera y cuarta década de vida y el CSCF se superpone con edad del OSCF, que se presenta entre la segunda y sexta década de vida.
Si bien, el OSCF y CSCF pueden ubicarse en cualquier hueso del territorio craneofacial, la ubicación en huesos de origen membranoso inclina el diagnóstico hacia el OSCF, mientras que la ubicación en zonas de origen endocondral inclina el diagnóstico hacia el CSCF.
El signo clínico inicial del OSCF y CSCF es una masa de consistencia dura y crecimiento rápido, generalmente sin dolor. Las lesiones ubicadas en huesos que forman cavidades, avanzan hacia el interior de éstas, y es probable que la lesión sea percibida tardíamente por el paciente, retrasando la atención médica y condicionando un mal pronóstico. Tanto el OSCF como el CSCF son más propensos a la recidiva local que a la metástasis. En el OSCF y CSCF, las metástasis han afectado a pulmones y a otros huesos.
En relación con la imagenología, las radiografías y CBCT entregan información preliminar para la detección del OSCF y CSCF, pero son insuficientes por su baja capacidad de discriminar entre diferentes tejidos blandos. La TC permite evaluar la integridad cortical, estructuras anatómicas adyacentes y metástasis pulmonar. La RM es útil para evaluar tejidos blandos, tamaño y perfusión del OSCF y CSCF. La GO, SPECT y PET evalúan metástasis a distancia y la estadificación del OSCF y CSCF. Las características imagenológicas del OSCF en TC varían entre una masa hipodensa, mixta e hiperdensa, con patrones de presentación lítico, esclerótico, y mixto, los dos últimos presentan reacciones periósticas en rayos de sol y laminada (o piel de cebolla). En la mayoría de los OSCF los márgenes son mal definidos e infiltrantes. En RM, el OSCF de alto grado suele ser isointenso en T1, hipointensos en T2 y resaltar homogéneamente con márgenes bien definidos en las imágenes con contraste. En GO y SPECT, las metástasis se han observado con capación intensa, siendo homogénea en GO. En TC del CSCF se ha observado una masa de densidad mixta, un patrón de presentación lítico, con márgenes mal definidos e infiltrantes y escasa reacción perióstica puntiforme. En RM, el CSCF se ha observado como una masa lobulada con intensidad de señal baja e intermedia en T1, e hiperintensa en T2 en elementos no mineralizados. En GO y SPECT, las metástasis se han observado con captación intensa sin especificar si hay o no homogeneidad. Los espacios masticatorio e infrahioideo, y la lengua no se reportan afectados, independiente de la cercanía del OSCF y CSCF a estas regiones.