INTRODUCCIÓN
La enfermedad periodontal (EP) abarca una serie de condiciones inflamatorias que afectan los tejidos que rodean y sostienen a los dientes (1). Este grupo incluye a la gingivitis, que es la inflamación de las encías, y la periodontitis, que es una forma más grave de EP que puede causar la destrucción progresiva del hueso alveolar que sostiene los dientes. La EP ha sido durante mucho tiempo un tema de intenso estudio debido a sus posibles implicaciones sistémicas basándose en la interacción entre la inflamación, factores genéticos y factores ambientales (1).
La periodontitis es un problema de salud pública de gran importancia a nivel mundial, que se caracteriza por causar una inflamación persistente que desencadena una respuesta del sistema inmunitario (2,3). Presenta una variedad de manifestaciones clínicas, que incluyen desde el sangrado de encías, bolsas periodontales, reabsorción ósea alveolar y pérdida de dientes (4). Existen investigaciones que indican que productos relacionados con la inflamación y bacterias vinculadas con la periodontitis pueden ingresar al torrente sanguíneo, lo que podría afectar la salud general y contribuir al desarrollo y/o empeoramiento de diversas enfermedades sistémicas, como diferentes enfermedades cardiovasculares(5), infecciones respiratorias(6), problemas gastrointestinales(1), artritis reumatoide(7), diabetes mellitus(8), complicaciones en el embarazo(1), trastornos renales e inmunológicos(9) y varios tipos de cáncer (1,10). Los patógenos periodontales, como Porphyromonas gingivalis y Fusobacterium nucleatum, se encuentran frecuentemente en tumores malignos dentro de la cavidad oral (11) y en otros tipos de cáncer (12,13,14,15). Esta conexión se debe a la respuesta inflamatoria que provocan las formas graves de la enfermedad periodontal, lo que podría influir en el desarrollo de estas afecciones sistémicas, incluida la carcinogénesis (1).
Además, estudios in vitro han demostrado que Porphyromonas gingivalis, un microorganismo anaerobio gramnegativo oral implicado en la patogénesis de la periodontitis crónica, incrementa la agresividad tumoral y capacidad invasiva de los tumores (16). Además, estudios recientes también han demostrado que Fusobacterium nucleatum, otro de los patógenos periodontales, puede diseminarse desde la cavidad oral hasta los tumores mamarios a través del torrente sanguíneo, acelerando el crecimiento tumoral y promoviendo la progresión metastásica (17). Este descubrimiento resalta el potencial impacto del microbioma oral y su papel en el desarrollo y progresión del cáncer de mama, sugiriendo que la disbiosis microbiana oral podría estar asociada con factores de riesgo de esta neoplasia (17).
El cáncer es la segunda causa principal de mortalidad a nivel mundial, donde se estima que, en el 2024, en los Estados Unidos se diagnosticarán 2.001.140 casos nuevos de cáncer y que 611.720 personas morirán por la enfermedad (18). El cáncer de mama es uno de los que se diagnosticarán con mayor frecuencia, llegándose a reportar 313.510 nuevos casos y 42.780 defunciones (18). En las mujeres los tres cánceres más comunes son el cáncer de mama, cáncer de pulmón y cáncer colorrectal (19). En España, el cáncer sigue siendo una de las principales causas de morbilidad y mortalidad. Se estima que en el 2024 se diagnosticaran alrededor de 286.664 casos, de acuerdo con las proyecciones de REDECAN (20). Los cánceres más frecuentemente diagnosticados en España en 2024 serán el colorrectal (44.294 nuevos casos), mama (36.395), pulmón (32.768), próstata (30.316) y vejiga urinaria (22.097) (21). Entre las mujeres españolas, se espera que el cáncer de mama (31%) fuera el cáncer diagnosticado con mayor frecuencia, seguido del cáncer colorrectal (14%), el cáncer de pulmón (7%) y el cáncer de útero (6%) (22).
El aumento de la incidencia de esta enfermedad entre las mujeres se debe a factores como la edad de la menarquia, una edad más tardía del primer embarazo, periodos más cortos de lactancia materna y menopausia tardía; siendo estos factores de riesgo para el cáncer de mama. Un estudio reciente ha demostrado que las portadoras de la mutación BRCA experimentan una enfermedad más grave y peores resultados (23,24,25).
Además de estos factores, junto con los hábitos de vida poco saludables, como la inactividad física, el consumo de alcohol y la obesidad, agravan significativamente el riesgo de desarrollar esta enfermedad (24).
Dado que la enfermedad periodontal (EP) es una afección inflamatoria crónica con implicaciones sistémicas, su posible relación con el cáncer de mama ha sido objeto de creciente interés, especialmente por los mecanismos inflamatorios y la disbiosis oral que ambas enfermedades pueden compartir. Sin embargo, los estudios actuales presentan diversa evidencia, lo que impide establecer una correlación clara y directa entre ambas patologías. Algunos estudios observacionales sugieren que la EP podría estar asociada con el cáncer de mama, debido a la inflamación sistémica crónica que comparten ambas enfermedades. Sin embargo, otras investigaciones, como aquellas basadas en análisis genéticos, no han encontrado evidencia suficiente para establecer una relación causal directa entre ambas patologías. Por ello, se requiere más investigación rigurosa para esclarecer los mecanismos específicos y determinar si la EP influye en el desarrollo del cáncer de mama o si la relación observada se debe a factores de riesgo compartidos, como el tabaquismo, la obesidad, el estado hormonal o la predisposición genética. (17,26)
Esta revisión sistemática tiene como objetivo evaluar y sintetizar los hallazgos de estudios que han investigado la asociación entre la enfermedad periodontal y el cáncer de mama, proporcionando una visión integral que puede ser útil para guiar futuras investigaciones y mejorar las estrategias de manejo y prevención en la práctica clínica.
MATERIAL Y MÉTODO
Esta revisión sistemática se llevó a cabo según las pautas de realización de revisiones sistemáticas de acuerdo con la declaración PRISMA (27) para asegurar transparencia en la identificación, selección y evaluación de los estudios incluidos. Se emplearon las directrices de la guía "Grading of Recommendations, Assessment, Development and Evaluation" (GRADE) (28), para calificar la calidad de la evidencia según factores como el diseño del estudio, el riesgo de sesgo y la consistencia de los resultados."
Estrategia de búsqueda
Se realiza una búsqueda en la base de datos PubMed, usando las palabras clave "periodontal disease" y "breast cancer"; combinándolo con el operador booleano AND. La estrategia de búsqueda se llevó a cabo utilizando dichos términos donde la ecuación final de búsqueda fue la siguiente: periodontal disease AND breast cancer. Además, se llevó a cabo una búsqueda en la base de datos Cochrane Library con los mismos términos: periodontal disease AND breast cancer. Las búsquedas se limitaron a estudios en inglés y español, publicados entre el año 2000 y 2024.
Criterios de elegibilidad
Para la selección de los estudios incluidos en esta revisión sistemática, se definieron los siguientes criterios de elegibilidad basados en el modelo PICO (Población, Intervención, Comparación y Resultados):
"La revisión sistemática se guio por la siguiente pregunta de investigación basada en el modelo PICO: ¿Existe una relación entre la enfermedad periodontal y el cáncer de mama en términos de riesgo, progresión o impacto de los tratamientos oncológicos en la salud periodontal?": Población (P): Mujeres diagnosticadas con cáncer de mama. Intervención (I): Presencia de enfermedad periodontal, evaluada mediante parámetros clínicos como la pérdida de inserción clínica, profundidad de sondaje y sangrado gingival. Comparación (C): Mujeres con cáncer de mama y enfermedad periodontal frente a aquellas sin enfermedad periodontal o frente a mujeres sin cáncer de mama. Resultados (O): Asociación entre enfermedad periodontal y cáncer de mama, considerando mecanismos inflamatorios compartidos, impacto del tratamiento oncológico en la salud periodontal o progresión del cáncer.
Criterios de inclusión y exclusión:
Los criterios de inclusión fueron los siguientes: Estudios observacionales (cohortes, casos y controles, estudios transversales) y ensayos clínicos. Artículos publicados entre el año 2000 y 2024. Publicaciones en inglés o castellano.
Los estudios que se excluyeron fueron: Revisiones sistemáticas o narrativas o trabajos que no proporcionen datos originales. Estudios que examinen únicamente la enfermedad periodontal en pacientes sin cáncer de mama. Estudios in vitro o en animales.
Extracción de datos
La extracción de datos se llevó a cabo de manera sistemática utilizando una hoja de recolección de datos predefinida. Se recopiló información clave de cada estudio incluido, como los siguientes aspectos:
- Información sobre los autores, año de publicación y país donde se realizó el estudio.
- Tipo de estudio (cohorte, caso-control, transversal o ensayo clínico).
- Características de la población estudiada, incluyendo la edad y diagnóstico de cáncer de mama y estado del tratamiento oncológico.
- Parámetros periodontales evaluados, como la profundidad de sondaje, pérdida de inserción clínica, índice de sangrado gingival y presencia de placa dental.
- Resultados principales: Asociación entre enfermedad periodontal y cáncer de mama, impacto de la inflamación sistémica y efecto de los tratamientos oncológicos en la salud periodontal.
- Principal CONCLUSIÓN de cada estudio.
- Un revisor (J.Y.B.R.) de manera independiente realizo la extracción de datos para minimizar errores y sesgos. En caso de discrepancias, se consultó a un segundo revisor para llegar a un consenso.
Análisis de datos
Dado el enfoque de esta revisión, se optó por realizar una síntesis cualitativa de carácter narrativo, permitiendo analizar y discutir los hallazgos más relevantes sobre la relación entre la enfermedad periodontal y el cáncer de mama.
Este enfoque facilitó la identificación de patrones comunes, la comparación de resultados y la exploración de mecanismos biológicos compartidos entre ambas patologías.
Variables analizadas
Las variables analizadas en los estudios seleccionados incluyeron:
-Presencia de enfermedad periodontal: Definida mediante parámetros clínicos como pérdida de inserción clínica, profundidad de sondaje y sangrado gingival.
-Riesgo o progresión del cáncer de mama: Incluye variables como el estadio del cáncer en el momento del diagnóstico, el tipo de tratamiento recibido y los cambios en la respuesta tumoral a lo largo del tiempo.
-Factores de riesgo comunes: Los estudios también analizaron variables como el tabaquismo, la edad, el consumo de alcohol y el estado general de salud bucal y sistémico.
-Impacto del tratamiento oncológico en la salud periodontal: Efecto de quimioterapia, diversos fármacos relacionados en la progresión de la enfermedad periodontal.
Riesgo de sesgo y evaluación de la calidad
La evaluación del riesgo de sesgo de los estudios incluidos se realizó utilizando la herramienta Cochrane Risk of Bias(RoB)(29) para ensayos clínicos (Tabla 1) y la escala Newcastle-Ottawa (NOS)(30) para estudios observacionales (Tabla 1).
Tabla 1. Tabla de la evaluación del riesgo de sesgo de los estudios incluidos con la herramienta Cochrane Risk of Bias(RoB) para ensayos clínicos y la escala Newcastle-Ottawa (NOS) para estudios observacionales, y para la calidad de la evidencia, se utilizó el sistema GRADE.
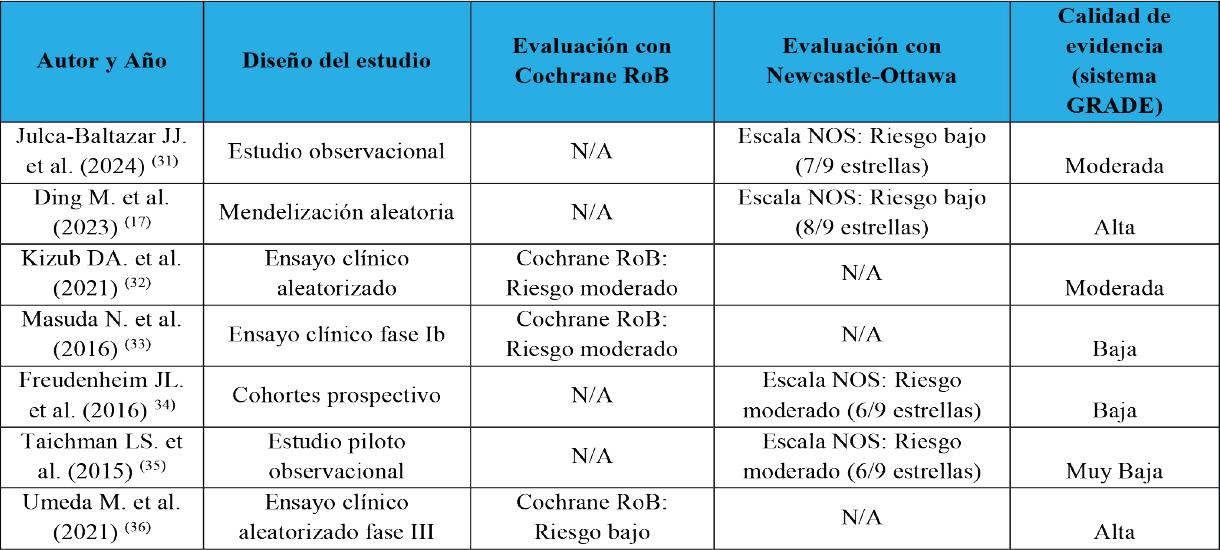
Tabla 2. Resumen de los artículos incluidos. EOT: Estudio Observacional Transversal, MAB: Mendelización Aleatoria Bidireccional, ECA: Ensayo Clínico Aleatorizado, ECF Ib: Ensayo Clínico Fase Ib, CP: Cohorte prospectivo, EPO: Estudio Piloto Observacional, CM: Cáncer de mama, EP: Enfermedad Periodontal, EM: Edad Media, a: años.
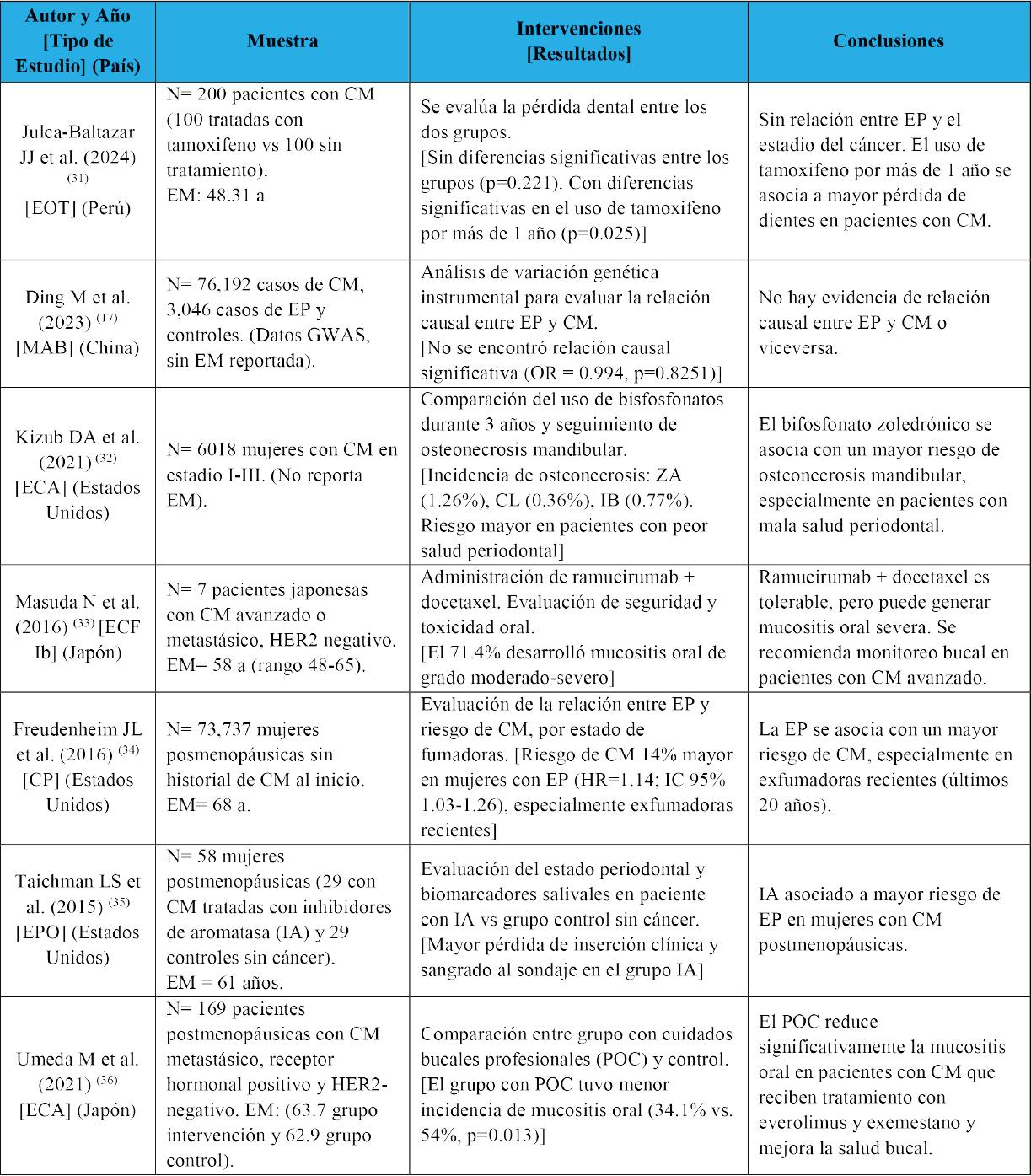
Para la evaluación de la calidad de la evidencia, se utilizó el sistema GRADE (26). Los estudios se clasificaron en alta, moderada, baja o muy baja calidad, basándose en factores como el diseño del estudio, riesgo de sesgo, consistencia de los resultados y precisión de las estimaciones. Los estudios con un riesgo elevado de sesgo o baja calidad metodológica fueron considerados en los análisis de sensibilidad para evaluar su impacto en los resultados generales (Tabla 1).
Resultados
Selección de los estudios
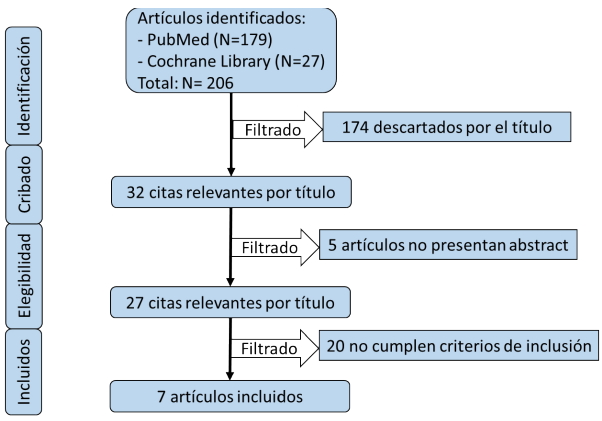
Mostramos un diagrama de flujo que describe la identificación, inclusión y los procesos de exclusión de los estudios seleccionados (Figura 1). La selección de estudios se realizó en tres fases. En la fase 1, tras la primera búsqueda nos dio como resultados un total de 206 artículos (179 artículos pertenecían a PubMed y 27 pertenecían a Cochrane Libray), de los cuales tras leer el título y eliminar los duplicados, descartamos 174 artículos. En la fase 2, de las 32 citas seleccionadas se eliminaron 5 artículos por no presentar su resumen. En la fase 3, 27 artículos fueron elegidos para una revisión de su texto completo, se aplican los criterios de elegibilidad, inclusión y exclusión. Finalmente, se seleccionaron 7 artículos que cumplían con los criterios de inclusión de nuestra revisión.
Diseño de los estudios
Los 7 estudios incluidos en esta revisión sistemática abarcan una amplia variedad de diseños, lo que refleja la diversidad de enfoques empleados para explorar la relación entre la enfermedad periodontal (EP) y el cáncer de mama. Entre los estudios seleccionados, se encuentran diseños observacionales (4 estudios) (31,17,34,35) y ensayos clínicos (3 estudios) (32,33,36) que evalúan tanto los factores de riesgo asociados con la EP (17,34) como los efectos del tratamiento del cáncer de mama en la salud periodontal (31,32,33,35,36).
-Cuatro estudios fueron de tipo observacional:
Julca-Baltazar et al. (2024) (31): un estudio de cohorte retrospectivo que comparó la pérdida dental en pacientes con cáncer de mama tratadas con tamoxifeno versus aquellas sin dicho tratamiento. Ding et al. (2023) (17): un estudio de mendelización aleatoria que exploró la relación causal entre la periodontitis y el cáncer de mama, utilizando datos genéticos de dos muestras independientes. Freudenheim et al. (2016) (34): un estudio cohorte prospectivo que evaluó la prevalencia de EP en mujeres postmenopáusicas y su relación con el cáncer de mama. Taichman et al. (2015) (35): un ensayo piloto que investigó la salud periodontal en mujeres postmenopáusicas con cáncer de mama en tratamiento con inhibidores de aromatasa.
-Tres estudios fueron ensayos clínicos aleatorizados:
Kizub et al. (2021) (32): un ensayo clínico que evaluó los factores de riesgo asociados con la osteonecrosis mandibular en pacientes con cáncer de mama tratadas con bisfosfonatos, parte del ensayo clínico SWOG 0307. Masuda et al. (2016) (33): un ensayo clínico de fase Ib que evaluó la seguridad y farmacocinética de la combinación de ramucirumab y docetaxel en pacientes japonesas con cáncer de mama avanzado o metastásico. Umeda et al. (2021) (36): un subanálisis de un ensayo clínico aleatorizado que evaluó el impacto de una guía de cuidado bucal en pacientes tratadas con everolimus y exemestano.
En cuanto a las características poblacionales, Los 7 artículos incluidos en esta revisión estaban escritos en inglés y español y fueron publicados entre 2000 y 2024 (31,17,32,33,34,35,36). Se estudia un total de 159,427 pacientes, divididos en el estudio de Julca-Baltazar JJ et al. (2024) (31) con una muestra de 200 pacientes con diagnóstico de cáncer de mama, con una edad promedio de 48.31 años (rango de 20 a 75 años). En el estudio de Ding M et al. (2023) (17) tuvo una muestra de 76,192 casos de cáncer de mama, 3,046 casos de periodontitis y controles. En el estudio de Kizub DA et al. (2021) (32) conto con 6018 mujeres con cáncer de mama en estadio I-III. En el estudio de Masuda N et al. (2016) (33) se evaluaron 7 pacientes japonesas con cáncer de mama avanzado o metastásico, donde la edad promedio fue 58 años (rango: 48 a 65 años). En el estudio de Freudenheim JL et al. (2016) (34) conto con una muestra de 73,737 mujeres posmenopáusicas, con una edad promedio de 68 años. En el estudio de Taichman LS et al. (2015) (35) tuvo una muestra de 58 mujeres con cáncer de mama en etapa temprana, con una edad promedio de 61 años. En el estudio de Umeda M et al. (2021) (36) conto con una muestra de 169 pacientes postmenopáusicas con cáncer de mama metastásico, con una edad promedio de 63.7 grupo intervención y 62.9 grupo control.
En cuanto a la distribución geográfica, 3 de los trabajos están localizados en Asia (1 en China y 2 en Japón) (17,32,36). 4 en América (1 en Perú y 3 en Estados Unidos) (31,32,34,35).
Algunos estudios se centraron en pacientes en fases tempranas del cáncer de mama (31,17,32,34,35), mientras que otros incluyeron mujeres con cáncer avanzado o metastásico (33,36).
La mayoría de los estudios emplearon parámetros periodontales bien definidos (31,34,35,36), tales como la pérdida de inserción clínica, la profundidad de sondaje, el índice de sangrado gingival y la presencia de placa dental. Estos parámetros fueron comparados con variables oncológicas como el diagnóstico, estadio y la progresión del cáncer de mama, lo que permitió investigar una posible asociación entre la EP y la evolución de la enfermedad oncológica.
Síntesis de los resultados
En esta sección, se presentan los hallazgos de los estudios seleccionados organizados en torno a las principales variables analizadas. De esta manera nos permitirá comparar entre los distintos trabajos y su relación con los objetivos de esta revisión.
-Relación entre enfermedad periodontal y cáncer de mama:
Varios estudios han sugerido una posible asociación entre la enfermedad periodontal (EP) y el cáncer de mama (CM). En el estudio de Freudenheim et al. (2016), se observó que las mujeres con periodontitis tenían un 14% más de riesgo de desarrollar cáncer de mama (HR=1.14; IC 95% 1.03-1.26), particularmente en exfumadoras recientes. Este hallazgo sugiere que la inflamación sistémica derivada de la EP podría estar implicada en la carcinogénesis mamaria. Sin embargo, en el análisis de Ding et al. (2023) basado en Mendelización Aleatoria, no se encontró una relación causal significativa entre EP y CM (OR=0.994, p=0.8251), lo que indica que otros factores compartidos podrían explicar la asociación observada en estudios observacionales.
-Impacto del tratamiento oncológico en la salud periodontal:
Los tratamientos hormonales y los bisfosfonatos empleados en el manejo del cáncer de mama han demostrado efectos adversos sobre la salud periodontal. Taichman et al. (2015) reportaron que las pacientes en tratamiento con inhibidores de aromatasa presentaban mayor pérdida de inserción clínica, sangrado gingival y acumulación de cálculo dental en comparación con el grupo control. Asimismo, Kizub et al. (2021) encontraron que el uso de bisfosfonatos aumentó el riesgo de osteonecrosis mandibular (BRONJ), con una incidencia del 1.26% en pacientes tratadas con zoledronato, comparado con 0.36% en aquellas tratadas con clodronato y 0.77% en el grupo con ibandronato. Este riesgo fue mayor en pacientes con salud periodontal deficiente, lo que resalta la importancia del monitoreo odontológico previo y durante la terapia.
-Efectos de la terapia con everolimus y exemestano en la cavidad oral:
El estudio de Umeda et al. (2021) evaluó el impacto del tratamiento con everolimus y exemestano en la salud oral de pacientes con CM metastásico. Se observó que el grupo con cuidados bucales profesionales (POC) tuvo una menor incidencia de mucositis oral (34.1% vs. 54%, p=0.013), lo que sugiere que la intervención odontológica temprana podría mitigar las complicaciones orales asociadas a estos fármacos.
-Pérdida dentaria en pacientes con cáncer de mama:
El estudio de Julca-Baltazar et al. (2024) evaluó la pérdida dentaria en 200 pacientes con cáncer de mama (100 tratadas con tamoxifeno vs. 100 sin tratamiento). No se encontraron diferencias significativas en la pérdida de dientes entre ambos grupos (p=0.221), pero en pacientes con uso prolongado de tamoxifeno (>1 año) sí se observó una mayor pérdida dentaria (p=0.025). Estos hallazgos sugieren que el tamoxifeno podría influir en la salud oral a largo plazo.
-Mucositis oral como efecto adverso del tratamiento:
La mucositis oral es una complicación frecuente en pacientes con cáncer de mama sometidas a terapia sistémica. Masuda et al. (2016) encontraron que el 71.4% de las pacientes en tratamiento con ramucirumab y docetaxel desarrollaron mucositis oral de grado moderado-severo. Estos resultados refuerzan la necesidad de una vigilancia odontológica rigurosa en pacientes que reciben terapia antiangiogénica y quimioterapia.
DISCUSIÓN
La relación entre la enfermedad periodontal (EP) y el cáncer de mama ha sido objeto de múltiples estudios, los cuales exploran posibles vínculos a través de mecanismos inflamatorios sistémicos compartidos. Aunque no todos los estudios logran establecer una relación causal directa, varios resultados apuntan a asociaciones significativas que merecen ser investigadas con mayor profundidad. A continuación, se presenta un análisis crítico basado en los estudios seleccionados y en revisiones sistemáticas recientes.
Uno de los hallazgos de especial interés es la implicación de Fusobacterium nucleatum, un patógeno oral asociado a la periodontitis, en el desarrollo y progresión del cáncer de mama. Según el metaanálisis de Gaba et al. (2022) (37), este microorganismo ha sido detectado en tejido mamario canceroso y se ha sugerido que puede actuar como biomarcador potencial de la enfermedad. La conexión entre la presencia de Fusobacterium nucleatum y la progresión del cáncer destaca la necesidad de evaluar el impacto del microbiota oral en la oncogénesis mamaria.
Algunos estudios observacionales, como el de Freudenheim et al. (2016) (34) y Taichman et al. (2015) (35), sugieren que la inflamación crónica asociada a la EP podría desempeñar un papel en el desarrollo del cáncer de mama, especialmente en mujeres postmenopáusicas y exfumadoras. Esta asociación se justifica por la presencia de marcadores inflamatorios sistémicos elevados, como resultado de la respuesta inmunitaria a patógenos periodontales, que pueden facilitar un entorno proinflamatorio favorable para el crecimiento tumoral. Sin embargo, otros estudios, como el de Ding et al. (2023) (17), que utilizaron análisis de mendelización aleatoria, no lograron establecer una relación causal, sugiriendo que factores como el tabaquismo o la predisposición genética podrían explicar su asociación.
En el metaanálisis de Wang et al. (2022) (4), se observó un incremento significativo en la incidencia de cáncer de mama en pacientes con enfermedad periodontal. De manera similar, el estudio de Shi et al. (2018) (24), que incluyó a más de 168,000 individuos, reportó que la presencia de periodontitis se asoció con un riesgo 1.19 veces mayor de desarrollar cáncer de mama. Estos hallazgos refuerzan la hipótesis de que la inflamación crónica periodontal podría desempeñar un papel en la carcinogénesis mamaria.
El mecanismo subyacente a esta relación se ha vinculado con la inflamación sistémica crónica, la activación inmunitaria y la disbiosis oral. Issrani et al. (2021) (24) explican que el microbiota oral patógena puede contribuir a la progresión del cáncer al alterar la homeostasis inmunitaria y promover la proliferación celular incontrolada. Además, se ha sugerido que la inflamación inducida por la periodontitis puede modificar el microambiente tumoral, favoreciendo la angiogénesis y la diseminación metastásica.
Los tratamientos para el cáncer de mama, especialmente los hormonales y los bisfosfonatos, han mostrado tener efectos adversos en la salud bucal. El estudio de Julca-Baltazar JJ et al. (2024) (31) destaca la asociación entre el tratamiento con tamoxifeno en pacientes con cáncer de mama y la pérdida dental, sugiriendo que los efectos hormonales de este fármaco pueden tener consecuencias sobre la salud periodontal. Este hallazgo se alinea con estudios previos que sugieren que el tratamiento hormonal en pacientes oncológicos podría aumentar el riesgo de deterioro periodontal, debido a los cambios hormonales que afectan los tejidos periodontales. Asimismo, Kizub et al. (2021) (32) señalaron un mayor riesgo de osteonecrosis mandibular en pacientes tratadas con bisfosfonatos, especialmente en aquellas con salud periodontal deficiente. Este hallazgo subraya la importancia de una evaluación periodontal exhaustiva antes y durante el tratamiento con bisfosfonatos. Además, el estudio de Masuda et al. (2016) (33) mostró toxicidades orales en pacientes tratadas con la combinación de ramucirumab y docetaxel, resaltando la necesidad de un monitoreo continuo de la salud bucal en pacientes sometidas a tratamientos oncológicos agresivos. Umeda et al. (2021) (36) demostraron que las intervenciones de cuidado oral profesional (POC) en pacientes tratadas con everolimus y exemestano lograron reducir significativamente la mucositis oral, mejorando la calidad de vida de las pacientes. Este hallazgo apoya la inclusión de protocolos de cuidado bucal en el manejo integral de pacientes con cáncer de mama, especialmente en aquellas con tratamientos que afectan la salud periodontal.
Comparando nuestros resultados con otras revisiones sistemáticas, encontramos coherencia en la mayoría de los hallazgos, aunque algunas discrepancias podrían atribuirse a diferencias metodológicas. Corbella et al. (2021) (39) señalan que, a pesar de la evidencia emergente, aún existen limitaciones en la calidad de los estudios, incluyendo la heterogeneidad en la definición de periodontitis y la falta de estudios con métodos estandarizados. Estos factores destacan la necesidad de estandarizar criterios diagnósticos en futuros estudios para obtener resultados más concluyentes.
CONCLUSIONES
La evidencia actual sugiere que la enfermedad periodontal podría estar asociada con un mayor riesgo de complicaciones en pacientes con cáncer de mama, especialmente en aquellos que se encuentran sometidos a tratamientos hormonales y con bisfosfonatos. Aunque no se ha establecido una relación causal directa entre la EP y el cáncer de mama, el impacto que genera la inflamación periodontal en la salud general resalta la importancia del manejo adecuado de estos pacientes. Los cuidados bucales profesionales han demostrado reducir las complicaciones orales y mejorar la calidad de vida, lo que resalta la importancia de incorporar la evaluación periodontal en el tratamiento integral del cáncer de mama. Se requieren más estudios clínicos para clarificar el rol de la EP en la progresión del cáncer.