Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.3 Madrid mar. 2010
Cambios en la dieta y tendencia del cáncer colorrectal en España durante 1951-2007
Dietary changes and colorectal cancer trends in Spain during 1951-2007
L. Béjar1, M. Gili1, 2, G. Ramírez2, J. López1,2 y J. L. Cabanillas1
1 Departamento de Medicina Preventiva y Salud Pública. Universidad de Sevilla.
2 Servicio de Medicina Preventiva y Salud Pública. Hospital Virgen Macarena. Sevilla
Este estudio ha sido parcialmente financiado por el Instituto de Salud Carlos III (subvención N o 01/1033).
Dirección para correspondencia
RESUMEN
Objetivos: análisis de la evolución del cáncer colorrectal en España durante el periodo 1951-2007 y su relación con la dieta.
Material y métodos: cálculo de tasas de incidencia, mortalidad y años potenciales de vida perdidos ajustadas (población mundial), así como de consumos
per capita de distintos alimentos.
Resultados: el consumo de carnes rojas y procesadas, pollo, pescado y frutas ha aumentado y el de hortalizas, cereales y legumbres ha descendido.
La incidencia de cáncer colorrectal ha experimentado un aumento constante en ambos géneros, más marcado en varones, en todos los grupos de edad, en contraposición con lo ocurrido en otros países. La mortalidad aumentó durante el periodo 1951-2000, pero desde ese momento hasta 2007 se ha estabilizado en varones y decrecido en mujeres.
Los años potenciales de vida perdidos muestran una distribución similar a la mortalidad.
Los coeficientes de correlación presentan valores cercanos a uno para el consumo de carnes rojas, pollo, pescado, hortalizas y frutas y valores fuertemente negativos para el consumo de cereales y legumbres con la incidencia y la mortalidad, en ambos géneros, y con los años potenciales de vida perdidos, aunque sólo en varones, con correlaciones débiles en mujeres.
Conclusiones: en el cáncer colorrectal es necesario un mínimo de diez-quince años para que cambios en la exposición a factores de riesgo y protección puedan modificar su incidencia. Por ello, se deben aplicar medidas legislativas y educativas en materia de Promoción de la Salud respecto a dieta por parte del Estado y los Gobiernos Regionales de forma urgente.
Palabras clave: Cáncer colorrectal. Incidencia. Mortalidad. Dieta.
ABSTRACT
Objectives: analysis of the evolution of colorectal cancer in Spain during the period 1951-2007 and its relationship with diet.
Material and methods: calculation of incidence rates, standardized mortality and years of potential life lost (world population) and
per capita consumption of different foods.
Results: red and processed meats, poultry, fish and fruits intake has increased and consumption of vegetables, cereals and legumes has decreased.
The incidence of colorectal cancer has steadily increased in both genders, more markedly among men, and across all age groups, in contrast to what has been observed in other countries. Mortality increased during the period 1951-2000, but from that time until 2007 these rates have kept steady in men and fallen in women.
The years of potential life lost (YPLL) shows a similar distribution to mortality.
The correlation coefficients have values close to one for consumption of red meat, poultry, fish, vegetables and fruits and strongly negative values for the consumption of cereals and vegetables with the incidence and mortality in both genders, and the YPLL, but only among men, with weaker correlations for women.
Conclusions: in colorectal cancer, a minimal time span of ten-fifteen years is necessary for changes in exposure to risk factors to be able to modify the incidence of this tumour. Therefore, Spanish State and Regional Governments should implement legislative and educational measures in the field of Health Promotion regarding the diet urgently.
Key words: Colorectal cancer. Incidence. Mortality. diet.
Introducción
Numerosos estudios epidemiológicos han identificado diversos factores de riesgo y protección del cáncer colorrectal (1,2), y algunos han demostrado que cambios en la exposición a estos factores influyen en la incidencia y mortalidad por este tumor. Un hecho notable es que muchos de estos factores están asociados al comportamiento de las personas y que, por tanto, son potencialmente evitables o modificables (3,4).
Entre los factores asociados al comportamiento de las personas se han descrito como factores de riesgo la ingesta excesiva de carnes rojas y procesadas (5-10), el bajo consumo de hortalizas y ácido fólico (11-15), el tabaquismo (16), el consumo excesivo de alcohol (17), el estilo de vida sedentario, el sobrepeso y la obesidad (18-21), y la diabetes (22). A la inversa, la ingesta de pescado (9), la terapia hormonal sustitutiva (23), el uso de anticonceptivos orales (24), el consumo de calcio (25) y el ejercicio físico (26-28) han sido considerados como factores de protección de este tumor. En cuanto al consumo de fibra dietética, los resultados de numerosos estudios han sido inconsistentes (29-33). En relación al consumo de grasas de origen animal, un meta-análisis de trece estudios de casos y controles no pudo demostrar que elevase el riesgo de cáncer de colon después del ajuste de la energía total (34) y la mayoría de los estudios de cohortes no apoyan una asociación causal entre este factor y el cáncer colorrectal (35).
La variación de incidencia del cáncer colorrectal en el mundo es del orden de veinticinco veces. Estos grandes contrastes geográficos a nivel mundial son consecuencia probablemente de las enormes diferencias en las exposiciones ambientales a los distintos factores de riesgo y protección de este tipo de tumor (36).
En la actualidad, en España, el cáncer colorrectal es el segundo tumor de mayor incidencia en mujeres, después del cáncer de mama (excluyendo el cáncer de piel). En los varones, ocupa el segundo lugar, después del cáncer de pulmón, o el tercero, tras el cáncer de pulmón y próstata, según los Registros de Cáncer consultados (37).
El cáncer colorrectal representa la segunda causa de muerte por cáncer tras el cáncer de pulmón. En 2007, murieron 13.516 españoles por cáncer colorrectal (7.870 varones y 5.646 mujeres), constituyendo el 13,1% del total de muertes por cáncer durante ese año (38). Ese mismo año, los años potenciales de vida perdidos (APVP) por cáncer colorrectal ocuparon en el cómputo global de todos los tumores, el segundo lugar en varones después del cáncer de pulmón y el tercero en mujeres tras el cáncer de mama y de pulmón (38).
A nivel internacional las tendencias de incidencia y mortalidad del cáncer colorrectal han presentado grandes variaciones durante la segunda mitad del siglo XX. Muchos países industrializados como Reino Unido, EE. UU., Australia, Francia, Canadá y Suecia han disminuido las tasas de incidencia y mortalidad durante ese periodo a diferencia de lo ocurrido en España, donde este tipo de tumor ha experimentado un importante crecimiento (3). En consecuencia, estas distintas tendencias han dado como resultado que algunos países con tasas más altas que España en el pasado presenten en la actualidad valores más bajos (18).
En este estudio se pretende analizar la evolución de la incidencia, la mortalidad y los APVP por cáncer colorrectal en España durante el periodo 1951-2007 y su relación con los cambios en los patrones dietéticos de la población durante este periodo.
Material y métodos
Las tasas de incidencia ajustadas a la población mundial por cáncer colorrectal para varones y mujeres se obtuvieron de las publicaciones de los Registros de Cáncer españoles supervisados por la International Agency for Research on Cancer (IARC). Estas tasas se publican para periodos de tres-cinco años. En este estudio, y para poder realizar comparaciones con las tasas de mortalidad y APVP anuales, así como correlaciones con los consumos anuales per capita de las variables de la dieta, se asigna el valor de la tasa de incidencia publicado al año intermedio para cada periodo y para el resto de años se calcula mediante método de intrapolación lineal. Se incluyeron únicamente los datos de los Registros de Navarra y Zaragoza, provincias contiguas del norte de España con poblaciones de 600.646 y 923.911 habitantes, respectivamente, y no del resto de Registros de Cáncer españoles debido a la disponibilidad de los datos publicados, desde 1973 en Navarra y desde 1968 en Zaragoza (37,39-43).
Los datos anuales del número de muertes en España por cáncer colorrectal -códigos 153 y 154 en la octava y novena revisiones de la Clasificación Internacional de Enfermedades (CIE), y C18-C21 en la décima revisión- se obtuvieron de las estadísticas de mortalidad publicadas por el Instituto Nacional de Estadística (INE) a través de las "Defunciones según la causa de muerte" para los años 1951-2007, último año con datos disponibles en el momento de la realización de este estudio (38). Los datos se agrupan según género y grupos de edad quinquenales comenzando en el grupo de "cero a cuatro años", a excepción del último grupo considerado, grupo de edad abierto de "ochenta o más años". Paralelamente, las poblaciones de referencia se obtuvieron a mediados de cada año oficial de las "Estimaciones de Población" publicadas por el INE, según género y grupos de edad similares (44).
A partir de los datos del número de fallecidos y la población de referencia, según género y grupos de edad, se calcularon las tasas anuales específicas.
Las tasas de mortalidad anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres se obtuvieron por el método directo, utilizando como referencia la población mundial estándar para el periodo 1951-2007 (37).
Toda persona que fallece entre los uno-setenta años se considera que ha dejado de vivir una serie de años, los que van desde la edad del fallecimiento hasta los indicados setenta años. Los APVP suman todos esos años para el conjunto de la población. Para cada grupo de edad se seleccionó el punto medio del intervalo como edad del fallecimiento, excepto para el grupo de "uno a cuatro años" que se consideró como media tres años. Para el resto de grupos de edad se seleccionaron siete años, doce años y sucesivos hasta sesenta y siete años. Una vez obtenidos los APVP específicos por género y grupos de edad y con los datos de población anteriormente comentados, se calcularon las tasas de APVP anuales específicas y a partir de ellas, siguiendo la misma metodología que para la mortalidad, se obtuvieron las tasas de APVP anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres (45).
El consumo de los distintos alimentos estudiados se calculó per capita anualmente en el periodo 1961-2003 a partir de los datos publicados por Food and Agriculture Organization of United Nations (FAO) (46).
Se representan gráficamente en escala logarítmica las tasas de incidencia, mortalidad y APVP anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres y el consumo anual per capita de carnes rojas y procesadas, pollo, pescado, frutas, hortalizas, cereales y legumbres en los años disponibles para cada variable en estudio.
Se calcularon los coeficientes de correlación de Pearson para las variables de consumo de alimentos y las tasas ajustadas con un intervalo de retraso de diez años, es decir, las distintas tasas calculadas se correlacionaron con los datos de consumo diez años atrás. El análisis estadístico se realizó con el programa STATA 10.0 (StataCorp LP, Texas, USA).
Resultados
En la figura 1 se muestran las tasas de incidencia, mortalidad y APVP anuales ajustadas a la población mundial por cáncer colorrectal para varones y mujeres.
Las tasas de incidencia aumentan en Navarra y Zaragoza con marcada pendiente y de forma constante desde 1980 en ambos géneros. Este considerable aumento se hace patente en el resto de Registros de Cáncer españoles (37,39-43).
Las tasas de mortalidad y APVP muestran representaciones gráficas con líneas prácticamente paralelas y con un aumento importante desde 1951 hasta comienzos del nuevo milenio, aunque con menor pendiente en comparación con las tasas de incidencia. La tendencia creciente en el periodo indicado sólo se interrumpe en el año 1980 donde tiene lugar una marcada depresión en ambas tasas y en ambos géneros. Durante ese periodo 1951-2000, en España, se produce un incremento anual promedio en las tasas de mortalidad del 4,70% en varones y 1,75% en mujeres, y en las tasas de APVP del 2,63% en varones y 1,40% en mujeres. Sin embargo, desde ese momento hasta 2007, las tasas se mantienen estables en varones, con una media de variación anual para la mortalidad del 0,12%, y para APVP de -0,50% y disminuyen en mujeres, con una media de disminución anual de mortalidad del 1,22%, y para APVP del 2,50%.
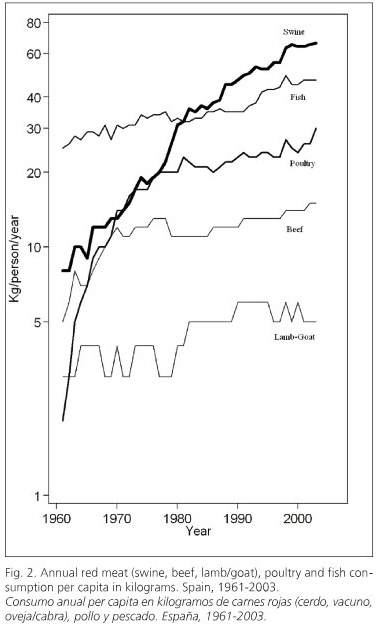
En las figuras 2 y 3 se puede observar cómo evoluciona el consumo de los distintos alimentos durante el periodo 1961-2003. En la figura 2 destaca el notable aumento del consumo de carnes rojas y procesadas, especialmente la carne de cerdo, así como de pollo y pescado. En la figura 3 se observa un aumento en el consumo de frutas y un descenso en la ingesta de cereales y judías, destacando la caída del consumo de esta legumbre. En la evolución del consumo de hortalizas un periodo de aumento durante los años setenta y ochenta ha sido seguido por un periodo de descenso desde la década de los noventa hasta 2003.
La tabla I muestra los coeficientes de correlación de Pearson entre las variables de estudio. Los coeficientes de correlación presentan valores positivos próximos a uno para el consumo de carnes rojas y procesadas, pollo, pescado, hortalizas y frutas y valores fuertemente negativos para el consumo de cereales y legumbres con la incidencia y la mortalidad, en ambos géneros, y con APVP, pero únicamente en varones, con correlaciones débiles en mujeres.
Discusión
El aumento en las tasas de incidencia indica que cada año el número de personas diagnosticadas en España por cáncer colorrectal es mayor, en ambos géneros. Del mismo modo que un aumento en las tasas de mortalidad y APVP reflejan un mayor número de fallecidos y una mayor prematuridad en la mortalidad, respectivamente, por lo que el paralelismo entre estas dos últimas tasas es coherente.
El marcado descenso de las tasas de mortalidad y APVP en 1980 coincide con el año de implantación en España de la octava revisión de la CIE. Los cambios de codificación pueden modificar sustancialmente las tendencias de mortalidad por causas específicas en su año de aplicación (47). En el periodo 1980-2000 las tasas de mortalidad y APVP han ido ralentizando su crecimiento en varones e incluso estabilizándose o decreciendo en mujeres mientras que las tasas de incidencia se han mantenido en constante aumento en ambos géneros.
El destacado aumento de la ingesta de carnes rojas y procesadas como fuente de proteínas en lugar de legumbres durante los últimos años, contribuye a explicar el aumento de la incidencia, mortalidad y APVP, en ambos géneros por cáncer colorrectal en España durante la segunda mitad del siglo XX. Este incremento en la ingesta de carnes rojas y procesadas es paralelo al del poder adquisitivo en España. Por otro lado, la ingesta de pescado aumentó de forma moderada, debido, muy probablemente, a un substancial incremento de sus precios en comparación con los de las carnes rojas y procesadas y pollo.
Las diferencias entre las tasas de incidencia y de mortalidad podrían tener su explicación en el aumento de la supervivencia para el cáncer colorrectal señalado en los Registros de Cáncer durante el periodo 1985-1999 (48-50). Este aumento ha sido común en muchos países europeos lo cual puede explicarse, en parte, a una mayor difusión de los protocolos específicos de cáncer in situ, a la quimioterapia adyuvante, a la radioterapia preoperatoria y al uso generalizado de la escisión mesorrectal para disminuir las recidivas locales en el cáncer rectal (51-54). Los programas de cribado del cáncer colorrectal han sido poco frecuentes en España durante este periodo, y si bien se han realizado espléndidos estudios a nivel local sobre su eficacia, así como la factibilidad de la implementación de programas de detección precoz del cáncer colorrectal en nuestro medio (55,56), no ha habido un programa a nivel nacional (como es el caso de cáncer de cérvix y de mama), y por tanto, es poco probable que hayan tenido un efecto importante sobre la supervivencia.
Se observa un importante contraste según género en las distintas tasas calculadas, normalmente con valores superiores en varones. En el caso de la incidencia la explicación se puede encontrar en el efecto de una mayor exposición en varones a factores de riesgo relacionados con el estilo de vida como la dieta, pero también a otros como el tabaquismo, el consumo excesivo de alcohol, la vida sedentaria, el sobrepeso, la obesidad y la diabetes. En cuanto a la mortalidad y APVP las diferencias son probablemente debidas a que el aumento de la supervivencia fue mayor en mujeres, lo que explica, a su vez, la tendencia decreciente en las tasas de mortalidad y APVP en este colectivo en los últimos años. Esta mayor supervivencia en las mujeres, tanto para el cáncer colorrectal como en otros tipos de cánceres, se ha atribuido a diversos factores como menor edad en el momento del diagnóstico, mayor preocupación por el cuidado de su salud y factores hormonales. Asimismo, se ha atribuido a las marcadas diferencias en la prevalencia de ciertas comorbilidades, en particular en aquellos casos en el que un determinado factor de exposición como el tabaquismo y el consumo excesivo de alcohol, se asocia con un mayor riesgo de incidencia o mortalidad por cáncer u otras patologías como las enfermedades cardiovasculares, respiratorias y hepáticas (54).
Se estima que en varones de mediana edad la proporción de riesgo atribuible de cáncer de colon a seis factores de riesgo entre los que se incluye consumo de carnes rojas y bajo consumo de ácido fólico es del 71% (57). En un reciente estudio en el Reino Unido sobre el efecto de la modificación de cinco factores de riesgo conductuales entre los que se incluía la reducción del consumo de carnes rojas y el aumento de la ingesta de frutas y hortalizas, los investigadores llegaron a la conclusión que estas intervenciones explicaban la disminución de las tasas de cáncer colorrectal en la actualidad y en las proyecciones de futuro en ese país (3).
En el cáncer colorrectal, para que los cambios en la exposición a los factores de riesgo y protección puedan modificar la incidencia del tumor son necesarios al menos diez-quince años. Por tanto, la aplicación en España de medidas legislativas y educativas más efectivas en materia de Promoción de la Salud que promuevan estilos de vida saludables respecto a la dieta, es urgente. Estas medidas de prevención primaria para el cáncer colorrectal pueden generar mayores beneficios, en término de muertes evitables, que los programas nacionales de cribado y las mejoras en el tratamiento, en ambos géneros y en todos los grupos de edad (3, 57), medidas que no son excluyentes sino complementarias a las anteriores. Por otra parte, estas medidas legislativas y educativas sobre la dieta y otros factores conductuales de riesgo del cáncer colorrectal como el tabaquismo, el consumo excesivo de alcohol y el ejercicio físico tienen el valor añadido de ser a su vez excelentes medidas de prevención primaria sobre muchas de las enfermedades crónicas que tienen mayor impacto en la morbimortalidad en España.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luis María Béjar Prado.
Departamento de Medicina Preventiva y Salud Pública.
Facultad de Medicina. Universidad de Sevilla.
Avda. Sánchez Pizjuán, s/n. 41007 Sevilla.
e-mail: lmbprado@us.es
Recibido: 17-07-09.
Aceptado: 11-11-09.
Bibliografía
1. Rodrigo L, Riestra S. Diet and colon cancer. Rev Esp Enferm Dig 2007; 99: 183-9. [ Links ]
2. Solera J, Tarraga PJ, Carbayo JA, Lopez MA, Celada A, Cerdan M, et al. Influence of diet and lifestyle in colorectal cancer. Rev Esp Enferm Dig 2007; 99: 190-200. [ Links ]
3. Parkin DM, Olsen AH, Sasieni P. The potential for prevention of colorectal cancer in the UK. Eur J Cancer Prev 2009; 18: 179-90. [ Links ]
4. Platz EA, Willett WC, Colditz GA, Rimm EB, Spiegelman DL, Giovannucci EL. Proportion of colon cancer risk that might be preventable in a cohort of middle-aged US men. Cancer Causes Control 2000; 11: 579-88. [ Links ]
5. Sandhu MS, White IR, McPherson K. Systematic review of the prospective cohort studies on meat consumption and colorectal cancer risk: a meta-analytical approach. Cancer Epidemiol Biomarkers Prev 2001; 10: 439-46. [ Links ]
6. Norat T, Lukanova A, Ferrari P, Riboli E. Meat consumption and colorectal cancer risk: dose-response meta-analysis of epidemiological studies. Int J Cancer 2002; 98: 241-56. [ Links ]
7. Kono S. Secular trend of colon cancer incidence and mortality in relation to fat and meat intake in Japan. Eur J Cancer Prev 2004; 13: 127-32. [ Links ]
8. English DR, MacInnis RJ, Hodge AM, Hopper JL, Haydon AM, Giles GG. Red meat, chicken, and fish consumption and risk of colorectal cancer. Cancer Epidemiol Biomarkers Prev 2004; 13: 1509-14. [ Links ]
9. Norat T, Bingham S, Ferrari P, Slimani N, Jenab M, Mazuir M, et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into Cancer and Nutrition. J Natl Cancer Inst 2005; 97: 906-16. [ Links ]
10. Chao A, Thun MJ, Connell CJ. Meat consumption and risk of colorectal cancer. JAMA 2005; 293: 172-82. [ Links ]
11. Steinmetz KA, Potter JD. Vegetables, fruit, and cancer prevention: a review. J Am Diet Assoc 1996; 96: 1027-39. [ Links ]
12. Michels KB, Giovannucci E, Joshipura KJ, Rosner BA, Stampfer MJ, Fuchs CS, et al. Prospective study on fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst 2000; 92: 1740-52. [ Links ]
13. Terry P, Giovannucci E, Michels KB, Bergkvist L, Hansen H, Holmberg L, et al. Fruit, vegetables, dietary fiber, and risk of colorectal cancer. J Natl Cancer Inst 2001; 93: 525-33. [ Links ]
14. Lanza E, Schatzkin A, Daston C, Corle D, Freedman L, Ballard-Barbash R, et al. Implementation of a 4-y, highfiber, high-fruit-and-vegetable, low-fat dietary intervention: results of dietary changes in the Polyp Prevention Trial. Am J Clin Nutr 2001; 74: 387-401. [ Links ]
15. Riboli E, Norat T. Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. Am J Clin Nutr 2003; 78 (Supl.): 559-69. [ Links ]
16. Botteri E, Iodice S, Bagnardi V, Raimondi S, Lowenfels AB, Maisonneuve P. Smoking and colorectal cancer: a meta-analysis. JAMA 2008; 300: 2765-78. [ Links ]
17. Cho E, Smith-Warner SA, Ritz J, van den Brandt PA, Colditz GA, Folsom AR, et al. Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med 2004; 140: 603-13. [ Links ]
18. World Cancer Research Fund / American Institute for Cancer Research. Policy and action for cancer prevention. Food, nutrition, and physical activity: a global perspective. Washington DC: 2009. [ Links ]
19. Calle EE, Thun MJ. Obesity and cancer. Oncogene 2004; 23: 6365-78. [ Links ]
20. Pischon T, Lahmann PH, Boeing H, Friedenreich C, Norat T, Tjønneland A, et al. Body Size and risk of colon and rectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC). J Natl Cancer Inst 2006; 98: 920-31. [ Links ]
21. Larsson SC, Wolk A. Obesity and colon and rectal cancer risk: a meta-analysis of prospective studies. Am J Clin Nutr 2007; 86: 556-65. [ Links ]
22. Larsson SC, Orsini N, Wolf A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 2005; 97: 1679-87. [ Links ]
23. Grodstein F, Newcomb PA, Stampfer MJ. Postmenopausal hormone therapy and the risk of colorrectal cancer: a review and meta-analysis. Am J Med 1999; 106: 574-82. [ Links ]
24. Fernández E, La Vecchia C, Balducci A, Chatenoud L, Franceschi S, Negri E. Oral contraceptives and colorrectal cancer risk: a meta-analysis. Br J Cancer 2001; 84: 722-27. [ Links ]
25. Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, Van den Brandt PA, Colditz GA, et al. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies (erratum published in J Natl Cancer Inst 2004; 96: 1724). J Natl Cancer Inst 2004; 96: 1015-22. [ Links ]
26. Paffenbarger R, Hyde R, Wing A, Lee IM, Jung D, Kampert J. The association of changes in physical activity level and other lifestyle characteristics with mortality among men. N Engl J Med 1993; 328: 538-45. [ Links ]
27. Colditz GA, Samplin-Salgado M, Ryan CT, Dart H, Fisher L, Tokuda A, et al. Harvard Report on Cancer Prevention, Volume 5. Fulfilling the potential for cancer prevention: policy approaches. Cancer Causes Control 2002; 13: 199-212. [ Links ]
28. Wolin KY, Yan Y, Colditz GA, Lee IM. Physical activity and colon cancer prevention: a meta-analysis. Br J Cancer 2009; 100: 611-6. [ Links ]
29. Bingham SA, Day NE, Luben R, Ferrari P, Slimani N, Norat T, et al. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet 2003; 361: 1496-501. [ Links ]
30. Park Y, Hunter DJ, Spiegelman D, Bergkvist L, Berrino F, van den Brandt PA, et al. Dietary fiber intake and risk of colorectal cancer: a pooled analysis of prospective cohort studies. JAMA 2005; 294: 2849-57. [ Links ]
31. Alberts DS, Martinez ME, Roe DJ, Guillen-Rodriguez JM, Marshall JR, van Leeuwen JB, et al. Lack of effect of a high-fiber cereal supplement on the recurrence of colorectal adenomas. Phoenix Colon Cancer Prevention Physicians' Network. N Engl J Med 2000; 342: 1156-62. [ Links ]
32. Schatzkin A, Lanza E, Corle D, Lance P, Iber F, Caan B, et al. Lack of effect of a low-fat, highfiber diet on the recurrence of colorectal adenomas. Polyp Prevention Trial Study Group. N Engl J Med 2000; 342: 1149-55. [ Links ]
33. Baron JA. Dietary fiber and colorectal cancer: an ongoing saga. JAMA 2005; 294: 2904-6. [ Links ]
34. Howe GR, Aronson KJ, Benito E, Castelleto R, Cornee J, Duffy S, et al. The relationship between dietary fat intake and risk of colorectal cancer -evidence from the combined analysis of 13 case-control studies. Cancer Causes Control 1997; 8: 215-28. [ Links ]
35. Willett WC. Goals for nutrition in the year 2000. CA Cancer J Clin 1999; 49: 331-52. [ Links ]
36. Parkin DM. International variation. Oncogene 2004; 23: 6329-40. [ Links ]
37. Curado MP, Edwards B, Shin HR, Storm H, Ferlay J, Heanue M, et al., editores. Cancer incidence in five continents. Vol. IX. Lyon: IARC Press; 2007. [ Links ]
38. Instituto Nacional de Estadística. Defunciones según la Causa de Muerte: 2009. Disponible en: http://www.ine.es / [ Links ]
39. Cancer incidence in five continents. Vol I-IV. Available at: http://www-dep.iarc.fr [ Links ]
40. Muir CS, Waterhouse J, Mack T, Powell J, Whelan SL, editores. Cancer incidence in five continents. Vol. V. Lyon: IARC Press; 1987. [ Links ]
41. Parkin DM, Muir CS, Whelan SL, Gao Y-T, Ferlay J, Powell J, editors. Cancer incidence in five continents. Vol. VI. Lyon: IARC Press; 1992. [ Links ]
42. Parkin DM, Whelan SL, Ferlay J, Raymond L, Young J, editores. Cancer incidence in five continents. Vol. VII. Lyon: IARC Press; 1997. [ Links ]
43. Parkin DM, Whelan SL, Ferlay J, Teppo L, Thomas DB, editores. Cancer incidence in five continents. Vol. VIII. Lyon: IARC Press; 2002. [ Links ]
44. Instituto Nacional de Estadística. Estimaciones de Población: 2009. Disponible en: http://www.ine.es / [ Links ]
45. Romeder JM, McWhinnie JR. Potential years of life lost between ages 1 and 70: an indicator of premature mortality for health planning. Int J Epidemiol 1977; 6: 143-51. [ Links ]
46. Food and Agriculture Organization of United Nations. FAOSTAT. Crops primary equivalent and livestock and fish primary equivalent consumption statistics, 1961-2003. Available at: http://faostat.fao.org / [ Links ]
47. Janssen F, Kunst AE. ICD coding changes and discontinuities in trends in cause-specific mortality in six European countries, 1950-99. Bull World Health Organ 2004; 82: 904-13. [ Links ]
48. Berrino F, Capocaccia R, Esteve J, Gatta G, Hakulinen T, Micheli A, et al., editores. Survival of cancer patients in Europe: the EUROCARE-2 study. Lyon: IARC Press; 1999. [ Links ]
49. Berrino F, De Angelis R, Sant M, Rosso S, Bielska-Lasota M, Coebergh JW, et al. Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995-99: results of the EUROCARE-4 study. Lancet Oncol 2007; 8: 773-83. [ Links ]
50. Sant M, Aareleid T, Berrino F, Bielska Lasota M, Carli PM, Faivre J, et al. EUROCARE-3: survival of cancer patients diagnosed 1990-94-results and commentary. Annal Oncol 2003; 14 (Supl. 5): 61-118. [ Links ]
51. Sauer R, Becker H, Hohenberger W, Rodel C, Wittekind C, Fietkau R, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731-40. [ Links ]
52. Verdecchia A, Francisci S, Brenner H, Gatta G, Micheli A, Mangone L, et al. Recent cancer survival in Europe: a 2000-02 period analysis of EUROCARE-4 data. Lancet Oncol 2007; 8: 784-96. [ Links ]
53. Jessup JM, Stewart A, Greene FL, Minsky BD. Adjuvant chemotherapy for stage III colon cancer: implications of race/ethnicity, age, and differentiation. JAMA 2005; 294: 2703-11. [ Links ]
54. Micheli A, Ciampichini R, Oberaigner W, Ciccolallo L, de Vries E, Izarzugaza I, et al. The advantage of women in cancer survival: an análisis of EUROCARE-4 data. Eur J Cancer 2009; 45: 1017-27. [ Links ]
55. Díaz J, Marin JC. Colorectal cancer screening with fecal occult blood testing. Rev Esp Enferm Dig 2008; 100: 315-9. [ Links ]
56. Navarro M, Peris M, Binefa G, Nogueira JM, Miquel JM, Espinas JA, et al. Colonoscopic findings from a pilot screening study for colorectal cancer in Catalonia. Rev Esp Enferm Dig 2008; 100: 343-8. [ Links ]
57. Platz EA, Willett WC, Colditz GA, Rimm EB, Spiegelman DL, Giovannucci EL. Proportion of colon cancer risk that might be preventable in a cohort of middle-aged US men. Cancer Causes Control 2000; 11: 579-88. [ Links ]











 texto en
texto en