Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 no.6 Madrid jun. 2016
Guía de Práctica Clínica: Síndrome del intestino irritable con estreñimiento y estreñimiento funcional en adultos
Clinical Practice Guideline: Irritable bowel syndrome with constipation and functional constipation in the adult
Fermín Mearin1, Constanza Ciriza2, Miguel Mínguez3, Enrique Rey4, Juan José Mascort5, Enrique Peña6, Pedro Cañones7 y Javier Júdez8, para la Sociedad Española de Patología Digestiva (SEPD), la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), la Sociedad Española de Médicos de Atención Primaria (SEMERGEN) y la Sociedad Española de Médicos Generales y de Familia (SEMG)
1 Coordinador de la GPC. Comité Roma de Trastornos Funcionales Intestinales. Miembro AEG. Centro Médico Teknon. Barcelona.
2 Grupo de Trastornos Funcionales. SEPD. Hospital Universitario 12 de Octubre. Madrid.
3 Miembro de AEG y SEPD. Hospital Clínico Universitario. Universitat de Valencia. Valencia.
4 SEPD. Hospital Clínico Universitario San Carlos. Madrid.
5 Secretario Científico. semFYC.
6 Coordinador de Digestivo. SEMERGEN.
7 Coordinador de Digestivo. SEMG.
8 Departamento de Gestión del Conocimiento. SEPD
Dirección para correspondencia
RESUMEN
En esta Guía de Práctica Clínica analizamos el manejo diagnóstico y terapéutico de pacientes adultos con estreñimiento y molestias abdominales, bajo la confluencia del espectro del síndrome del intestino irritable y el estreñimiento funcional. Ambas patologías están encuadradas en los trastornos funcionales intestinales y tienen una importante repercusión personal, sanitaria y social, afectando a la calidad de vida de los pacientes que las padecen. La primera es el subtipo de síndrome del intestino irritable en el que el estreñimiento es la alteración deposicional predominante junto con dolor abdominal recurrente, hinchazón y distensión abdominal frecuente. El estreñimiento se caracteriza por la dificultad o la escasa frecuencia en relación con las deposiciones, a menudo acompañado por esfuerzo excesivo durante la defecación o sensación de evacuación incompleta. En la mayoría de los casos no tiene una causa orgánica subyacente, siendo considerado un trastorno funcional intestinal. Son muchas las similitudes clínicas y fisiopatológicas entre ambos trastornos, con respuesta similar del estreñimiento a fármacos comunes, siendo la diferencia fundamental la presencia o ausencia de dolor, pero no de un modo evaluable como "todo o nada". La gravedad de estos trastornos depende no sólo de la intensidad de los síntomas intestinales sino también de otros factores biopsicosociales: asociación de síntomas gastrointestinales y extraintestinales, grado de afectación, y formas de percepción y comportamiento. Mediante los criterios de Roma, se diagnostican los trastornos funcionales intestinales. Esta Guía de Práctica Clínica está adaptada a los criterios de Roma IV difundidos a finales de mayo de 2016 y analiza los criterios de alarma, las pruebas diagnósticas y los criterios de derivación entre Atención Primaria y Aparato Digestivo. Asimismo, se revisan todas las alternativas terapéuticas disponibles (ejercicio, ingesta de líquidos, dieta con alimentos ricos en fibra soluble, suplementos de fibra, otros componentes de la dieta, laxantes osmóticos o estimulantes, probióticos, antibióticos, espasmolíticos, esencia de menta, prucaloprida, linaclotida, lubiprostona, biofeedback, antidepresivos, tratamiento psicológico, acupuntura, enemas, neuroestimulación de raíces sacras o cirugía), efectuando recomendaciones prácticas para cada una de ellas.
Palabras clave: Síndrome del intestino irritable. Estreñimiento. Molestia abdominal. Adultos. Atención primaria. Enfermedades digestivas. Guía de práctica clínica.
ABSTRACT
In this Clinical Practice Guideline we discuss the diagnostic and therapeutic approach of adult patients with constipation and abdominal complaints at the confluence of the irritable bowel syndrome spectrum and functional constipation. Both conditions are included among the functional bowel disorders, and have a significant personal, healthcare, and social impact, affecting the quality of life of the patients who suffer from them. The first one is the irritable bowel syndrome subtype, where constipation represents the predominant complaint, in association with recurrent abdominal pain, bloating, and abdominal distension. Constipation is characterized by difficulties with or low frequency of bowel movements, often accompanied by straining during defecation or a feeling of incomplete evacuation. Most cases have no underlying medical cause, and are therefore considered as a functional bowel disorder. There are many clinical and pathophysiological similarities between both disorders, and both respond similarly to commonly used drugs, their primary difference being the presence or absence of pain, albeit not in an "all or nothing" manner. Severity depends not only upon bowel symptom intensity but also upon other biopsychosocial factors (association of gastrointestinal and extraintestinal symptoms, grade of involvement, and perception and behavior variants). Functional bowel disorders are diagnosed using the Rome criteria. This Clinical Practice Guideline has been made consistent with the Rome IV criteria, which were published late in May 2016, and discuss alarm criteria, diagnostic tests, and referral criteria between Primary Care and gastroenterology settings. Furthermore, all the available treatment options (exercise, fluid ingestion, diet with soluble fiber-rich foods, fiber supplementation, other dietary components, osmotic or stimulating laxatives, probiotics, antibiotics, spasmolytics, peppermint essence, prucalopride, linaclotide, lubiprostone, biofeedback, antidepressants, psychological therapy, acupuncture, enemas, sacral root neurostimulation, surgery) are discussed, and practical recommendations are made regarding each of them.
Key words: Irritable bowel syndrome. Constipation. Abdominal discomfort. Adults. Primary care. Digestive diseases. Clinical practice guideline.
Aspectos conceptuales, impacto y fisiopatología
1. ¿Por qué abordar el síndrome del intestino irritable con estreñimiento y el estreñimiento funcional en el adulto conjuntamente?
El síndrome del intestino irritable (SII) y el estreñimiento funcional (EF) son dos trastornos funcionales intestinales (TFI) (1,2). Por tanto, ambos comparten que su causa no se explica por las alteraciones morfológicas, metabólicas o neurológicas demostrables por las técnicas diagnósticas habituales. El SII se divide, según el tipo de alteración del hábito deposicional predominante, en SII con estreñimiento (SII-E) y SII con diarrea (SII-D); cuando se combinan ambos trastornos, estreñimiento y diarrea, se habla de SII de tipo mixto (SII-M), y de SII de tipo indeterminado (SII-I) cuando el patrón de las deposiciones es intermedio y no puede clasificarse como diarrea ni estreñimiento (1,2).
Aunque desde un punto de vista conceptual el SII-E y el EF son dos TFI diferentes, en la práctica pueden ser muy parecidos e incluso indistinguibles (3-5). En los dos el estreñimiento es un síntoma primordial, como también lo es la hinchazón/distensión del abdomen. La presencia de dolor abdominal más de una vez a la semana, así como la relación temporal del dolor con la defecación, es lo que teóricamente diferencia al SII-E del EF (1). Sin embargo, puede haber pacientes con EF y un cierto grado de dolor y la relación temporal no siempre es fácil de establecer (3). En realidad, el SII-E y el EF forman un espectro en el que en un extremo estarían los pacientes con dolor abdominal muy importante junto con estreñimiento y en el otro, los pacientes con estreñimiento y ausencia absoluta de dolor; en la práctica, la mayoría de casos están en un lugar intermedio. De hecho, pudiera ser más lógico clasificar este tipo de TFI de la siguiente manera: estreñimiento con dolor (similar al SII-E) y estreñimiento sin dolor (similar al EF) (Fig. 1).
Además de estas similitudes conceptuales y clínicas, el SII-E y el EF tienen diversos mecanismos patogénicos comunes y en ambos se han demostrado respuestas beneficiosas a los mismos fármacos (6-11).
Todos los aspectos anteriores nos han movido a realizar una GPC en la que se abordan de manera conjunta el SII-E y el EF. Sin duda, entre ellos hay más semejanzas que diferencias.
2. ¿Qué es el síndrome del intestino irritable?
El SII se caracteriza por la presencia de dolor abdominal recurrente asociado a alteraciones del ritmo deposicional, ya sea en forma de estreñimiento, de diarrea, o de ambas; la hinchazón y la distensión abdominal son muy frecuentes en el SII (1,2). De acuerdo con los criterios de Roma IV (2), el SII se diagnostica por la presencia de dolor abdominal recurrente que debe estar presente al menos un día a la semana, con dos o más de las siguientes características: a) se asocia a la defecación; b) está relacionado con un cambio en la frecuencia de las deposiciones; y c) está relacionado con un cambio en la consistencia de las deposiciones. En cuanto a los requerimientos de duración de las molestias, hay que tener en cuenta que los criterios deben cumplirse durante los últimos tres meses y los síntomas, haber comenzado un mínimo de seis meses antes del diagnóstico (1,2).
El solapamiento del SII con otros TFI (como el EF o la diarrea funcional), otros trastornos funcionales digestivos no intestinales (como la dispepsia funcional o la pirosis funcional) o extradigestivos (como la fibromialgia o la cistitis intersticial) es muy frecuente (12,13).
El diagnóstico debe fundamentarse en los síntomas característicos que se han sistematizado en los criterios de Roma IV (Tablas I y II, algoritmo 1), aunque ello no exime de realizar las exploraciones pertinentes para establecer el diagnóstico diferencial con algunas patologías orgánicas que pueden manifestarse de forma similar.
3. ¿Qué es el síndrome del intestino irritable con estreñimiento?
El SII-E es el subtipo de SII en el que el estreñimiento es la alteración deposicional predominante. Las características de las heces permiten clasificar los subtipos del SII utilizando la escala de Bristol (14) (Fig. 2). Según el porcentaje de uno u otro tipo de heces, en los días en que estas son anormales, se establecen como SII-E, SII-D o SII-M. En el caso de SII-E se precisa que en más de un 25% de las deposiciones las heces sean de tipo 1 o 2 y que en menos de un 25% de las deposiciones las heces sean de tipo 6 o 7 (1,2) (Tabla I).
4. ¿Qué es el estreñimiento funcional?
El estreñimiento se caracteriza por la dificultad o la escasa frecuencia en relación con las deposiciones, a menudo acompañada por esfuerzo excesivo durante la defecación o sensación de evacuación incompleta (1,2). En la mayoría de los casos no tiene una causa orgánica subyacente, siendo considerado un TFI. De acuerdo con los criterios de Roma IV (Tabla II), el EF se define como la presencia durante los últimos 3 meses de dos o más de los siguientes factores: a) esfuerzo defecatorio (≥ 25% deposiciones); b) deposiciones duras o caprinas (≥ 25% deposiciones); c) sensación de evacuación incompleta (≥ 25% deposiciones); d) obstrucción defecatoria (≥ 25% deposiciones); e) maniobras manuales para la defecación (≥ 25% deposiciones); y f) menos de 3 deposiciones espontáneas completas/semana. Los síntomas deben haber comenzado un mínimo de 6 meses antes del diagnóstico, y no debe existir diarrea si no es tras la toma de laxantes ni cumplirse criterios de SII (1).
La Asociación Americana de Gastroenterología (AGA) prefiere realizar una definición más sencilla, aunque en realidad es muy similar: "Defecaciones insatisfactorias caracterizadas por deposiciones infrecuentes, heces difíciles de evacuar, o ambos, durante al menos 3 meses. La dificultad en evacuar las heces incluye el esfuerzo, la sensación de evacuación incompleta, las heces duras, el tiempo prolongado para defecar y la necesidad de maniobras manuales" (15).
Sin embargo, estas definiciones han sido establecidas por consensos médicos y opiniones de expertos, siendo importante conocer cuál es la opinión de los propios pacientes sobre el estreñimiento. Así, en un estudio poblacional realizado en Estados Unidos, de un total de 557 sujetos con estreñimiento los porcentajes de síntomas que aquejaban eran los siguientes: 79% esfuerzo excesivo, 74% gases, 71% heces duras, 62% molestia abdominal, 57% deposiciones poco frecuentes, 57% distensión abdominal y 54% sensación de evacuación incompleta (16).
5. ¿En qué se parecen y en qué se diferencian el síndrome del intestino irritable con estreñimiento y el estreñimiento funcional?
Tal y como se ha comentado anteriormente son muchas las similitudes clínicas entre el SII-E y el EF: más frecuentes en personas de características similares (mujeres de mediana edad), obviamente la presencia de estreñimiento (pero también de distensión/hinchazón abdominal), y respuesta similar del estreñimiento a fármacos comunes. Además, es importante hacer constar que el estreñimiento es de características semejantes en ambos TFI (3). La diferencia fundamental estriba en la presencia o ausencia de dolor, pero nuevamente se debe señalar que este es un aspecto discutible, y no evaluable como "todo o nada".
En lo que se refiere a la fisiopatología, las causas del estreñimiento también son comunes: alteraciones de la motilidad colónica, dificultad expulsiva, ausencia de compresión abdominal suficiente, y combinación de las anteriores. Cabe recordar, no obstante, que en un considerable número de casos (en especial con SII-E) puede no detectarse ninguna de las causas anteriores.
La diferencia fisiopatológica fundamental pudiera ser la distinta sensibilidad visceral en uno y otro caso: más frecuente la hipersensibilidad colónica en el SII y más frecuente la hiposensibilidad rectal en el EF (17-19).
6. ¿Cuál es la importancia clínica, social y económica del síndrome del intestino irritable con estreñimiento y del estreñimiento funcional?
Algunos médicos consideran el SII-E y el EF unas patologías banales, pero la realidad es que su repercusión personal, sanitaria y social es muy importante. La calidad de vida relacionada con la salud (CVRS) de los pacientes con SII está notablemente alterada, como reflejan varias revisiones al respecto (20,21). A su vez, los costes asociados al SII son importantes. Baste citar que sólo en Estados Unidos consultan anualmente por este problema 3,5 millones de personas, lo que supone un gasto anual de 20.000 millones de dólares (22). Datos obtenidos en Europa, y específicamente en España, también demuestran el incremento de los costes directos e indirectos en los pacientes con SII-E (23).
En lo que se refiere a la repercusión del EF en las actividades cotidianas de los pacientes que lo padecen, el 69% considera que afecta a su rendimiento escolar o laboral (16), siendo una causa relevante de absentismo en los casos graves (media de pérdida de días de actividad de 2,4/mes) y de disminución de la productividad (16). Otros estudios han confirmado las repercusiones sociales al comparar datos de sujetos con EF y población general (24). Todo ello condiciona que el gasto sanitario, directo e indirecto, del EF sea enorme. En Estados Unidos conlleva aproximadamente 2,5 millones de visitas cada año y 92.000 hospitalizaciones anuales, con un coste en exploraciones de casi 7.000 millones de dólares (24,25).
En lo que respecta a la CVRS en el EF, sirvan como resumen los resultados de una revisión sistemática publicada en el año 2010. Se identificaron 10 estudios empleando diferentes cuestionarios de salud genéricos: siete que utilizaban el SF-36 (Short-Form 36), dos el PGWBI (Psychological General Well Being Index) y uno el SF-12 (26). Se comprobó que, utilizando el SF-36, prácticamente todos los dominios estaban alterados en los pacientes con EF al compararlos con los controles sanos; como era de esperar, las diferencias eran mayores en los pacientes atendidos en el ámbito hospitalario que en el ambulatorio.
Cuando se compara la CVRS de los pacientes con estreñimiento con otras patologías frecuentes el resultado es sorprendente (26). El impacto en los aspectos físicos de los pacientes con EF que precisan atención especializada es mayor, por ejemplo, que el de la colitis ulcerosa, estable o inestable, la enfermedad de Crohn estable, o que el de enfermedades no digestivas como las alergias crónicas, o el dolor de espalda.
7. ¿Cómo establecer la gravedad del síndrome del intestino irritable con estreñimiento y del estreñimiento funcional?
La gravedad de los TFI, incluidos el SII y el EF, depende no sólo de la intensidad de los síntomas intestinales sino también de otros factores biopsicosociales: asociación de síntomas gastrointestinales y extraintestinales, grado de afectación, y formas de percepción y comportamiento. De tal forma, tanto los factores fisiológicos viscerales como los centrales influyen en la gravedad del SII. A su vez, la gravedad afecta directamente a la calidad de vida, y debe tenerse en cuenta a la hora de tomar decisiones diagnósticas y terapéuticas (27,28).
La gravedad del SII, y de otros TFI, se establece por lo general de dos formas: a) utilizando una escala individual de síntomas (p. ej., leve, moderado, grave, muy grave); o b) mediante la combinación de múltiples síntomas o actitudes (p. ej., dolor abdominal junto con la consistencia y frecuencia de las deposiciones, urgencia defecatoria, impacto en la calidad de vida, utilización de recursos sanitarios y grado de discapacidad).
El cuestionario más ampliamente utilizado para valorar la gravedad del SII es el llamado Irritable Bowel Syndrome Severity Scoring System (IBS-SSS) (29). En él se analizan la intensidad de 5 ítems diferentes durante un periodo de 10 días: dolor abdominal, distensión, frecuencia de las deposiciones, consistencia de las deposiciones, e interferencia con las actividades cotidianas. Cada ítem se puntúa de 0 a 100 en una escala visual analógica, obteniéndose el sumatorio de las 5 puntuaciones. El IBS-SSS ha sido traducido y validado al español (30).
Diagnóstico
8. ¿Cuántos tipos fisiopatológicos hay en el estreñimiento funcional (sin o con síndrome del intestino irritable)?
El EF se clasifica, según los mecanismos fisiopatológicos implicados, en tres grupos (1,31-34):
1. Pacientes con trastorno funcional de la defecación (Tabla III): en los que se detecta una alteración del vaciado rectal ocasionado por una insuficiente propulsión rectal o por un comportamiento anómalo de la relajación de la musculatura estriada responsable de la apertura del canal anal (déficit de relajación, contracción paradójica o disinergia de la defecación). Ambas disfunciones pueden asociarse y a menudo se acompañan de una disminución de la sensibilidad rectal (hiposensibilidad), defectos estructurales del suelo pélvico (descenso perineal excesivo, rectocele, enterocele, intususcepción, etc.) o trastornos de la motilidad colónica con retraso del tiempo de tránsito colónico (TTC) (32).
2. Pacientes con tránsito colónico lento (TCL), en los que el tiempo que tarda el material intestinal en recorrer el colon está aumentado con respecto a la normalidad.
3. Pacientes con tránsito colónico normal (TCN). El diagnóstico de estos subtipos fisiopatológicos precisa de técnicas diagnósticas funcionales complementarias que deben realizarse en centros especializados.
¿Qué estudios funcionales permiten establecer el diagnóstico de disfunción de la defecación, en qué orden y dónde deben realizarse?
Hay tres técnicas exploratorias que nos sirven para hacer el diagnóstico y, aunque no existe consenso que permita unificar la metodología de cada una de ellas, es necesario verificar mediante dos técnicas, como mínimo, la presencia de una evacuación ineficaz (32).
El test de expulsión del balón, por su accesibilidad, sencillez, coste, ausencia de efectos secundarios, sensibilidad y especificidad diagnóstica, deberá ser siempre el primero en realizarse (32,34-36). Aunque no requiere un centro especializado, en la práctica clínica es muy difícil que en asistencia primaria o en consulta especializada ambulatoria se realice. Este test consiste en evaluar la habilidad de un paciente para expulsar, en condiciones de intimidad, un globo lleno de agua a temperatura corporal y con un volumen suficiente como para producir deseos de defecación. Se considera normal la expulsión en un tiempo máximo de 1 a 2 minutos. En un estudio no controlado en pacientes con EF se ha observado que esta prueba es útil para identificar disfunción de la defecación y muestra una sensibilidad y especificidad del 87,5% y 89%, respectivamente, y unos valores predictivos positivos y negativos del 64% y 97%, respectivamente (37). La probabilidad, por tanto, de que un paciente presente un trastorno de la expulsión si el estudio es normal es muy baja; sin embargo, cuando es patológica deberemos realizar una cuantificación meticulosa de la función rectoanal que justifique esta alteración. El estudio más útil para ello es la manometría ano-rectal (32,34-36), que registra, tanto en reposo como durante la maniobra defecatoria espontánea o provocada tras la distensión de un balón intrarrectal, las presiones a lo largo del canal anal y del recto, valora la sensibilidad rectal e identifica la indemnidad de los reflejos rectoanales. En los pacientes con disinergia se objetivará la inadecuada relajación o la contracción paradójica del canal anal y la presencia o no de una presión intrarrectal suficiente para propulsar las heces. Tanto el test de la expulsión del balón como la manometría ano-rectal presentan, entre otros, el inconveniente de que se hacen con el canal anal ocupado permanentemente por una sonda, y ello no garantiza que la maniobra defecatoria reproduzca la situación que el individuo experimenta en la vida cotidiana. Por ello, en caso de que los síntomas del paciente no se justifiquen con los hallazgos en ambos estudios, o exista divergencia en el resultado de los mismos, deberemos realizar una defecografía (33,38). Esta técnica permite estudiar, además de la función, la anatomía del recto-ano durante el acto voluntario de la defecación. Existen dos técnicas para su realización, la videofluoroscopia, en la que se evalúa y cuantifica la capacidad de expulsar el contenido rectal (con el paciente sentado en un asiento radiotraslúcido) y, además, la existencia de alteraciones estructurales del sigma, recto y canal anal, y la defecografía con resonancia magnética (RM), que visualiza también los tejidos blandos perirrectales y el sistema genito-urinario en múltiples planos anatómicos, no utiliza radiación ionizante y es menos operador-dependiente que la videofluoroscopia. Ambas técnicas deben realizarse en centros especializados y la interpretación de los resultados debe contrastarse siempre con los síntomas del paciente antes de tomar decisiones terapéuticas (sobre todo quirúrgicas), dada la alta prevalencia en sujetos normales de alteraciones morfológicas (rectocele, enterocele e intususcepción).
¿Qué estudios funcionales permiten establecer el diagnóstico de estreñimiento por tiempo de tránsito lento y dónde deben realizarse?
Existen tres técnicas que miden de forma cuantitativa el TTC total y en sus distintos segmentos: el estudio radiológico con marcadores radiopacos (39), la evaluación gammagráfica del colon tras la ingesta de una comida (40) o de una cápsula marcada con indio (111In-DTPA) (41), y el estudio con cápsula inalámbrica de la motilidad (SmartPill®) (42). Todas las técnicas deben realizarse e interpretarse en centros especializados, si bien por accesibilidad el estudio con marcadores radiopacos es el más ampliamente utilizado. En España, disponemos de un estudio con un número elevado de sujetos normales que nos proporciona valores de normalidad para los estudios radiológicos (39). El uso de la SmartPill®, aunque de elevado coste, ha demostrado tener una buena correlación con los resultados de los estudios radiológicos para clasificar a los pacientes con TCL respecto a los de TCN, no es ionizante y mide, además del tiempo, la actividad motora en todo el tracto gastrointestinal. Este dato es muy importante cuando debemos decidir realizar cirugía exerética de colon en un paciente con TCL ya que previamente se deben descartar trastornos motores del resto del intestino.
9. ¿Qué utilidad clínica tiene conocer el tipo fisiopatológico de estreñimiento funcional?
Es muy útil en la práctica clínica hacer lo antes posible el diagnóstico de pacientes con disfunción de la defecación por disinergia del suelo pélvico, por su prevalencia, porque responden a tratamiento con biofeedback (BFB) pero no lo hacen a tratamiento habitual (43-46) y, además, porque en un porcentaje elevado de pacientes la eficacia del BFB normaliza el TTC cuando este está enlentecido (43).
En pacientes sin disfunción de la defecación conocer el TTC nos va a permitir ser más o menos agresivos en la actitud terapéutica. Los pacientes con TCN no deberían nunca ser tratados con medidas extremas y aún menos mediante cirugía. Por otra parte, los pacientes con TCL sin disfunción de la defecación frecuentemente presentan empeoramiento clínico al tratamiento con fibra y responden mal a los laxantes habituales (incluyendo los estimulantes). En este subgrupo de pacientes se ha demostrado que la neuromodulación de raíces sacras (47) y de forma muy selectiva la colectomía subtotal con anastomosis íleo-rectal pueden ser tratamientos eficaces y satisfactorios (48,49).
10. ¿Puede un paciente presentar cambios en sus síntomas y cumplir en diferentes etapas de su vida ambos diagnósticos (síndrome del intestino irritable con estreñimiento y el estreñimiento funcional)?
Aplicando los criterios diagnósticos de Roma es muy frecuente tanto el solapamiento diagnóstico (especialmente con criterios previos a Roma IV) como el cambio de diagnóstico en el mismo individuo a lo largo del tiempo. Uno de los estudios prospectivos más importantes realizados en asistencia primaria (n:432 pacientes; EF:231, SII-E:201) demostró, que el 89,5% de pacientes con criterios de SII-E (tal y como eran definidos en 2005) cumplía así mismo criterios de EF y que el 43,8% de pacientes con EF cumplían plenamente los criterios de SII-E, y además que el cambio en los diagnósticos en ambos sentidos (EF frente a SII-E y SII-E frente a EF) en un seguimiento de 12 meses se observaba hasta en un tercio de los pacientes (50).
11. ¿Qué exploraciones complementarias son necesarias para el diagnóstico de síndrome del intestino irritable con estreñimiento y el estreñimiento funcional?
Como se ha comentado previamente, en la actualidad, los diagnósticos de SII-E y EF se establecen mediante datos que se extraen de la historia clínica y que deben cumplir los criterios establecidos por consenso de grupos de expertos (Roma) (2) (Tablas I y II) o bien, exclusivamente para EF, los criterios descritos previamente de la AGA (31).
Una vez se constatan los criterios específicos que constituyen el diagnóstico de cualquiera de los dos procesos (SII-E y EF), y dado que es requisito imprescindible que el origen de los síntomas no tenga una justificación orgánica, metabólica ni farmacológica, debemos establecer criterios muy claros respecto a qué estudios complementarios son necesarios para garantizar la funcionalidad de los síntomas. La anamnesis dirigida y la exploración física rigurosa son obligatorias y nos ayudan a confirmar la ausencia de enfermedades intestinales y extraintestinales (Tabla IV) o de la toma de fármacos (Tabla V) que justifiquen los síntomas. Asimismo, nos permiten conocer si cumplen criterios de alarma (Tabla VI) que favorezcan la realización específica de determinados estudios complementarios.
En ausencia de criterios de alarma, ¿qué estudios de laboratorio o de imagen se consideran imprescindibles para descartar causalidad metabólica u orgánica en pacientes que cumplen los criterios clínicos consensuados de SII-E o de EF?
A excepción de un hemograma para evaluar la existencia de anemia y/o infección, no se ha demostrado que la realización de estudios en los que se determinen electrolitos, hormonas tiroideas, calcio y perfil bioquímico completo (glucosa en ayunas, urea, creatinina, etc.) tengan utilidad diagnóstica ni sean costo-eficaces (31,33,50). De forma que estas pruebas sólo deben solicitarse cuando exista una sospecha específica de alguno de los trastornos anteriores.
Tampoco se ha demostrado que la realización de radiología simple de abdomen (51,52) o de enema opaco (53) tenga utilidad para encontrar características morfológicas que les discriminen respecto a la población normal y no hay ninguna evidencia que soporte la utilidad de la realización de colonoscopia en pacientes con clínica de estreñimiento (54,55). Por ello, las guías de consenso (31,33,38) no recomiendan realizar estudios de laboratorio ni morfológicos a excepción de que el médico observe criterios de riesgo o sospecha clínica de patología orgánica o metabólica.
¿Qué estudios debemos realizar si existen criterios de alarma?
Además de pedir las pruebas específicas en función del hallazgo guía de alarma, en la mayoría de casos deberá realizarse una colonoscopia.
¿Qué controles de laboratorio o de imagen debemos hacer a los pacientes cuyo diagnóstico de SII-E o de EF tenga varios años de evolución y se mantenga clínicamente estable sin signos ni síntomas de alarma?
Ninguno. La única excepción es cuando el paciente cumpla criterios poblacionales de cribaje de cáncer colorrectal (CCR) por edad, o por la aparición en su entorno familiar de CCR. En estos casos deberán realizarse los estudios aplicables a cada caso: sangre oculta en heces (SOH) o colonoscopia (33).
¿Qué controles debemos hacer en pacientes cuyo diagnóstico de SII-E o de EF esté bien establecido pero aparezcan cambios en la intensidad de los síntomas, en su frecuencia o en la respuesta al tratamiento?
En el supuesto de que no exista una explicación plausible para justificar los cambios, de forma individualizada se debe investigar la presencia de patología asociada que lo justifique. Es importante tener en consideración, tras una nueva exploración física, cuándo se realizaron los últimos estudios analíticos y morfológicos (si los tuviera) y si han cambiado las características epidemiológicas familiares. Característicamente, ambas patologías cursan con fases en las que hay cambios en la intensidad de los síntomas o en la percepción personal de que padecen una enfermedad orgánica no suficientemente investigada. Además, hay que tener en consideración que tanto el EF como el SII-E son diagnósticos intercambiables en el mismo individuo con el curso del tiempo si aplicamos los criterios diagnósticos de Roma, de manera que hasta un tercio de los pacientes con EF cumplirá criterios de SII-E en el seguimiento a un año y viceversa (4) y ello no debe ser motivo de exploraciones complementarias. Únicamente síntomas o signos de alarma justifican el hacer estas.
Una vez diagnosticado un paciente de SII-E o de EF, ¿qué estudios funcionales deberíamos realizar y cuándo? ¿Son útiles los síntomas para sospechar el mecanismo patogénico por el que se produce el EF?
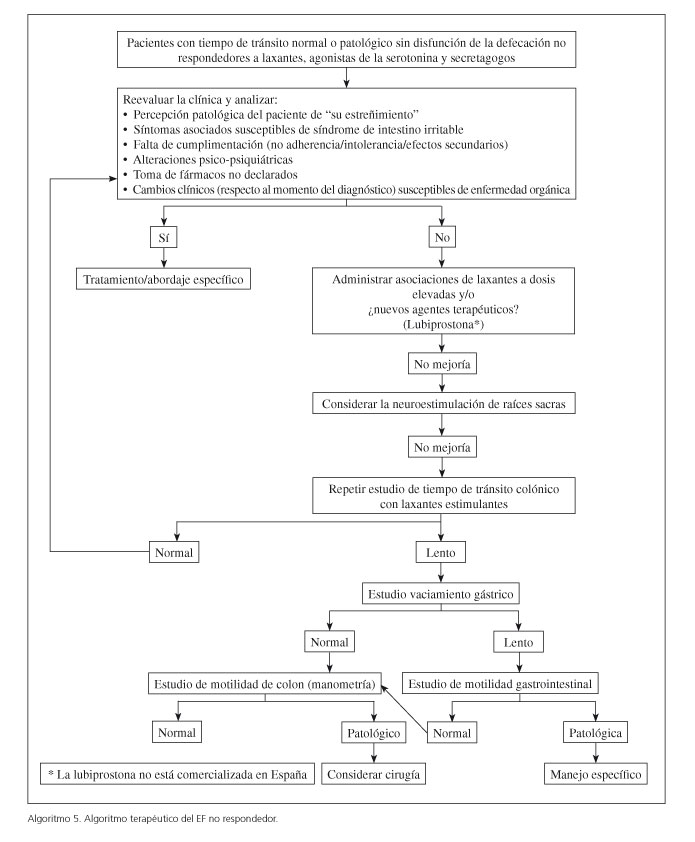
Los pacientes con estreñimiento, cumplan criterios de SII o no, pueden presentar alteraciones funcionales rectoanales o trastornos de la motilidad del colon que no van a responder a medidas habituales, por lo que es necesario un diagnóstico específico mediante estudios funcionales (Algoritmos 2 y 3). El trastorno funcional rectoanal más frecuente es la disfunción defecatoria por disinergia de la defecación, que afecta a entre un 14,9% y un 52,9% de pacientes con EF (36) y que consiste básicamente en una alteración de la apertura del ano en el momento de la defecación o en una insuficiente propulsión rectal en la fase expulsiva. El diagnóstico precoz de este trastorno es muy importante dado que precisa un tratamiento específico (BFB ano-rectal). Existen datos en la historia clínica que, aunque no son específicos para el diagnóstico de disinergia ano-rectal (56,57), son más frecuentes en esta entidad, como se ha señalado en algunos estudios, como son el dolor anal con la defecación (7), la ayuda manual para la expulsión de las heces, el esfuerzo excesivo para defecar y el bloqueo anal (58). Además, hay un signo que se relaciona fuertemente con este trastorno cuando lo detectan profesionales experimentados, y es el hecho de objetivar una contracción paradójica del ano al invitar al paciente a efectuar una maniobra defecatoria durante la realización de un tacto ano-rectal (59,60). Si el paciente presenta este signo, realizado por personal experto y en condiciones de intimidad deberemos solicitar un test funcional de expulsión del balón, y si este es patológico, una manometría ano-rectal para confirmar el diagnóstico de disinergia. Sin embargo, y dado que en la práctica clínica estos requisitos (experiencia en tacto ano-rectal dinámico, áreas de exploración bien acondicionadas) no suelen darse, las guías de práctica clínica estiman que estas pruebas deben solicitarse ante cualquier paciente que no haya respondido a tratamiento con medidas higiénico-dietéticas, cambios en el estilo de vida y laxantes habituales y en el que, por los síntomas o el tacto anal, se sospeche la existencia de disinergia (33,36). Siendo más rigurosos, incluso puede exigirse antes de realizar estas exploraciones a los pacientes también refractarios a los tratamientos con agonistas de la serotonina y secretagogos (38). En los pacientes en los que exista discordancia en los resultados del test de expulsión del balón y la manometría ano-rectal, se debe solicitar una defecografía mediante fluoroscopia o RM con el fin de evaluar la presencia de alteraciones estructurales ocultas (enterocele, intususcepción, rectocele) y/o confirmar la existencia de disfunción de la musculatura pelviana durante la maniobra de defecación.
Hay síntomas que en algunas series observacionales son más prevalentes en pacientes con EF con un TCL: la infrecuencia defecatoria (58,61), el estreñimiento desde la infancia y la dependencia de los laxantes (61); pero únicamente la consistencia de las heces (muy duras, escala de Bristol < 3) se ha objetivado que tiene un valor predictivo para el diagnóstico de TCL (sensibilidad 85%, especificidad 82%) (62). En el momento actual el estudio del TTC se debe realizar en los pacientes que no responden a ninguna medida terapéutica y siempre después, y aconsejando además descartar la existencia de disinergia ano-rectal por medio del estudio específico realizado mediante el test de expulsión del balón y la manometría ano-rectal (31,33,38).
12. ¿Se puede, en una consulta de AP diagnosticar subtipos fisiopatológicos de estreñimiento funcional? ¿Cómo?
Por criterios diagnósticos, los subtipos fisiopatológicos de estreñimiento precisan de técnicas diagnósticas que no están accesibles en la consulta de AP, sin embargo, existen síntomas o signos exploratorios básicos que han demostrado tener una correlación bastante buena con los resultados de estas técnicas. Dada la importancia que podría tener desde el punto de vista pronóstico y fundamentalmente terapéutico priorizar en función de la sospecha estudios específicos, es muy importante conocer e identificar estos síntomas y signos.
Para poder efectuar una aproximación diagnóstica en AP de los diferentes subtipos de EF deberemos realizar una historia clínica y una exploración física minuciosas. En la anamnesis es trascendental conocer el patrón defecatorio habitual (frecuencia y consistencia de las heces), los síntomas y signos acompañantes (dolor, malestar, distensión abdominal, esfuerzo defecatorio, sensación de evacuación incompleta, manualización para defecar, etc.) así como los antecedentes personales de tratamientos previos (cambios de estilo de vida, cambios dietéticos, laxantes, fármacos analgésicos, antidepresivos, etc.) y la respuesta obtenida. La exploración física ha de incluir una exploración abdominal completa, una inspección anal y perineal y un tacto rectal dinámico (con maniobra defecatoria) (63).
Con estos datos, como se ha comentado en el apartado anterior, se obtendrán síntomas que por su prevalencia en subtipos de EF sugieren la existencia de una disinergia de la defecación o de un TCL y, fundamentalmente, un signo (la disinergia anal durante el tacto ano-rectal) que tiene valor predictivo, en manos expertas, para el diagnóstico de disinergia de la defecación.
Tratamiento
13. Importancia del cumplimiento terapéutico y aspectos prácticos generales para cualquier alternativa terapéutica
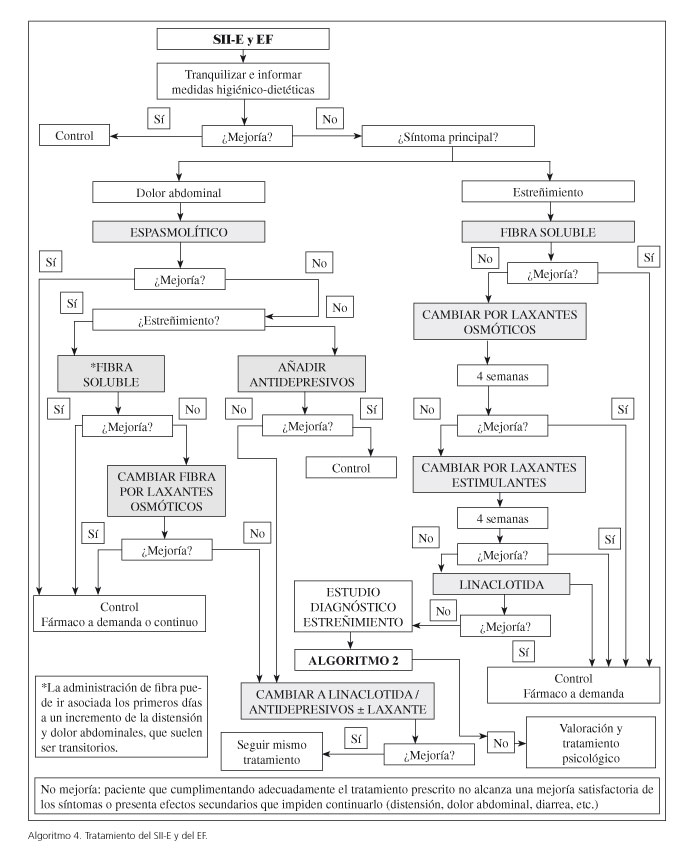
Como en cualquier otra patología, el cumplimiento terapéutico estricto es imprescindible para conseguir la eficacia del plan terapéutico prescrito (Algoritmos 4 y 5). En el caso de los procesos que nos ocupan, incluye no sólo la toma de fármacos sino el seguimiento de los consejos higiénico-dietéticos pautados (Tabla VII) y la modificación de los estilos de vida cuando ello procede.
Es cierto que no basta con plantear dicho plan terapéutico, porque resultará del todo inútil si el paciente no lo asimila, lo admite y acepta ponerlo en práctica. Por tanto, no se trata de que el paciente adopte una conducta de sumisión o de obediencia a la prescripción, sino que se debe conseguir el clima adecuado entre médico y paciente que conlleve la colaboración y la participación activa de este en la toma de decisiones y en la asunción de su propia responsabilidad sobre el cuidado o la mejora de su salud.
Por ello, además de tomar en consideración las mejores opciones terapéuticas desde el punto de vista objetivo, es preciso valorar otras cuestiones que facilitarán el compromiso y con ello el cumplimiento por parte del paciente. Entre ellas son interesantes las siguientes:
- Pautar fármacos cuya posología sea simple, con el menor número posible de tomas o empleando formulaciones galénicas que las simplifiquen.
- Facilitar al paciente información y recordatorios escritos, simples y de fácil comprensión.
- Elaborar "calendarios" de cumplimiento mediante los cuales monitorizar la toma de medicación o la realización de actividades pautadas.
- Proveer al paciente de información acerca de la fisiopatología de su proceso, adaptada a su idiosincrasia y nivel cultural, de manera que se sienta implicado en la evolución de su enfermedad.
- Incluir en todas estas estrategias a los familiares y cuidadores de manera que también actúen como refuerzo positivo de la actitud del paciente.
- Es muy importante la regularidad en el tratamiento indicado para el estreñimiento. Mientras que unos pacientes se automedican permanentemente con laxantes estimulantes, otros los utilizan sólo de forma intermitente y puntual ante agravamientos y, con cierta frecuencia, algunos pacientes evitan la toma de cualquier tratamiento con el concepto erróneo de que los laxantes producen dependencia o pueden resultar peligrosos.
Por último, conviene recordar que el personal de enfermería puede desempeñar un papel muy eficaz en la educación sanitaria y en el seguimiento de la evolución de estos pacientes.
En todo caso, es inútil intentar valorar la eficacia del plan terapéutico sin asegurar el óptimo cumplimiento del mismo por parte del paciente. Su falta de eficacia no será mejorada con modificaciones aisladas o globales de la prescripción si no es factible garantizar la mejor disponibilidad del paciente para comprometerse con dicho plan terapéutico.
14. Utilidad del ejercicio físico aeróbico para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Se suele recomendar la realización de ejercicio físico de forma empírica para mejorar el estreñimiento y la distensión abdominal. El ejercicio físico aeróbico es útil para mantener una adecuada función intestinal y reducir el estrés (64).
Eficacia
Un programa regular de actividad física aeróbica (caminar, bicicleta) puede ser eficaz en el estreñimiento, ya que se ha observado una mejoría en el TTC total y en rectosigma (65). También se ha señalado su efecto beneficioso en la distensión abdominal y la retención de gas (66), aunque en menor grado que en los sujetos sanos (67). En otros dos estudios se demostró una mejoría global de los síntomas en el SII y en la consistencia de las heces (68,69). Además, también mejoraron otros aspectos que pueden influir en el SII, como la ansiedad y la depresión (68).
Limitaciones
La práctica moderada y regular de ejercicio físico aeróbico ajustada a las condiciones físicas de cada individuo no tiene grandes limitaciones clínicas, salvo en pacientes con alteración de la movilidad. Sin embargo, está por determinar la intensidad y la duración óptima de la misma.
Recomendaciones prácticas
El ejercicio físico aeróbico practicado de forma regular puede ser útil en la mejoría del estreñimiento, favorece la evacuación del gas intestinal y mejora la distensión, por lo que parece recomendable aconsejar su práctica en los pacientes con SII-E y EF.
15. ¿El aumento en la ingesta de líquidos mejora el estreñimiento?
La mayoría de las guías clínicas recomiendan realizar modificaciones en el estilo de vida, como la adecuada ingesta de líquidos y de una dieta rica en fibra. En concreto, se suele recomendar beber 1,5-2 litros de líquido al día según algunas guías (49,70,71) y otras revisiones más específicas sobre el EF en ancianos (72).
Eficacia y limitaciones
En un estudio aleatorizado, la ingesta de 2 litros de agua al día en pacientes con EF, que ya estaban consumiendo una dieta rica en fibra, mejoró la frecuencia defecatoria y la necesidad de laxantes (73). Sin embargo, no se dispone de ensayos clínicos que demuestren que la ingestión de líquidos en sí misma, sin otras medidas adicionales, mejore el estreñimiento, salvo en pacientes deshidratados (49,50).
Recomendaciones prácticas
Aunque la evidencia para recomendar el aumento de la ingesta de líquidos es insuficiente, esta medida sí que puede ofrecer algún beneficio en casos de estreñimiento leve asociada al adecuado consumo de fibra con la dieta.
16. Utilidad de fibra en la dieta para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
En la mayoría de las guías se recomienda la dieta rica en fibra como medida inicial para mejorar el estreñimiento. Se suele aconsejar un aumento gradual de la misma para evitar la distensión abdominal; la cantidad de fibra recomendada al día es de unos 25-30 g. Sin embargo, aunque esta medida puede mejorar la frecuencia defecatoria y la consistencia de las heces, puede empeorar otros síntomas como el dolor y la distensión abdominal.
Eficacia
En un metaanálisis se concluyó que el consumo de ciruelas secas (100 g/día) fue beneficioso para mejorar el estreñimiento y que este efecto fue incluso superior al obtenido con psyllium (74).
En otro metaanálisis la dieta rica en fibra fue útil para mejorar el estreñimiento, pero no para el dolor y la distensión abdominal en pacientes con SII (75). En esta misma revisión sistemática, la fibra soluble de los alimentos es la que proporcionó algún beneficio en los pacientes con SII.
Limitaciones
Aunque los alimentos ricos en fibra soluble pueden tener algún beneficio en el estreñimiento, no ocurre lo mismo con la fibra insoluble. En un metaanálisis se analizaron 5 estudios, con un total de 221 pacientes. Se llegó a la conclusión de que no existen diferencias en la mejoría sintomática al comparar los que tomaban fibra insoluble frente a los que hacían una dieta baja en fibra o recibían placebo (riesgo relativo [RR] 1,02; 95% intervalo de confianza [IC] 95%: 0,82-1,27) (76). Por otra parte, en casos de estreñimiento grave con importante enlentecimiento del TTC, la dieta con alto contenido en fibra no es eficaz y puede empeorar el dolor y la distensión (49).
Recomendaciones prácticas
Una dieta con alimentos de alto contenido en fibra soluble (como las ciruelas secas) ha demostrado beneficio en la mejoría del estreñimiento leve pero no en la del dolor o la distensión abdominal, pudiendo incluso empeorar estos síntomas en pacientes con SII.
17. Utilidad de las distintas dietas en el síndrome de intestino irritable con estreñimiento y en el estreñimiento funcional para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Aproximadamente dos tercios de los pacientes con SII creen que sus síntomas son desencadenados por algún alimento.
En pacientes con SII se ha demostrado la existencia de sensibilidad al trigo en ausencia de enfermedad celiaca. En un ensayo clínico, se investigaron 920 pacientes con síntomas de SII y se evidenció que un tercio de los sujetos empeoró (aumento del dolor abdominal y la distensión) al ingerir trigo pero no placebo (77). Sin embargo, está por determinar cuál es el papel de la sensibilidad al gluten no-celiaca, ya que en un estudio realizado en pacientes diagnosticados de esta entidad que cumplían criterios de SII se comprobó que la administración de gluten en distintas concentraciones de forma aleatorizada y ciega frente a placebo no fue identificada por los pacientes (78).
Aunque la malabsorción de lactosa no juega un papel en el estreñimiento, sí se ha relacionado con el dolor y la distensión abdominal en pacientes con SII. En una revisión sistemática se analizaron los resultados de 7 estudios en los que se había realizado test de hidrógeno espirado con lactosa en pacientes con SII. El resultado fue que más de un tercio de los mismos tenían malabsorción de lactosa y que la intolerancia a la misma también era más común en los pacientes que en los controles (79); sin embargo, es frecuente que los pacientes con SII presenten síntomas gastrointestinales tras la ingesta de productos lácteos aun cuando no se demuestra malabsorción de lactosa.
Por otra parte, una extensión de la hipótesis de la intolerancia a distintos hidratos de carbono en el SII ha llevado a plantear una dieta exenta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP). En un estudio aleatorizado, 41 pacientes con SII recibieron dieta baja en FODMAP o su dieta regular. El 68% de los pacientes que recibieron dieta baja en FODMAP refirió control adecuado de los síntomas con respecto al 23% que continuó con su dieta habitual (p = 0,005). La consistencia de las heces no se modificó en ambos grupos (80). No obstante, en un estudio reciente, la dieta baja en FODMAP no fue superior al consejo dietético clásico en el SII (81).
Limitaciones
Como efectos secundarios de este tipo de dietas hay que señalar la posible malnutrición si se mantienen de forma prolongada.
Recomendaciones prácticas
El papel de algunos componentes de la dieta como desen-cadenantes de los síntomas o en la patogénesis del SII es objeto de interés creciente. La dieta sin gluten o la dieta baja en FODMAP parecen mejorar los síntomas de dolor y distensión abdominal en el SII pero no el estreñimiento. La dieta FODMAP no ha sido evaluada en pacientes con EF pero es muy poco probable que sea de utilidad. En definitiva, la evidencia actual es limitada para su recomendación rutinaria en la práctica clínica para el SII-E y el EF.
18. Utilidad de los suplementos de fibra para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. ¿Qué tipo de fibra? ¿Cuál es la tolerabilidad?
Mecanismo de acción
Los suplementos de fibra en la dieta engloban un conjunto de hidratos de carbono complejos poco digeribles en el intestino delgado y que alcanzan íntegros el colon, contribuyendo a aumentar el volumen fecal y siendo parcialmente fermentados por la microbiota, produciendo ácidos grasos de cadena corta, agua y gases (hidrógeno, metano, dióxido de carbono). Suele clasificarse en fibra soluble e insoluble, según su comportamiento en solución acuosa. Los efectos biológicos de la fibra son la aceleración del TTC, un aumento de la biomasa con cambios en el pH colónico y la microbiota, y potencialmente tiene efectos sobre la permeabilidad y la inflamación (82).
Eficacia
Varios metaanálisis han revisado la evidencia de la fibra sobre el EF y el SII. Todos ellos coinciden en la dificultad para extraer conclusiones conjuntas por la heterogeneidad de diseños y objetivos, y la baja calidad en general de los estudios. En conjunto, la fibra tiene un beneficio sobre los síntomas de estreñimiento (número de deposiciones, esfuerzo defecatorio) o sobre objetivos secundarios (uso de laxantes) superior al placebo, especialmente la fibra soluble (psyllium) tanto en estudios realizados en pacientes con EF como con SII. Los efectos sobre otros síntomas como el dolor o la distensión no están claros (83-85).
Efectos adversos
Los principales efectos adversos de la fibra dietética se derivan de su potencial para producir distensión, en general derivado de la producción de gases por la fermentación bacteriana. La mayoría de los ensayos clínicos no lo señalan como efecto adverso relevante, pero la práctica clínica muestra que esto puede ser importante, especialmente en pacientes en los que el estreñimiento se asocia con distensión abdominal y dolor (86).
Limitaciones
El uso de suplemento de fibra dietética no tiene grandes limitaciones clínicas. Deben utilizarse con precaución y control clínico en pacientes inmovilizados o con trastornos graves conocidos de la motilidad intestinal y colónica, por un mayor riesgo de impactación.
Recomendaciones prácticas
La utilización de fibra dietética o suplemento de fibra como primera medida terapéutica es razonable en cualquier paciente con estreñimiento, asocie o no molestias abdominales, existiendo mayor evidencia con la fibra soluble, pudiendo considerarse que un curso de tratamiento de 6 semanas es suficiente para evaluar su eficacia (87). Se debe prestar atención no sólo a la eficacia sino también a la tolerancia, por lo que es aconsejable ir aumentando la cantidad de fibra de forma progresiva.
19. Utilidad de los laxantes osmóticos para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Los laxantes osmóticos contienen iones no absorbibles o moléculas que retienen agua en la luz intestinal. Los más utilizados son el polietilenglicol (PEG), la lactulosa y las sales de magnesio.
Eficacia
Este tipo de laxantes mejoran el estreñimiento y la consistencia de las heces, pero se obtiene una pobre respuesta en el dolor y la distensión abdominal. La mayor evidencia, por los estudios disponibles, es para el PEG, pero las sales de magnesio se utilizan frecuentemente en la práctica clínica con resultado satisfactorio.
Sólo dos ensayos clínicos han estudiado el uso de laxantes osmóticos (PEG) en SII-E. En el primero, no se observó superioridad con respecto al placebo (88). En el segundo ensayo, se demostró mejoría en la frecuencia defecatoria pero no en el dolor o la distensión abdominal (89).
En cuanto a los estudios específicos para el EF, en 5 ensayos se evaluó el PEG frente a placebo. Se demostró la superioridad del PEG con un número necesario de pacientes a tratar (NNT) de 3 (IC 95%: 2-4). La lactulosa también fue superior al placebo con un NNT de 4 (IC 95%: 2-7) (90).
En otra revisión sistemática en la que se comparan PEG y lactulosa, el PEG fue superior en los resultados: número de deposiciones a la semana, consistencia de las heces, alivio del dolor abdominal y necesidad de otros fármacos (91).
Efectos adversos
Los efectos secundarios más frecuentes son dolor y distensión abdominal, diarrea, náuseas y vómitos. Se han descrito muy pocos casos de reacciones de hipersensibilidad (erupción, urticaria o edema). Tienen buen perfil de seguridad y se pueden utilizar en pacientes ancianos, mujeres embarazadas y durante la lactancia. También se pueden utilizar en caso de insuficiencia hepática o renal. El PEG tiene menos efectos secundarios que la lactulosa y su administración es segura durante periodos prolongados (hasta 6 meses). En el caso de las sales de magnesio, el efecto secundario más común es el desequilibrio electrolítico; por ello, se debe utilizar con precaución en pacientes con insuficiencia renal por el riesgo de hipermagnesemia (71).
Limitaciones
La principal limitación de este grupo de laxantes es su escasa respuesta para el control del dolor y la distensión abdominal, síntomas importantes, sobre todo en pacientes con SII. El PEG parece algo superior a la lactulosa en este sentido y por ello esta última no es recomendable en pacientes con SII-E (92).
Recomendaciones prácticas
Los laxantes osmóticos son útiles para el tratamiento del estreñimiento pero no para el control del dolor y la distensión abdominal, por lo que son fármacos de primera línea en el EF pero su utilidad es más limitada en el SII-E. El PEG es más eficaz que la lactulosa en el control de los síntomas y produce menos efectos secundarios, por lo que debe considerarse como fármaco de primera elección. Tienen un buen perfil de seguridad y, por lo tanto, se pueden utilizar en situaciones específicas, como en ancianos, durante el embarazo y en pacientes con insuficiencia renal y hepática.
20. Utilidad de los laxantes estimulantes para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Estos fármacos favorecen la secreción de agua y electrolitos en el colon o inducen la peristalsis del mismo. Entre los laxantes estimulantes se incluyen los difenilmetanos (fenolftaleína, bisacodilo, picosulfato sódico) y las antraquinonas (Senna, cáscara sagrada, Aloe vera).
Eficacia
En dos ensayos clínicos se estudió la eficacia del bisacodilo y del picosulfato sódico. En el primero fueron incluidos 247 pacientes a los que se trató con 10 mg de bisacodilo, frente a 121 pacientes que recibieron placebo una vez al día durante 4 semanas. El bisacodilo fue superior al placebo para mejorar el estreñimiento, así como otros síntomas asociados al mismo, y mejorar la calidad de vida (93). En el segundo ensayo se evaluó la eficacia del picosulfato sódico frente al placebo, de forma que 131 pacientes recibieron 10 mg de picosulfato sódico y 71 recibieron placebo durante 4 semanas. Como en el caso anterior, el picosulfato sódico fue superior al placebo para mejorar el estreñimiento (94). Considerando ambos estudios en conjunto, en el 42,1% de los pacientes que recibieron laxantes estimulantes fracasó el tratamiento frente al 78% de los que recibieron placebo, con un NNT de 3 (IC 95%: 2-3,5) (90).
Efectos adversos
Los efectos adversos más frecuentes son dolor abdominal, diarrea, náuseas y vómitos. Con menor frecuencia se han descrito reacciones alérgicas. Los tratamientos prolongados pueden provocar pérdida de líquidos y electrolitos, por lo que se deben utilizar con mucha precaución en ancianos, pacientes con insuficiencia cardiaca o en pacientes con tratamiento diurético o con corticoides. No se dispone de suficientes estudios para poder garantizar su seguridad durante el embarazo, por lo que no se recomiendan en esta situación.
Limitaciones
Como ocurre con los laxantes osmóticos, estos fármacos no han demostrado su eficacia en el control del dolor y la distensión abdominal, e incluso pueden empeorar estos síntomas. Por otra parte, en muchos casos los pacientes no pueden conseguir un ritmo intestinal "predecible".
Recomendaciones prácticas
Los laxantes estimulantes son útiles para el tratamiento del estreñimiento, aunque menos eficaces para controlar el dolor y la distensión abdominal, por lo que su utilidad es muy limitada en el SII-E. Su perfil de seguridad es menor que el de los laxantes osmóticos.
21. Utilidad de los probióticos para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Mecanismo de acción
Los probióticos son bacterias vivas que poseen diversas características como son la supervivencia en el tracto gastrointestinal, la adherencia al epitelio intestinal y la modulación de la flora intestinal, inhibiendo las bacterias potencialmente patógenas y produciendo diversos efectos inmunomoduladores e inmunoestimulantes, como el estímulo para la proliferación de células inmunitarias, el aumento en la actividad de las células fagocíticas o el incremento en la producción de IgA. Todo ello determina su potencial efecto beneficioso en la prevención de infecciones, especialmente por patógenos de origen intestinal, y de la translocación bacteriana (95-97).
Eficacia
En base a las revisiones sistemáticas y metaanálisis existentes al respecto, el uso de los probióticos para el alivio de los síntomas globales (mejoría de la defecación, de la hinchazón abdominal y el dolor abdominal) de los pacientes con SII es todavía incierto, existiendo tanto estudios que arrojan resultados positivos sobre su uso como otros que no encuentran diferencias significativas.
Respecto al EF, los datos son más inciertos todavía, dada la heterogeneidad entre los diversos estudios y los sesgos existentes en los mismos (90,98-100).
Efectos adversos
En ningún estudio se aprecian efectos secundarios respecto del uso de probióticos en este tipo de pacientes.
Limitaciones
No se encuentran actualmente limitaciones al uso de probióticos en ningún estudio.
Recomendaciones prácticas
Dada la falta de evidencia actual a favor por los resultados contradictorios que arrojan los diversos estudios respecto de su eficacia en el alivio de los síntomas de dolor abdominal, distensión y mejora en el ritmo deposicional en los pacientes con SII-E y EF, no podemos recomendar hoy por hoy su uso en estos pacientes.
22. Utilidad de los antibióticos para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Mecanismo de acción
La rifaximina es un antibiótico sintético derivado de la rifamicina, con actividad gram positiva, gram negativa y frente a microorganismos aerobios y anaerobios, no absorbible a través de la mucosa intestinal (< 0,01% tras la administración oral), por lo que actúa intraluminalmente, con nulo efecto sistémico. Impide la adherencia de los patógenos a la mucosa intestinal y la invasión de las células epiteliales por estos, al unirse a la subunidad β de la ácido ribonucleico (ARN) polimerasa microbiana, inhibiendo de este modo la transcripción y la síntesis de ARN (101).
Eficacia
El uso de rifaximina parece reducir, según las revisiones de los estudios llevados a cabo, los síntomas de distensión, flatulencia y dolor abdominal en los pacientes con SII sin estreñimiento (90,101-103). En un estudio se señala que pudiera ser útil en el subgrupo de pacientes de SII-E (104).
No hay actualmente estudios que evalúen sus efectos en el EF.
Limitaciones. Efectos adversos y contraindicaciones
No se reflejan en los distintos estudios y revisiones efectos secundarios mayores o más frecuentes que los comparados con placebo (3-5).
Recomendaciones prácticas
No existen suficientes datos actualmente para recomendar la utilización de rifaximina en pacientes con EF o SII-E, aunque podría disminuir la hinchazón y la flatulencia.
23. Utilidad de los espasmolíticos para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Los espasmolíticos se han utilizado clásicamente en el tratamiento empírico del SII basándose en que la contracción espástica del músculo liso colónico contribuye a los síntomas del SII, especialmente al dolor. Se distinguen 3 clases principales: antagonistas de canales del calcio (otilonio y pinaverium), relajantes directos del músculo liso (mebeverina) y anticolinérgicos/antimuscarínicos (hioscina, cimetropium, hidrocloruro de diciclomina).
Eficacia
Los espasmolíticos son superiores al placebo en la mejoría de los síntomas en el SII, sobre todo el dolor y la distensión abdominal (38% en el grupo placebo y 56% en el grupo tratado con espasmolíticos) (odds ratio [OR]: 2,13 [IC 95%: 1,77-2,58]) (105). El efecto de los distintos espasmolíticos de forma individual es variable y difícil de interpretar, ya que sólo hay un reducido número de estudios que evalúen cada uno de los 12 diferentes fármacos disponibles. De todos ellos, el bromuro de otilonio (5 ensayos) y la hioscina (3 ensayos) mostraron evidencia de eficacia (76). El bromuro de cimetropium, de pinaverium y el hidrocloruro de diciclomina también han demostrado cierto grado de beneficio (90). En cualquier caso, hay que tener en cuenta la heterogeneidad de los estudios. Otros espasmolíticos estudiados no fueron superiores al placebo.
En otro ensayo clínico multicéntrico se demostró, además, que los pacientes tratados con bromuro de otilonio tuvieron menos probabilidad de recurrencias de los síntomas que los tratados con placebo (106).
Efectos adversos
El 14% de los pacientes tratados con espasmolíticos refirieron efectos secundarios, frente al 9% de los tratados con placebo. Los efectos secundarios más frecuentes fueron sequedad bucal, mareo y visión borrosa, y no hubo ningún efecto adverso grave. El RR de presentar un efecto adverso frente a placebo fue 1,61 (IC 95%: 1,08-2,39) (76,90).
Los espasmolíticos con más acción anticolinérgica pueden provocar alteraciones visuales, retención urinaria, estreñimiento y sequedad de boca. Se deben administrar con precaución en pacientes ancianos, con antecedentes de infarto agudo de miocardio e hipertensión. No se recomienda su utilización en el embarazo y en la lactancia, ya que su seguridad en estas situaciones no ha sido establecida.
Limitaciones
Los espasmolíticos son útiles en el control del dolor y la distensión abdominal pero no tienen acción sobre el estreñimiento.
Recomendaciones prácticas
Los espasmolíticos son eficaces en el tratamiento del dolor y la distensión abdominal en pacientes con SII con buen perfil de seguridad. Los efectos secundarios de estos fármacos son poco frecuentes; no obstante, los que tienen mayor acción anticolinérgica pueden tener efectos adversos a dosis altas.
24. Utilidad de la esencia de menta para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Mecanismo de acción
La esencia de menta, con frecuencia también llamada aceite, tiene propiedades espasmolíticas y en la modulación del dolor al atenuar la hipersensibilidad visceral.
Eficacia
En dos revisiones sistemáticas se demuestra un efecto superior al placebo en el control del dolor en pacientes con SII (76,90). En la más reciente fueron incluidos 5 ensayos con un total de 482 pacientes (107-111), y se demostró un efecto positivo estadísticamente significativo a favor de la esencia de menta frente a placebo, con un NNT de 3 (IC 95%: 2-4) (90). Sin embargo, había heterogeneidad significativa entre los estudios.
Efectos adversos
En los estudios señalados no se describieron efectos secundarios significativos con respecto al placebo. La esencia de menta no suele tener efectos adversos a dosis convencionales, pero se han descrito reacciones alérgicas, pirosis y cefalea. No se conoce su perfil de seguridad a las dosis que se utilizan para el tratamiento en SII en el caso de embarazo y lactancia, por lo que no se recomienda su utilización en estas situaciones.
Limitaciones
Como ocurre con otros espasmolíticos, no tiene acción demostrada sobre el estreñimiento.
Recomendaciones prácticas
La esencia de menta ha demostrado ser eficaz para el control del dolor y la distensión en pacientes con SII con escasos efectos adversos.
25. Utilidad de la prucaloprida para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
La serotonina (5-HT) juega un papel crucial en el tracto gastrointestinal, influyendo en las funciones secretora, motora y sensorial. Existen 7 subtipos de receptores de 5-HT a nivel intestinal. De ellos, el receptor 5-HT4 favorece la secreción intestinal y aumenta el peristaltismo y el tránsito intestinal (112). Prucaloprida es un agonista altamente selectivo del receptor 5-HT4 y que, por tanto, actúa estimulando la motilidad intestinal (113).
Eficacia
En los ensayos fase III prucaloprida fue superior al placebo a la hora de mejorar el estreñimiento, el dolor y la distensión abdominal, así como la calidad de vida (114-116).
En una revisión sistemática en la que se incluyeron 8 ensayos clínicos, la respuesta de prucaloprida para mejorar el estreñimiento fue superior a la obtenida con placebo (fracaso del tratamiento en un 71% de los pacientes con prucaloprida y en un 87,4% con placebo), aunque se identificó importante heterogeneidad en los estudios (90).
En otro metaanálisis, en el que fueron incluidos 9 ensayos, también se demostró la eficacia de prucaloprida en el estreñimiento, consiguiendo una media de al menos 3 deposiciones a la semana (RR = 1,63; IC 95%: 1,07-2,49). Además, mejoraron tanto la calidad de vida (RR = 1,51; IC 95%: 1,07-2,11) como la consistencia de las heces (diferencia media frente al grupo control 9,16; IC 95%: 7,28-11,03) (117). También parece ser un fármaco útil para el estreñimiento refractario en el anciano según los resultados obtenidos en un ensayo clínico fase II (118).
Por otra parte, hay que reseñar su potencial utilidad, aunque no hay suficiente evidencia al respecto, en otros trastornos de la motilidad que cursan con estreñimiento, como la pseudoobstrucción intestinal crónica. Prucaloprida mejoró los síntomas de distensión y dolor abdominal en pacientes con esta patología (119).
Se necesitan estudios para verificar la asociación de prucaloprida con otros fármacos, como linaclotida o lubiprostona, para los casos de estreñimiento grave.
Efectos secundarios
La seguridad y la tolerancia del fármaco son buenas. Los efectos secundarios más frecuentes son dolor de cabeza, náuseas, dolor abdominal y diarrea. El perfil de seguridad cardiaco es muy bueno debido a su afinidad selectiva por los receptores 5-HT4 intestinales. No obstante, se debe utilizar con precaución en la insuficiencia renal avanzada y en la insuficiencia hepática grave. No se recomienda la utilización de prucaloprida durante el embarazo (fármaco de clase C) ni durante la lactancia.
Limitaciones
El fármaco no ha sido comercializado en España con la indicación de SII-E aunque, por lo señalado anteriormente, podría tener un papel en los casos de SII-E grave y sin respuesta a otros tratamientos.
Recomendaciones prácticas
Prucaloprida es un fármaco útil en el tratamiento del EF sin respuesta a otras medidas farmacológicas; en menor medida, también mejora el dolor y la distensión en estos pacientes con un buen perfil de seguridad. Se puede utilizar en pacientes ancianos con estreñimiento refractario, con la recomendación de reducir la dosis a la mitad (1 mg).
26. Utilidad de la linaclotida para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
La linaclotida es una agonista de la guanilato ciclasa C, cuyo estímulo produce un aumento del guanosín monofostafo cíclico (GMPc) intracelular en el enterocito. Este GMPc actúa a nivel intracelular produciendo un aumento de la secreción de bicarbonato y cloro hacia la luz intestinal y se difunde al espacio extracelular ejerciendo una acción sobre las terminaciones sensitivas, disminuyendo su actividad. Desde el punto de vista farmacodinámico, el efecto final es un aumento de la secreción intraluminal con la consiguiente aceleración del tránsito y un efecto analgésico visceral, con disminución de umbrales sensitivos a la distensión mecánica (120,121).
Eficacia
Tomando como base los ensayos clínicos y metaanálisis comparativos de linaclotida frente a placebo (122,123) tanto en pacientes con SSI-E (RR 1,95 con IC 95%: 1,3-2,9, basado en 7 estudios) como en pacientes con EF (RR 4,26 con IC 95%: 2,80-6,47, basado en 3 estudios), linaclotida es claramente eficaz para aliviar los síntomas de estreñimiento con NNT 7 (IC 95%: 5-11) (122) en ambos grupos de pacientes, mostrando unos resultados muy homogéneos a lo largo de todos los estudios. Los efectos de la linaclotida no se limitan sólo a su acción sobre los síntomas de estreñimiento sino que en ambos grupos (EF, SII-E) se muestra una mejoría del dolor y la distensión en los ensayos clínicos (un beneficio de un 15-30% sobre el placebo).
Efectos adversos
Desde el punto de vista práctico, el único efecto adverso registrado relevante es la diarrea, cuya importancia ha de ser evaluada con el paciente. De hecho, en los ensayos clínicos se reporta diarrea en aproximadamente un 20% de los pacientes tratados con linaclotida, pero sólo un 2% es catalogada como grave y sólo motivó la retirada del fármaco en el 4,5% de los pacientes tratados.
Limitaciones
La linaclotida no se absorbe y no pasa a la circulación sistémica, ni actúa sobre el citocromo P450; por ello, aunque no se ha estudiado específicamente en pacientes con insuficiencia hepática o renal, no cabe pensar que exista ninguna limitación para su uso en este tipo de pacientes. Su eficacia y seguridad son similares tanto en el anciano como en el adulto de mediana edad. No existen datos respecto a la posibilidad de efectos teratogénicos, aunque son improbables, y por ello no se aconseja su utilización en el embarazo. El fármaco está comercializado en España para la indicación de SII-E, no para el EF. En otros países europeos o en Estados Unidos, donde se indica en EF, se utiliza a mitad de dosis.
Recomendaciones prácticas
La linaclotida es el fármaco de elección en pacientes con estreñimiento y molestias abdominales, como dolor y distensión, cuando la fibra dietética y los laxantes han fracasado (122,123).
27. Utilidad de la lubiprostona para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
La lubiprostona es un derivado prostaglandínico que activa los canales del cloro tipo 2 (CIC-2) de la membrana luminal del enterocito, produciendo un aumento de la secreción de cloro hacia la luz intestinal, lo que conlleva un aumento del tránsito intestinal. No se han demostrado efectos sobre la sensibilidad visceral.
Eficacia
La lubiprostona ha mostrado su eficacia para mejorar los síntomas de estreñimiento NNT 4 (IC 95%: 3-7) (124). En ensayos clínicos en pacientes con síndrome de intestino irritable ha mostrado un cierto efecto sobre el dolor (aproximadamente un 7% de ventaja sobre el placebo) que aparece al mes de tratamiento (124,125).
Efectos adversos
Los principales efectos adversos son la diarrea y las náuseas, ocurriendo estas últimas hasta en un 15% de los pacientes que reciben tratamiento activo. Aunque raro, se ha descrito disnea en relación con lubiprostona.
La lubiprostona no requiere ajuste en pacientes con insuficiencia renal; aunque no existe evidencia de metabolización hepática, la FDA recomienda reducir la dosis en pacientes con hepatopatía con un grado B o C de Child-Pugh. Está contraindicado su uso durante el embarazo, encontrándose clasificada en la categoría C.
Recomendaciones prácticas
La lubiprostona no se encuentra comercializada en Europa.
28. Utilidad del biofeedback anorrectal para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión
Mecanismo de acción
El BFB anorrectal es una técnica de reeducación indicada en pacientes con disinergia defecatoria en la que se monitoriza la actividad fisiológica anal y rectal y se muestran las alteraciones al paciente enseñando las maniobras adecuadas para corregirlas.
Eficacia
Los estudios comparando el BFB con el BFB ficticio, tratamiento estándar, laxantes o diazepam (44,126) muestran una superioridad del BFB sobre todos ellos, de una magnitud variable, para mejorar los síntomas de estreñimiento. Tan sólo un estudio evalúa su efecto sobre el dolor abdominal, observando un beneficio significativo comparado con laxantes. Ningún estudio evalúa su efecto sobre la distensión abdominal
Efectos adversos
No se han descrito. No existen a priori limitaciones para la aplicación del BFB por las características del paciente, aunque se requiere una adecuada disponibilidad y capacidad para seguir las instrucciones y completar la reeducación.
Recomendación práctica
El BFB es la técnica de elección en pacientes con estreñimiento y disinergia pélvica demostrada (127).
29. Utilidad de los antidepresivos para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Las vías por las que estos fármacos ejercen sus efectos beneficiosos, varían dependiendo de qué familia de fármacos utilicemos.
Los antidepresivos tricíclicos (ADT) (amitriptilina) logran sus efectos mediante la capacidad de modulación de la percepción del dolor a nivel central (128).
Los inhibidores de la recaptación de la serotonina (ISRS) (fluoxetina, paroxetina, citalopram, escitalopram) disminuyen la sensibilidad visceral, mejoran la sensación de bienestar global, poseen propiedades ansiolíticas y potencian los efectos de otros fármacos como los ADT (128,129).
Los inhibidores de la recaptación de la serotonina y noradrenalina (ISRSN) (duloxetina, venlafaxina, desvenlafaxina) mejoran el control del dolor mediante el bloqueo dual de los receptores de serotonina y noradrenalina (130).
Eficacia
Sobre la eficacia de los ADT y los ISRS, hay resultados dispares dependiendo del fármaco estudiado. En un metaanálisis (128), el uso de ADT o ISRS mejoró de forma global los síntomas de distensión, dolor abdominal y también la consistencia de las heces en pacientes con SII con una NNT de 4 para ambas terapias (IC 95%: 3-6; 4 para ADT con IC 95%: 3-8, y 3,5 para ISRS con IC 95%: 2-14). Sin embargo, en el SII-E no deben utilizarse los ADT por aumentar el estreñimiento.
Por otra parte, en otro estudio (129) en el que se analizó la terapia durante 16 semanas con fluoxetina (ISRS), se concluye que la fluoxetina, a dosis inferiores a las que se utilizan en el tratamiento para las distintas psicopatologías, mejoró de forma global todos los síntomas asociados de SII-E (dolor, distensión abdominal y consistencia de las heces). El análisis con paroxetina frente a placebo, doble ciego y randomizado, no encontró diferencias significativas en la variable principal (dolor abdominal), pero sí en las de memoria global y severidad de los síntomas (131). También hay estudios a favor del citalopram en este aspecto (130).
Respecto de los ISRSN, sólo duloxetina a dosis de 60 mg/día ha sido estudiada en pacientes con SII (132), mejorando los síntomas de dolor y consistencia de las deposiciones.
Limitaciones. Efectos adversos (133)
- ADT: son los que tienen un mayor número de efectos secundarios derivados de los múltiples mecanismos de acción (sequedad de boca, estreñimiento, náuseas, vómitos, hipotensión ortostática, etc.). Debido a que favorecen marcadamente el estreñimiento no deben utilizarse en SII-E (ni, obviamente, en EF). Precaución en enfermos cardiacos, neurológicos, urológicos e insuficiencia hepática entre otros.
- ISRS: mejor tolerados que los ADT. Los efectos secundarios suelen ser leves pero molestos y en ocasiones obligan a la retirada del fármaco. Entre ellos están la sequedad oral y el adormecimiento, disminución de la libido, anorgasmia, alteraciones gastrointestinales (sensación nauseosa, diarreas o estreñimiento) y ganancia ponderal.
- ISRSN: también mejor tolerados que los ADT. Pueden provocar náuseas, somnolencia, mareos, diarrea, fatiga, estreñimiento, hiperhidrosis, boca seca, vómitos, disminución del apetito, astenia y anorexia.
Recomendaciones prácticas
El uso de antidepresivos, a dosis inferiores a las usadas para las alteraciones psiquiátricas, puede estar indicado en el tratamiento de los síntomas persistentes de distensión y dolor abdominal y mejora de la consistencia de las heces en el SII-E. Los antidepresivos recomendados en el SII-E son los ISRS, evitando los ADT. Debería reservarse su uso a pacientes con persistencia de estos síntomas tras otros tratamientos (medidas higiénico-dietéticas, laxantes y linaclotida), así como a aquellos con una psicopatología asociada que indique su uso. Cuando clínicamente sean eficaces, se recomienda prolongar el tratamiento al menos 6 meses.
No hay datos suficientes actualmente para hacer esta recomendación en los casos de EF, salvo en la existencia de comorbilidad psiquiátrica que tenga indicado su uso.
30. Utilidad de los tratamientos psicológicos en pacientes con SII para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Diversos estudios han señalado la asociación entre el estrés psicológico y el empeoramiento de los síntomas gastrointestinales en pacientes con SII (134-137). No tienen lugar en tratamiento de EF. Los tratamientos psicológicos pueden disminuir el nivel de estrés, modificar el umbral perceptivo visceral y, en consecuencia, conseguir mejorar la clínica de los pacientes (64) en cuanto al dolor y el hábito intestinal.
Eficacia
En una revisión sistemática sobre los tratamientos psicológicos, en la que se incluyó a 2.189 pacientes, se observó un efecto estadísticamente significativo a favor de las terapias psicológicas, con un NNT de 4 (IC 95%: 3-5); no obstante, se evidenció importante heterogeneidad en los estudios y la calidad de los mismos es limitada (90). Por otra parte, por el tipo de intervención no fue posible seleccionar estudios doble ciego. Con respecto a los 10 diferentes tipos de terapias, las que han demostrado beneficio han sido la terapia cognitiva-conductual, la hipnoterapia, el tratamiento psicológico multi-componente presencial y vía telefónica y la psicoterapia dinámica (90).
La hipnosis puede modificar el umbral perceptivo visceral y conseguir una mejoría clínica a corto y largo plazo (138,139).
Efectos secundarios
No se han descrito.
Limitaciones
Este tipo de terapias requiere la colaboración del paciente, así como dedicación y tiempo por parte de este y del terapeuta. Además, son tratamientos caros y poco accesibles.
Recomendaciones prácticas
Algunos tipos de tratamientos psicológicos, como la terapia cognitivo-conductual y la hipnosis, pueden ser útiles para controlar el dolor abdominal, además de disminuir el nivel de estrés en pacientes con SII.
31. Utilidad de la acupuntura en pacientes con SII para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos
Mecanismo de acción
La acupuntura se basa en el efecto de la estimulación de determinadas zonas o "puntos gatillo" repartidas por todo el cuerpo, que tienen relación con las distintas vísceras y otras partes del organismo (articulaciones, paquetes musculoesqueléticos, etc.), a través de la inserción superficial en la piel de finas agujas. A este respecto, determinados puntos de estimulación se relacionan con el dolor abdominal, la diarrea y el estreñimiento, pudiendo actuar sobre estos síntomas tratando de estimular los puntos necesarios mediante esta técnica (140).
Eficacia
En un metaanálisis en el que se incluyeron 17 estudios controlados y randomizados sobre los probables beneficios de la acupuntura en la mejoría de los síntomas globales y la calidad de vida de pacientes con SII no fue posible hallar datos favorables al respecto (141).
Otro estudio, que evaluó el tratamiento con acupuntura y sus efectos a nivel de mejora global de síntomas como variable principal y como variables secundarias la mejora en la calidad de vida y en los diversos síntomas por separado, tampoco encontró diferencias a favor de dicha terapia (142).
Respecto del probable efecto sobre los síntomas en EF no hay, hoy por hoy, estudios al respecto.
Limitaciones
No se han descrito limitaciones en este tipo de terapia.
Recomendaciones prácticas
No hay evidencia disponible que permita recomendar la acupuntura para mejorar los síntomas y la calidad de vida de los pacientes con SII-E o EF.
32. Utilidad de los supositorios y los enemas como medicación de rescate para mejorar el estreñimiento. Efectos adversos y precauciones en situaciones especiales
Los enemas y supositorios son esenciales en el tratamiento del estreñimiento complicado con impactación fecal, en algunos casos de defecación obstructiva y como complemento de otras medidas terapéuticas en casos de estreñimiento grave con importante alteración del tránsito intestinal para conseguir la limpieza del colon distal.
Mecanismo de acción
Existen diferentes tipos de enemas y supositorios. Todos ellos producen distensión rectal, favoreciendo la defecación. Dependiendo del tipo de enema, pueden existir mecanismos de acción adicionales, por ejemplo, los enemas salinos hacen que el agua drene hacia el colon, los de fosfato estimulan la motilidad colónica y los de aceite mineral o emolientes lubrican y ablandan las heces duras. Como ocurre con los enemas, el mecanismo de acción varía dependiendo del tipo de supositorios. Existen supositorios con efecto estimulante, como los que contienen bisacodilo. Otros, como los supositorios de glicerina, tienen acción local. El efecto mecánico para la inserción del supositorio puede por sí mismo estimular la defecación.
Eficacia
La evidencia científica respecto al tipo de enema que se debe utilizar es escasa, aunque la utilización de agua templada, suero salino (fisioenema) o algún tipo de sustancia osmótica suele ser lo más frecuente (143).
En el caso de pacientes con disfunción neurogénica intestinal secundaria a lesión medular, se ha utilizado con éxito el sistema de irrigación anal con Peristeen®, mediante el cual se introducen unos 750 ml de agua templada en el colon. En un estudio aleatorizado se consiguió reducir el número de procedimientos necesarios para conseguir la limpieza intestinal, además de mejorar la incontinencia y la calidad de vida de los pacientes con respecto al tratamiento conservador (144). Estos alentadores resultados se han confirmado posteriormente en un estudio multicéntrico italiano, que concluye que se puede considerar el tratamiento de elección en este tipo de pacientes (145). Además, esta terapia es coste-efectiva con respecto al tratamiento con servador (145,146).
Otros enemas frecuentemente utilizados son los de fosfato de sodio de 250 ml, que tienen un efecto osmótico, y también los enemas de suero salino (fisioenema), que no tienen efectos secundarios ni requieren receta médica, como sí ocurre con los enemas de fostatos, cuyos efectos secundarios se señalan en el siguiente apartado.
En el caso de los supositorios, como se ha señalado anteriormente, hay que diferenciar los que actúan localmente, de forma tópica, para favorecer el vaciado de la ampolla rectal, de los supositorios activos, como por ejemplo los de bisacodilo, que se tratan en el apartado de los laxantes estimulantes.
Efectos secundarios
No se han descrito efectos secundarios importantes de la irrigación de agua con el sistema Peristeen®.
En el caso de los enemas de fosfato, su utilización prolongada puede ocasionar desequilibrios hidroelectrolíticos, como hiperfosfatemia, hipocalcemia e hipernatremia. Por ello, se deben utilizar con precaución en caso de alteraciones electrolíticas previas, como en la insuficiencia renal grave, en pacientes ancianos, en caso de hipertensión no controlada y en la insuficiencia cardiaca. El abuso en la aplicación de enemas también puede provocar fibrosis y estenosis anorrectal por microtrauma de repetición (147).
Los efectos adversos más frecuentes de los supositorios son irritación, escozor o picor anal. Debido al tipo de medicamento de que se trata y a su vía de administración, no afecta al uso concomitante de otros fármacos.
Limitaciones
En algunos casos, la correcta aplicación de los supositorios o enemas puede ser difícil en pacientes con problemas de movilidad, como ocurre en los casos de lesión medular. Sin embargo, esta dificultad parece ser menor con la utilización del sistema Peristeen®.
Recomendaciones prácticas
Los enemas son útiles en el caso de estreñimiento complicado con impactación fecal y como medida de rescate asociada a otros tratamientos en casos de estreñimiento grave, aunque no hay evidencia científica al respecto. Sí que hay evidencia de la utilidad de la irrigación transanal de agua con el sistema Peristeen® en pacientes con lesión medular y probablemente pueda tener cierta eficacia en otros casos de estreñimiento grave.
33. Utilidad de la neuroestimulacón de raíces sacras para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
Consiste en la estimulación de las raíces sacras S3-S4 mediante electrodos implantados, inicialmente de forma temporal durante unas 4 semanas y posteriormente, si se muestra eficaz, implantados de forma permanente. El mecanismo de acción no está claro pero parece mejorar la sensibilidad rectal y la contractilidad colónica, mejorando el TTC.
Eficacia
Los estudios publicados respecto a la eficacia de la neuroestimulación de raíces sacras se centran en pacientes con estreñimiento por tránsito lento refractarios a todo tipo de tratamiento y se carece de estudios controlados, evaluándose la eficacia mediante diseños cruzados. Un metaanálisis de la Cochrane Database of Systematic Reviews de 2007 señala un aumento del número de deposiciones de 2 a 5 semanales y una mejoría del dolor y la distensión abdominal (47). El estudio más relevante es un estudio multicéntrico europeo con 62 pacientes; se implanta el dispositivo de forma permanente al 73%, obteniéndose una mejoría sostenida en un seguimiento a 28 meses de los síntomas de estreñimiento, dolor y distensión abdominal. No obstante, persisten las dudas respecto al beneficio a más largo plazo (148).
Efectos adversos
El procedimiento no está exento de efectos adversos. En el estudio multicéntrico (148) se registran 11 efectos adversos graves relacionados con el tratamiento, fundamentalmente por infección, dolor postimplantación, erosión mecánica de tejidos y migración del electrodo.
Entre las precauciones especiales cabe señalar la recomendación de detener la estimulación si ocurre un embarazo. No existe información respecto a su seguridad en pacientes con comorbilidades importantes.
Recomendación práctica
La utilidad de la neuroestimulación de raíces sacras es discutida, por lo que debería considerarse una opción únicamente en pacientes con EF intratable por TCL, en los que se ha descartado una disinergia defecatoria.
34. Utilidad de la cirugía para mejorar: a) el estreñimiento; b) el dolor abdominal; y c) la distensión. Efectos adversos y precauciones en situaciones especiales
Mecanismo de acción
La cirugía se ha propuesto para el tratamiento del estreñimiento con TCL grave mediante técnicas resectivas (colectomía), siendo el mecanismo de acción una disminución de la capacidad reabsortiva del agua del material fecal.
Eficacia
No existen estudios controlados de cirugía en el EF y la eficacia debe extrapolarse de la revisión de series de casos (48). En este análisis de 2011, de 48 estudios con 1.443 pacientes el 65% mejoró la frecuencia defecatoria y un 88% no requirió laxantes posteriormente. Su eficacia sobre la distensión abdominal y el dolor no es conocida.
Efectos adversos
De acuerdo con la revisión de series de casos (48), la mortalidad se sitúa en el 0,2%. Además de las complicaciones inmediatas (íleo: 0-16%; infección: 0-13%; dehiscencia de anastomosis: 0-22%), se deben considerar importantes complicaciones tardías (obstrucción: 0-74%; incontinencia: 0-53%).
Recomendación práctica
La cirugía debe reservarse para casos excepcionales de estreñimiento en los que se ha demostrado un TCL descartando pseudobstrucción intestinal y disinergia defecatoria y tras una evaluación psicológica adecuada. Estos pacientes deben ser atendidos en centros especializados.
Coordinación entre niveles asistenciales
35. ¿Cuándo se debe derivar a un paciente con síndrome del intestino irritable con estreñimiento o con estreñimiento funcional a una consulta especializada? Diagnóstico y coordinación entre niveles asistenciales
El diagnóstico del SII-E o del EF queda bien establecido en los criterios propuestos por el panel de expertos de Roma (Algoritmos 1-3, Tablas I y II). Sin embargo, el profesional de AP siempre ha de tener presentes diferentes situaciones en las que ha de valorar la derivación a la atención especializada fundamentalmente para descartar organicidad pero también, en algunas ocasiones, para optimizar el seguimiento y el tratamiento de estos pacientes en el marco de una atención integrada y compartida (Algoritmos 4 y 5, Tablas VIII y IX). Para ello, resulta imprescindible una anamnesis adecuada, incluyendo antecedentes familiares y personales, investigar la presencia de síntomas y signos de alarma y una exploración física minuciosa.
Diferentes documentos de consenso y GPC establecen distintos motivos que obligan a descartar patología orgánica, aunque la precisión diagnóstica de alguno de ellos es controvertida (Tabla VI).
También pueden ser motivo de derivación a una consulta especializada la presencia de síntomas persistentes o con mala respuesta al tratamiento, un deterioro importante de la calidad de vida, la no accesibilidad a pruebas diagnósticas o dudas en el diagnóstico (33,37,38,90,149-154).
¿Cuándo se debe derivar a un paciente con SII-E o con EF, con diagnóstico de certeza, a una consulta de gastroenterología o de otras especialidades?
En la actualidad, pueden existir vías de actuación diferentes en cada departamento o área asistencial, en función de la existencia o no de protocolos de actuación. Lo ideal es crear unos sistemas de actuación por procedimientos según los cuales el médico de AP tenga acceso directo al especialista de digestivo con el fin de consultar cambios en el tratamiento o derivar al paciente para la realización de estudios complementarios o tratamientos específicos únicamente accesibles a asistencia especializada.
En este sentido, sería razonable la derivación del paciente en los siguientes supuestos (ver también Tabla X):
1. No respondedores o intolerantes a tratamiento con medidas básicas higiénico-dietéticas, cambios de estilo de vida y laxantes habituales, incluyendo tratamiento de rescate con laxantes estimulantes (bisacodilo y picosulfato sódico).
En el supuesto de que existan vías de acceso no presenciales, la prescripción de fármacos agonistas de la serotonina o secretagogos puede realizarse por el médico de Atención Primaria consensuando con el especialista el seguimiento. En los pacientes con SII-E se incluirán los no respondedores a tratamiento con espasmolíticos o con antidepresivos.
2. Pacientes con una exploración ano-rectal en los que se sospeche la existencia de una disfunción de la defecación.
3. Pacientes que con un control satisfactorio de los síntomas experimenten un empeoramiento no justificable. En estos casos la derivación puede ser bien al especialista de digestivo o en función de síntomas o signos asociados a consultas específicas (endocrino, ginecología, cirugía, psiquiatría, etc.).
4. Pacientes cuyas características psicológicas, actitud frente a los síntomas o cuestionamiento en la búsqueda constante de la organicidad de sus molestias requieran el refuerzo de la opinión de un especialista.
Conflicto de Intereses
Los autores firmantes de esta Guía de Práctica Clínica (GPC) lo hacen en nombre de la Sociedad Española de Patología Digestiva (SEPD), la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), la Sociedad Española de Médicos Generales y de Familia (SEMG) o como socios de la Asociación Española de Gastroenterología (AEG). Ni estas sociedades científicas ni ninguno de los integrantes del grupo de trabajo tienen vinculación alguna con las compañías que desarrollan los fármacos para las patologías abordadas en esta GPC. La SEPD, la semFYC, la SEMERGEN y la SEMG, así como los componentes del grupo pertenecientes a las mismas, no tienen intereses económicos en las compañías que han realizado la investigación y distribuyen medicamentos para estas patologías del aparato digestivo, si bien mantienen, tanto sociedades como integrantes del grupo, una sostenida relación con las mismas en la promoción de formación, investigación y mejora de la práctica clínica hacia la promoción de la salud digestiva. Finalmente, la SEPD, la semFYC, la SEMERGEN y la SEMG, así como los autores firmantes, declaran que este trabajo ha recibido financiación de Almirall y Allergan, que ha carecido de cualquier tipo de influencia externa en el mismo y que ninguna tercera parte ha participado en la deliberación ni desarrollo del mismo ni ha conocido el contenido del texto final antes de su publicación efectiva en la Revista Española de Enfermedades Digestivas y resto de órganos de expresión de cada sociedad participante.
Agradecimientos
Los autores agradecen la colaboración de los responsables de las cuatro sociedades científicas de las que forman parte, así como el trabajo de apoyo de Marién Castillo Sánchez, de Joaquín León Molina en la gestión bibliográfica y de José María Tenías en el soporte metodológico. También agradecen especialmente las sugerencias y comentarios de los siguientes revisores externos: Agustín Balboa Rodríguez, R. Manuel Devesa Muñiz, Higinio Flores Tirado, Juan Manuel Mendive Arbeloa, Xavier Puigdengolas Armengol, Mercedes Ricote Belinchón, Cecilio Santander Vaquero, Jordi Serra Pueyo, Carlos A. Siljeström Laredo y María José Soria de la Cruz.
Nota metodológica: Esta GPC ha sido desarrollada entre enero de 2015 y diciembre de 2015 por un Grupo de Trabajo formado por expertos seleccionados por la SEPD, la semFYC, la SEMERGEN y la SEMG. Entre diciembre de 2015 y abril de 2016 ha sido sometida a revisión, con la última adaptación a Roma IV en mayo de 2016.
Más información sobre el proceso metodológico de trabajo mediante el cual se ha elaborado esta GPC en: http://www.sepd.es/file/GPC_SII_E_EF_Metodologia.pdf
Adicionalmente a esta versión íntegra, esta GPC se publica, de manera coordinada, dividida en dos partes, en los órganos de expresión respectivos de semFYC, SEMERGEN y SEMG (en prensa).
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Júdez.
Director. Departamento de Gestión del Conocimiento.
Sociedad Española de Patología Digestiva.
C/ Sancho Dávila, 6. 28028 Madrid
e-mail: jjudez@sepd.es
Recibido: 18-04-2016
Aceptado: 19-04-2016
Bibliografía
1. Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006;130(5):1480-91. PMID: 16678561. DOI: 10.1053/j.gastro.2005.11.061. [ Links ]
2. Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016;150:1393-407. [ Links ]
3. Rey E, Balboa A, Mearin F. Chronic constipation, irritable bowel syndrome with constipation and constipation with pain/discomfort: Similarities and differences. American Journal of Gastroenterology 2014;109(6):876-84. PMID: 24589666. DOI: 10.1038/ajg.2014.18. [ Links ]
4. Wong RK, Palsson OS, Turner MJ, et al. Inability of the Rome III criteria to distinguish functional constipation from constipation-subtype irritable bowel syndrome. American Journal of Gastroenterology 2010;105(10):2228-34. PMID: 20502449. DOI: 10.1038/ajg.2010.200. [ Links ]
5. Bharucha AE, Locke GR, Zinsmeister AR, et al. Differences between painless and painful constipation among community women. American Journal of Gastroenterology 2006;101(3):604-12. PMID: 16464225. DOI: 10.1111/j.1572-0241.2006.00435.x. [ Links ]
6. Kamm MA, Muller-Lissner S, Talley NJ, et al. Tegaserod for the treatment of chronic constipation: A randomized, double-blind, placebo-controlled multinational study. American Journal of Gastroenterology 2005;100(2):362-72. PMID: 15667494. DOI: 10.1111/j.1572-0241.2005.40749.x. [ Links ]
7. Novick J, Miner P, Krause R, et al. A randomized, double-blind, placebo-controlled trial of tegaserod in female patients suffering from irritable bowel syndrome with constipation. Alimentary Pharmacology & Therapeutics 2002;16(11):1877-88. PMID: 12390096. DOI: 10.1046/j.1365-2036.2002.01372.x. [ Links ]
8. Johanson JF, Morton D, Geenen J, et al. Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of lubiprostone, a locally-acting type-2 chloride channel activator, in patients with chronic constipation. American Journal of Gastroenterology 2008;103(1):170-7. PMID: 17916109. DOI: 10.1111/j.1572-0241.2007.01524.x. [ Links ]
9. Drossman DA, Chey WD, Johanson JF, et al. Clinical trial: Lubiprostone in patients with constipation-associated irritable bowel syndrome - Results of two randomized, placebo-controlled studies. Alimentary Pharmacology & Therapeutics 2009;29(3):329-41. PMID: 19006537. DOI: 10.1111/j.1365-2036.2008.03881.x. [ Links ]
10. Lembo AJ, Schneier HA, Shiff SJ, et al. Two randomized trials of linaclotide for chronic constipation. New England Journal of Medicine 2011;365(6):527-36. PMID: 21830967. DOI: 10.1056/NEJ-Moa1010863. [ Links ]
11. Johnston JM, Kurtz CB, MacDougall JE, et al. Linaclotide improves abdominal pain and bowel habits in a phase IIb study of patients with irritable bowel syndrome with constipation. Gastroenterology 2010;139(6):1877-U139. PMID: 20801122. DOI: 10.1053/j.gastro.2010.08.041. [ Links ]
12. Vandvik PO, Wilhelmsen I, Ihlebaek C, et al. Comorbidity of irritable bowel syndrome in general practice: A striking feature with clinical implications. Alimentary Pharmacology & Therapeutics 2004;20(10):1195-203. PMID: 15569123. DOI: 10.1111/j.1365-2036.2004.02250.x. [ Links ]
13. Whitehead WE, Palsson OS, Levy RR, et al. Comorbidity in irritable bowel syndrome. American Journal of Gastroenterology 2007;102(12):2767-76. PMID: 17900326. DOI: 10.1111/j.1572-0241.2007.01540.x. [ Links ]
14. Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scandinavian Journal of Gastroenterology 1997;32(9):920-4. PMID: 9299672. DOI: 10.3109/00365529709011203. [ Links ]
15. Bharucha AE, Wald AM. Anorectal disorders. American Journal of Gastroenterology 2010;105(4):786-94. PMID: 20372131. DOI: 10.1038/ajg.2010.70. [ Links ]
16. Johanson JF, Kralstein J. Chronic constipation: A survey of the patient perspective. Alimentary Pharmacology & Therapeutics 2007;25(5):599-608. PMID: 17305761. DOI: 10.1111/j.1365-2036.2006.03238.x. [ Links ]
17. Posserud I, Syrous A, Lindstrom L, et al. Altered rectal perception in irritable bowel syndrome is associated with symptom severity. Gastroenterology 2007;133(4):1113-23. PMID: 17919487. DOI: 10.1053/j.gastro.2007.07.024. [ Links ]
18. Ng C, Danta M, Kellow J, et al. Attenuation of the colorectal tonic reflex in female patients with irritable bowel syndrome. American Journal of Physiology-Gastrointestinal and Liver Physiology 2005;289(3):G489-G94. PMID: 15905412. DOI: 10.1152/ajpgi.00527.2004. [ Links ]
19. Burgell RE, Scott SM. Rectal hyposensitivity. Journal of Neurogastroenterology and Motility 2012;18(4):373-84. PMID: 23105997. DOI: 10.5056/jnm.2012.18.4.373. [ Links ]
20. El-Serag HB, Olden K, Bjorkman D. Health-related quality of life among persons with irritable bowel syndrome: A systematic review. Alimentary Pharmacology & Therapeutics 2002;16(6):1171-85. PMID: 12030961. DOI: 10.1046/j.1365-2036.2002.01290.x. [ Links ]
21. Mearin F, Perello A, Perona M. Quality of life in patients with irritable bowel syndrome. Gastroenterología y Hepatología 2004;27(Suppl. 3):24-31. DOI: 10.1157/13058927. [ Links ]
22. Everhart JE, Ruhl CE. Burden of digestive diseases in the United States Part II: Lower gastrointestinal diseases. Gastroenterology 2009;136(3):741-54. PMID: 19166855. DOI: 10.1053/j.gastro.2009.01.015. [ Links ]
23. Tack J, Stanghellini V, Mearin F, et al. Economic burden of moderate to severe irritable bowel syndrome with constipation in six European countries: A 12-month observational study. En prensa 2016. [ Links ]
24. Sun SX, DiBonaventura M, Purayidathil FW, et al. Impact of chronic constipation on health-related quality of life, work productivity, and healthcare resource use: An analysis of the National Health and Wellness Survey. Digestive Diseases and Sciences 2011;56(9):2688-95. PMID: 21380761. DOI: 10.1007/s10620-011-1639-5. [ Links ]
25. Dennison C, Prasad M, Lloyd A, et al. The health-related quality of life and economic burden of constipation. Pharmacoeconomics 2005;23(5):461-76. PMID: 15896098. DOI: 10.2165/00019053-200523050-00006. [ Links ]
26. Belsey J, Greenfield S, Candy D, et al. M. Systematic review: Impact of constipation on quality of life in adults and children. Alimentary Pharmacology & Therapeutics 2010;31(9):938-49. PMID: 20180788. DOI: 10.1111/j.1365-2036.2010.04273.x. [ Links ]
27. Drossman DA, Chang L, Bellamy N, et al. Severity in irritable bowel syndrome: A Rome Foundation working team report. American Journal of Gastroenterology 2011;106(10):1749-59. PMID: 21747417. DOI: 10.1038/ajg.2011.201. [ Links ]
28. Mearin F, Lacy BE. Diagnostic criteria in IBS: Useful or not? Neurogastroenterology and Motility 2012;24(9):791-801. PMID: 22908861. DOI: 10.1111/j.1365-2982.2012.01992.x. [ Links ]
29. Francis CY, Morris J, Whorwell PJ. The irritable bowel severity scoring system: A simple method of monitoring irritable bowel syndrome and its progress. Alimentary Pharmacology & Therapeutics 1997;11(2):395-402. PMID: 9146781. DOI: 10.1046/j.1365-2036.1997.142318000.x. [ Links ]
30. Almansa C, García R, Barceló M, et al. Translation, cultural adaptation and validation of a Spanish version of the Irritable Bowel Syndrome Severity Score. Revista Española De Enfermedades Digestivas 2011;103(12):612-8. PMID: 22217344. DOI: 10.4321/S1130-01082011001200002. [ Links ]
31. Brandt LJ, Schoenfeld P, Prather CM, et al. Evidence-based position statement on the management of chronic constipation in North America. American Journal of Gastroenterology 2005;100(1). DOI: 10.1111/j.1572-0241.2005.50613_2.x. [ Links ]
32. Bharucha AE, Wald A, Enck P, et al. Functional anorectal disorders. Gastroenterology 2006;130(5):1510-8. PMID: 16678564. DOI: 10.1053/j.gastro.2005.11.064. [ Links ]
33. Bharucha AE, Dorn SD, Lembo A, el al. American Gastroenterological A. American Gastroenterological Association medical position statement on constipation. Gastroenterology 2013;144(1):211-7. PMID: 23261064. DOI: 10.1053/j.gastro.2012.10.029. [ Links ]
34. Wald A, Bharucha AE, Cosman BC, et al. ACG Clinical Guideline: Management of benign anorectal disorders. American Journal of Gastroenterology 2014;109(8):1141-57. PMID: 25022811. DOI: 10.1038/ajg.2014.190. [ Links ]
35. Rao SSC, Meduri K. What is necessary to diagnose constipation? Best Practice & Research in Clinical Gastroenterology 2011;25(1):127-40. PMID: 21382584. DOI: 10.1016/j.bpg.2010.11.001. [ Links ]
36. Videlock EJ, Lembo A, Cremonini F. Diagnostic testing for dyssynergic defecation in chronic constipation: Meta-analysis. Neurogastroenterology and Motility 2013;25(6). PMID: 23644388. DOI: 10.1111/nmo.12096. [ Links ]
37. Mínguez M, Herreros B, Sanchiz V, et al. Predictive value of the balloon expulsion test for excluding the diagnosis of pelvic floor dyssynergia in constipation. Gastroenterology 2004;126(1):57-62. PMID: 14699488. DOI: 10.1053/j.gastro.2003.10.044. [ Links ]
38. Tack J, Mueller-Lissner S, Stanghellini V, et al. Diagnosis and treatment of chronic constipation - An European perspective. Neurogastroenterology and Motility 2011;23(8):697-710. PMID: 21605282. DOI: 10.1111/j.1365-2982.2011.01709.x. [ Links ]
39. Spanish Group for the Study of Digestive Motility. Measurement of colonic transit time (total and segmental) with radiopaque markers. National reference values obtained in 192 healthy subjects. Gastroenterología y hepatología 1998;21(2):71-5. PMID: 9549181. [ Links ]
40. Bonapace ES, Maurer AH, Davidoff S, et al. Whole gut transit scintigraphy in the clinical evaluation of patients with upper and lower gastrointestinal symptoms. American Journal of Gastroenterology 2000;95(10):2838-47. PMID: 11051357. DOI: 10.1111/j.1572-0241.2000.03195.x. [ Links ]
41. Burton DD, Camilleri M, Mullan BP, et al. Colonic transit scintigraphy labeled activated charcoal compared with ion exchange pellets. Journal of Nuclear Medicine 1997;38(11):1807-10. PMID: 9374360. [ Links ]
42. Camilleri M, Thorne NK, Ringel Y, et al. Wireless pH-motility capsule for colonic transit: Prospective comparison with radiopaque markers in chronic constipation. Neurogastroenterology and Motility 2010;22(8):874-E233. PMID: 20465593. DOI: 10.1111/j.1365-2982.2010.01517.x [ Links ]
43. Chiarioni G, Salandini L, Whitehead WE. Biofeedback benefits only patients with outlet dysfunction, not patients with isolated slow transit constipation. Gastroenterology 2005;129(1):86-97. PMID: 16012938. DOI: 10.1053/j.gastro.2005.05.015. [ Links ]
44. Chiarioni G, Whitehead WE, Pezza V, et al. Biofeedback is superior to laxatives for normal transit constipation due to pelvic floor dyssynergia. Gastroenterology 2006;130(3):657-64. PMID: 16530506. DOI: 10.1053/j.gastro.2005.11.014. [ Links ]
45. Rao SSC, Seaton K, Miller M, et al. Randomized controlled trial of biofeedback, sham feedback, and standard therapy for dyssynergic defecation. Clinical Gastroenterology and Hepatology 2007;5(3):331-8. PMID: 17368232. DOI: 10.1016/j.cgh.2006.12.023. [ Links ]
46. Heymen S, Scarlett Y, Jones K, et al. Randomized, controlled trial shows biofeedback to be superior to alternative treatments for patients with pelvic floor dyssynergia-type constipation. Diseases of the Colon & Rectum 2007;50(4):428-41. PMID: 17294322. DOI: 10.1007/s10350-006-0814-9. [ Links ]
47. Kamm MA, Dudding TC, Melenhorst J, et al. Sacral nerve stimulation for intractable constipation. Gut 2010;59(3):333-40. PMID: 20207638. DOI: 10.1136/gut.2009.187989. [ Links ]
48. Arebi N, Kalli T, Howson W, et al. Systematic review of abdominal surgery for chronic idiopathic constipation. Colorectal Disease 2011;13(12):1335-43. PMID: 20969711. DOI: 10.1111/j.1463-1318.2010.02465.x. [ Links ]
49. Bove A, Bellini M, Battaglia E, et al. Consensus statement AIGO/SICCR diagnosis and treatment of chronic constipation and obstructed defecation (Part II: Treatment). World Journal of Gastroenterology 2012;18(36):4994-5013. PMID: 23049207. DOI: 10.3748/wjg.v18.i36.4994. [ Links ]
50. Muller-Lissner SA, Kamm MA, Scarpignato C, et al. Myths and misconceptions about chronic constipation. American Journal of Gastroenterology 2005;100(1):232-42. PMID: 15654804. DOI: 10.1111/j.1572-0241.2005.40885.x. [ Links ]
51. Moylan S, Armstrong J, Díaz-Saldano D, et al. Are abdominal x-rays a reliable way to assess for constipation? Journal of Urology 2010;184(4):1692-7. PMID: 20728159. DOI: 10.1016/j.juro.2010.05.054. [ Links ]
52. Pensabene L, Buonomo C, Fishman L, et al. Lack of utility of abdominal x-rays in the evaluation of children with constipation: Comparison of different scoring methods. Journal of Pediatric Gastroenterology and Nutrition 2010;51(2):155-9. PMID: 20453675. DOI: 10.1097/MPG.0b013e3181cb4309. [ Links ]
53. Patriquin H, Martelli H, Devroede G. Barium enema in chronic constipation - Is it meaningful. Gastroenterology 1978;75(4):619-22. PMID: 710831. [ Links ]
54. Pepin C, Ladabaum U. The yield of lower endoscopy in patients with constipation: Survey of a university hospital, a public county hospital, and a Veterans Administration medical center. Gastrointestinal Endoscopy 2002;56(3):325-32. PMID: 12196767. DOI: 10.1067/mge.2002.126882. [ Links ]
55. Gupta M, Holub J, Knigge K, et al. Constipation is not associated with an increased rate of findings on colonoscopy: Results from a national endoscopy consortium. Endoscopy 2010;42(3):208-12. PMID: 20101567. DOI: 10.1055/s-0029-1243843. [ Links ]
56. Mertz H, Naliboff B, Mayer EA. Symptoms and physiology in severe chronic constipation. American Journal of Gastroenterology 1999;94(1):131-8. PMID: 9934743. DOI: 10.1111/j.1572-0241.1999.00783.x. [ Links ]
57. Eltringham MT, Khan U, Bain IM, et al. Functional defecation disorder as a clinical subgroup of chronic constipation: Analysis of symptoms and physiological parameters. Scandinavian Journal of Gastroenterology 2008;43(3):262-9. PMID: 18266173. DOI: 10.1080/00365520701686210. [ Links ]
58. Koch A, Voderholzer WA, Klauser AG, et al. Symptoms in chronic constipation. Diseases of the Colon & Rectum 1997;40(8):902-6. PMID: 9269805. DOI: 10.1007/BF02051196. [ Links ]
59. Orkin BA, Sinykin SB, Lloyd PC. The Digital Rectal Examination Scoring System (DRESS). Diseases of the Colon & Rectum 2010;53(12):1656-60. PMID: 21178861. DOI: 10.1007/DCR.0b013e3181f23c85. [ Links ]
60. Tantiphlachiva K, Rao P, Attaluri A, et al. Digital rectal examination is a useful tool for identifying patients with dyssynergia. Clinical Gastroenterology and Hepatology: The Official Clinical Practice Journal of the American Gastroenterological Association 2010;8(11):955-60. PMID: 20656061. DOI: 10.1016/j.cgh.2010.06.031. [ Links ]
61. Glia A, Lindberg G, Nilsson LH, et al. Clinical value of symptom assessment in patients with constipation. Diseases of the Colon & Rectum 1999;42(11):1401-8. PMID: 10566527. DOI: 10.1007/BF02235036. [ Links ]
62. Saad RJ, Rao SSC, Koch KL, et al. Do stool form and frequency correlate with whole-gut and colonic transit? Results from a multicenter study in constipated individuals and healthy controls. American Journal of Gastroenterology 2010;105(2):403-11. PMID: 19888202. DOI: 10.1038/ajg.2009.612. [ Links ]
63. Lam TJ, Felt-Bersma RJF. Clinical examination remains more important than anorectal function tests to identify treatable conditions in women with constipation. International Urogynecology Journal 2013;24(1):67-72. PMID: 22618205. DOI: 10.1007/s00192-012-1796-x. [ Links ]
64. Saha L. Irritable bowel syndrome: Pathogenesis, diagnosis, treatment, and evidence-based medicine. World Journal of Gastroenterology 2014;20(22):6759-73. PMID: 24944467. DOI: 10.3748/wjg.v20.i22.6759. [ Links ]
65. De Schryver AM, Keulemans YC, Peters HP, et al. Effects of regular physical activity on defecation pattern in middle-aged patients complaining of chronic constipation. Scandinavian Journal of Gastroenterology 2005;40(4):422-9. PMID: 16028436. DOI: 10.1080/00365520510011641. [ Links ]
66. Villoria A, Serra J, Azpiroz F, et al. Physical activity and intestinal gas clearance in patients with bloating. American Journal of Gastroenterology 2006;101(11):2552-7. PMID: 17029608. DOI: 10.1111/j.1572-0241.2006.00873.x. [ Links ]
67. Dainese R, Serra J, Azpiroz F, et al. Effects of physical activity on intestinal gas transit and evacuation in healthy subjects. American Journal of Medicine 2004;116(8):536-9. PMID: 15063815. DOI: 10.1016/j.amjmed.2003.12.018. [ Links ]
68. Johannesson E, Ringstrom G, Abrahamsson H, et al. Intervention to increase physical activity in irritable bowel syndrome shows long-term positive effects. World Journal of Gastroenterology 2015;21(2):600-8. PMID: 25593485. DOI: 10.3748/wjg.v21.i2.600. [ Links ]
69. Johannesson E, Simren M, Strid H, et al. Physical activity improves symptoms in irritable bowel syndrome: A randomized controlled trial. American Journal of Gastroenterology 2011;106(5):915-22. PMID: 21206488. DOI: 10.1038/ajg.2010.480. [ Links ]
70. Ternent CA, Amir LB, Morin NA, et al. Practice parameters for the evaluation and management of constipation. Diseases of the Colon & Rectum 2007;50(12):2013-22. PMID: 17665250. DOI: 10.1007/s10350-007-9000-y. [ Links ]
71. Remes Troche JM, Gómez Escudero O, Icaza Chávez ME, et al. Guidelines for diagnosis and treatment of constipation in Mexico. C) Medical and surgical treatment. Revista de Gastroenterología de México 2011;76(2):141-54. PMID: 21724490. [ Links ]
72. Gallegos-Orozco JF, Foxx-Orenstein AE, Sterler SM, et al. Chronic constipation in the elderly. American Journal of Gastroenterology 2012;107(1):18-25. PMID: 21989145. DOI: 10.1038/ajg.2011.349. [ Links ]
73. Anti M, Pignataro G, Armuzzi A, et al. Water supplementation enhances the effect of high-fiber diet on stool frequency and laxative consumption in adult patients with functional constipation. Hepato-Gastroenterology 1998;45(21):727-32. PMID: 9684123. [ Links ]
74. Lever E, Cole J, Scott SM, et al. Systematic review: The effect of prunes on gastrointestinal function. Alimentary Pharmacology & Therapeutics 2014;40(7):750-8. PMID: 25109788. DOI: 10.1111/apt.12913. [ Links ]
75. Bijkerk CJ, Muris JWM, Knottnerus JA, et al. Systematic review: The role of different types of fibre in the treatment of irritable bowel syndrome. Alimentary Pharmacology & Therapeutics 2004;19(3):245-51. PMID: 14984370. DOI: 10.1111/j.0269-2813.2004.01862.x. [ Links ]
76. Ford AC, Talley NJ, Spiegel BMR, et al. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: Systematic review and meta-analysis. British Medical Journal 2008;337:PMID: 19008265. DOI: 10.1136/bmj.a2313. [ Links ]
77. Carroccio A, Mansueto P, Iacono G, et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: Exploring a new clinical entity. American Journal of Gastroenterology 2012;107(12):1898-906. PMID: 22825366. DOI: 10.1038/ajg.2012.236. [ Links ]
78. Biesiekierski JR, Peters SL, Newnham ED, et al. No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology 2013;145(2):320-+. PMID: 23648697. DOI: 10.1053/j.gastro.2013.04.051. [ Links ]
79. Brandt LJ, Chey WD, Foxx-Orenstein AE, et al. An Evidence-based position statement on the management of irritable bowel syndrome. American Journal of Gastroenterology 2009;104:S1-S36. PMID: 19521341. [ Links ]
80. Staudacher HM, Lomer MCE, Anderson JL, et al. Fermentable carbohydrate restriction reduces luminal bifidobacteria and gastrointestinal symptoms in patients with irritable bowel syndrome. Journal of Nutrition 2012;142(8):1510-8. PMID: 22739368. DOI: 10.3945/jn.112.159285. [ Links ]
81. Boehn L, Stoersrud S, Liljebo TM, et al. A randomized, controlled trial comparing a diet low in FODMAPs with traditional dietary advice in patients with IBS. Gastroenterology 2015;148(4):S654-S. PMID: 26255043. [ Links ]
82. Stephen AM, Cummings JH. Mechanism of action of dietary fiber in the human-colon. Nature 1980;284(5753):283-4. PMID: 7360261. [ Links ]
83. Rao SSC, Yu S, Fedewa A. Systematic review: Dietary fibre and FODMAP-restricted diet in the management of constipation and irritable bowel syndrome. Alimentary Pharmacology & Therapeutics 2015;41(12):1256-70. PMID: 25903636. DOI: 10.1111/apt.13167 [ Links ]
84. Yang J, Wang H-P, Zhou L, et al. Effect of dietary fiber on constipation: A meta analysis. World Journal of Gastroenterology 2012;18(48):7378-83. PMID: 23326148. DOI: 10.3748/wjg.v18.i48.7378. [ Links ]
85. Suares NC, Ford AC. Systematic review: The effects of fibre in the management of chronic idiopathic constipation. Alimentary Pharmacology & Therapeutics 2011;33(8):895-901. PMID: 21332763. DOI: 10.1111/j.1365-2036.2011.04602.x. [ Links ]
86. Francis CY, Whorwell PJ. Bran and irritable-bowel-syndrome - Time for reappraisal. Lancet 1994;344(8914):39-40. PMID: 7912305. [ Links ]
87. Voderholzer WA, Schatke W, Muhldorfer BE, et al. Clinical response to dietary fiber treatment of chronic constipation. American Journal of Gastroenterology 1997;92(1):95-8. PMID: 8995945. [ Links ]
88. Awad RA, Camacho S. A randomized, double-blind, placebo-controlled trial of polyethylene glycol effects on fasting and postprandial rectal sensitivity and symptoms in hypersensitive constipation-predominant irritable bowel syndrome. Colorectal Disease 2010;12(11):1131-8. PMID: 19575740. DOI: 10.1111/j.1463-1318.2009.01990.x. [ Links ]
89. Chapman RW, Stanghellini V, Geraint M, et al. Randomized clinical trial: Macrogol/PEG 3350 plus electrolytes for treatment of patients with constipation associated with irritable bowel syndrome. American Journal of Gastroenterology 2013;108(9):1508-15. PMID: 23835436. DOI: 10.1038/ajg.2013.197. [ Links ]
90. Ford AC, Moayyedi P, Lacy BE, et al. American College of Gastroenterology monograph on the management of irritable bowel syndrome and chronic idiopathic constipation. American Journal of Gastroenterology 2014;109:S2-S26. PMID: 25091148. DOI: 10.1038/ajg.2014.187. [ Links ]
91. Lee-Robichaud H, Thomas K, Morgan J, et al. Lactulose versus polyethylene glycol for chronic constipation. Cochrane Database of Systematic Reviews 2010(7). PMID: 20614462. [ Links ]
92. Hookway C, Buckner S, Crosland P, et al. Irritable bowel syndrome in adults in primary care: Summary of updated NICE guidance. Bmj-British Medical Journal 2015;350. PMID: 25716701. DOI: 10.1136/bmj.h701. [ Links ]
93. Kamm MA, Mueller-Lissner S, Wald A, et al. Oral bisacodyl is effective and well-tolerated in patients with chronic constipation. Clinical Gastroenterology and Hepatology 2011;9(7):577-83. PMID: 21440672. DOI: 10.1016/j.cgh.2011.03.026. [ Links ]
94. Mueller-Lissner S, Kamm MA, Wald A, et al. Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of sodium picosulfate in patients with chronic constipation. American Journal of Gastroenterology 2010;105(4):897-903. PMID: 20179697. DOI: 10.1038/ajg.2010.41. [ Links ]
95. Bernet MF, Brassart D, Neeser JR, et al. Lactobacillus-acidophilus la-1 binds to cultured human intestinal-cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria. Gut 1994;35(4):483-9. PMID: 8174985. DOI: 10.1136/gut.35.4.483. [ Links ]
96. Wang XD, Soltesz V, Molin G, et al. The role of oral-administration of oatmeal fermented by lactobacillus-reuteri r2lc on bacterial translocation after acute liver-failure induced by subtotal liver resection in the rat. Scandinavian Journal of Gastroenterology 1995;30(2):180-5. PMID: 7732342. DOI: 10.3109/00365529509093259. [ Links ]
97. Kaila M, Isolauri E, Soppi E, et al. Enhancement of the circulating antibody secreting cell response in human diarrhea by a human lactobacillus strain. Pediatric Research 1992;32(2):141-4. PMID: 1324462. DOI: 10.1203/00006450-199208000-00002. [ Links ]
98. O'Mahony L, McCarthy J, Kelly P, et al. Lactobacillus and bifidobacterium in irritable bowel syndrome: Symptom responses and relationship to cytokine profiles. Gastroenterology 2005;128(3):541-51. PMID: 15765388. DOI: 10.1053/j.gastro.2004.11.050. [ Links ]
99. Ford AC, Quigley EMM, Lacy BE, et al. Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: Systematic review and meta-analysis. American Journal of Gastroenterology 2014;109(10):1547-61. PMID: 25070051. DOI: 10.1038/ajg.2014.202. [ Links ]
100. Koebnick C, Wagner I, Leitzmann P, et al. Probiotic beverage containing Lactobacillus casei Shirota improves gastrointestinal symptoms in patients with chronic constipation. Canadian Journal of Gastroenterology 2003;17(11):655-9. PMID: 14631461. DOI: 10.1155/2003/654907. [ Links ]
101. Pimentel M, Chang C, Chua KS, et al. Antibiotic treatment of constipation-predominant irritable bowel syndrome. Digestive Diseases and Sciences 2014;59(6):1278-85. PMID: 24788320. DOI: 10.1007/s10620-014-3157-8. [ Links ]
102. Pimentel M, Park S, Mirocha J, et al. The effect of a nonabsorbed oral antibiotic (Rifaximin) on the symptoms of the irritable bowel syndrome - A randomized trial. Annals of Internal Medicine 2006;145(8):557-63. PMID: 17043337. DOI: 10.7326/0003-4819-145-8-200610170-00004. [ Links ]
103. Pimentel M, Lembo A, Chey WD, et al. Rifaximin therapy for patients with irritable bowel syndrome without constipation. New England Journal of Medicine 2011;364(1):22-32. PMID: 21208106. DOI: 10.1056/NEJMoa1004409. [ Links ]
104. Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome: A double-blind, randomized, placebo-controlled study. American Journal of Gastroenterology 2003;98(2):412-9. PMID: 12591062. DOI: 10.1111/j.1572-0241.2003.07234.x. [ Links ]
105. Quartero AO, Meineche-Schmidt V, Muris J, et al. Bulking agents, antispasmodic and antidepressant medication for the treatment of irritable bowel syndrome - art. no. CD003460.pub2. Cochrane Database of Systematic Reviews 2005(2). PMID: 15846668. [ Links ]
106. Clave P, Acalovschi M, Triantafillidis JK, et al. Randomised clinical trial: Otilonium bromide improves frequency of abdominal pain, severity of distention and time to relapse in patients with irritable bowel syndrome. Alimentary Pharmacology & Therapeutics 2011;34(4):432-42. PMID: 21679214. [ Links ]
107. Capanni M, Surrenti E, Biagini M, et al. Efficacy of peppermint oil in the treatment of irritable bowel syndrome: A randomized, controlled trial. Gazzetta Medica Italiana 2005(164):119-26. [ Links ]
108. Cappello G, Spezzaferro M, Grossi L, et al. Peppermint oil (Mintoil) in the treatment of irritable bowel syndrome: A prospective double blind placebo-controlled randomized trial. Digestive and Liver Disease 2007;39(6):530-6. PMID: 17420159. DOI: 10.1016/j.dld.2007.02.006. [ Links ]
109. Lech Y, Olesen KM, Hey H, et al. Treatment of irritable bowel syndrome with peppermint oil. A double-blind study with a placebo. Ugeskrift for laeger 1988;150(40):2388-9. PMID: 3061106. [ Links ]
110. Liu JH, Chen GH, Yeh HZ, et al. Enteric-coated peppermint-oil capsules in the treatment of irritable bowel syndrome: A prospective, randomized trial. Journal of Gastroenterology 1997;32(6):765-8. PMID: 9430014. DOI: 10.1007/BF02936952. [ Links ]
111. Merat S, Khalili S, Mostajabi P, et al. The effect of enteric-coated, delayed-release peppermint oil on irritable bowel syndrome. Digestive Diseases and Sciences 2010;55(5):1385-90. PMID: 19507027. DOI: 10.1007/s10620-009-0854-9. [ Links ]
112. Kim DY, Camilleri M. Serotonin: A mediator of the brain-gut connection. American Journal of Gastroenterology 2000;95(10):2698-709. PMID: 11051338. DOI: 10.1111/j.1572-0241.2000.03177.x. [ Links ]
113. Bassotti G, Blandizzi C. Understanding and treating refractory constipation. World Journal of Gastrointestinal Pharmacology and Therapeutics. 2014;5(2):77-85. PMID: 24868488. [ Links ]
114. Camilleri M, Kerstens R, Rykx A, et al. A placebo-controlled trial of prucalopride for severe chronic constipation. New England Journal of Medicine 2008;358(22):2344-54. PMID: 18509121. DOI: 10.1056/NEJMoa0800670. [ Links ]
115. Tack J, Van Outryve M, Beyens G, et al. Prucalopride (Resolor) in the treatment of severe chronic constipation in patients dissatisfied with laxatives. Gut 2009;58(3):357-65. PMID: 18987031. DOI: 10.1136/gut.2008.162404. [ Links ]
116. Quigley EMM, Vandeplassche L, Kerstens R, et al. Clinical trial: The efficacy, impact on quality of life, and safety and tolerability of prucalopride in severe chronic constipation - A 12-week, randomized, double-blind, placebo-controlled study. Alimentary Pharmacology & Therapeutics 2009;29(3):315-28. PMID: 19035970. DOI: 10.1111/j.1365-2036.2008.03884.x. [ Links ]
117. Shin A, Camilleri M, Kolar G, et al. Systematic review with meta-analysis: Highly selective 5-HT4 agonists (prucalopride, velusetrag or naronapride) in chronic constipation. Alimentary Pharmacology & Therapeutics 2014;39(3):239-53. PMID: 24308797. DOI: 10.1111/apt.12571. [ Links ]
118. Camilleri M, Beyens G, Kerstens R, et al. Safety assessment of prucalopride in elderly patients with constipation: A double-blind, placebo-controlled study. Neurogastroenterology and Motility 2009;21(12). PMID: 19751247. DOI: 10.1111/j.1365-2982.2009.01398.x. [ Links ]
119. Emmanuel AV, Kamm MA, Roy AJ, et al. Randomised clinical trial: The efficacy of prucalopride in patients with chronic intestinal pseudo-obstruction - A double-blind, placebo-controlled, cross-over, multiple n = 1 study. Alimentary Pharmacology & Therapeutics 2012;35(1):48-55. PMID: 22061077. DOI: 10.1111/j.1365-2036.2011.04907.x. [ Links ]
120. Busby RW, Bryant AP, Bartolini WP, et al. Linaclotide, through activation of guanylate cyclase C, acts locally in the gastrointestinal tract to elicit enhanced intestinal secretion and transit. European Journal of Pharmacology 2010;649(1-3):328-35. PMID: 20863829. DOI: 10.1016/j.ejphar.2010.09.019. [ Links ]
121. Eutamene H, Bradesi S, Larauche M, et al. Guanylate cyclase C-mediated antinociceptive effects of linaclotide in rodent models of visceral pain. Neurogastroenterology and Motility 2010;22(3). PMID: 19706070. DOI: 10.1111/j.1365-2982.2009.01385.x. [ Links ]
122. Videlock EJ, Cheng V, Cremonini F. Effects of linaclotide in patients with irritable bowel syndrome with constipation or chronic constipation: A meta-analysis. Clinical Gastroenterology and Hepatology 2013;11(9):1084-U82. PMID: 23421551. DOI: 10.1016/j.cgh.2013.04.032. [ Links ]
123. Atluri DK, Chandar AK, Bharucha AE, et al. Effect of linaclotide in irritable bowel syndrome with constipation (IBS-C): A systematic review and metaanalysis. Neurogastroenterology and Motility 2014;26(4):499-509. PMID: 24351035. DOI: 10.1111/nmo.12292. [ Links ]
124. Ford AC, Suares NC. Effect of laxatives and pharmacological therapies in chronic idiopathic constipation: Systematic review and meta-analysis. Gut 2011;60(2):209-18. PMID: 21205879. DOI: 10.1136/gut.2010.227132. [ Links ]
125. Wilson N, Schey R. Lubiprostone in constipation: Clinical evidence and place in therapy. Therapeutic advances in chronic disease 2015;6(2):40-50. PMID: 25729555. DOI: 10.1177/2040622314567678. [ Links ]
126. Woodward S, Norton C, Chiarelli P. Biofeedback for treatment of chronic idiopathic constipation in adults. Cochrane Database of Systematic Reviews 2014(3). PMID: 24668156. [ Links ]
127. Rao SSC, Benninga MA, Bharucha AE, et al. ANMS-ESNM position paper and consensus guidelines on biofeedback therapy for anorectal disorders. Neurogastroenterol Motil 2015;27(5):594-609. PMID: 25828100. DOI: 10.1111/nmo.12520. [ Links ]
128. Ford AC, Talley NJ, Schoenfeld PS, et al. Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: Systematic review and meta-analysis. Gut 2009;58(3):367-78. PMID: 19001059. DOI: 10.1136/gut.2008.163162. [ Links ]
129. Vahedi H, Merat S, Rashidioon A, et al. The effect of fluoxetine in patients with pain and constipation-predominant irritable bowel syndrome: A double-blind randomized-controlled study. Alimentary Pharmacology & Therapeutics 2005;22(5):381-5. PMID: 16128675. DOI: 10.1111/j.1365-2036.2005.02566.x. [ Links ]
130. Tack J, Broekaert D, Fischler B, et al. A controlled crossover study of the selective serotonin reuptake inhibitor citalopram in irritable bowel syndrome. Gut 2006;55(8):1095-103. PMID: 16401691. [ Links ]
131. Masand PS, Pae C-U, Krulewicz S, et al. A double-blind, randomized, placebo-controlled trial of paroxetine controlled-release in irritable bowel syndrome. Psychosomatics 2009;50(1):78-86. PMID: 19213976. DOI: 10.1176/appi.psy.50.1.78. [ Links ]
132. Brennan BP, Fogarty KV, Roberts JL, et al. Duloxetine in the treatment of irritable bowel syndrome: An open-label pilot study. Human Psychopharmacology-Clinical and Experimental 2009;24(5):423-8. PMID: 19548294. DOI: 10.1002/hup.1038. [ Links ]
133. Colonna L. Antidepresseurs. In: Flammarion MS, editor. Vassilis Kapsambelis D Ginestet: Thérapeutique médicamenteuse des troubles psychiatriques de l'adulte. París; 1996. p. 29-41. [ Links ]
134. Liu JP, Yang M, Lix YX, et al. Herbal medicines for treatment of irritable bowel syndrome. Cochrane Database of Systematic Reviews 2006(1). PMID: 16437473. [ Links ]
135. Park HJ, Jarrett M, Cain K, et al. Psychological distress and GI symptoms are related to severity of bloating in women with irritable bowel syndrome. Research in Nursing & Health 2008;31(2):98-107. PMID: 18181134. DOI: 10.1002/nur.20237. [ Links ]
136. Blanchard EB, Lackner JM, Jaccard J, et al. The role of stress in symptom exacerbation among IBS patients. Journal of Psychosomatic Research 2008;64(2):119-28. PMID: 18222125. DOI: 10.1016/j.jpsychores.2007.10.010. [ Links ]
137. Choung RS, Locke GR 3rd, Zinsmeister AR, et al. Psychosocial distress and somatic symptoms in community subjects with irritable bowel syndrome: A psychological component is the rule. American Journal of Gastroenterology 2009;104(7):1772-9. PMID: 19491833. DOI: 10.1038/ajg.2009.239. [ Links ]
138. Lindfors P, Unge P, Arvidsson P, et al. Effects of gut-directed hypnotherapy on IBS in different clinical settings-results from two randomized, controlled trials. American Journal of Gastroenterology 2012;107(2):276-85. PMID: 21971535. DOI: 10.1038/ajg.2011.340. [ Links ]
139. Webb AN, Kukuruzovic RH, Catto-Smith AG, et al. Hypnotherapy for treatment of irritable bowel syndrome. Cochrane Database of Systematic Reviews 2007(4). PMID: 17943840. [ Links ]
140. Dorsher P, Fleckenstein J. Puntos gatillo y puntos de acupuntura clásica. Parte 2: Correspondencias clínicas en el tratamiento del dolor y las disfunciones somatoviscerales. Revista Internacional de Acupuntura 2009;36(2). DOI: 10.1016/S1887-8369(09)71576-5. [ Links ]
141. Manheimer E, Wieland LS, Cheng K, et al. Acupuncture for irritable bowel syndrome: Systematic review and meta-analysis. American Journal of Gastroenterology 2012;107(6):835-47. PMID: 22488079. DOI: 10.1038/ajg.2012.66. [ Links ]
142. Lembo AJ, Conboy L, Kelley JM, et al. A treatment trial of acupuncture in ibs patients. American Journal of Gastroenterology 2009;104(6):1489-97. PMID: 19455132. DOI: 10.1038/ajg.2009.156. [ Links ]
143. Hussain ZH, Whitehead DA, Lacy BE. Fecal impaction. Current Gastroenterology Reports 2014;16(9):404-. PMID: 25119877. DOI: 10.1007/s11894-014-0404-2. [ Links ]
144. Christensen P, Bazzocchi G, Coggrave M, et al. A randomized, controlled trial of transanal irrigation versus conservative bowel management in spinal cord-injured patients. Gastroenterology 2006;131(3):738-47. PMID: 16952543. DOI: 10.1053/j.gastro. 2006.06.004. [ Links ]
145. Del Popolo G, Mosiello G, Pilati C, et al. Treatment of neurogenic bowel dysfunction using transanal irrigation: A multicenter Italian study. Spinal Cord 2008;46(7):517-22. PMID: 18317488. DOI: 10. 1038/sj.sc.3102167. [ Links ]
146. Christensen P, Andreasen J, Ehlers L. Cost-effectiveness of transanal irrigation versus conservative bowel management for spinal cord injury patients. Spinal Cord 2009;47(2):138-43. PMID: 18679401. DOI: 10.1038/sc.2008.98. [ Links ]
147. Podzemny V, Pescatori LC, Pescatori M. Management of obstructed defecation. World Journal of Gastroenterology 2015;21(4):1053-60. PMID: 25632177. DOI: 10.3748/wjg.v21.i4.1053. [ Links ]
148. Mowatt G, Glazener C, Jarrett M. Sacral nerve stimulation for faecal incontinence and constipation in adults. Cochrane Database of Systematic Reviews 2007(3). PMID: 17636759. [ Links ]
149. Mínguez M, Mora F, Mas P, et al. Guía práctica de actuación diagnóstico-terapéutica en estreñimiento crónico. Valencia: Fundación Española de Aparato Digestivo; 2013. [ Links ]
150. Fukudo S, Kaneko H, Akiho H, et al. Evidence-based clinical practice guidelines for irritable bowel syndrome. Journal of Gastroenterology 2015;50(1):11-30. PMID: 25500976. DOI: 10.1007/s00535-014-1017-0. [ Links ]
151. Chey WD, Kurlander J, Eswaran S. Irritable bowel syndrome: A clinical review. Jama-Journal of the American Medical Association 2015;313(9):949-58. PMID: 25734736. DOI: 10.1001/jama.2015.0954. [ Links ]
152. Grupo de trabajo de la Guía de Práctica Clínica sobre el síndrome del intestino irritable. Manejo del paciente con síndrome del intestino irritable. Barcelona: Asociación Española de Gastroenterología, Sociedad Española de Familia y Comunitaria y Centro Cochrane Iberoamericano; 2005. [ Links ]
153. Serra J, Mascort-Roca J, Marzo-Castillejo M, et al. Guía de práctica clínica sobre el manejo del estreñimiento crónico en el paciente adulto. Parte 1: Definición, etiología y manifestaciones clínicas. Gastroenterol Hepatol 2016; en prensa. [ Links ]
154. Serra J, Mascort-Roca J, Marzo-Castillejo M, et al. Guía de práctica clínica sobre el manejo del estreñimiento crónico en el paciente adulto. Parte 2: Diagnóstico y tratamiento. Gastroenterol Hepatol 2016; en prensa. [ Links ]
155. Rao SSC, Bharuca AE, Chiarioni G, et al. Anorectal Disorders. Gastroenterol 2016; 150: 1430-1442. [ Links ]











 texto en
texto en