INTRODUCCIÓN
Una de las comorbilidades más comunes de los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) es la infección por el virus de la hepatitis C (VHC) 1. De los 185 millones de personas crónicamente infectadas por el VHC a nivel mundial, aproximadamente cinco millones también están infectadas por el VIH 2. En España, sin embargo, la seroprevalencia de VHC en pacientes con infección por VIH ha disminuido de manera gradual. Datos recientes de cohortes españolas muestran tasas de seroprevalencia de anticuerpos anti-VHC en pacientes coinfectados del 37,7% y de enfermedad activa (con RNA VHC detectable) del 22,1% 3. Entre los factores que más han contribuido a esta reducción se encuentran la drástica disminución en el consumo de drogas por vía parenteral, principal vía de transmisión del VIH desde el año 1997, y la implementación en España de programas de reducción de daños.
Como es sabido, la infección concomitante con el VIH modifica la historia natural de la infección por VHC, provocando una progresión más acelerada de la fibrosis y un riesgo mayor de evolución a enfermedad hepática terminal 4. Estudios de cohortes observacionales han demostrado que el aclaramiento del VHC en estos pacientes se asocia con menores tasas de mortalidad y morbilidad por enfermedad hepática y no hepática 5. Alcanzar respuesta viral sostenida (RVS) supone una reducción significativa de la progresión a fibrosis, de hepatocarcinoma y de muerte por hepatopatía, no solo en aquellos con grados de fibrosis más avanzados sino también en pacientes con fibrosis moderada 6. Históricamente, el estándar terapéutico del virus de la hepatitis C se basaba en terapias duales que incluían interferón pegilado y ribavirina, que beneficiaron mayoritariamente a los pacientes monoinfectados. Las tasas de RVS eran sustancialmente inferiores en los pacientes coinfectados 7, presentando una elevada tasa de efectos secundarios 8. Posteriormente, la llegada de los inhibidores de la proteasa de primera generación en 2011 (telaprevir, boceprevir), utilizados en combinación con interferón pegilado y ribavirina, trajo consigo tasas de respuesta similares en ambos grupos, aunque su elevado coste, su desfavorable perfil de toxicidad y un gran número de interacciones con los fármacos antirretrovirales (FAR) impidieron su utilización a gran escala.
El desarrollo de agentes antivirales de acción directa (AAD) ha supuesto una mejora espectacular en el pronóstico de los pacientes con infección crónica por el VHC 9. Estas estrategias, libres de interferón y de administración oral, han demostrado ser superiores a todas las pautas anteriores desde que se comenzaron a utilizar en 2014 10.
Se ha estudiado la eficacia de los AAD en ensayos clínicos tanto en mono como en coinfectados 11) (12) (13) (14. Sin embargo, no tenemos suficiente evidencia de la efectividad de estos tratamientos en cohortes prospectivas y multicéntricas en nuestro país.
Nuestro objetivo en este estudio es analizar la efectividad y toxicidad del tratamiento con AAD en vida real en pacientes coinfectados por VIH y VHC así como determinar variables asociadas a una evolución desfavorable.
PACIENTES Y MÉTODOS
Diseño y población de estudio
Se realizó un estudio de cohorte ambispectivo multicéntrico en el que se estudió a 229 pacientes que presentaban coinfección por el VHC y VIH y que realizaban seguimiento activo en las consultas de la Unidad de VIH de ocho centros asistenciales de la comunidad autónoma de Castilla-La Mancha. El estudio se realizó en el periodo comprendido entre el 1 de septiembre de 2014 y el 31 de diciembre de 2016.
Fueron incluidos en el estudio aquellos pacientes adultos (mayores de 18 años) coinfectados por el VHC y VIH en los que se inició tratamiento dirigido para el VHC con AAD. Se excluyeron los pacientes que se encontraban recibiendo tratamiento con estrategias que incluían interferón pegilado. Se analizaron todos los pacientes tratados con serología y ácido ribonucleico (RNA) positivos para VHC, independientemente de la carga viral (CV) detectada. Se incluyeron pacientes que nunca habían recibido tratamiento para el VHC (naïve) y pacientes cuyos tratamientos previos con estrategias con interferón o bien con interferón y boceprevir, telaprevir o simeprevir habían fracasado. Las pautas de tratamiento antirretroviral (TAR) así como los AAD utilizados se dejaron a elección del investigador, en función de disponibilidad, toxicidades o interacciones. En aquellos pacientes que no estaban recibiendo TAR se requirió que presentasen unas cifras de linfocitos T CD4 superiores a 350 células por mm3 (cel/mm3). Se incluyeron pacientes infectados por los genotipos de VHC 1, 2, 3 y 4.
Adquisición de datos
Todos los pacientes atendidos en las unidades de VIH de los centros implicados quedan registrados en una base de datos interna de cada hospital. Los pacientes incluidos en este estudio fueron identificados a partir de estas bases y los datos de las variables principales han sido recogidos de una manera prospectiva (eficacia y toxicidad) en la consulta mediante la cumplimentación de un formulario.
Muchos de los datos epidemiológicos, biológicos, clínicos, analíticos, radiológicos, endoscópicos, histológicos y elastográficos se obtuvieron retrospectivamente a partir de la revisión minuciosa de las historias clínicas de los pacientes.
El estudio fue realizado de acuerdo con las guías de buena práctica clínica y previa obtención de la aprobación del Comité de Ética e Investigación Clínica del Hospital Universitario de Guadalajara.
Definiciones y variables de estudio
Las variables recogidas al inicio del estudio fueron la edad, el sexo, la vía de contagio, la clasificación de Center for Disease Control and Prevention (CDC) de VIH, la carga viral de VHC previa al inicio de los AAD, el genotipo de VHC, la carga viral de VIH previa al inicio de los AAD, el recuento absoluto y relativo de linfocitos T CD4 previo al inicio de los AAD, el tratamiento antirretroviral concomitante a los AAD, la presencia o ausencia de varices esofágicas, esplenomegalia, hipertensión portal, antígeno de superficie del virus de la hepatitis B, el polimorfismo de la interleucina B28, la presencia de comorbilidad hepática, ascitis o encefalopatía, antecedentes de enolismo e historia de tratamiento del VHC con estrategias previas.
Se determinaron la CV del VHC previa al tratamiento y al final del mismo y la respuesta viral sostenida a las 12 semanas de finalizarlo. Se analizó el grado de fibrosis hepática (medido en kilopascales) mediante elastografía de transición a vibración controlada (FibroScan(r) 402) al inicio del tratamiento. Las variables analíticas estudiadas fueron: creatinina, aspartato aminotranferasa (AST), alanina aminotransferasa (ALT), gamma glutamil transpeptidasa (GGT), plaquetas, bilirrubina total, INR y albúmina. En la población cirrótica se analizó además el estadio Child-Pugh previo al inicio de AAD.
Se definió como cirrosis hepática cualquiera de las siguientes condiciones: biopsia hepática compatible con cirrosis en cualquier momento antes o durante el screening o una rigidez hepática superior a 12,5 kilopascales (kPa) en la elastografía realizada previamente al inicio del tratamiento.
Se consideró alcoholismo el consumo diario reconocido de al menos 50 gramos de alcohol en mujeres y 70 gramos en varones o bien una adicción al alcohol diagnosticada por un servicio de psiquiatría o en seguimiento por una unidad de deshabituación enólica, en cualquier momento de la historia del paciente.
Se realizaron estudios analíticos y evaluación clínica a todos los pacientes antes del inicio del tratamiento, al finalizarlo y 12 semanas después. Se definió RVS como la ausencia de detección de RNA VHC a las 12 semanas de finalizar el tratamiento con AAD.
Se definió fracaso virológico como el aumento de al menos 1 log10 del RNA de VHC desde el nadir o bien la cuantificación de RNA VHC desde un estado indetectable durante el tiempo de tratamiento (breakthrough) o la presencia de RNA de VHC cuantificable una vez finalizado el tratamiento (recaída).
Se definió fracaso terapéutico como cualquier causa que justifique la ausencia de RVS a las 12 semanas de finalizar el tratamiento, incluidos el fracaso virológico, la pérdida de seguimiento, la muerte por cualquier causa, la interrupción del tratamiento por toxicidad, el embarazo o el mal cumplimiento con abandono del tratamiento.
Objetivos primarios y secundarios
El objetivo primario fue el análisis de eficacia en vida real (efectividad), definido como RVS. Se realizó un análisis por intención de tratamiento en el que cualquier pérdida de seguimiento, abandono de tratamiento o toxicidad terapéutica se consideró fracaso.
Objetivos secundarios del estudio fueron el análisis de la toxicidad (efectos adversos y causas de interrupción del tratamiento) y el análisis de factores asociados a la ausencia de RVS.
Análisis estadístico
Para la descripción de variables categóricas y cuantitativas se utilizaron porcentajes y medianas con rangos intercuartiles (RI). Para la comparación de variables categóricas se utilizó la 2 (y prueba exacta de Fisher cuando fue necesario) y para la comparación de variables cuantitativas se emplearon los test de t de Student y ANOVA. Como medida de riesgo se emplearon la odds ratio y su intervalo de confianza del 95%. Se realizó una regresión logística univariante y multivariante para el estudio de factores independientes de respuesta desfavorable, siendo la variable dependiente binaria: alcanzar o no la RVS. Se utilizó el paquete estadístico SPSS 20.0. Todos los test fueron de dos colas y se consideró un valor de significación estadística cuando el valor de p era inferior a 0,05.
RESULTADOS
Se estudiaron 229 pacientes con una mediana de edad de 49,6 años (RI: 46,7-52,8). El 83% (190) fueron varones. En la tabla 1 se muestran las características clínicas, analíticas y epidemiológicas basales de los pacientes. La mayoría de los pacientes presentaban un genotipo 1 y con menos frecuencia, genotipo 3 y 4. La cohorte reflejaba una población con hepatopatía avanzada, con un 50% de pacientes cirróticos (20% con grado Child B o C). Un 25% presentó hábito enólico. El 65% presentaba más de 800.000 copias/ml y el polimorfismo del gen de la interleucina 28B (IL28b) fue mayoritariamente desfavorable (65%). Se recogieron datos de fibrosis hepática basal en todos los pacientes salvo en 14. De estos, en tres se disponía de biopsia hepática y en el resto, los pacientes presentaban o bien signos clínicos de cirrosis, habían sido tratados previamente con interferón y ribavirina o presentaban dificultades técnicas por obesidad.
Tabla 1 Características epidemiológicas, clínicas y analíticas basales de la población a estudio


RI: rango intercuartil; VIH: virus de la inmunodeficiencia humana; VHC: virus de la hepatitis C; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; GGT: gamma glutamil transpeptidasa; INR: international normalized ratio; VHB: virus de la hepatitis B; CDC: Centers for Disease Control and Prevention; kPa: kilopascales; HSH: hombres que tienen sexo con hombres. aMedido en pacientes con cirrosis hepática basal. bHipertensión portal diagnosticada mediante endoscopia digestiva alta o prueba de imagen. cRigidez hepática medida mediante elastografía transicional. dHábito enólico en algún momento de la historia del paciente.
En la tabla 2 se recogen las pautas de tratamiento antirretroviral utilizadas por los investigadores. Las pautas más utilizadas incluyeron tenofovir disoproxil fumarato y los inhibidores de la integrasa (fundamentalmente raltegravir).
Tabla 2 Pautas de tratamiento antirretroviral utilizado durante la administración de AAD
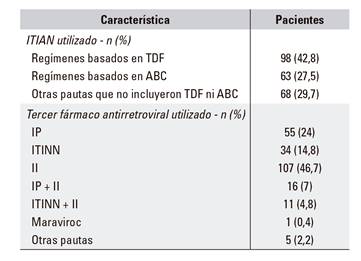
ITIAN: inhibidor de la transcriptasa inversa análogo de nucleósidos; CV: carga viral; VIH: virus de la inmunodeficiencia humana; TDF: tenofovir disoproxil fumarato; ABC: abacavir.
La respuesta viral sostenida se alcanzó globalmente en el 91,7% (en un análisis por intención de tratamiento) y el 95,6% mostraba una CV VHC indetectable al final del tratamiento. No se hallaron variables predictoras de fracaso virológico o terapéutico en la RVS (Fig. 1). En el análisis univariante no se halló asociación entre RVS y otras variables como la cifra de plaquetas, la albúmina o la clasificación de Child-Pugh en pacientes cirróticos.

Fig. 1 Análisis univariante: variables predictoras de evolución desfavorable. El gráfico recoge las principales variables que se incluyeron en el análisis univariante. Ninguna de ellas mostró ser predictora de evolución desfavorable (OR: odds ratio; CI: intervalo de confianza; VIH: virus de la inmunodeficiencia humana; TDF: tenofovir disoproxil fumarato; ABC: abacavir; IFN: interferón pegilado; Rib: ribavirina).
Las estrategias de AAD utilizadas se resumen en la figura 2. El 48% de las pautas incluyeron, además, ribavirina. La duración del tratamiento fue variable: el 65,9% completó pautas de 12 semanas, el 30,1% siguió pautas más prolongadas de 24 semanas y solo un 3,9% fue seleccionado para recibir pautas cortas de ocho semanas.
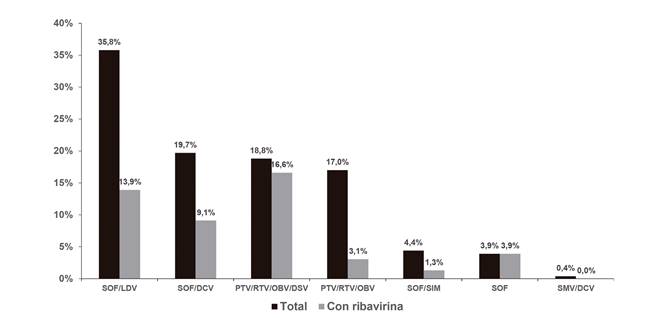
Fig. 2 Estrategias de agentes antivirales directos utilizadas. La figura expone las estrategias de agentes antivirales directos utilizadas y el porcentaje de pacientes en los que se ha utilizado ribavirina en cada grupo (SMV: simprevir; LDV: ledipasvir; SOF: sofosbuvir; DCV: daclatasvir; OBV: ombitasvir; PTV: paritaprevir; DSV: dasabuvir; RTV: ritonavir).
Las RVS obtenidas en los diferentes subgrupos se resumen en la figura 3. No se identificaron diferencias estadísticamente significativas entre las estrategias de AAD utilizadas. Hubo 19 fracasos terapéuticos; diez recaídas (distribuidas en todos los grupos salvo en el de paritaprevir/ritonavir/ombitasvir), un breakthrough (en el grupo de sofosbuvir/ledipasvir, en relación a mala cumplimentación por parte del paciente) y tres interrupciones por toxicidad (dos en el grupo de sofosbuvir/simeprevir y una en el grupo de sofosbuvir/daclatasvir). Aunque los pacientes que fracasaron por recaída presentaron el mismo genotipo en una nueva determinación, no podemos excluir completamente la posibilidad de una reinfección ya que no se realizó estudio filogenético. Además del paciente que realizó mala cumplimentación, otros cinco pacientes presentaron interrupción no relacionada con el tratamiento: dos por fallecimiento (uno a consecuencia de una sepsis y otro a consecuencia de un síndrome hepatorrenal en un paciente con descompensación hidrópica desde el inicio del tratamiento) y tres por pérdida de seguimiento. Además, hubo otro exitus de un paciente que ya había alcanzado RVS al que se le diagnosticó de adenocarcinoma pulmonar en estadio avanzado. También hubo otra interrupción de tratamiento por toxicidad; sin embargo, en este caso se alcanzó RVS. Los efectos adversos más documentados fueron la astenia y las alteraciones gastrointestinales.

Fig. 3 Respuesta viral sostenida en los diferentes subgrupos. *Se recoge la respuesta viral sostenida en los diferentes grupos de tratamiento con AAD. a) PTV/RTV/OBV; b) PTV/RTV/OBV/DSV; c) SOF/LDV; d) SOF/SMV; e) SOF/DCV; f) SOF (AAD: agentes antivirales directos; CV: carga viral; VHC: virus de la hepatitis C; SMV: simprevir; LDV: ledipasvir; SOF: sofosbuvir; DCV: daclatasvir; OBV: ombitasvir; PTV: paritaprevir; DSV: dasabuvir; RTV: ritonavir).
No se realizaron test de resistencias basales. Solo se realizó un test de resistencias en el paciente que presentó fracaso terapéutico por breakthrough y no se hallaron sustituciones asociadas a resistencias.
Se realizó un análisis multivariante mediante regresión logística con exclusión escalonada hacia atrás utilizando como variable dependiente la RVS y como variables independientes, el sexo, la edad, la cirrosis, el genotipo 1 o 4 frente al 3 y tener más de 800.000 copias/ml. No se observó ningún factor predictor independiente de RVS.
DISCUSIÓN
Los datos obtenidos en ensayos clínicos sobre tratamiento del VHC con AAD en pacientes coinfectados han demostrado presentar una eficacia similar a aquellos diseñados para pacientes monoinfectados 11) (12) (13) (14. Existen datos publicados en la literatura de cohortes españolas de monoinfectados 15) (16) (17) (18. Sin embargo, existe escasa evidencia de la efectividad de estos tratamientos en cohortes prospectivas de coinfectados en España 19. Este trabajo presenta datos de RVS en vida real en una cohorte multicéntrica.
En este estudio de cohortes, los pacientes presentaron una mediana de edad cercana a los 50 años, siendo mayoritariamente hombres. La proporción de pacientes que presentaban CV detectable para el VIH (> 50 copias/ml) fue < 10%. Resulta llamativo que casi un 45% de los pacientes tenían menos de 200 células CD4.
La coinfección por VHC y VIH es una condición con una fuerte asociación al uso de drogas por vía parenteral. Sin embargo, la epidemiología del VHC ha ido variando a lo largo de los años. Recientemente se han publicado datos que sugieren la aparición de microepidemias de transmisión de VHC en poblaciones con prácticas sexuales de riesgo entre hombres que tienen sexo con hombres (HSH), tales como el chemsex 20) (21. Esto justifica la importancia de continuar realizando educación sanitaria en los grupos de riesgo con el fin de difundir medidas generales para evitar la transmisión del virus e insistir en la necesidad de realizarse análisis serológicos frecuentes. Este continúa siendo uno de los principales objetivos del "Plan estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud", aprobado en España en 2015. Del mismo modo, estos datos también justifican un abordaje proactivo de los enfermos desde el punto de vista terapéutico, aun en aquellos con fibrosis nula o leve (F0-F1).
La infección por VHC en esta cohorte se debe de manera mayoritaria a los genotipos 1a y 4. Este hallazgo se ha observado también en otras series españolas y se debe a que son los genotipos que más se asocian al uso de drogas por vía parenteral, principal vía de transmisión histórica del VHC en nuestro medio. Los genotipos 2 y 1b han sido los menos frecuentes. Estos genotipos se han vinculado a otras vías de transmisión minoritarias (transfusión de derivados hemáticos). Los datos de nuestro estudio coinciden con los de otras series publicadas en España 22. Esta cohorte también arroja datos de pacientes con genotipo 3, de los cuales poseemos una evidencia limitada dado que se trata del genotipo más infrecuente.
A diferencia de los ensayos clínicos diseñados de manera específica en coinfectados, nuestro estudio contaba con más de un 45% de pacientes con criterios de cirrosis por elastografía (Metavir F4) 13) (14. Cabe destacar que una gran mayoría de los pacientes disponía de un estudio reciente de rigidez hepática por elastografía. No se observaron diferencias significativas de RVS entre los grupos de cirrosis y aquellos en estado pre-cirrótico o con rigidez en estadio leve y moderado. Tampoco se observaron diferencias estadísticamente significativas entre los diferentes genotipos. A diferencia de lo observado en otros estudios 13) (14, las tasas de recaída al estratificar los pacientes en función del RNA VHC basal, estableciendo como punto de corte las 800.000 copias/ml, fueron similares. Los datos obtenidos en nuestra cohorte son similares a los publicados de otros estudios observacionales de coinfectados, como es la cohorte francesa HEPAVIH 23.
Los estudios prospectivos realizados para el análisis en vida real de la eficacia de los AAD han mostrado resultados similares a los informados en los ensayos clínicos 24) (25. Las pautas terapéuticas recomendadas en estos pacientes son esencialmente las mismas que en monoinfectados, con la peculiaridad de las potenciales interacciones medicamentosas entre FAR y AAD. En esta cohorte tampoco se observaron diferencias de efectividad entre las pautas de AAD utilizadas.
En el análisis multivariante se trató de identificar aquellas variables potencialmente asociadas a una evolución desfavorable. Ninguna variable demostró de forma independiente asociarse de manera estadísticamente significativa en la predicción de mala evolución.
Los datos obtenidos de nuestra cohorte apoyan los excelentes resultados objetivados en los ensayos clínicos. La efectividad en vida real de los AAD en pacientes con confección por VIH y VHC es sobresaliente.
La toxicidad es excepcional, así como lo son los abandonos terapéuticos por toxicidad. Esto sugiere que la gran potencia y seguridad de estos fármacos supera con creces los factores predictores de mala evolución descritos anteriormente en otros estudios.
Limitaciones y fortalezas
Este estudio presenta las limitaciones propias de un estudio de cohortes con posibles factores de confusión que pueden sesgar la asociación de algunas de las variables con la respuesta viral sostenida. El escaso tamaño muestral impide tener una potencia adecuada para detectar factores predictores de evolución desfavorable e introducir un mayor número de variables en el análisis multivariante. La fortaleza de este estudio reside en que se trata de un estudio en vida real, ambispectivo, con un número amplio de hospitales, varios de ellos de pequeño tamaño, en el que se constata una extraordinaria eficacia del tratamiento con los AAD. El hecho de que no encontremos variables predictoras de una respuesta desfavorable sugiere que, aunque existan, no deben de tener gran importancia o, si la tienen, su impacto es escaso a la hora de lograr la curación de la infección por VHC.
CONCLUSIONES
El tratamiento del VHC en pacientes con infección por VIH presenta tasas de respuesta viral sostenida muy elevadas. Los datos en vida real son excelentes, así como lo han sido también en los ensayos clínicos. La seguridad y la tolerancia son grandes ventajas de estos fármacos. No hemos identificado en nuestra cohorte factores predictores específicos de evolución desfavorable.











 texto en
texto en 


