INTRODUCCIÓN
El diagnóstico de sangrados espontáneos o postquirúrgicos con pruebas rutinarias de coagulación en rangos normales puede convertirse en un reto difícil de afrontar. En el diagnóstico diferencial de este problema no podemos olvidarnos de incluir una posible etiología relacionada con déficits congénitos o adquiridos de la coagulación, revelados mediante pruebas específicas de detección.
El Factor XIII de la coagulación es una molécula formada por dos subunidades. La subunidad A (F. XIII-A) se sintetiza en los megacariocitos y es la forma activa. Por su parte, la subunidad B (F. XIII-B), sintetizada en el hígado, es la encargada del transporte y la inhibición del F. XIII-A.
El F. XIII interviene en la parte final de la cascada de la coagulación (Figura 1). Una vez el fibrinógeno se activa gracias a la trombina y se convierte en fibrina, el F. XIII es el encargado de generar uniones covalentes entre las moléculas de fibrina estabilizando así el trombo ya formado1. A su vez, el F. XIII también se une a diversas moléculas inhibitorias de la fibrinolisis, como la alfa2-antiplasmina, proporcionando así una mayor resistencia a esta. Al no intervenir en la formación del trombo sino en su estabilización, las pruebas de coagulación son normales incluso cuando existe déficit de este factor2,3. Es por este motivo que el diagnóstico de esta patología supone un reto, al requerir de estudios específicos de los niveles de este factor en sangre. Se considera que existe déficit leve cuando los niveles se encuentran entre el 20 y el 60 % del valor de referencia. A partir del 60 % no existe déficit del factor.
El déficit del F. XIII de la coagulación puede deberse a causas congénitas o a causas adquiridas. La enfermedad congénita se hereda de forma autosómica recesiva y su incidencia se sitúa en torno a 1-1,5/1.000.0004. Esta forma se caracteriza por grandes sangrados desde el nacimiento. Sin embargo, la forma más frecuente y de peor pronóstico es la adquirida. Existen múltiples causas que pueden provocar una caída de los niveles de F. XIII, entre las que se encuentran ciertas enfermedades autoinmunes, problemas hepáticos como la cirrosis o la insuficiencia hepática, ciertos fármacos (penicilina, procainamida, heparina y otros) o el consumo del factor por estrés tras una intervención quirúrgica.
CASO CLÍNICO
Paciente de 70 años, bebedor y fumador, con antecedentes de HTA y DM tipo II. Diagnosticado de carcinoma epidermoide de suelo de boca con estadiaje T1 N2c M0, por lo que se decidió tratamiento quirúrgico.
Al ingreso, el estudio preoperatorio con hemograma, bioquímica y coagulación mostraron valores normales. La intervención se realizó sin incidencias reseñables, llevándose a cabo la extirpación tumoral con márgenes y cierre directo junto a una disección cervical bilateral incluyendo niveles I, II, III, IV y V.
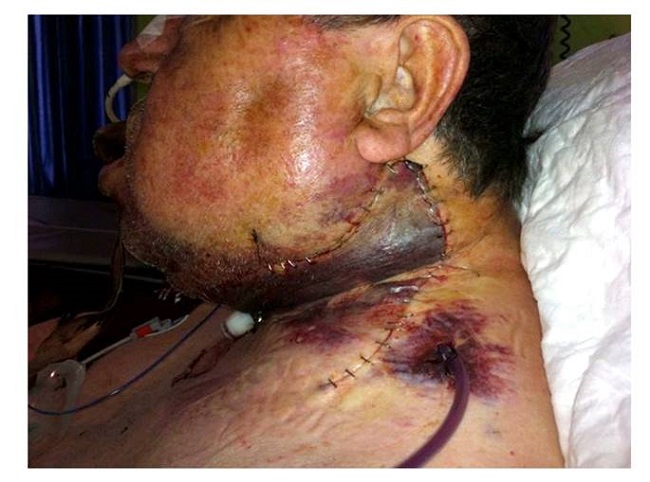
A las 48 horas de la intervención, el paciente presentó un gran hematoma lingual y de suelo de boca (Figura 2) con compromiso de la vía aérea que requirió de drenaje y de la realización de una traqueotomía urgente. Durante las siguientes 48 h continuaba con una evolución tórpida, apreciándose hematoma cervical bilateral a tensión (Figura 3 y Figura 4) con drenajes funcionantes altamente productivos, por lo que, bajo anestesia general, se realizó drenaje quirúrgico de los mismos, sin encontrase ningún vaso sangrante activo. Debido a que los drenajes seguían presentando alto débito (más de 150 cc el izquierdo y más de 400 cc el derecho en 24 horas), se llevó a cabo una cuarta y última intervención para drenar las colecciones cervicales y revisar el campo quirúrgico, cinco días después de la tercera cirugía.
Teniendo en cuenta el sangrado desproporcionado, la ausencia de vasos sangrantes y los resultados de laboratorio descritos, se realizó una interconsulta al servicio de hematología. Tras un estudio rutinario dentro de la normalidad, se consideró un déficit de Factor XIII adquirido como causa probable del cuadro, el cual fue confirmado mediante la medida cuantitativa de su actividad, mostrando valores del 40 %. En la analítica del día posterior los niveles del F. XIII fueron del 50 %, continuando así por debajo de los niveles normales, decidiéndose en este momento iniciar tratamiento intravenoso con plasma fresco congelado (PFC) cada 8 horas y amchafibrin 500 mg cada 6-8 horas. A las 24 horas del inicio del tratamiento los niveles de F. XIII ascendieron al 60,8 %, situándose así en el límite inferior de la normalidad. Debido a la gravedad del cuadro sufrido, se decidió mantener el tratamiento intravenoso para prevenir futuros sangrados. Al día siguiente, los niveles de Factor XIII se situaban en torno al 80 %, por lo que se retiró el tratamiento. Un mes después de la primera intervención el paciente fue dado de alta sin más complicaciones.
Durante el seguimiento los niveles de F. XIII volvieron a descender hasta el 40,7 %. El servicio de hematología no consideró oportuno iniciar tratamiento, pero sí pautó las medidas de prevención que se debían adoptar en caso de que el paciente fuese a ser intervenido quirúrgicamente de nuevo.
DISCUSIÓN
El sangrado postoperatorio en un paciente con pruebas de coagulación y hemostasia dentro de los valores de la normalidad puede suponer un gran reto diagnóstico.
Tras haber descartado otras causas de sangrado, es importante investigar la existencia de déficit de Factor XIII de la coagulación. El déficit de este factor es una patología poco frecuente y que se encuentra infradiagnosticada debido a que sus niveles plasmáticos no se evalúan en las pruebas de coagulación rutinarias. De este modo, si existe sospecha de dicha patología, hay que realizar pruebas específicas que nos muestren los niveles de F. XIII en sangre4.
El síntoma que se presenta con mayor frecuencia es el sangrado tras una intervención quirúrgica, siendo el sangrado espontáneo más frecuente en las formas congénitas. Actualmente existen pocos casos publicados sobre hemorragias postoperatorias debidas al déficit adquirido de F. XIII en el territorio cervicofacial. Boehlen y cols. realizaron una revisión de 60 casos de déficit de Factor XIII en la que únicamente uno de ellos describe sangrado a nivel de la cavidad oral tras una extracción dental5,6.
Para el diagnóstico de la esta patología, hay que tener en cuenta que este factor es el que tiene mayor vida media7, por lo que su déficit no se evidencia hasta pasados unos días tras la intervención. Según describen Chuliber y cols., los pacientes con déficit de F. XIII presentan un inicio de sangrado postprocedimiento más tardío que los pacientes sin déficit, existiendo asociación entre el sangrado que se inicia pasadas las 48 horas de la cirugía y el déficit del factor8.
En pacientes con historia de sangrados desde la infancia, puede ser necesario un estudio hematológico detallado previo a la intervención. Existen autores que defienden el uso de tratamiento profiláctico en pacientes con diagnóstico de déficit de F. XIII y episodios de hemorragia intracraneal o embarazo, sin llegar a un acuerdo definitivo en el tipo de profilaxis. En este campo, Nourbakhsh y cols. defienden la posibilidad de administrar de 20 a 70 U/kg/mes de concentrado de factor XIII4, mientras que Lim y cols. optan por una dosis preoperatoria de 2500 U (42 U/kg) 9.
En nuestro caso, el sangrado postoperatorio requirió de un tratamiento farmacológico, con PFC intravenoso, junto a un tratamiento intervencionista. El tratamiento con PFC logró elevar los niveles del F. XIII de forma rápida, hasta alcanzar niveles normales en apenas dos días. Sin embargo, en una revisión realizada meses después, se observó coómo los niveles de dicho factor habían vuelto a descender. Esto subraya la importancia de realizar un correcto diagnóstico y seguimiento de estos pacientes para adoptar las medidas profilácticas necesarias previas a una intervención quirúrgica.
La literatura describe casos que se resolvieron únicamente con tratamiento conservador mediante la administración de concentrado de Factor XIII, sin requerir reintervención quirúrgica. Dragu y cols. muestran un caso de sangrado persistente tras la realización de un colgajo de dorsal ancho en un paciente con déficit adquirido de Factor XIII. Los niveles de dicho factor descendieron hasta el 37 %. Los autores decidieron realizar un manejo conservador aportando 2500 U de concentrado de F. XIII, consiguiendo elevar los niveles al 90 % y controlar la hemorragia en las primeras 12 horas3. Por su parte, Chuliber y cols. describen 12 casos de sangrados postquirúrgicos en pacientes con déficit adquirido de F. XIII. En todos los casos se instauró terapia farmacológica de reemplazo del factor, siendo únicamente necesaria una reintervención quirúrgica en tres de los doce pacientes5.
Por lo referido previamente, es posible que los casos leves de déficit de F. XIII se puedan tratar únicamente con medidas farmacológicas, mientras que los casos más graves requerirán de medidas tanto conservadoras como intervencionistas. Sin embargo, hacen falta más estudios que ayuden a protocolizar el tratamiento.
En conclusión, el déficit adquirido de Factor XIII debe formar parte del enfoque diagnóstico de un sangrado postoperatorio inexplicado por las pruebas de laboratorio ni por la propia intervención. Esta complicación puede poner en riesgo la vida del paciente, especialmente si se produce en el territorio cervicofacial. Actualmente, contamos con opciones terapéuticas que implican el uso medidas farmacológicas y/o intervencionistas dependiendo de la gravedad y las características de cada caso.