INTRODUCCIÓN
El tumor glómico es una neoplasia mesenquimal originada a partir de células musculares lisas modificadas del aparato glómico implicadas en el proceso de termorregulación1.
Este tumor puede localizarse en cualquier parte del cuerpo y representa menos del 2 % de los tumores de tejidos blandos2. Surge preferentemente en las extremidades, particularmente en las yemas de los dedos (área subungueal) y, ocasionalmente, en los tractos respiratorio, digestivo y genitourinario3.
Menos del 1 % de estos tumores se localizan en la zona de la cabeza y el cuello, y hasta ahora solo se han descrito 39 casos de tumores glómicos orales y 3 masticatorios (orofaringe, fosa pterigoidea y parótida)1,3,4. Generalmente son de naturaleza benigna, aunque se han publicado descripciones aisladas de tumores glómicos malignos intraorales5 y tumores benignos de localización múltiple6.
Se han propuesto diferentes hipótesis patogénicas para explicar las diferentes localizaciones de los tumores glómicos: ya sea considerándolos como hiperplasias o hamartomas de células glómicas, como una proliferación heterotópica de células glómicas, o incluso como células perivasculares con diferenciación glomocítica3.
La mayoría de los tumores glómicos orales aparecen como una hinchazón indolora2 o neoplasia, y ocasionalmente como una masa dolorosa1. El caso aquí descrito es, hasta donde sabemos, el primer tumor glómico descrito en el espacio masticatorio, cuya presentación clínica fue una hinchazón oral dolorosa que afectó a la rama mandibular.
Por lo tanto, el objetivo de este informe fue describir la presentación del tumor con sus principales características clínicas, patológicas e inmunohistoquímicas, junto con su manejo quirúrgico.
CASO CLÍNICO
Mujer de 32 años, sin antecedentes médicos relevantes, remitida al Servicio de Cirugía Oral y Maxilofacial del Hospital Universitario Santiago de Compostela por dolor intenso e hipoestesia en la zona del nervio mandibular. El dolor aumentó durante la apertura de la boca, pero sin ninguna limitación mecánica para el movimiento mandibular.
El paciente había sido tratado con antinflamatorios esteroideos y no esteroideos (tanto locales como sistémicos), junto con miorrelajantes y opioides menores con malos resultados.
La exploración física reveló un abultamiento suave en el espacio masticatorio, sensible a la palpación, que no cambia de color con una presión suave. La ortopantomografía mostró una imagen radiolúcida en la rama de la mandíbula con bordes bien definidos en el área de la lingula mandibulae. La TC y la angio-TC mostraron una lesión hipervascular en el espacio masticatorio derecho con un diámetro máximo de 24,7 mm. La lesión estaba compuesta principalmente por una bola de estructuras vasculares, entre los músculos pterigoideos, erosionando el lado interno de la rama mandibular derecha (Figura 1 y Figura 2 A-B).

Figura 1. A: imagen radiolúcida en rama mandibular. B, C: masa dentro del espacio masticatorio que comprime el lado interno de la rama mandibular. D: histopatología: el tumor estaba compuesto por nidos o láminas de células con pequeños elementos vasculares. El tejido estromal era denso (HE, x10). E: las células tumorales mostraron forma redonda o poligonal, citoplasmas eosinofílicos y núcleos redondos u ovoides. No se observó atipia ni mitosis (HE, x40).
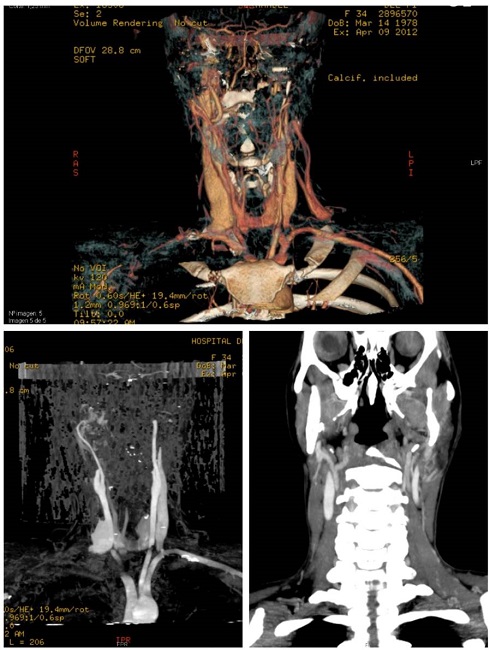
Figura 2. A: angiografía preoperatoria contrastada en color en donde la lesión se percibe claramente. B: angiografía preoperatoria contrastada en blanco y negro en donde la lesión se percibe claramente. C: angio-TC de control después de más de 10 años mostrando ausencia de patología.
Se optó por un abordaje intraoral de la lesión con cervicotomía para controlar la arteria carótida externa por proximidad con el tumor y prevenir hemorragias por una posible lesión intraoperatoria (Figura 3).
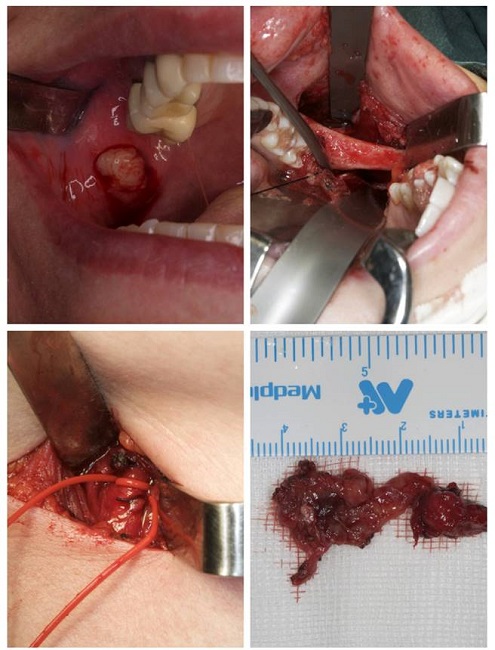
Figura 3. A: abordaje intraoperatorio mostrando el tumor. B: abordaje intraoperatorio mostrando la localización en el espacio masticatorio. C: abordaje cervical mostrando la cervicotomía. D: tumor extirpado y medido.
Análisis patológico: las muestras se fijaron en formalina tamponada neutra al 10 % durante 24 horas y se incrustaron en parafina de forma rutinaria. Las secciones, de 4 mm de espesor, fueron teñidas con hematoxilina y eosina (H&E). Las técnicas inmunohistoquímicas se realizaron automáticamente en un Autostainer Link 48 (Dako-Agilent, Glostrup, Dinamarca). Se emplearon los siguientes anticuerpos primarios Flex (Dako-Agilent): vimentina, actina del músculo liso (AML), actina específica del músculo (HHF35), cadena pesada de miosina del músculo liso (MML-CP), calponina, desmina, proteína S100, CK AE1/AE3, CD31, CD34, factor VIII, D2-40, CD56, CD68, cromogranina, sinaptofisina y Ki67 (MIB1). EnVision FLEX/HRP (Dako-Agilent), una peroxidasa de rábano picante de polímero dextrano, se utilizó como sistema de detección, y 3,3'-diaminobencidina como cromógeno.
Histológicamente, el tumor mostró un patrón organoide compuesto por masas sólidas e islas de células tumorales con espacios vasculares delgados rodeados de tejido conectivo denso. Las células tumorales eran pequeñas y uniformes. Presentaban morfología redonda o poliédrica y citoplasmas eosinofílicos. Los núcleos eran redondos u ovoides, pequeños y regulares. No se encontró atipia, y las figuras mitóticas eran discretas.
Las técnicas inmunohistoquímicas mostraron una positividad difusa y fuerte para la vimentina (Figura 4). La actina del músculo liso (AML), la actina específica muscular (HHF35) y la cadena pesada de miosina del músculo liso (MML-CP) también fueron positivas, pero la inmunorreactividad para estos marcadores varió tanto en extensión como en intensidad entre diferentes áreas tumorales. Calponina mostró inmunotinción focal y débil. Se observó negatividad para desmina, proteína S100, CK AE1/AE3, CD31, CD34, Factor VIII, D2-40, CD56, CD68, cromogranina y sinaptofisina. El índice de proliferación (Ki67-MIB1) fue menor del 1 %.
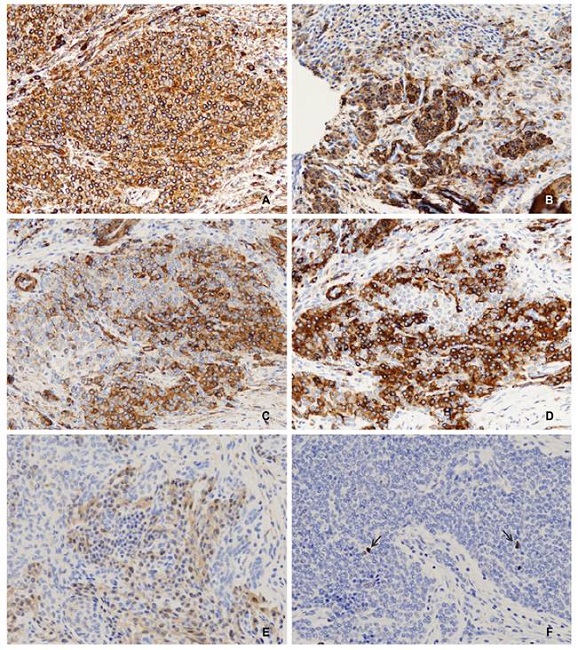
Figura 4. Inmunohistoquímica. A: prácticamente todas las células tumorales presentaron inmunorreactividad intensa para la vimentina (x20). B: actina del músculo liso (AML, x20). C: actina específica del músculo (HHF35, x20). D: la cadena pesada de miosina del músculo liso (MML-CP, x20) mostró inmunorreactividad irregular, con células positivas intensas entremezcladas con débiles o negativas. E: la inmunotinción para calponina fue focal y débil (x20). F: el índice de proliferación fue muy bajo, con núcleos dispersos inmunoteñidos para Ki67 (MIB1) (IHC, x20).
Sobre la base de estos hallazgos morfológicos e inmunohistoquímicos, el tumor se diagnosticó como un tumor glómico (tipo sólido de la clasificación de la OMS). No se observaron incidencias relevantes en el periodo intraoperatorio y postoperatorio. El paciente permanece asintomático después de más de 10 años de seguimiento con una hipoestesia en el área del nervio mandibular como única secuela. La angio-TC no mostró signos de recurrencia (Figura 2 C).
DISCUSIÓN
Las localizaciones orales más frecuentemente descritas para los tumores glomus son labio (n = 14), paladar duro (n = 7), mucosa bucal (n = 7), lengua (n = 5), encía y maxilar periodontal (n = 4) 1,3,4,7,8. Los tumores glómicos de localización múltiple son raros (cara, labio y mucosa bucal) 6, al igual que las presentaciones intraóseas con reabsorción radicular4. El caso mencionado que informamos se localizó dentro del espacio masticatorio, que puede albergar una amplia gama de trastornos, como pseudolesiones, lesiones del desarrollo e inflamatorias, así como tumores benignos y malignos o extensiones secundarias de tumores al espacio masticatorio; estas patologías pueden en ocasiones presentar características en común como ser radiolúcidas, redondeadas, limitadas en forma, y también pueden estar en relación con los dientes, dificultando su diagnóstico9. Este caso muestra el tumor glómico causante de cambios erosivos en la rama mandibular, vistos como una imagen radiolúcida en la ortopantomografía, sugiriendo una impresión primaria de lesión ósea de origen quístico o inducida por un tumor odontogénico (queratoquiste odontogénico, ameloblastoma, etc.), o pareciendo una lesión fibro-ósea como un fibroma osificante, o incluso parecida a la imagen producida por un tumor neurogénico. Sin embargo, la TC, la angio-TC y la RNM son herramientas obligatorias en el diagnóstico que permitieron identificar claramente la lesión como extraósea de origen vascular, lo que orientó tanto el diagnóstico como el abordaje terapéutico.
Los tumores glómicos benignos han demostrado ser capaces de ocupar el área de la médula ósea y reabsorber las raíces y el hueso cortical4.
En cuanto a los síntomas, los tumores orales suelen ser asintomáticos, mientras que los extraorales suelen ser dolorosos2. El dolor experimentado varía ampliamente en intensidad3, y los pacientes generalmente lo relacionan con variaciones en la presión10, lo que bien puede explicar los cambios en la intensidad del dolor con los movimientos masticatorios reportados por nuestro paciente.
Los tumores glómicos, especialmente los no superficiales, son un verdadero desafío para el diagnóstico prequirúrgico. Tanto la TC como la RNM son primordiales en el diagnóstico de masas del espacio masticatorio para distinguir entre lesiones intrínsecas y extrínsecas a este espacio; la TC aporta datos precisos acerca de tejidos duros y la RNM provee datos exactos en términos de tejidos blandos, haciendo un correcto diagnóstico basado en el componente de la lesión y su relación con las estructuras adyacentes9. La angiografía por tomografía computarizada o la angiografía por resonancia magnética también son útiles para el mapeo vascular de la lesión.
El tratamiento de los tumores glómicos es la escisión quirúrgica, con diferentes enfoques posibles. En el caso que presentamos, un abordaje intraoral puede ser útil para tumores pequeños y benignos seleccionados. En términos generales, la recidiva de los tumores glómicos es relativamente infrecuente (5-17 %)4, con 3 recurrencias de 39 (7,6 %)4,7,9 tumores orales notificados después de periodos de seguimiento que van de 2 meses a 8 años.
Se han descrito tres patrones histológicos diferentes de tumores glómicos: los más frecuentes son el tumor glómico sólido (masas sólidas de células glómicas), seguido del tipo angiomatoso (glomangioma) y el glomangiomioma (músculo liso)1.
El tipo sólido fue predominante en el caso que presentamos, y el perfil inmunohistoquímico puede arrojar luz sobre la histogénesis y filiación de los subtipos de tumores glómicos en esta localización rara, no descrita anteriormente.
En esta línea, los tumores glómicos deben incluirse en el diagnóstico diferencial de neoplasias en el espacio masticatorio, ya que puede aparecer incluso siendo un tumor poco frecuente en una localización atípica.














