INTRODUCCIÓN
Entendemos por Producto Sanitario a Medida (PSM) todo instrumento, dispositivo, equipo, programa informático, implante o material destinado a su uso en personas con fines médicos (diagnóstico, prevención, predicción, pronóstico o tratamiento), y que se haya fabricado bajo prescripción médica para ser utilizado únicamente por un paciente determinado con el fin de atender necesidades particulares1.
El PSM nos permite avanzar hacia la cirugía digital personalizada y de precisión. Se trata de una innovación asistencial con enormes ventajas potenciales por su personalización a muy bajo coste, pero donde también existen riesgos que obligan a cumplir una legislación muy amplia y exigente, tanto nacional como europea.
Los PSM se regulan a partir del Reglamento (UE) 2017/745 del Parlamento Europeo2, de directa aplicación en todos los países de la Unión Europea. Esta norma pretende garantizar el más alto nivel de seguridad y de protección de la salud de los pacientes y los usuarios, e impulsar la innovación. En España, el 21 de marzo de 2023 se publicó en el BOE el Real Decreto 192/2023 (RD 192/2023) que regula ciertos aspectos competenciales que el reglamento concede a nivel nacional3.
El concepto de hospital fabricante contemplado en esta legislación surge, no como competencia de la industria médica tradicional, sino como un nuevo modelo asistencial y académico que permite generar valor gracias a la incorporación de ingenieros a la infraestructura del hospital con la máxima seguridad y calidad para los pacientes. El proceso se compone de varias etapas: la adquisición de imagen radiológica, la segmentación digital, el diseño 3D, la fabricación aditiva en múltiples materiales y técnicas, la esterilización, el registro documental completo, la biovigilancia y el control de calidad de los procesos. Todo este flujo de trabajo acumula experiencia y conocimiento, que se quedan dentro del centro hospitalario, y que supone una mejora incremental en los procesos asistenciales4.
El Real Decreto 192/2023 también aborda el sistema de vigilancia de productos sanitarios como un instrumento fundamental para la garantía de la seguridad y calidad de los mismos. Recibe y evalúa las notificaciones de incidentes graves y las acciones correctoras de seguridad y determina las medidas de protección de la salud dirigidas a reducir sus consecuencias y a prevenir su repetición en el futuro. Dedica atención especial a los productos implantables, con la regulación de la tarjeta de implante.
El conceptoPoint of Care (POC), análogo al de fabricación académica, comprende la creación "justo a tiempo" de un modelo anatómico, instrumental quirúrgico o cualquier otro dispositivo médico basado en datos de imagen y realizado en el lugar de atención al paciente o en una instalación propiedad de la institución que proporciona los cuidados5,6. La amplia legislación a cumplir en el proceso POC integrado como fabricación académica hospitalaria es uno de los grandes inconvenientes para su universalización.
Atendiendo al riesgo que suponen para el paciente, los productos sanitarios se clasifican en cuatro clases: clase I, clase IIa, clase IIb y clase III. Los productos de clase I se corresponden con el menor riesgo, y los de clase II con el mayor riesgo. Los productos clase I son aquellos que no entran en contacto con el paciente o que entran en contacto solo con la piel intacta. Se incluyen también los productos que penetran por orificios corporales, como la boca o nariz, pero de uso pasajero. Los productos clase IIa son aquellos que se introducen en el cuerpo por orificios corporales o por medios quirúrgicos (a través de la piel), pero que no están destinados a permanecer en él. Los productos clase IIb son aquellos implantables (aunque muchos se clasifican como clase III) o los que pueden influenciar en los procesos fisiológicos o que administran sustancias o energía de forma potencialmente peligrosa y que se destinan al diagnóstico de las funciones vitales. Por último, los productos clase III son aquellos productos implantables destinados a entrar en contacto con el sistema nervioso central o con el sistema circulatorio central con fines de terapia o diagnóstico, los que contienen sustancias medicinales, los que se absorben totalmente y los que contienen derivados animales7.
Basado en esa clasificación la Agencia Española de Medicamentos y Productos Sanitarios establece dos escenarios posibles para la fabricación hospitalaria: la fabricación in-house y la fabricación bajo licencia.
Para la primera se establece el requisito de ser fabricado y utilizado en el mismo hospital (centros sanitarios con camas de hospitalización, excluido por tanto centros de consultas o centros médicos pequeños) y se limita a la fabricación de productos clase I o clase IIa, en el marco de proyectos de innovación, que respondan a necesidades específicas de grupos de pacientes, con prohibición de cesión a terceros o de venta al público. Mientras que, para el segundo escenario, la fabricación de implantes (clase IIb y III), resulta imprescindible tener licencia de fabricante y trabajar bajo un sistema de gestión de calidad sólido (norma ISO 13485), que priorice la trazabilidad y la biovigilancia4. En el RD (192/2023) se especifica que los productos de clase IIb, clase III e implantables no podrán ser objeto de fabricación por las unidades hospitalarias con actividad de fabricación en la modalidad de actividad in-house3. Para poder realizarlo el hospital debe conseguir licencia específica de fabricante.
En España existen actualmente más de 20 hospitales universitarios con unidades de impresión 3D con licencia o comunicación de actividad in-house para producir PSM tipo I y IIa. El Hospital General Universitario Gregorio Marañón dispone de una unidad de planificación avanzada y manufactura 3D (UPAM3D) que obtuvo en 2020, por iniciativa del Servicio de Cirugía Ortopédica y Traumatología, la primera licencia de fabricación in-house para PSM en España (tipo I y IIa) y que, por tanto, cumple todos los requisitos legales y de control de calidad en los procesos bajo la norma ISO 13485. Además, recientemente ha sido el primer hospital en conseguir la licencia, de alcance europeo, como hospital fabricante para PSM tipo IIb. De manera que desde septiembre de 2023 podemos planificar, diseñar y producir implantes permanentes a medida en nuestros pacientes, siendo además centro de referencia de la Comunidad de Madrid. Es, en sentido estricto, el primer hospital fabricante a nivel nacional. La UPAM3D tiene establecidas alianzas con más de 25 empresas de ingeniería proveedoras y acuerdos de subcontratación para la fabricación delegada o colocalizada (outsourcing) de los PSM.
En la última revisión en abril de 2023, en el periodo de enero de 2022 a marzo de 2023, sobre un total hospitalario de 365 casos, Cirugía Maxilofacial era el servicio que más casos había desarrollado en la UPAM3D, con un 32,7 % del total del hospital, seguido por traumatología y ortopedia con un 27,2 %. En el Servicio de Cirugía Maxilofacial, del total de casos realizados, el 62 % corresponde a biomodelos de uso intraoperatorio, fundamentalmente órbitas; el 28 % guías de corte y férulas, estas últimas principalmente para cirugía guiada de implantes osteointegrados; el 6 % prótesis a medida en titanio o PEEK obtenidas mediante fabricación delegada; el 3 % biomodelos de uso educativo; y el 1 % otros, como por ejemplo material fungible de apoyo quirúrgico. Si se van a emplear quirúrgicamente, tras la impresión se esterilizan y utilizan en los pacientes. Estos porcentajes concuerdan con la revisión del grupo de Ostas8, que especifica un 39 % de biomodelos, un 15 % de moldes, un 33 % de guías quirúrgicas, un 7 % de implantes específicos para el paciente, un 4 % modelos educativos y un 2 % de placas de osteosíntesis a medida.
Realizamos una descripción de 3 casos y del flujo de trabajo como hospital fabricante, en diseño y manufactura de producto sanitario a medida clase IIB.
MATERIAL Y MÉTODOS
Presentamos una serie de ejemplos de tres casos tratados en el Servicio de Cirugía Oral y Maxilofacial del Hospital General Universitario Gregorio Marañón durante los años 2023-2024, que requirieron reconstrucción con un PSM IIB. En los tres casos se realizó fabricación académica hospitalaria de PSM en colaboración con la UPAM3D.
En los 3 casos se realizó un diagnóstico de la patología mediante tomografía computarizada (TC); en uno de ellos también se realizó RM. Dos pacientes presentaban hemangioma intraóseo (uno supraorbitario y el segundo caso a nivel de huesos propios nasales) y el otro paciente una fractura mandibular patológica secundaria a osteorradionecrosis.
Una vez el cirujano tiene el diagnóstico clínico corroborado con las imágenes de TC y/o RM y el informe del radiólogo, realiza la petición a la Unidad de Procesado Avanzado y Manufactura 3D (UPAM3D) mediante un formulario incorporado a la historia clínica del paciente en el sistema HCIS (Health Care Integrated System) del hospital. Exactamente igual que se solicita una radiografía de tórax o una analítica, podemos solicitar un biomodelo de estudio, una guía de corte o una prótesis implantable permanente (Figura 1). La UPAM3D recibe la solicitud y prepara la transformación de las imágenes mediante un proceso de diseño digital (adquisición, segmentación y procesado) con diferentes softwares. Los softwares empleados en esta unidad por el equipo de ingenieros son el "3D slicer" y el "mimics software (materialise)", el primero de ellos libre y el segundo bajo pago de licencia. Dentro de los softwares empleados habitualmente por los cirujanos del servicio son el Blue Sky Bio y el Meshmixer. Los ingenieros de la Unidad, integrados en el circuito asistencial, tienen acceso a las pruebas de imagen y preparan el caso conjuntamente con los cirujanos en una primera reunión para la aprobación de los diseños digitales. Una vez los diseños son los correctos, tanto de las guías de corte como de las prótesis a medida, se genera una prescripción que debe ser firmada por el cirujano que se responsabiliza y se emite una orden al servicio de compras del hospital para contratar la fabricación delegada de la prótesis a medida. Si el caso solo requiere guías de corte se procede a la impresión 3D in-house.
Habitualmente se requieren tres presupuestos distintos a diferentes empresas para adjudicar la fabricación de la prótesis a medida, dando importancia también a los tiempos de producción y entrega. Todos los proveedores están auditados y tienen garantía de calidad. Dentro de las empresas acreditadas y auditadas por la UPAM3D, estas se seleccionan según experiencia previa de la empresa en la patología de interés, el coste y la opinión del cirujano principal. Una vez fabricada la prótesis, esta es enviada a la UPAM3D que la recepciona y envía a esterilizar para su uso clínico según el manual de calidad de los procesos de esterilización. Desde allí es enviada al quirófano para su uso en el paciente. Una vez completado el flujo de trabajo se emite un documento donde queda reflejado el nombre del paciente, número de historia, cirujano e ingeniero responsable y las características del diseño y fabricación de la prótesis a medida. Este documento queda incorporado como un informe más a la historia clínica del paciente.
RESULTADOS
El primer caso es el de un paciente varón con un hemangioma intraóseo supraorbitario izquierdo, que se intervino de resección y reconstrucción con PSM mediante un abordaje tipo blefaroplastia superior (Figura 2). Se diseñaron las guías de corte y la prótesis de titanio a medida.
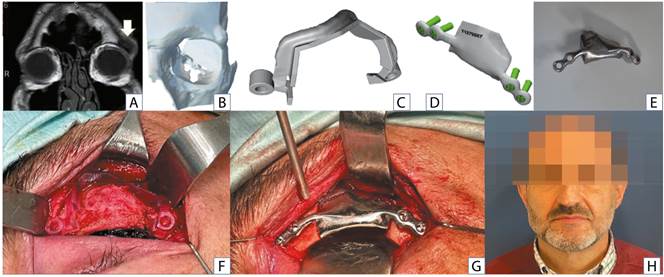
Figura 2. A: imagen preoperatoria de la lesión. B: diseño digital de biomodelo. C: diseño digital guía quirúrgica. D: diseño digital PSM. E: PSM en titanio. F: imagen intraoperatoria guía en negativo. G: imagen intraoperatoria PSM. H: imagen postoperatoria.
El segundo caso es un paciente varón con una fractura patológica mandibular secundaria a osteorradionecrosis, que se intervino de reducción abierta y fijación interna con placa de alto perfil en basal mandibular con abordaje cervical para prevenir comunicación del PSM con la cavidad oral (Figura 3). Diseñamos distintas alternativas de guía de reposicionamiento mandibular, diferentes diseños de placas de reconstrucción mandibular con apoyo vestibular o basal, optando finalmente por reducir los fragmentos, injerto de interposición y placa en la basal mandibular.
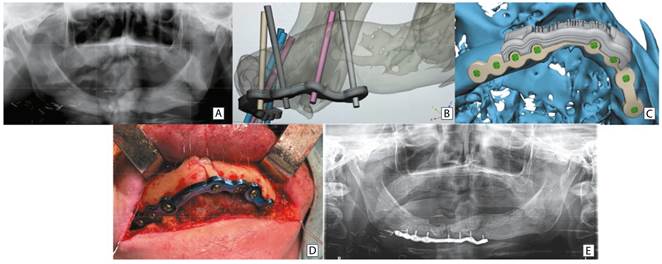
Figura 3. A: imagen preoperatoria de fractura patológica mandibular por osteoradionecrosis. B: diseño de orificios de placa de reconstrucción según zonas de mejor densidad ósea. C: diseño de placa de alto perfil en la basal con guía de reposicionamiento de fragmentos y placa d. D: imagen intraoperatoria, abordaje cervical sin comunicar con cavidad oral. E: ortopantomografía postoperatoria, evolución sin complicaciones.
El tercer caso es un paciente varón con un tumor vascular a nivel de dorso nasal, que se intervino de resección y reconstrucción con PSM mediante abordaje por cicatriz nasal de traumatismo previo. En este caso la guía quirúrgica se diseñó en positivo, con el fin de evitar una incisión de mayor tamaño (Figura 4) y prótesis de titanio fenestrada para reconstrucción del contorno nasal.
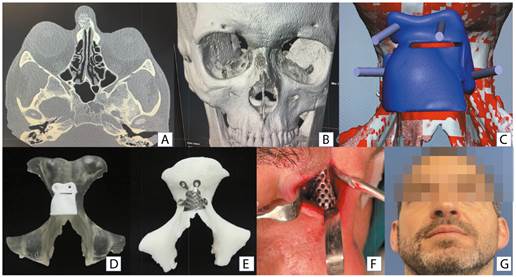
Figura 4. A: imagen TC lesión huesos propios nasales. B: reconstrucción 3D preoperatoria (TC). C: diseño digital guía quirúrgica. D: guía quirúrgica sobre biomodelo. E: PSM sobre biomodelo. F: imagen intraoperatoria de PSM. G: imagen postoperatoria.
En los 3 casos se consiguió buena precisión según la planificación previa y buenos resultados estéticos y funcionales. Ninguno de los pacientes presentó complicaciones en el postoperatorio inmediato ni durante el seguimiento.
DISCUSIÓN
En el concepto de una unidad POC se acepta como la creación en el plazo oportuno de un modelo anatómico, instrumental quirúrgico o cualquier otro dispositivo médico basado en datos de imagen y realizada en el lugar de atención al paciente o en una instalación propiedad de la institución que proporciona los cuidados7.
La FDA sobre los POC y la impresión 3D, en un documento abierto a discusión, afirma que la tecnología aplicada al POC hospitalario tiene el potencial de responder ágilmente a las necesidades de los pacientes, aportando a tiempo tratamientos personalizados y aportando innovación al cuidado de los pacientes y sus terapias. Advierte a su vez que siempre debemos tener en cuenta que los PSM fabricados en el hospital deben ser de la máxima calidad, desarrollados según el diseño previo y en ningún caso pueden exponer al paciente a riesgos no razonables de posible daño o lesión9.
Tras la pandemia, la FDA reconoce el potencial imparable de las unidades POC y la impresión 3D y resume las controversias en 4 puntos:
- Asegurar que los dispositivos obtenidos en los POC son seguros y efectivos. Esa seguridad debe ser independiente de dónde y cómo se ha manufacturado el producto.
- Garantizar los controles apropiados durante la fase de diseño y manufactura para cumplir las especificaciones obligatorias en cada producto.
- Establecer claramente la entidad responsable del producto. Dicha responsabilidad se extiende al diseño, pruebas, documentación, control de calidad de producción, recogida y manejo de efectos adversos y de quejas, así como establecer las acciones correctoras precisas.
- Formación y capacidades del POC: las entidades responsables deben garantizar el conocimiento y experiencia para realizar adecuadamente sus actividades.
El concepto de hospital fabricante supone una innovación con alto valor científico, pues supone la integración en la práctica clínica habitual (diagnóstico, planificación y diseño a medida que queda reflejado en la historia clínica del paciente), e introduce el control de calidad y la vigilancia local continuada en el tiempo. La responsabilidad legal de todo este proceso la asume el hospital y con él el cirujano prescriptor de cada caso. Debemos entender, por tanto, que nuestra responsabilidad como cirujanos en el PSM se extiende a tres escenarios, ¿quién diseña, quién lo usa y quién se responsabiliza?
El cirujano que diseña debe firmar la prescripción del diseño previo a su fabricación en todos los casos. Por tanto, la responsabilidad del cirujano se inicia desde el momento del diseño y afecta también al software utilizado, que puede ser libre o usado bajo una licencia. Como afirma Ganry, dado que ninguno de los programas de código abierto ha sido validado para uso médico por parte de la Comunidad Europea, los cirujanos que utilizan estos programas de planificación para sus pacientes deben ser conscientes de que serán responsables de cualquier daño potencial debido al uso de esta técnica. Esa responsabilidad es la misma, no varía, si usamos un software bajo licencia o con pago por uso10.
Las dos grandes ventajas del concepto manufactura POC son la posibilidad de fabricar un producto a medida en tiempo muy corto y a un costo económico muy reducido, de manera que es un concepto innovador, costo efectivo y de posible aplicación universal.
Un aspecto importante en el presupuesto de la UPAM3D es el coste de las licencias de software. Está establecido que si usamos software de código abierto, gratuito, podemos obtener guías de corte por menos de 2 € cada una11,12. Existen licencias de software de pago anual, muy utilizadas, que alcanzan hasta los 12.000 € de cuota anual.
Otro capítulo importante del presupuesto de la unidad es el coste de las impresoras y el material de impresión de las guías. En cuanto a manufactura de PSM categoría I y II, empleamos dos tipos de impresoras, de fusión y deposición de filamento mediante técnica aditiva, capa a capa, o de polimerización láser de una resina mediante estereolitografía.
Respecto a la fabricación de PSM categoría IIB y III, en el área de cirugía maxilofacial, los materiales más empleados son el titanio y el PEEK. Con relación a la impresión 3D, nuestra unidad está en trámites de adquirir la primera impresora hospitalaria en PEEK (material termoplástico semicristalino de excelente biocompatibilidad) para una fabricación aditiva y esterilización in situ. Se basa en utilizar tecnología de impresión 3D por depósito fundido. El PEEK presenta características físicas similares al hueso cortical humano, con alta resistencia mecánica a la corrosión y a la abrasión y alta biocompatibilidad tras la implantación. Además es radiotransparente, lo que facilita el seguimiento y es modificable intraoperatoriamente.
En el estudio de viabilidad el coste de esa impresora representa el consumo bianual, solo en craneoplastias, del Servicio de Neurocirugía. Dentro del estudio de un proyecto competitivo presentado al ministerio por la UPAM3D en la que participan varios miembros del servicio para adquirir una impresora PEEK y avanzar en la fabricación académica, se estima que una vez que se cuente con una unidad de producción hospitalaria cualificada, los costes de amortización y el precio del material biocompatible, supone unos 200-300 € por craneoplastia. Debemos de saber que la industria, con sus márgenes de beneficio de fabricación y distribución, cobra unos 6000 € por craneoplastia. El mensaje fundamental desde el punto de vista económico es que el hospital no ahorra gastos como el sector privado, sino que reduce costes para escalar la solución personalizada a un mayor número de pacientes.
Situación distinta es la impresión en titanio, que necesita maquinaria mucho más costosa. Es aquí donde la fabricación delegada, el outsourcing, es la alternativa más económica para nuestra unidad. El hecho de presentar nuestro diseño a tres fabricantes distintos ya supone una cierta contención de los costes. Son fabricantes auditados, que competirán entre ellos por proporcionar el producto en el mínimo tiempo y con presupuestos ajustados. Todo esto redunda en una disminución del coste de cada prótesis a medida y permite con el mismo presupuesto extender el uso a muchos más pacientes. En los casos oncológicos, no solo el presupuesto sino también los tiempos de producción y entrega son factores clave para adjudicar el caso a uno u otro fabricante. Es lógico pensar que el aumento de casos y la generalización de la fabricación académica como centro de referencia suponga una disminución mayor del coste de cada caso.
La gestión de la calidad mediante un programa de garantía de productos y procedimientos es otro elemento fundamental. Supone contar con un responsable técnico con la cualificación y titulación adecuada y un sistema de archivo documental para almacenar la documentación generada con cada producto y el mantenimiento de un registro de todos los productos que permita garantizar la trazabilidad de los mismos. Para los dispositivos implantables, según el Reglamento Europeo de 20172 y el Real Decreto nacional de 20233, se debe conservar la documentación al menos 10 años. La incorporación de esa documentación a la historia clínica del paciente cubre los aspectos médico-legales y además en cada caso la unidad emite un informe que se adjunta a la historia, e incluye las particularidades del diseño y la fabricación de la prótesis a medida junto a fotografías de la misma. En los próximos años asistiremos al desarrollo de la normativa de vigilancia a largo plazo de las prótesis fabricadas a medida, esto también debe ser realizado por el cirujano y deberá quedar reflejado en la historia clínica del paciente.
Por tanto, el sistema de gestión de calidad ISO 13485 genera toda la preceptiva documentación técnica que cumple la legislación vigente: documentación de prescripción y justificación clínica para un paciente específico, documento de conformidad y liberación del producto, proceso de esterilización empleado, instrucciones de uso y etiquetado, datamatrix inequívoco para trazabilidad (sistema industrial de codificación de datos bidimensional) y documento de implante que se incluye en la historia clínica de paciente.
Respecto al entorno europeo, Ostas y cols.8 establecen que en el campo de la cirugía maxilofacial los modelos anatómicos son los productos personalizados más frecuentemente producidos de forma in-house en los hospitales europeos, (39 % del total de las aplicaciones in-house), seguido por la elaboración de guías de corte con un 32 % de los casos de uso y ya mucho más excepcional, la creación de dispositivos implantables permanentes en los pacientes. Considera que la producción de productos implantables requiere un equipamiento costoso y cumplir unos requisitos legales que son muy difíciles de alcanzar en un entorno hospitalario.
Para nosotros la planificación virtual personalizada y el producto sanitario a medida permiten al cirujano la disminución del tiempo quirúrgico, un menor tiempo de ingreso hospitalario, una mayor precisión y predictibilidad de los resultados y una recuperación más rápida; todo ello disminuyendo el coste sanitario global del procedimiento11,13.
Se ha observado en diferentes estudios que la inclusión de unidades con esta tecnología en el centro de atención al paciente permite solventar problemas, permitiendo una comunicación fluida entre radiólogos, clínicos e ingenieros8,11. Otra ventaja es que permite el control y monitorización del procedimiento completo, desde la petición del producto hasta el empleo del mismo, pasando por la verificación, modificaciones del diseño, producción y control de seguridad y calidad9,14. Todo ello permite al cirujano tener la posibilidad de incluir esta tecnología en su día a día, mejorando los resultados y la calidad de vida de los pacientes1.
CONCLUSIONES
El diseño personalizado y la fabricación aditiva mediante impresión 3D de guías de corte en el "point-of-care" o de implantes específicos permanentes de forma delegada (outsourcing) permite una mejora de la técnica quirúrgica, aumentando la precisión de los resultados y su personalización junto al empleo de abordajes más conservadores con excelentes resultados estéticos y funcionales. La inclusión de estas unidades en el entorno hospitalario permite una monitorización y registro del proceso completo de diseño y fabricación del producto sanitario a medida.
El futuro de la medicina personalizada está en el trabajo por procesos en unidades multidisciplinares como la UPAM3D. La unión de radiólogos, cirujanos e ingenieros permite construir un lenguaje común y una visión compartida innovadora que mejora nuestros resultados y convierte la medicina personalizada, a medida, en una realidad.















