Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 no.6 Madrid ago./sep. 2005
REVISIÓN
Tolerabilidad de Aspirina
M. R. Moreno-Brea1
| Moreno-Brea MR. Aspirin tolerability. Rev Soc Esp Dolor 2005; 12: 357-372.
| ||
| SUMMARY The acetylsalicylic acid (ASA) is a widely used drug worldwide, both as prescription and over-the-counter products, and both as the only active drug or associated to other drugs in fixed doses. It is used either occasionally for the management of acute symptomatic conditions, or continuously in prophylactic anti-thrombotic regimes. Its profile of adverse reactions and potential interactions with other drugs makes it very important to have a well-tolerated and safe substance. Both things are particularly relevant when the population exposed to this drug has reached a certain age, since its specific features may increase its susceptibility to side effects and complications. Aspirin shares the general profile of adverse reactions of the NSAIs and it is considered as its prototype. When acutely administered, the incidence of side effects, most of them light, are the same as with other analgesics. Gastrointestinal effects are the most frequent of all and several risk factors have been identify for the development of severe gastrointestinal complications. These risk factors must be considered along with the need to take prophylactic measures in order to reduce the morbi-mortality. In recent years, special attention has been devoted to hypersensitivity reactions, in particular Aspirin-induced asthma, and potential cross-reactions with other frequently used NSAIs. The most susceptible sub-population for asthmatic reactions has well-defined features. The anti-aggregation effects of Aspirin can complicate some conditions associated to hemostasis disorders; however, its benefit has been shown for the prevention of athero-thrombotic vascular accidents. The Reye´s Syndrome is a rare but severe condition in which the use of Aspirin is contraindicated in children or adolescents with fever or certain viral infections. Given the extensive use of Aspirin, it can generally be considered a well-tolerated drug whose most severe adverse reactions require special pharmacovigilance, as well as special attention to high risk populations. This also suggests the need to implement health education programs about the use of analgesics. In any case, Aspirin is still a reference drug with a high therapeutic potential derived from the benefits provided by its use. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S.L. Key words: Aspirin. NSAIs. Tolerability. Adverse reactions to drugs. Interactions. Elderly. Gastropathy. Asthma.
| RESUMEN El ácido acetilsalicílico (AAS) es un fármaco profusamente utilizado en todo el mundo, presente tanto en preparados que requieren prescripción médica como en productos de libre dispensación, sea en formulaciones que lo contienen como único principio activo, sea como parte de asociaciones a dosis fija. Se emplea tanto de forma puntual, en indicaciones agudas, sintomáticas, como de forma continuada en los regímenes profilácticos anti-trombóticos. Así pues, es muy importante disponer de una sustancia bien tolerada y segura, por su perfil de reacciones adversas y capacidad para interaccionar con otros fármacos. Ambos rasgos son particularmente importantes cuando la población expuesta al fármaco es de cierta edad, debido a sus particulares características que aumentan la susceptibilidad ante reacciones adversas y sus complicaciones. Aspirina comparte el perfil general de reacciones adversas de los AINE, de los que se considera el fármaco prototipo. Administrada de forma aguda, la incidencia de reacciones adversas, por lo general leves, parece similar a la de otros analgésicos. Destacan por su frecuencia los efectos sobre el tracto gastrointestinal, habiéndose detectado una serie de factores de riesgo para el desarrollo de complicaciones graves de las lesiones digestivas. La consideración de estos factores de riesgo junto con la toma de medidas profilácticas, puede disminuir su morbimortalidad. En los últimos años se ha prestado especial atención a las reacciones de hipersensiblidad, destacando el asma inducido por Aspirina, que puede ser cruzado con otros AINE de uso, asimismo, frecuente. El sector de la población más susceptible a presentar reacciones de tipo asmático, presenta unos rasgos bien definidos. Las propiedades antiagregantes de Aspirina pueden complicar ciertas situaciones en que la hemostasia está comprometida, no obstante, se ha demostrado su beneficio en la prevención de accidentes vasculares de carácter atero-trombótico. El síndrome de Reye es un cuadro de rara presentación, pero de graves consecuencias, que contraindica el uso de Aspirina en niños o adolescentes con fiebre o ciertas infecciones virales. Dada la extensa utilización de Aspirina, puede ser considerado un fármaco bien tolerado en general, cuyas reacciones adversas más graves deben ser objeto de una especial farmacovigilancia, prestando especial atención a la población de mayor riesgo. Esta situación aconseja, asimismo, la puesta en marcha de programas de educación sanitaria sobre el uso de los analgésicos. En todo caso, Aspirina sigue siendo un fármaco de referencia con una importante potencialidad terapéutica derivada de los beneficios inherentes a su uso. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S.L. Palabras clave: Aspirina. AINE. Tolerabilidad. Reacciones adversas medicamentosas. Interacciones. Ancianos. Gastropatía. Asma.
|
1Dpto. de Neurociencias (Farmacología y Psiquiatría). Universidad de Cádiz.
Recibido: 09-03-05.
Aceptado: 18-08-05.
ÍNDICE
1. INTRODUCCIÓN
2. MECANISMOS GENERALES IMPLICADOS EN LAS REACCIONES ADVERSAS DE ASPIRINA
3. REACCIONES ADVERSAS COMUNES DE LOS AINE
3.1. Reacciones adversas de localización gastrointestinal
3.2. Toxicidad renal
3.3. Efectos hematológicos
3.4. Alergia o hipersensibilidad
3.5. Otros efectos indeseables
4. CARACTERÍSTICAS DEL PERFIL DE REACCIONES ADVERSAS DE ASPIRINA
4.1. Reacciones adversas digestivas
4.2. Nefrotoxicidad
4.3. Reacciones de hipersensibilidad a Aspirina: asma inducido por Aspirina
4.4. Reacciones adversas hematológicas
4.5. Síndrome de Reye
4.6. Otros efectos indeseables
4.7. Intoxicación por ácido acetilsalicílico
5. IMPORTANCIA DE LAS INTERACCIONES MEDICAMENTOSAS DE ASPIRINA
5.1. Interacciones farmacocinéticas
5.2. Interacciones farmacodinámicas
6. CONCLUSIONES
1. INTRODUCCIÓN
El ácido acetilsalicílico, Aspirina, es desde su introducción en clínica en el año 1899 un fármaco de primer orden a nivel mundial. Sintetizado en 1853 por los laboratorios Bayer, a la búsqueda de una sustancia contra la artritis de eficacia similar a la del ácido salicílico pero mejor tolerada, sus antecedentes históricos son antiguos y pueden encontrarse en el empleo de corteza de sauce (que contiene un derivado salicílico, la salicilina) ya en el tercer milenio antes de Cristo o en la Grecia Hipocrática. Un siglo después de que se identificaran los principales beneficios terapéuticos de Aspirina, su trayectoria terapéutica aún no está concluida sino que continúa siendo objeto de investigación a la par que se descubren nuevas propiedades e indicaciones médicas, erigiéndose como uno de los hitos de la historia de la Farmacología.
Aspirina (del término Spiraea, planta de la que alguna vez se preparó el ácido salicílico) se ha convertido en el prototipo de analgésico-antitérmico-antiinflamatorio, es decir, del grupo de los antiinflamatorios no esteroideos (AINE), al punto que estos fármacos han llegado a denominarse "fármacos tipo Aspirina" o "similares a Aspirina".
Este grupo de fármacos tiene un gran peso en la terapéutica, siendo ampliamente utilizados debido a su reconocida eficacia analgésica y antiinflamatoria. Su consumo no sólo deriva de la prescripción médica sino que a él también contribuye de manera muy importante su presencia en medicamentos de dispensación libre sin prescripción (productos over the counter, OTC, en la terminología anglosajona). Merece la pena destacar que el ácido acetilsalicílico (AAS) figura como principio activo en varios de los 10 medicamentos de libre dispensación más vendidos en España en los últimos años de forma reiterada. Puede decirse que todos en algún momento de nuestra vida hemos tomado Aspirina. Además, el aumento de las indicaciones que pueden beneficiarse del empleo de AINE, en general, y de AAS en particular, puede suponer en los próximos años un aumento considerable de la población expuesta a estos fármacos, a sus beneficios y a sus posibles perjuicios.
Así pues, en virtud de la magnitud de la población expuesta a los efectos de Aspirina, se acentúa la importancia de conocer su seguridad y su tolerabilidad, es decir, impacto que el uso del medicamento puede tener sobre la vida del paciente, los efectos secundarios que puede ocasionar, su frecuencia y gravedad, particularmente si pueden entrañar compromiso para la vida del paciente.
Por otro lado, la constatación de los efectos beneficiosos de Aspirina en la profilaxis de los eventos trombóticos de origen aterogénico, ha supuesto la extensión de su uso continuado a personas de cierta edad. Así pues, buena parte de la población que toma AAS de forma regular, está constituida por personas mayores. Es bien sabido que este momento de la vida presenta características fisiológicas particulares debido a los cambios experimentados por el organismo en razón de su envejecimiento. Tales modificaciones afectan, no sólo a los efectos de los fármacos (farmacodinamia), sino a su evolución en el organismo (farmacocinética)1 (1-4) (Tabla I), aumentando la vulnerabilidad a los efectos adversos. A estos cambios, inexorables huellas del paso del tiempo, se suman otros factores simultáneos como la presencia de otras enfermedades (que pueden alterar la disponibilidad de los fármacos) y el consumo de diversos medicamentos (Tabla II). Este cúmulo de circunstancias puede colaborar para que se produzca un aumento de la incidencia de efectos secundarios de los analgésicos en el anciano (5,6).
En definitiva, todos estos motivos recomiendan una aproximación detallada a la realidad clínica de las reacciones adversas que pueden presentarse frente al AAS, conociendo no sólo su expresión sintomatológica y gravedad sino, lo que es más importante en su prevención, su epidemiología y los factores de riesgo involucrados en su aparición. Una justa ponderación de los mismos, valorada junto con los numerosos e indudables beneficios terapéuticos de Aspirina, es decir, la estimación de la relación beneficio/riesgo nos permitirá un uso más racional de este fármaco universal.
2. MECANISMOS GENERALES IMPLICADOS EN LAS REACCIONES ADVERSAS DE ASPIRINA
El mecanismo de acción de Aspirina, común al grupo de los AINE, consiste en la inhibición de la enzima prostaglandina-sintasa de endoperóxido o ciclooxigenasa de ácidos grasos. Esta acción básica es la clave no sólo de los principales efectos terapéuticos, sino también de buena parte de las reacciones adversas características de este grupo farmacológico2.
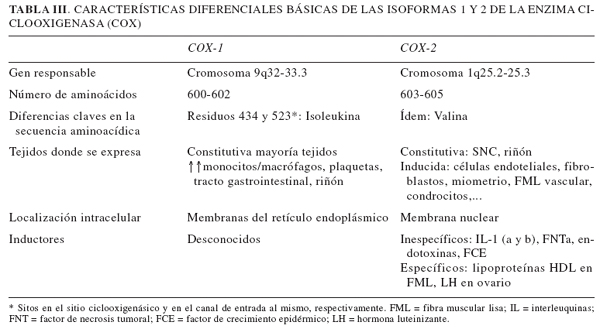
La ciclooxigenasa (COX) es una enzima que interviene en la formación de prostaglandinas a partir de ácido araquidónico, liberado de los lípidos que forman parte de la membrana celular por acción de la fosfolipasa A1 (Fig. 1). Desde principios de la década de los años noventa (7) se conoce la existencia de, al menos, dos isoformas mayores de COX3 (8):
-La tipo 1 (COX-1), cuya expresión es constitutiva en ciertas células en las que se expresa de forma relativamente permanente, controlando la síntesis de eicosanoides implicados en la regulación de numerosas funciones fisiológicas.
-La tipo 2 (COX-2), inducible, es decir, de expresión más restringida en condiciones basales (salvo en algunos tejidos) pero rápidamente aumentada bajo ciertos estímulos, particularmente inflamatorios; interviene en la producción de prostaglandinas en situaciones fisiológicas y patológicas.
Las principales diferencias entre ambas isoenzimas pueden apreciarse en la Tabla III. Las divergencias reconocidas entre ellas han permitido explicar mejor el espectro de acciones de los AINE, tanto los terapéuticos como los indeseables. Asimismo, su conocimiento ha orientado la síntesis y comercialización de un nuevo tipo de AINE, los inhibidores selectivos de la COX-2, también llamados en sus inicios "super-Aspirina", por conservar teóricamente las propiedades terapéuticas del grupo en ausencia de sus efectos indeseables, fundamentalmente digestivos. No obstante, su uso ha demostrado que no están carentes de efectos secundarios, pese a su diferente perfil, y sus aplicaciones terapéuticas también abarcan un espectro diferente.
Papel de las isoenzimas de la COX. El descubrimiento de los dos tipos de isoenzimas mayores de la COX y el establecimiento de su participación diferencial en el mantenimiento de la homeostasis ha sido una de las líneas de investigación fisiológica que más interés ha despertado en la década de los noventa por su aplicabilidad farmacológica. Aunque la codificación de estas enzimas depende de genes situados en distintos cromosomas, sus diferencias estructurales son mínimas desde un punto de vista funcional. En efecto, pese a que COX-1 y COX-2 sólo comparten un 63% de la secuencia de aminoácidos, los sitios de unión para el ácido araquidónico o para los AINE (sus dos sustratos específicos) son prácticamente idénticos en ambas, diferenciándose sólo en un par de aminoácidos de los presentes en el dominio catalítico. Por el contrario, sus patrones de síntesis y distribución difieren bastante, determinando su diferente contribución fisiológica (revisión en 9 y 10).
Merece la pena destacar en lo que a implicación funcional se refiere, la participación de la COX-1 en el mantenimiento de la homeostasis interna, en tanto que enzima constitutiva en numerosos tejidos entre los que destacan riñón y tracto gastrointestinal. Así, interviene en la síntesis de prostaglandinas claves en el mantenimiento de la integridad de la mucosa gastroduodenal, de la función renal normal, así como en la agregación plaquetaria. La COX-2, por su parte, participa en la formación de prostaglandinas importantes en la ovulación, el desarrollo del embarazo, del parto y posiblemente también en la integración central de la nocicepción y en la termorregulación. Además, como se ha comentado, es inducida en las lesiones inflamatorias, manteniendo los mecanismos inflamatorios y amplificando las señales dolorosas consecuentes, de ahí la trascendencia terapéutica de su inhibición.
La inhibición de la ciclooxigenasa por el ácido acetilsalicílico presenta características diferenciales con respecto a otros AINE debido a su carácter irreversible. Dicha irreversibilidad viene mediada por la unión covalente del AAS al centro activo de la enzima, de forma que la acción catalítica de la molécula afectada no se recupera sino que se precisa de la síntesis de nuevos elementos enzimáticos. Este rasgo distintivo ocasiona importantes repercusiones, pues la duración de los efectos de Aspirina en los distintos tejidos depende de la velocidad de recambio sintético de la COX en estos. Así, en el caso de las plaquetas, su incapacidad para la biosíntesis proteica no les permite regenerar a la enzima, de ahí su gran sensibilidad a la inactivación de la COX mediada por Aspirina. Esto se traduce en que una sola dosis de AAS inhibe a la COX plaquetaria durante todo el ciclo vital de la célula.
Además, es una inhibición no selectiva: el AAS modifica a las dos isoformas de la enzima, pudiendo, por tanto, afectar a todas las funciones en que esta participa. En concreto, el AAS acetila la serina 530 de la estructura de la COX-1, impidiendo que se ligue el ácido araquidónico al sitio activo de la enzima y que se formen prostaglandinas. En el caso de la COX-2, el AAS acetila el residuo 516 constituido por una serina; esta isoforma acetilada pasa a sintetizar 15(R)-HETE (15(R)hidroxieicosatetranoico)4 (11,12).
La vía de la 5-lipooxigenasa, responsable de la formación de leucotrienos a partir de ácido araquidónico (Fig. 1), no se ve inhibida por el ácido acetilsalicílico ni por los AINE en general. Así pues, es posible que, bloqueado un camino metabólico por la presencia de los AINE, el ácido araquidónico tome la ruta metabólica alternativa y se formen sustancias que puedan participar en otros efectos de los AINE, caso de ciertas reacciones adversas mediadas por los leucotrienos. Esta cuestión se abordará más adelante en el apartado de reacciones de hipersensibilidad.
Todo lo expuesto hasta aquí nos permite comprender el origen de la mayor parte de los efectos farmacológicos de Aspirina, tanto terapéuticos (p. ej. menor formación de prostaglandinas participantes en la inflamación y/o el dolor) como indeseables (p. ej. menor síntesis de prostaglandinas con acción citoprotectora gástrica) derivados de su mecanismo de acción principal: la inhibición de la ciclooxigenasa. No obstante, algunas reacciones adversas no dependen de este mecanismo de acción sino de sus acciones sobre otras vías o se trata de reacciones idiosincráticas o cuyo origen no ha sido convenientemente esclarecido.
3. REACCIONES ADVERSAS COMUNES DE LOS AINE
La familia de los AINE, con Aspirina como estándar, comparte perfil general de reacciones adversas sobre la base común de la inhibición de la COX, estableciéndose diferencias en su presentación para cada familia química, con más exactitud según cada principio activo concreto. No obstante, las reacciones pueden ser cruzadas entre distintos AINE, incluyendo al AAS (13). Estos efectos secundarios han sido bien sistematizados y así quedan recogidos en los principales textos de farmacología, a los cuales remitimos (Tabla IV).
Pese a su variedad, la incidencia real depende mucho de la reacción concreta en consideración. Algunos autores llegan a considerar que si se tiene en cuenta el uso y abuso de los AINE, a menudo carentes de supervisión médica, podría decirse que pese a todos los problemas que pueden aparecer, estos fármacos han resultado bien tolerados (14), en oposición frontal a quienes han considerado la existencia de una epidemia silenciosa de gastropatía por AINE. En definitiva, este tema reclama un especial tratamiento en lo que a educación sanitaria se refiere.
Abordaremos a continuación las reacciones adversas comunes a los antiinflamatorios no esteroideos, en general, para más adelante atender a las características propias del ácido acetilsalicílico.
3.1. Reacciones adversas de localización gastrointestinal
Son las más frecuentes del grupo completo de los AINE así como para el caso concreto de Aspirina. Guardan relación directa con la dosis administrada y el riesgo de aparición se ve aumentado por el consumo simultáneo de varios AINE.
Con el fin de disminuir su frecuencia e intensidad, se han diseñado una serie de formas galénicas que, básicamente, limitan el tiempo de contacto del fármaco con la mucosa gastroduodenal. Así, la irritación de la mucosa es más frecuente con la forma de tableta y disminuye con la microencapsulación, las fórmulas de liberación retardada, las presentaciones en solución o polvo disgregable o las tamponadas-efervescentes. La ingesta simultánea de alimentos, una medida muy popular, o simplemente beber un vaso completo de líquido con el medicamento, amortiguan el efecto irritante local, al retardar la absorción del principio activo y alargar el tiempo necesario para alcanzar concentraciones plasmáticas máximas. Sin embargo, no se altera la cantidad total de fármaco absorbido. Todas ellas no suponen sino un alivio de un factor irritante pasajero que no es el determinante final de las posibles lesiones; en definitiva, estas medidas pueden reducir la frecuencia e intensidad de las lesiones irritativas agudas, pero su influencia es menor cuando la administración de AINE perdura en el tiempo, debido a la patogenia de las lesiones que los antiinflamatorios provocan en la mucosa digestiva.
Las manifestaciones clínicas de estas lesiones, aunque son habitualmente de carácter leve, pueden abarcar toda una pléyade de síntomas: molestias gástricas inespecíficas, pirosis, dispepsia, anorexia, gastritis, dolor gástrico o alteraciones del ritmo de evacuación intestinal (diarrea o estreñimiento). La intensidad de la clínica no permite predecir la presencia de lesiones y su severidad; existe una disociación entre el grado de lesión de la mucosa, observable por endoscopia, y la sintomatología aquejada por el paciente. De hecho, pueden existir lesiones severas en pacientes asintomáticos previamente o, viceversa, pacientes con sintomatología florida, que no presentan lesiones graves. En todo caso, existen diferencias notables según el régimen de consumo de AINE, de forma que la ingesta continuada suele acompañarse de lesiones, desde enrojecimiento de la mucosa a petequias, ulceraciones superficiales o incluso úlceras (es decir, pérdida de sustancia que alcanza al menos hasta la submucosa) que pueden llegar a perforarse.
En cuanto a su localización, predomina la lesión del tracto gastrointestinal superior, principalmente estómago y primera porción del duodeno, si bien, puede surgir en cualquier tramo del tubo digestivo. De hecho, se han apreciado, aunque más raramente, lesiones esofágicas (incluso sangrado de varices en pacientes cirróticos) e intestinales, donde se presume un aumento de su incidencia por el uso de las preparaciones de liberación retardada (15).
Habitualmente, las úlceras provocadas por los AINE son asintomáticas y de significación clínica limitada. Sin embargo, pueden complicarse en algunos pacientes y originar situaciones graves debido a pérdidas sanguíneas importantes, que pueden llegar a manifestarse como hemorragia digestiva alta o perforaciones. La gastropatía por AINE se ha identificado repetidamente como la causa más frecuente de ingreso hospitalario de origen iatrogénico, sobre todo ligado a sangrado ulceroso (16). No toda la población presenta idéntica susceptibilidad a desarrollar complicaciones hemorrágicas digestivas, los estudios epidemiológicos han identificado claramente una serie de factores de riesgo, ligados a características propias del paciente o de sus circunstancias "terapéuticas", que multiplican dichas posibilidades (17,18) (Tabla V). En el anciano, no sólo el riesgo de úlcera sino de complicaciones graves, como hemorragia digestiva alta, se ven claramente aumentados. Estas circunstancias deben ser tenidas muy en cuenta a fin de evitar aquellos factores que sean abordables y aumentar la farmacovigilancia, sobre todo en una población en la que la incidencia de una complicación de este tipo presenta más visos de revestir gravedad, por su menor capacidad de recuperación y mayor posibilidad de complicaciones vitales. En personas de riesgo que precisan tomar AINE, está indicado instaurar medidas farmacológicas profilácticas; tanto misoprostol (análogo de prostaglandinas, que por tanto contrarresta de forma natural los efectos de los AINE en la mucosa digestiva) como los inhibidores de la bomba de protones, han demostrado en estudios controlados su capacidad para prevenir estas lesiones, siendo mejor tolerados los segundos.
Así pues, puede considerarse que el riesgo individual de gastrolesividad por AINE no es alto salvo en las circunstancias anteriormente apuntadas. Sin embargo, su extensa utilización multiplica extraordinariamente el riesgo epidemiológico en virtud del gran número de pacientes expuestos a estos fármacos.
-Las causas de la lesión de la mucosa gastroduodenal son varias:
•Acción directa aguda debido al efecto local irritativo originado por la presencia en la luz gástrica de sustancias ácidas débiles como el AAS. En la endoscopia puede reflejarse como una gastritis superficial y, en ocasiones, hemorragia submucosa. Su trascendencia clínica es escasa.
Los ácidos débiles apenas se ionizan a pH bajo, como el que hay en el estómago, lo que determina su mayor liposolubilidad y, en consecuencia, capacidad de atravesar las membranas celulares. Así, difunden al interior de las células epiteliales, donde el pH es más alto, se ionizan, pierden liposolubilidad y quedan parcialmente atrapados en dichas células. Como consecuencia, originan una serie de cambios intracelulares entre los que destaca el desacoplamiento de fosforilación oxidativa mitocondrial o la desestructuración del citoesqueleto. En definitiva, aumenta la permeabilidad de la barrera epitelial y se produce una retrodifusión de ácido al interior de la mucosa gástrica y posterior inducción de daño tisular.
• Acción indirecta como consecuencia de la menor formación de prostaglandinas citoprotectoras gástricas debido a la inhibición de la COX-1 tras la absorción del AINE. Se produce un desequilibrio entre los agentes agresores (secreción ácida gástrica) y protectores, según la interpretación patogénica clásica del ulcus. Esta acción sí puede originar úlceras gastro-duodenales, susceptibles de complicacación en algunos individuos, como se ha comentado previamente.
Las prostaglandinas, sobre todo la PGI2 y la PGE2, son agentes esenciales en la protección de la mucosa gástrica frente a la secreción ácida, pues:
-Favorecen la microcirculación local mucosa, que elimina los hidrogeniones difundidos y aporta nutrientes y elementos reparadores.
-Promueven la reparación del epitelio ya dañado.
-Estimulan la secreción mucosa y bicarbonatada (primera barrera química frente a los hidrogeniones).
-Pueden inhibir la secreción ácida de las células parietales por acción sobre sus receptores EP3.
En definitiva, la supresión de la síntesis de estas sustancias por los AINE, al anular o disminuir todos los efectos listados, parece hacer más vulnerable al revestimiento gastroduodenal frente a las agresiones. A partir de las lesiones superficiales, cuando se sobrepasan todos los mecanismos de defensa y reparación, se produce la lesión de la membrana basal.
Teóricamente, los AINE con mayor afinidad para inhibir a la COX-1 serían más gastrolesivos; sin embargo, existe cierta discrepancia en los resultados publicados sobre la selectividad de los AINE clásicos por una u otra isoenzima, así como en su relación con la incidencia clínica de complicaciones digestivas (19,20).
La alarma sanitaria ante la incidencia de la gastropatía por AINE aconseja acentuar la vigilancia frente a este problema identificando a los pacientes de riesgo, establecer medidas profilácticas oportunas, además de realizar una labor de educación sanitaria importante en el uso de estos fármacos.
3.2. Toxicidad renal
Se han identificado importantes efectos adversos renales en relación con el consumo de AINE; aunque menos frecuentes que las digestivas, estas reacciones son potencialmente graves. El riesgo de lesión renal no es idéntico para todos los AINE (21) y pueden presentarlo no sólo los AINE clásicos, sin selectividad por la inhibición de una u otra isoenzima, sino también los nuevos inhibidores selectivos de la COX-2 (22).
En sujetos sin otra enfermedad concomitante, con una función renal normal, los AINE no parecen tener gran efecto sobre la función renal; pese a disminuir la filtración glomerular, esta situación revierte a la normalidad. Esto se ha atribuido a la escasa participación de las prostaglandinas en el mantenimiento de la función renal en individuos con suficiencia de sodio. Sin embargo, estos fármacos disminuyen el flujo renal y la filtración glomerular en pacientes con insuficiencia cardaca congestiva, cirrosis hepática con ascitis, hipovolemia o nefropatías crónicas. En todas estas circunstancias puede desencadenarse una insuficiencia renal aguda, posiblemente porque en todas ellas el riego renal depende más estrechamente de la síntesis de prostaglandinas vasodilatadores. En efecto, las prostaglandinas contribuyen a compensar las influencias vasoconstrictoras (noradrenalina, angiotensina II) puestas en marcha como respuesta a la menor irrigación renal presente en todas las situaciones citadas, a fin de mantener una velocidad de filtración adecuada. También parecen ser más susceptibles a la lesión los pacientes en tratamiento con diuréticos.
Aunque existen otras formas agudas de presentación, caso de la nefritis intersticial aguda, la insuficiencia renal aguda constituye la forma más frecuente de nefrotoxicidad por AINE. Parece claro que los usuarios de AINE tienen el doble de posibilidades de ingreso hospitalario debido a insuficiencia renal aguda (23), guardando relación con la dosis consumida y el tiempo de tratamiento, así como con la coincidencia temporal con otros fármacos nefrotóxicos (24).
Además de estos efectos hemodinámicos, los AINE también pueden modificar el perfil de intercambio iónico tubular. Así, estimulan la retención de sodio y agua en respuesta a la inhibición de la reabsorción de cloro (dependiente de prostaglandinas) y al antagonismo de la acción de la hormona antidiurética. Los fármacos de este grupo pueden, asimismo, propiciar el desarrollo de una hiperpotasemia a través de varios mecanismos: a) mayor reabsorción de potasio como consecuencia de la menor disponibilidad de sodio en zonas tubulares distales; y b) supresión de la secreción de renina inducida por prostaglandinas. La retención de agua y sodio, favorecedora de la de potasio, puede ser el origen de edemas en pacientes en situaciones comprometidas que toman estos fármacos, además de poder disminuir la eficacia de regímenes antihipertensivos. Asimismo los antiinflamatorios pueden desencadenar una insuficiencia renal aguda en pacientes con insuficiencia renal moderada.
La patogenia de las lesiones renales crónicas, menos frecuentes y asociadas al uso prolongado de estos fármacos, ha sido menos dilucidada. Raramente, esta nefropatía surge con el uso de un solo AINE de forma continuada. Por contra, el desarrollo de daño renal como necrosis papilar, nefritis intersticial crónica e insuficiencia renal crónica final (denominada nefropatía crónica por analgésicos), se ha vinculado al consumo abusivo, en tiempo y dosis, de mezclas analgésicas. De comienzo habitualmente insidioso, la disminución de la función tubular y de la concentración de la orina, suelen pasar desapercibidas durante largo tiempo. La persistencia de la agresión, con un sustrato anatomopatológico que evoluciona de atrofia a necrosis tubular con posible afectación glomerular, puede conducir a insuficiencia renal irreversible si persiste el consumo abusivo de antiinflamatorios, apareciendo de forma progresiva toda la sintomatología característica del cuadro. Sólo en raras ocasiones el debut es agudo. La retirada del tratamiento mejora el cuadro, mientras que su mantenimiento puede propiciar una insuficiencia renal terminal o la aparición de carcinomas en las uniones uro-epiteliales. Esta reacción, más frecuente en mujeres, parece idiosincrásica, habiéndose identificado una serie de factores de riesgo (Tabla VI).
3.3. Efectos hematológicos
Son, en conjunto, poco frecuentes, salvo las hemorragias relacionadas con el efecto antiagregante de Aspirina. Este, como ha sido indicado previamente, se debe a la acetilación irreversible por el AAS de la ciclooxigenasa plaquetaria y a la inhibición resultante de la producción de tromboxano A2. Se manifiesta incluso a dosis bajas. Puede complicar el microsangrado gastrointestinal producido por otro AINE o favorecer el desarrollo de manifestaciones hemorrágicas extradigestivas en sujetos con hemostasia comprometida (25).
Es de destacar la posibilidad de aparición de cuadros graves derivados de la interferencia de algunos antiinflamatorios con la hematopoyesis, ocasionando graves trastornos en la formación de células sanguíneas. Pueden manifestarse como agranulocitosis, trombocitopenia, o anemia aplásica; también se han descrito episodios de hemolisis en pacientes con déficit de glucosa-6-fosfato-deshidrogenasa. En estos casos suele mediar la participación de mecanismos inmunitarios. Se relacionan con AINE específicos, presentando una baja incidencia global.
3.4. Alergia o hipersensibilidad
Algunas personas no toleran ciertos AINE, incluyendo a Aspirina, pese a que, en comparación con otros tipos de fármacos, las reacciones de hipersensibilidad son poco frecuentes. Esta intolerancia puede presentarse bajo toda una pléyade de síntomas, sean reacciones respiratorias (rinitis vasomotora, asma), dermatológicas (erupciones maculopapulares, urticaria generalizada) o cuadros complicados (edema angioneurótico, edema laríngeo, shock anafiláctico).
Aunque estas reacciones pueden tener un trasfondo inmunológico, como una verdadera reacción alérgica, más frecuentemente no existe una intervención del sistema inmunológico en su presentación sino que se derivan del mecanismo de acción de los AINE. En el primer caso suelen predominar las reacciones tipo angioedema o shock; se relacionan con tipos químicos concretos de AINE como las pirazolonas, sin que exista reacción cruzada con otros fármacos de esta gran familia. Al contrario ocurre con el segundo tipo de reacción; abordaremos esta situación más adelante, junto con las reacciones propias de Aspirina, por ser bastante característica, aunque no exclusiva del AAS. Casi sin excepción el individuo que no tolera a Aspirina también puede mostrar esta hipersensibilidad frente a otros AINE pese a su diversidad estructural.
3.5. Otros efectos indeseables
Los AINE pueden prolongar la gestación, retrasando el momento del parto, debido a la menor presencia uterina de prostaglandinas E y F, oxitócicas, cuya síntesis miometrial aumenta de forma importante horas antes del parto. La inhibición de la COX también puede provocar el cierre prematuro del conducto arterioso en el feto y existen datos experimentales sobre los efectos teratogénicos de antiinflamatorios no esteroideos.
4. CARACTERÍSTICAS DEL PERFIL DE REACCIONES ADVERSAS DE ASPIRINA
Sobre la base general de los efectos secundarios más frecuentes y comunes de los AINE, revisaremos a continuación el perfil de tolerabilidad de Aspirina. De manera genérica, podemos decir que existen diferencias marcadas entre el uso agudo o anecdótico y el empleo continuado de Aspirina, aunque sea a dosis pequeñas. En estudios presentados recientemente, donde se abordaba el uso de Aspirina en comparación con otros tratamientos en una indicación bastante frecuente, el tratamiento de la migraña, Aspirina efervescente originó una tasa de reacciones adversas similar a ibuprofeno, y similar o menor a sumatriptán (26,27). En las condiciones de estos estudios, todos los tratamientos fueron eficaces no ya para disminuir el dolor sino para mejorar la sintomatología acompañante de la jaqueca, a excepción de náuseas y vómitos.
Asimismo, su utilización en periodos cortos, como analgésico ante dolores músculo-esqueléticos, indujo cifras de tolerabilidad similares a las de otros AINE de empleo frecuente con los que se ha comparado (28).
Los síntomas más frecuentemente registrados en ensayos controlados en los que se emplea Aspirina adosis únicas de forma aguda (caso de la analgesia postquirúrgica y/o traumatológica) han sido mareos e irritación gástrica (29). En consumo crónico, las reacciones adversas más notificadas son las digestivas, seguidas de las renales, las derivadas de la alteración de la hemostasia, las cefaleas y las náuseas. De todas ellas, las complicaciones más graves del tratamiento con Aspirina son la aparición de hemorragias digestivas junto con la hemorragia cerebral.
4.1. Reacciones adversas digestivas
Son, como para el resto del grupo de los AINE, las reacciones más frecuentes, pudiendo compartir todo el espectro anatomo-patológico y clínico con ellos comentado con anterioridad. Guardan relación directa con la dosis administrada, aumentando la incidencia de síntomas de la esfera digestiva cuando se superan los 900 mg de Aspirina. Asimismo, la ingesta simultánea de otros fármacos parece desvelarse como un factor crucial para el desarrollo de toxicidad digestiva severa debida a AAS, al igual que con otros AINE ampliamente utilizados. La exclusión de este factor disminuye, en un estudio reciente, la incidencia de efectos gastrointestinales graves a niveles muy bajos, sobre todo en pacientes de bajo riesgo (30).
Para el ácido acetilsalicílico, se han desarrollado algunas de las formulaciones galénicas que citamos en el apartado general de AINE, con el fin de alcanzar ciertos objetivos farmacocinéticos a la par que se intenta reducir el (limitado) efecto agresor local derivado de la ingesta de un ácido débil. A las formas tamponadas-efervescentes (más solubles, más rápidas de absorción y efecto), se suman la entérica-coatada (31) y la que contiene glicina (32).
Los estudios epidemiológicos revelan que el ácido acetilsalicílico se sitúa entre los AINE de riesgo intermedio para la hemorragia gastrointestinal alta, de forma similar a naproxeno, diclofenaco o indometacina y menor que el riesgo detectado para piroxicam (33). Sin embargo, en otros estudios el índice de toxicidad gastrointestinal de Aspirina es relativamente bajo (34), a pesar de su halo de fármaco ulcerógeno. Es evidente la influencia de factores ligados al diseño de los estudios epidemiológicos para explicar estas diferencias. Existe una relación con la dosis, de forma que las hemorragias no suelen aparecer cuando se emplean dosis por debajo de los 75 mg diarios de ácido acetilsalicílico.
Por otro lado, la inhibición de la agregación plaquetaria asociada a una prolongación anormal, pero reversible, del tiempo de sangrado puede ser un mecanismo participante en las complicaciones hemorrágicas de las lesiones gastroduodenales en pacientes de riesgo consumidores de Aspirina; no obstante, estos no representan más de una tercera parte de aquellos que presentan sangrado (35). Parece que incluso a dosis pequeñas (características del régimen profiláctico antitrómbotico), Aspirina aumenta el riesgo de sangrado gastrointestinal alto (36,37). No obstante, es el antiagregante plaquetario asociado con menor riesgo de sangrado, frente a productos más actuales como los inhibidores de la glucoproteína IIa/IIIb (38). Incluso en el rango de dosis bajas, existe una proporcionalidad directa entre toxicidad digestiva y dosis de AAS empleada, sin que se haya confirmado por todos los estudios la dosis a partir de la cual puede considerarse que "comienza" el riesgo. Dosis diarias de hasta 300 mg de Aspirina, suponen un riesgo demostrado para el desarrollo de úlceras sintomáticas, tanto gástricas como duodenales, aunque menor que el evidenciado para otros AINE (39).
En todo caso, los factores de riesgo individuales genéricos recogidos en la Tabla IV, son igualmente válidos y aplicables para Aspirina (40). En estos pacientes con factores de riesgo para desarrollar complicaciones del tracto gastrointestinal alto (historia previa de úlcera, de sangrado, consumo concomitante de otros antiagregantes, anticoagulantes, etc.) y en los que, una vez valorado el cociente beneficio/riesgo, parezca recomendable un régimen profiláctico antitrombótico con Aspirina, puede optarse por instaurar medidas preventivas del daño digestivo. Aunque no existe un criterio único sobre la actitud a tomar, una estrategia profiláctica posible consiste en el uso de omeprazol, prototipo de inhibidor de la bomba de protones de las células parietales gástricas. Se ha apreciado que el uso de omeprazol en pacientes de alto riesgo que toman dosis bajas de Aspirina de forma continuada, resulta efectivo para reducir el daño agudo de la mucosa gastroduodenal y también se asocia con una frecuencia más baja de complicaciones gastrointestinales altas (41,42). Otras aproximaciones farmacológicas para reducir o evitar el daño, como el uso de ranitidina (antihistamínico H2) o misoprostol (análogo de la prostaglandina E) no han sido suficientemente exploradas, habida cuenta la escasez de estudios controlados desarrollados en este grupo de población.
Debe recordarse, además que el AAS no sólo es un agente agresor para el tracto digestivo sino que puede ser beneficioso en ciertas enfermedades, caso de la profilaxis del cáncer colorrectal.
4.2. Nefrotoxicidad
Aspirina no figura entre los AINE más nefrotóxicos (21); su perfil de efectos adversos renales es similar al de otros miembros de esta numerosa familia farmacológica. La afectación de la función renal por los salicilatos es netamente apreciable cuando se alcanzan concentraciones plasmáticas superiores a 25 mg.100 ml-1. En sujetos con función renal previa normal, este efecto, incluso tras largo tiempo de tratamiento, carece de relevancia clínica, caso contrario a los citados en la Tabla VI.
4.3. Reacciones de hipersensibilidad a Aspirina: asma inducido por Aspirina
Aunque en comparación con otros fármacos las reacciones de hipersensibilidad a Aspirina son poco frecuentes, en algunas personas con antecedentes de asma, Aspirina (al igual que otros AINE inhibidores de la COX-1) puede exacerbar esta condición. Este síndrome clínico distintivo se conoce como asma inducido por Aspirina (AIA). En todo caso, las reacciones alérgicas a Aspirina, sean de carácter respiratorio (más frecuentemente), dermatológico5 (43) o cuadros complejos, suelen presentarse muy próximas en el tiempo a la ingesta del medicamento (entre minutos y una hora); esta relación temporal puede simplificar el diagnóstico.
Se calcula que el AIA afecta aproximadamente al 5-10% de los pacientes asmáticos en edad adulta; estas cifras aumentan considerablemente si el diagnóstico se realiza a partir de pruebas de provocación (con Aspirina u otros AINE) en lugar de su recogida en la historia clínica (21 frente a 3%), como así lo revela una reciente revisión sistemática (44). El AIA suele permanecer infradiagnosticado durante mucho tiempo debido a que el propio paciente no relaciona las crisis con la toma de Aspirina sino con la evolución de su enfermedad, además de carecer, hasta ahora, de pruebas in vitro que permitan diagnosticar el cuadro. En los niños el AIA es más raro (5%).
El patrón de presentación del cuadro es muy regular y característico, sugiriendo una base común. Se caracteriza por la presencia de sinusitis, pólipos nasales, sensibilidad a Aspirina y asma: esta es la historia natural del AIA (45). El curso es, a menudo, severo, pudiendo requerirse glucocorticoides sistémicos para lograr su control6. Desgraciadamente, la evitación de Aspirina u otros AINE no previene la progresión de la enfermedad inflamatoria subyacente. Parece más frecuente en mujeres, en las que los síntomas se manifiestan de forma más precoz y la enfermedad progresa con mayor celeridad y severidad. Otro factor predisponente parece ser la atopia. Sinusitis y asma comparten una base histológica común: un infiltrado de carácter eosinofílico.
En los últimos años, este cuadro ha despertado gran interés, lo que ha generado un gran avance en el conocimiento de su fisiopatología. Parecía claro desde un principio que, sobre una base atópica, genética e inmunológica, había una participación importante del mecanismo de acción de Aspirina en la presentación de estas reacciones alérgicas. La capacidad de los AINE para inhibir la actividad de la ciclooxigenasa resulta en una mayor disponibilidad de sustratos para la vía alternativa del metabolismo del ácido araquidónico (vía de la 5-lipooxigenasa) (Fig. 1). Resultado de esta vía son los leucotrienos, potentes broncoconstrictores con acciones adicionales que cooperan en la patogenia del asma (quimiotaxis,").
En la actualidad se sabe que, a nivel bioquímico, el AIA se caracteriza por una sobreproducción de cisteinil-leucotrienos (LTC4, LTD4, LTE4). La enzima limitante (sintetasa de LTC4) está sobre-expresada en los bronquios de estos pacientes cuyos eosinófilos también presentan una mayor sensibilidad para reactivar el ARNm correspondiente a esta enzima (46). Además, parece evidente que en estos pacientes existe un déficit de producción de PGE2 bajo condiciones proinflamatorias en las vías aéreas asmáticas; esta se acompaña de una una menor expresión de COX-2 en condiciones basales (47). Se ha postulado que esta falta de reactividad puede debilitar los mecanismos de defensa local y promover la sobreproducción de cistenil-leucotrienos.
Quizás el mayor inconveniente de esta reacción radique en la posibilidad de hipersensibilidad cruzada con otros AINE. De hecho, se ha demostrado una gran correspondencia con otros AINE de uso también muy extendido (en muchos casos presentes en preparados sin necesidad de prescripción médica) como ibuprofeno, naproxeno y diclofenaco. Por el contrario, la sensibilidad cruzada con paracetamol es muy débil (7%) (43).
En estas circunstancias, la medida más sencilla y beneficiosa consiste en evitar inhibidores de la COX-1 (salvo paracetamol). Los inhibidores selectivos de la COX-2 se toleran bien y pueden usarse con seguridad en estos pacientes (48). También es posible realizar una desensibilización con Aspirina, sobre todo en pacientes que presentan poliposis nasal resistente.
4.4. Reacciones adversas hematológicas
Merced a sus propiedades antitrombóticas, Aspirina reduce de forma importante la incidencia y mortalidad de los accidentes vasculares de origen atero-trombótico en una amplia variedad de pacientes de alto riesgo. Sin embargo, este mismo efecto puede ocasionar fenómenos hemorrágicos.
Las complicaciones hemorrágicas espontáneas fuera del tracto gastrointestinal raramente aparecen cuando se utiliza Aspirina en sujetos con una hemostasia normal (30), aumentando el riesgo en pacientes con una coagulación alterada de forma espontánea o debido a tratamiento anticoagulante. Por este motivo, se desaconseja el empleo de AAS en sujetos con daño hepático importante, hipotrombinemia, déficit de vitamina K o hemofilia. El riesgo de sangrado y de hemorragia cerebral, una posible y grave complicación en pacientes que tras un ictus reciben Aspirina como antiagregante, resulta ser mayor en la fase aguda posterior al accidente cerebro-vascular en comparación con la fase estable (49).
Pese a que en sujetos sin problemas de coagulación, tal y como se ha referido, no es frecuente que se presenten accidentes hemorrágicos, se recomienda por precaución suspender el tratamiento con Aspirina si se prevé una intervención quirúrgica en áreas de hemostasia crítica o particularmente sangrantes.
Quisiéramos citar en este punto una situación que ha comenzado a preocupar en los últimos años; es la denominada "resistencia a Aspirina", es decir, la ausencia del efecto profiláctico antitrombótico de este fármaco (algo que se ha detectado particularmente en pacientes con trombosis sintomática). Esta resistencia, que podría denominarse clínica, puede ser originada por factores muy diferentes, muchos de ellos ajenos al propio fármaco. Por este motivo, parece más adecuado hablar de resistencia "bioquímica" a Aspirina; esto es, cuando el empleo de AAS a dosis terapéuticas antitrombóticas resulta incapaz de producir un efecto profiláctico (anticipado) detectable por pruebas de laboratorio de función plaquetaria. Mientras se definen mejor las circunstancias de esta resistencia y la forma de evitarla o superarla, un buen cumplimiento de la pauta antitrombótica a la vez que la evitación de ibuprofeno, parece erigirse como la estrategia más adecuada (50).
4.5. Síndrome de Reye
Es un cuadro de muy rara aparición pero de extrema gravedad, pues puede ser letal en un 20-40% de los casos. Consiste en una encefalopatía grave acompañada de hepatopatía aguda. A principios de los años ochenta se encontró una asociación epidemiológica entre la presentación de este cuadro y el empleo de AAS/salicilatos en niños y adolescentes aquejados de procesos febriles agudos, infecciones víricas como la varicela o la gripe. Más raramente puede aparecer en adultos. Este riesgo, que desaparece tras cesar el tratamiento, es independiente de la dosis de AAS empleada. Ante la gravedad del cuadro, hace ya tiempo que se contraindicó el uso de Aspirina en estas situaciones; tal recomendación se ha visto reforzada por una serie de medidas tomadas recientemente en nuestro país por la Agencia Española del Medicamento7 (51).
4.6. Otros efectos indeseables
No se han demostrado efectos teratogénicos del AAS durante los tres primeros meses de embarazo, aunque, como se ha comentado anteriormente, debe evitarse su consumo prolongado a dosis altas durante los tres últimos meses de gestación y muy especialmente los últimos quince días, ante la posibilidad de retraso del parto, riesgo de hemorragias y cierre precoz del conducto arterioso fetal.
Se conoce que el AAS a concentraciones bajas puede inhibir la secreción tubular de ácido úrico, pudiendo favorecer la acumulación de ácido úrico en presencia de otros fármacos hiperuricemiantes.
4.7. Intoxicación por ácido acetilsalicílico
La ingestión excesiva de AAS de forma progresiva, crónica (salicilismo), o aguda (intoxicación) puede causar cuadros tóxicos de diferente expresión y gravedad.
El salicilismo, es una intoxicación moderada, debida a la acumulación crónica, paulatina, de salicilatos. En su forma más florida incluye síntomas de ototoxicidad (acúfenos, pérdida de audición), además de cefaleas, visión borrosa, confusión mental, somnolencia, sudación, sed, náuseas y, a veces, diarrea. Los acúfenos pueden presentarse a concentraciones plasmáticas de salicilatos comprendidas en el rango de dosis necesarias para obtener un efecto antiinflamatorio.
La forma más grave de intoxicación, debida a una sobredosificación evidente, incluye alteraciones más profundas del sistema nervioso central con confusión, agitación, alucinaciones, convulsiones generalizadas y posterior depresión central con estupor y coma. Además, las acciones sobre el centro respiratorio ocasionan hiperventilación con respiración dificultosa. El rápido intercambio gaseoso asociado al desacoplamiento de la fosforilación oxidativa (cadena de la respiración mitocondrial) ocasiona importantes modificaciones del equilibrio ácido-base (con acidosis notable en niños pequeños) que se acompaña de alteraciones hidroelectrolíticas y metabólicas. A menudo surgen síntomas digestivos y no son raros los fenómenos hemorrágicos derivados de los efectos antitrombóticos de Aspirina. La dosis letal en niños se sitúa en torno a los 4 g y en los adultos oscila entre 10 y 30 g. La gravedad del cuadro no depende de los niveles plasmáticos puntuales sino de su relación con el tiempo transcurrido tras la ingestión. En los niños, la propensión a la intoxicación y la gravedad del pronóstico son mayores; cuando son muy pequeños, el cuadro puede pasar inicialmente camuflado bajo cambios conductuales, una mayor somnolencia o alteraciones del ritmo respiratorio. Por su posible evolución fatal, debe actuarse con rapidez para impedir que continúe la absorción del producto, si ha transcurrido poco tiempo de la ingesta, y para corregir todas las alteraciones homeostáticas causadas.
5. IMPORTANCIA DE LAS INTERACCIONES MEDICAMENTOSAS DE ASPIRINA
Un último aspecto que, bajo nuestro punto de vista, concierne a la tolerabilidad de un fármaco se relaciona, aunque indirectamente, con su posibilidad de desarrollar interacciones con otros medicamentos. Un fármaco con gran número de interacciones puede ver fácilmente aumentada su toxicidad clínica o la de otras sustancias usadas de forma simultánea y con las que interacciona.
Esta situación es particularmente importante para un producto, como Aspirina, de uso podría decirse que "cotidiano", sin control médico en muchos casos, aunque frecuentemente de forma limitada en el tiempo, asociada a un uso sintomático. No resultaría por tanto extraño que coincidiera con otros tratamientos instaurados por motivos diferentes para abordar otras condiciones patológicas. Esta situación es bastante plausible en pacientes de cierta edad con enfermedades crónicas que requieren medicación diaria y en los que Aspirina puede ser parte de ese régimen terapéutico diario.
En este sentido, aunque el AAS no carece de interacciones farmacológicas, las más importantes pueden ser prevenidas sin mayor problema, evitando las situaciones que supongan una amenaza para la salud en la vida del paciente.
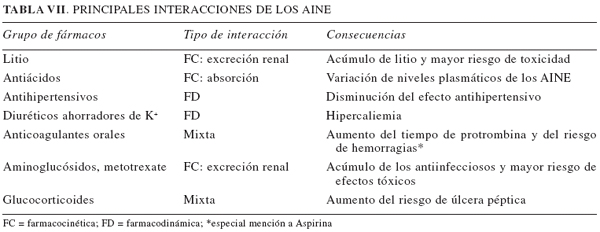
Según su origen, dividiremos las interacciones en aquellas de origen farmacocinético (dependientes de interacciones en la absorción, distribución, metabolización o excreción de los fármacos) o aquellas otras de origen farmacodinámico (dependientes de los mecanismos de acción y acciones de los fármacos). En la Tabla VII se recogen las interacciones comunes de los AINE de mayor relevancia.
5.1. Interacciones farmacocinéticas
Las preparaciones tamponadas de Aspirina interfieren en la absorción oral de fármacos como ciertas fluorquinolonas, tetraciclinas o ketoconazol. Por este motivo, en caso de precisarse su utilización, el AAS debe ser administrado entre 2 y 6 horas antes.
Debido a la intensa unión de los salicilatos a la albúmina plasmática para su transporte, pueden interaccionar con otros fármacos que presenten gran apetencia por la unión a proteínas. Por su gravedad, destaca el aumento de la concentración plasmática de la fracción libre de los anticoagulantes orales o de los antidiabéticos orales tipo sulfonilureas debido a un desplazamiento de su unión a proteínas. En ambas situaciones, pueden originarse efectos secundarios graves debido a un exceso de efecto anticoagulante en el primer caso (fenómenos hemorrágicos, a los que se suma, además, el efecto antiagregante de Aspirina) e hipoglucemiante en el segundo (desencadenando hipoglucemia).
Por su relevancia clínica, destacaremos las interacciones farmacocinéticas a nivel de la excreción renal. Así, los compuestos que acidifican la orina (como el ácido ascórbico, el cloruro amónico o los fosfatos de sodio o potasio) producen disminución de la excreción urinaria de salicilatos y aumentan sus niveles plasmáticos; las sustancias que alcalinizan la orina (antiácidos absorbibles como el bicarbonato sódico o los inhibidores de la anhidrasa carbónica), tienen el efecto contrario.
5.2. Interacciones farmacodinámicas
Debido al efecto antiagregante y anti-protrombina (a dosis altas), el empleo de AAS en enfermos tratados con anticoagulantes (orales o heparina) o trombolíticos, puede propiciar la aparición de hemorragias, por lo que es preciso extremar la vigilancia de estos enfermos. En caso de su elección como analgésico, la opción más prudente pasa por seleccionar otro fármaco del grupo.
El riesgo de fenómenos hemorrágicos también aumenta si se utilizan fármacos que pueden ocasionar hipotrombinemia como algunas cefalosporinas (cefamandol, cefoperazona) o ácido valproico.
Debe evitarse el uso simultáneo o secuencial de salicilatos y vancomicina, aminoglucósidos u otros fármacos ototóxicos, debido al posible aumento de la lesión auditiva causada por ambos.
Se desaconsejaba el uso simultáneo de AAS y fármacos uricosúricos empleados en el tratamiento de la hiperuricemia, debido al efecto inhibidor de la reabsorción tubular de ácido úrico por Aspirina (ya presente a concentraciones de 5 mg.100 ml-1). No obstante, estos fármacos, de poco empleo han sido retirados en nuestro país.
6. CONCLUSIONES
-Aspirina es un medicamento de uso universal y tolerabilidad aceptable, salvo en ciertos grupos de riesgo en los que pueden desarrollarse efectos secundarios importantes e incluso peligrosos.
-Además de su eficacia analgésica, ha sido suficientemente establecido el efecto benéfico profiláctico antitrombótico de Aspirina gracias a sus propiedades antiagregantes.
-El beneficio neto puede ser aumentado con una especial consideración de los individuos de mayor riesgo, especialmente los de edad más avanzada, estableciendo pautas profilácticas de las lesiones digestivas, evitando las interacciones medicamentosas y mejorando la educación sanitaria sobre medicamentos.
-Asimismo, el conocimiento de los cambios relacionados con la edad que afectan al tracto gastrointestinal superior, puede permitir mejorar la tolerabilidad de Aspirina en las personas añosas.
1No existe acuerdo a propósito de la afectación de los niveles plasmáticos totales de ácido acetilsalicílico debido a los cambios farmacocinéticos inducidos por el envejecimiento. El aumento de las concentraciones plasmáticas de AAS. no se ha confirmado en todos los estudios (1,2); si bien este resultado sería esperable en virtud de la menor actividad de la esterasa plasmática de aspirina detectada en ancianos debilitados (3) y de la disminución de la unión de los salicilatos a proteínas plasmáticas (4). Queda, pues, por establecer el significado real de estos cambios fisiológicos.
2Además de las consecuencias derivadas de la inhibición de la formación de prostaglandinas, los AINEs presentan otras acciones que colaboran a su espectro de efectos farmacológicos. Es el caso de la inhibición de la proliferación de linfocitos o de la adhesividad de las células en lo focos inflamatorios que no están mediadas por tal inhibición de la ciclooxigenasa sino por modificaciones de la transducción celular a través de otros sistemas.
3Un tercer tipo de ciclooxigenasa, la COX-3, ha sido descrito más recientemente y se ha propuesto como posible diana para algunos analgésicos como paracetamol o dipirona (8).
4El 15(R)-HETE por acción de la 5-lipooxigenasa, la otra vía posible que puede seguir el ácido araquidónico (Fig. 1), puede generar un derivado antiinflamatorio que potencia la acción antiinflamatoria de la aspirina (12).
5Las reacciones cutáneas suelen ser de carácter leve, aunque excepcionalmente se ha descrito necrolisis epidérmica tóxica. Pueden adoptar patrones muy diversos y su incidencia es mayor en individuos con antecedentes de angioedema o urticaria idiopática recurrentes. Al igual que ocurre en el asma inducida por aspirina, la urticaria idiopática crónica exacerbada por los AINE, se relaciona con una excesiva producción e cisteinil-leucotrienos y activación de los mastocitos en relación con la inhibición de la COX-1 y los inhibidores de la COX-2 permiten un abordaje seguro cuando es preciso un tratamiento antiinflamatorio (43).
6Los antagonistas de los receptores de los leucotrienos (familia de los "lukast") también han mostrado su eficacia en este cuadro. Fisiopatológicamente es una aproximación muy racional, al bloquear las acciones de los leucotrienos sobre sus receptores presentes en la fibra muscular lisa bronquial, mastocitos, etc.
7La reevaluación de la situación en el pasado año por el Comité de Seguridad de Medicamentos de Uso Humano (órgano asesor de la Agencia Española del Medicamento en materia de seguridad de medicamentos) no ha permitido descartar la asociación AAS/síndrome de Reye. La gravedad del cuadro ha conducido a la suspensión de la comercialización en nuestro país el pasado mes de Junio (con fecha 27 de Junio de 2003) de las especialidades farmacéuticas publicitarias de administración sistémica y uso exclusivamente infantil que contienen A.A.S./salicilatos sean solos o combinados. Se mantiene la contraindicación de uso en menores de 16 años para el resto de las especialidades farmacéuticas publicitarias que contengan AAS/salicilatos en cantidades superiores a los 500 mg y como medida preventiva se establece como obligatoria la inclusión en la ficha técnica y en el prospecto de los preparados con salicilatos de prescripción médica y administración sistémica su contraindicación en menores de 16 años para el tratamiento de la fiebre, procesos víricos o varicela (Circular 10/2003 de la Agencia Española de Medicamentos y Productos Sanitarios) (51).
|
BIBLIOGRAFÍA
1. Ho PC, Triggs EJ, Bourne DWA, Haelwood VJ. The effects of age and sex on the disposition of acetylsalicylic acid and its metabolites. Br J Clin Pharmacol 1985; 19: 675-84. [ Links ]
2. Durnas C, Loi CM, Cusack BJ. Hepatic drug metabolism and ageing. Clin Pharmacokinet 1990; 19: 359-89. [ Links ]
3. Williams FM, Wynne H, Woodhouse KW, Rawlins MD. Plasma aspirin esterase: the influence of age and frailty. Age Ageing 1989; 18: 39-42. [ Links ]
4. Woodhouse KW, Wynne H. The pharmacokinetics of non-steroidal anti-inflammatory drugs in the elderly. Clin Pharmacokinet 1987; 12: 11-122. [ Links ]
5. Moreno Brea MR, Micó JA. Farmacocinética de los analgésicos en el anciano. Dolor 1999; 14: 172-87. [ Links ]
6. Wilder-Smith CH. Pain treatment in multiborbid patients, the older population and other high-risk groups. The clinical challenge of reducing toxicity. Drug Saf 1998; 18: 457-72. [ Links ]
7. O'Bannion MK, Sadowski HB, Winn V, et al. A serum- and glucocorticoid-regulated 4-kilobase mRNA encodes a cyclooxygenase-related protein. J BiolChem 1991; 266: 23261-7. [ Links ]
8. Chandrasekharan NV, Dai H, Roos KL, Evanson NK, Tomsik J, Elton TS, et al. COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression. Proc Natl Acad Sci U A. 2002; 99: 13926-31. [ Links ]
9. Jouzeau JY, Terlain B, Abid A, et al. Cyclo-oxygenase isoenzymes. How recent findings affect thinking about nonsteroidal anti-inflammatory drugs. Drugs 1997; 53: 563-82. [ Links ]
10. Vane JR, Bakhle YS, Botting, RM. Cyclooxygenases 1 and 2. Annu Rev Pharmacol Toxicol 1998; 38: 97-120. [ Links ]
11. Lecomte MN, Laneuville O, Ji C, DeWitt L, Smith WL. Acetylation of human prostaglandin endoperoxide synthase-2 (cyclooxygenase-2) by aspirin. J Biol Chem 1994; 269: 13207-15. [ Links ]
12. Serhan CN, Takano T, Maddox JF. Aspirin-triggered 15-epilipoxin A4 and stable analogs of lipoxin A4 are potent inhibitors of acute inflammation. Receptors and pathways. Adv Exp Med Biol 1999; 447: 133-49. [ Links ]
13. Stevenson DD. Approach to the patient with a history of adverse reactions to aspirin or NSAIDs: diagnosis and treatment. Allergy Asthma Proc 2000; 21: 25-31. [ Links ]
14. Hersh EV, Moore PA, Ross GL. Over-the-counter analgesics and antipyretics: a critical assessment. Clin Ther 2000; 22: 500-48. [ Links ]
15. Davies NM. Sustained release and enteric coated NSAIDs: are they really GI safe? J Pharm Pharmaceut Sci 1999; 2: 5-14. [ Links ]
16. Hawkey CJ, Cullen DJ, Greenwood DC, Wilson JV, Logan RF. Prescribing of nonsteroidal anti-inflammatory drugs in general practice: determinants and consequences. Aliment Pharmacol Ther 1997; 11: 293-8. [ Links ]
17. Pérez Gutthann S, García Rodríguez LA, Raiford DS. Individual non-steroidal anti-inflammatory drugs and other risk factors for upper gastrointestinal bleeding and perforation. Epidemiology 1997; 8: 19-24. [ Links ]
18. García Rodríguez LA, Jick H. Risk of upper gastrointestinal bleeding and perforation associated with individual non-steroidal anti-inflammatory drugs. Lancet 1994; 343: 769-72. [ Links ]
19. Somasundaram S, Hayllar J, Rafi S, Wigglesworth J, MacPherson AJS, Bjarnason I. The biochemical basis of NSAID-induced damage to the gastrointestinal tract: a review and hypothesis. Scand J Gastroenterol 1995; 30: 289-99. [ Links ]
20. Hayllar J, Bjarnason I. NSAIDs, COX-2 inhibitors, and the gut. Lancet 1995; 346: 521-2. [ Links ]
21. Perneger TV, Whelton PK, Klag MJ. Risk of kidney failure associated with the use of acetaminophen, aspirin, and nonsteroidal antiinflammatory drugs. N Engl J Med 1994; 331: 1675-9. [ Links ]
22. Brater DC. Effects of nonsteroidal anti-inflammatory drugs on renal function: focus on cyclooxygenase-2-selective inhibition. Am J Med 1999; 107: 65S-70S. [ Links ]
23. Sommerville K, Noble G. Non-steroidal anti-inflammatory drugs: is the balance shifting? Age Ageing 1997; 26: 417-22. [ Links ]
24. Pérez Gutthann S, García Rodríguez LA, Raiford DS, et al. Non-steroidal anti-inflammatory drugs and the risk of hospitalization for acute renal failure. Arch Int Med 1996; 156: 2433-9. [ Links ]
25. Schafer AI. Effects of nonsteroidal anti-inflammatory therapy on platelets. Am J Med 1999; 31: 25S-36S. [ Links ]
26. Eikermann A, Diener HC, Gessner U, et al. Efficacy of 1000 mg effervescent acetylsalicylic acid and sumatriptan in treating migraine symptoms. Libro de ponencias y comunicaciones. International Headache Society Congress, Septiembre 2003, Roma (Italia). [ Links ]
27. Diener HC, Bussone G, de Llano H, et al. The EMSASI (European Migraine Study on Aspirin, Sumatriptan and Ibuprofen). Placebo-controlled comparison of effervescen acetylsalicylic acid, sumatriptan and ibuprofen in the treatment of migraine attacks. Libro de ponencias y comunicaciones. International Headache Society Congress, Septiembre. Roma (Italia), 2003. [ Links ]
28. Le Parc JM, Van Ganse E, Moore N, Wall R, Schneid H, Verriere F. Comparative tolerability of paracetamol, aspirin and ibuprofen for short-term analgesia in patients with musculoskeletal conditions: results in 4291 patients. Clin Rheumatol 2002; 21: 28-31. [ Links ]
29. Edwards JE, Oldman A, Smith L, et al. Single dose oral aspirin for acute pain. Cochrane Database Syst Rev 2000; 2: CD002067. [ Links ]
30. Fries JF, Bruce B. Rates of serious gastrointestinal events from low dose use of acetylsalicylic acid, acetaminophen, and ibuprofen in patients with osteoarthritis and rheumatoid arthritis. J Rheumatol 2003; 30: 2226-33. [ Links ]
31. Dammann HG, Burkhardt F, Wolf N. Enteric coating of aspirin significantly decreases gastroduodenal mucosal lesions. Aliment Pharmacol Ther 1999; 13: 1109-14. [ Links ]
32. Kusche W, Paxinos R, Haselmann J, Schwantes U, Breddin HK. Acetylsalicylic acid tablets with glycine improve long-term tolerability in antiplatelet drug therapy: results of a noninterventional trial. Adv Ther 2003; 20: 237-45. [ Links ]
33. Laporte JR, Carné X, Vidal X, Moreno V, Juan J. Upper gastrointestinal bleeding to previous use of analgesics and non-steroidal anti-inflammatory drugs. Lancet 1991; 337: 85-9. [ Links ]
34. Fries JF, Williams CA, Bloch DA. The relative toxicity of nonsteroidal anti-inflammatory drugs. Arthritis Rheum 1991; 34: 1353-60. [ Links ]
35. Lanas A. Non-steroidal anti-inflammatory drugs and gastrointestinal bleeding. Ital J Gastroenterol Hepatol 1999; 31 (Supl. 1): S37-42. [ Links ]
36. Serrano P, Lanas A, Arroyo MT; Fereira IJ. Risk of upper gastrointestinal bleeding in patients taking low-dose aspirin for the prevention of cardiovascular diseases. Aliment Pharmacol Ther 2002; 16: 1945-53. [ Links ]
37. Lanas A, Bajador E, Serrano P, et al. Nitrovasodilators, low-dose aspirin, other nonsteroidal antiinflammatory drugs, and the risk of upper gastrointestinal bleeding. N Engl J Med 2000; 343: 834-9. [ Links ]
38. Serebruany VL, Malinin AI, Eisert RM, Sane DC. Risk of bleeding complications with antiplatelet agents: meta-analysis of 338,191 patients enrolled in 50 randomized controlled trials. Am J Hematol 2004; 75: 40-7. [ Links ]
39. García Rodríguez LA, Hernández-Díaz S. Risk of uncomplicated peptic ulcer among users of aspirin and nonaspirin nonsteroidal anti-inflammatory drugs. Am J Epidemiol 2004; 159: 23-31. [ Links ]
40. Sibilia J, Ravaud P, Marck GR. Risk factors for gastrointestinal bleeding associated with low-dose aspirin. Presse Med 2003; 32: S9-S16. [ Links ]
41. Lanas A, Ferrández A. Treatment and prevention of aspirin-induced gastroduodenal ulcers and gastrointestinal bleeding. Expert Opin Drug Saf 2002, 2: 245-52. [ Links ]
42. Lanas A, Rodrigo L, Márquez JL, et al. Low frequency of upper gastrointestinal complications in a cohort of high-risk patients taking low-dose aspirin or NSAIDS and omeprazole. Scand J Gastroenterol 2003; 38: 693-700. [ Links ]
43. Zembowicz A, Mastalerz L, Setkowicz M, Radziszewski W, Szczeklik A. Safety of cyclooxygenase 2 inhibitors and increased leukotriene synthesis in chronic idiopathic urticaria with sensitivity to nonsteroidal anti-inflammatory drugs. Arch Dermatol 2003; 139: 1577-82. [ Links ]
44. Jenkins C, Costello J, Hodge L. Systematic review of prevalence of aspirin induced asthma and its implications for clinical practice. Br Med J 2004; 328: 434-41. [ Links ]
45. Szczeklik A, Nizankowska E, Duplaga M. Natural history of aspirin-induced asthma. AIANE Investigators. European Network on Aspirin-Induced Asthma. Eur Respir J. 2000; 16: 432-6. [ Links ]
46. Szczeklik A, Nizankowska E, Sanak M, Swierczynska M. Aspirin-induced rhinitis and asthma. Curr Opin Allergy Clin Immunol 2001; 1: 27-33. [ Links ]
47. Pierzchalska M, Szabo Z, Sanak M, Soja J, Szczeklik A. Deficient prostaglandin E2 production by bronchial fibroblasts of asthmatic patients, with special reference to aspirin-induced asthma. J Allergy Clin Immunol 2003; 111: 1041-8. [ Links ]
48. Gyllfors P, Bochenek G, Overholt J, et al. Biochemical and clinical evidence that aspirin-intolerant asthmatic subjects tolerate the cyclooxygenase 2-selective analgetic drug celecoxib. J Allergy Clin Immunol 2003; 111: 1116-21. [ Links ]
49. Boysen G. Bleeding complications in secondary stroke prevention by antiplatelet therapy: a benefit-risk analysis. J Intern Med 1999; 246: 239-45. [ Links ]
50. Hankey GJ, Eikelboom JW. Aspirin resistance. Br Med J 2004; 328: 477-9. [ Links ]
51. Agencia Española de Medicamento y Productos Sanitarios. Circular 10/ 2003. http://www.agemed.es [Consulta on-line: 5 de Marzo de 2004]. [ Links ]