Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 no.6 Madrid nov./dic. 2012
TÉCNICAS INTERVENCIONISTAS
Bloqueo y radiofrecuencia de la articulación sacroilíaca
Block and radiofrequency sacroiliac joint
J. De Andrés Ares1, G. Roca Amatriaín2, A. Perucho González3, C. Nieto4 y D. López5
Unidad del Dolor.
1Complejo Hospitalario de Toledo-Clínica del Dolor de Toledo.
2Hospital German Trias y Pujol. Badalona (Barcelona).
3Hospital Ramón y Cajal. Madrid.
4Hospital de Alcorcón. Madrid.
5Hospital General Universitario de Valencia.
RESUMEN
La articulación sacroilíaca (ASI) es una importante fuente de dolor axial, contribuyendo en hasta un 15% del dolor crónico axial. Existen numerosas pruebas diagnósticas, aunque el examen físico, las pruebas radiológicas son insuficientes para el adecuado diagnóstico. El criterio diagnóstico más aceptado es el alivio del dolor de la ASI tras uno o varios bloqueos diagnósticos intra-articulares con anestésicos locales, realizados de manera adecuada. El proceder ante la positividad del bloqueo es la radiofrecuencia de las ramas que inervan la ASI. En el siguiente artículo se repasará la anatomía, el diagnóstico y los distintos tratamientos intervencionistas del dolor de origen sacroilíaco.
Palabras clave: Articulación sacroilíaca. Dolor sacroilíaco. Denervación. Radiofrecuencia. Radiofrecuencia pulsada.
ABSTRACT
Sacroiliac joint (ASI) is an important source of pain, contributing to 15% of chronic back pain. There are numerous diagnostic tests, although historical and physical examination findings and radiological imaging are insufficient for a proper diagnosis. An analgesic response to a properly performed diagnostic block, is the most reliable method to diagnose sacroiliac joint pain. If there is a positive block, radiofrequency denervation of the ASI is performed for a longterm pain-free period. The following article will review the anatomy, diagnosis and interventional treatment of sacroiliac joint pain.
Key words: Sacroiliac joint.
Anatomía
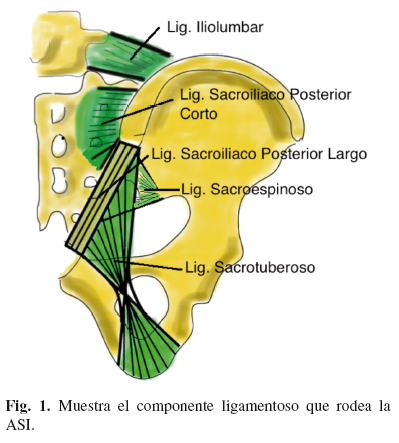
Mayor complejidad de lo que se piensa. La ASI conecta la columna vertebral con la pelvis, mediante una articulación diartrósica entre dos superficies óseas, el sacro y el ilíaco. El sacro forma la pared posterior de la pelvis. La ASI es la mayor de las articulaciones del cuerpo, con una superficie de 17,5 cm2 (1). La articulación es tal, que el espacio entre la concavidad sacra y la convexidad ilíaca es de 1-2 mm, y la articulación mantiene una forma de C con convexidad anterior e inferior (2). Las superficies articulares tienen 1 mm de membrana hialina en el lado ilíaco, y 6 mm en el lado sacro. La parte posterior de la articulación tiene las cualidades histológicas de una sindesmosis, con una densa red de ligamentos, mientras que la parte inferior y anterior de la articulación tiene las características de una articulación sinovial (3). Los ligamentos sacroilíacos anteriores y posteriores dan fortaleza a la unión entre el sacro y el ilíaco (4), y su misión parece ser dar estabilidad y limitar los movimientos en cualquier plano. En las mujeres, los ligamentos son algo más débiles para permitir cierta movilidad al canal del parto. Los principales ligamentos pueden verse en la fig. 1. Existen un gran número de alteraciones anatómicas interindividuales (5,6). Además del componente ligamentoso, hay un importante componente muscular asociado a los ligamentos de la ASI como son el glúteo mayor, el piriforme y el bíceps femoral cuya acción puede afectar la movilidad de la ASI (7). A lo largo de la vida se producen cambios en la ASI, y estos suelen comenzar en la pubertad. En la adolescencia la ASI comienza a presentar irregularidades con la presencia de placas fibrosas. Estos cambios aumentan en las décadas 40-50 y a partir de los 60 la ASI se anquilosa por procesos fibróticos. En la octava década se producen erosiones articulares (8).
Dado que la mayoría de las técnicas sobre la ASI se realizan con fluoroscopia, la anatomía radiológica de la ASI es muy importante (Fig. 2).
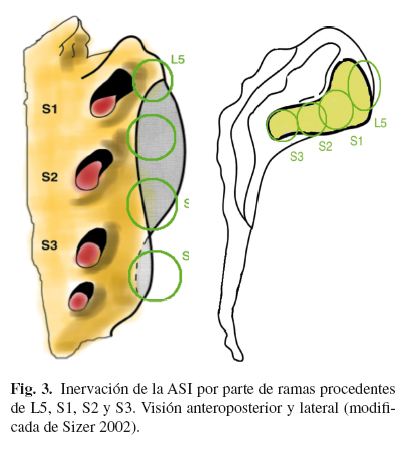
La inervación de la ASI es un tema muy controvertido. La inervación de la parte posterior parece que se debe a las ramas laterales de los ramos dorsales de L5 a S3 (9), aunque hay autores que amplían hasta L4 e incluso L3 dicha inervación (10). La inervación de la parte anterior es también muy ambigua, hay autores que afirman que está inervada por ramas ventrales de L2 a S2 (11), otros de L4 a S2 (12) y otros de L5 a S2 (13). Incluso hay autores que afirman que la porción ventral de la ASI carece de inervación (14) (Fig. 3).
de la ASI
No todo es apertura y cierre. La ASI está diseñada para dar estabilidad. Las principales funciones son: transmitir cargas del tronco a las extremidades inferiores, limitar la rotación y facilitar el parto. Comparada con la región lumbar, la ASI puede soportar pesos seis veces superiores, pero solo la mitad de la torsión y tan solo 1/20 de la compresión axial (15). La ASI rota en los tres ejes, aunque los movimientos son muy pequeños, y difíciles de medir (16,17). La ASI permite movimientos de nutación y contranutación18.
Prevalencia del dolor sacroilíaco
Más frecuente de lo que se piensa. La ASI contribuye hasta en un 15% del dolor lumbar crónico (19). La prevalencia es mayor en pacientes con artrodesis, aumentando entre un 32 y un 43% (20) y en pacientes ancianos (21).
Diagnóstico
El galimatías. El dolor de la ASI suele ser un dolor referido a la región glútea en un 94%, en la región lumbar baja en un 72%, en genitales 14%, en la región lumbar alta 6% o abdomen 2%. El dolor referido a miembros inferiores se da en un 28% de los pacientes y hasta un 12% refiere dolor en el pie (22) (Fig. 4).
La IASP ha establecido como dolor producido por la ASI aquel que se localiza en la ASI o se refiere a la zona glútea y región posterior del muslo, que o bien se reproduce por maniobras de provocación o se alivia al realizar un bloqueo diagnóstico (23). Sin embargo estos criterios de diagnóstico clínicos de la IASP son ambiguos (24), en primer lugar por la escasa especificidad y sensibilidad de las maniobras de provocación, y en segundo lugar porque los bloqueos diagnósticos muchas veces son intravasculares, intraligamentosos o muy difícil de conseguir situar el anestésico local intraarticular (Tabla I).
Las maniobras de provocación de dolor de la ASI tienen poco valor diagnóstico (25). Dadas las características anatómicas, se necesita mucha fuerza para provocar dolor en la ASI, por lo que son muy frecuentes los falsos negativos (26-29). Hay múltiples pruebas diagnósticas que pueden reproducir el dolor del paciente y orientar al origen de la ASI como causa del dolor. Estas pruebas diagnósticas son poco sensibles y poco específicas, sin embargo la sensibilidad y especificidad de los mismos aumenta si son positivos tres o más de los tests (30,31). Este hecho se confirmó por un metanálisis de Szadeck (32) y fue corroborado por Young (33). Las principales pruebas diagnósticas se reflejan en la Tabla II.
Las pruebas de imagen no suelen tener una adecuada correlación clínica (34), es decir, ASI muy alteradas anatómicamente, pueden no provocar dolor y viceversa (35). Sin embargo las pruebas de imagen (radiología simple, tomografía computarizada TC, resonancia magnética RM o gammagrafía ósea) deberían solicitarse para excluir las denominadas "banderas rojas", es decir condiciones clínicas que requieren intervención médica o quirúrgica urgente (36).
La prueba diagnóstica más aceptada es el bloqueo diagnóstico con anestésicos locales, aunque no hay prueba que sea 100% sensible y 100% específica (37). Este se realiza bajo escopia, introduciendo una aguja en la ASI, realizando una comprobación con contraste yodado de la situación intraarticular de la aguja (realizando una artrografía) (38) y administrando 1-2 ml de anestésico local (AL) (39). Es controvertido la realización de doble bloqueo diagnóstico, que muchos abogan como la única forma de aumentar la sensibilidad y especificidad de los bloqueos diagnósticos (40). Este consiste en realizar dos bloqueos diagnósticos con dos AL de vida media distinta, y si la duración del alivio coincide con la duración del efecto del anestésico local, entonces podríamos considerar los bloqueos positivos, y que la posible causa del dolor sea la ASI. La importancia del doble bloqueo es reducir al máximo el número de falsos negativos y falsos positivos. Sin embargo, muchas veces por la elevada presión asistencial es muy difícil poder realizar doble bloqueo.
De todos modos, la realización del bloqueo debe ser guiado por fluoroscopia, por ecografía o por TC. En principio la ecografía tiene la principal ventaja de la ausencia de irradiación al realizador y al paciente, sin embargo no permite ver la distribución del contraste del artrograma. La TC permite la realización de la técnica con mayor precisión, pero la radiación para el paciente es muy grande y además no permite visualizar absorciones intravasculares que podrían provocar falsos negativos. La fluoroscopia, pese a la radiación del paciente y realizador, y la mayor dificultad para su realización, constituye la técnica más empleada, pues permite la realización de un artrograma, visualizando la distribución intraarticular del contraste; y permite ver si se produce inyección intravascular del mismo a tiempo real.
Bloqueo diagnóstico (Inyección intraarticular)
No siempre se llega. El paciente se sitúa en decúbito prono. Se coloca el aparato de escopia en posición anteroposterior. Se visualiza el borde inferior de la ASI como una pequeña V. Se ven así los bordes posterior y anterior de la ASI, siendo la línea medial el borde posterior y la lateral el borde anterior. Se realiza una pequeña lateralización del arco de escopia contralateral hasta hacer coincidir los bordes anterior y posterior. Se puede dar una pequeña inclinación cefálica para que la parte posterior del borde caudal de la ASI se visualice mejor del resto de la articulación. Se introduce aguja de 25 G en el borde inferior, se debe notar una pequeña pérdida de resistencia al penetrar la aguja dentro de la articulación (41). Una vez comprobada con escopia, se administra 0,5 ml de contraste yodado bajo visión escópica directa, y se observa la distribución del contraste. Esta debe ser craneal y en línea, siguiendo el borde de la ASI. Muchas veces cuesta introducir el contraste y este, a veces se extravasa de la ASI. Si no se consigue con escopia, se puede realizar guiado por TC (Fig. 5).
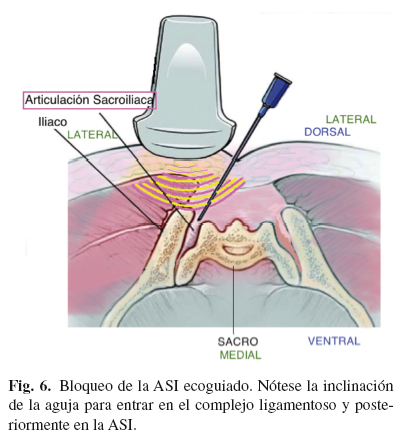
El bloqueo diagnóstico puede realizarse de manera relativamente sencilla ecoguiado (42,43). El paciente se sitúa en decúbito prono. Se escoge un transductor de baja frecuencia curvilíneo. Se sitúa el transductor transversalmente sobre el sacro, a la altura del hiato sacro. Se mueve el transductor lateral y craneal hasta identificar el contorno óseo del íleo. El espacio entre el íleo y el borde lateral del sacro representa la ASI. La diana es el punto más caudal. Se introduce una aguja de 22 G bajo visión ecográfica directa en plano, hasta que la punta de la aguja se sitúa dentro del la ASI (44) (Fig. 6).
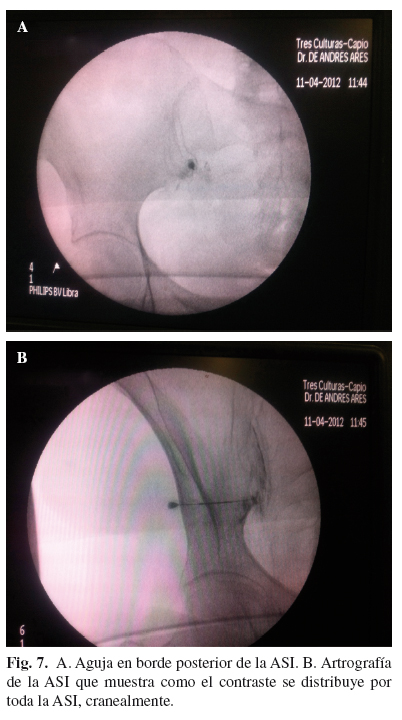
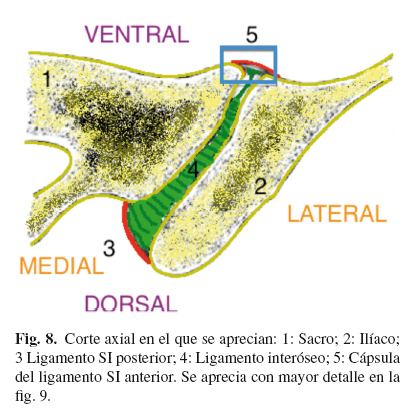
Posteriormente se inyecta 1 cc de contraste yodado para comprobar como se distribuye por la ASI (artrografía) (Fig. 7 A y 7 B). En muchos casos, incluso con volúmenes pequeños, se puede romper la cápsula articular, y se sale el contraste de la ASI.
El corte axial se aprecia en la fig. 8.
Diagnóstico diferencial
Piensa en ellos. El dolor procedente de la ASI debe ser distinguido de: espondiloartropatías como espondilitis anquilosante, artropatía psoriásica o artritis reactiva; síndrome cluneal; compresión radicular: coxalgia; endometriosis; entesopatías; dolor miofascial y síndrome piriforme (45).
Técnicas de denervación de la ASI
Realiza una, pero realízala bien. Existen múltiples técnicas de denervación de la ASI. El principal propósito de la denervación, es conseguir un alivio más duradero que los bloqueos o las infiltraciones de la ASI con corticoides y AL. En principio hay tres tipos de técnicas:
1. Crear lesiones de la ASI (46).
2. RF de los nervios que inervan la ASI (47,48).
3. Una combinación de lesiones ligamentosas y nerviosas de la ASI (49).
- Lesiones de la ASI: Ferrante (46) en 2001 describió la técnica de denervación intraarticular, que consistía en introducir tres o cuatro agujas de RF próximas entre sí, en el borde posteroinferior de la ASI. Se realizaba seguidamente la radiofrecuencia convencional 90", 80o. La técnica se conoció como "salto de rana" al no disponer todavía de generadores de RF capaces de realizar varias lesiones a la vez.
- RF de ramos laterales sacros y posteriores lumbares. Existe gran disparidad en la técnicas descritas para la denervación de la ASI, ya que hay autores como Cohen (47) y Buijs (48) que incluyen el ramo posterior de L4 como diana, y otros como Kapural (50), Burnham y Yasui (51), Yin (52) y Cosman (53) que no. Independientemente de esto, todos están de acuerdo en lesionar los ramos posteriores de L5 y los ramos laterales de S1, S2 y S3.
- Combinación de lesiones ligamentosas y nerviosas de la ASI. Gergavaez realizó un interesantísimo articulo en el que realizaba lesiones guiadas por TC en tres puntos del ligamento posterior SI y en el ramo posterior de L5, consiguiendo un alivio a los tres meses de un 92,1% de pacientes (7,9% de pacientes sin alivio alguno) (49).
De todas las técnicas descritas de denervación, vamos a tratar de resumir las principales características de las más conocidas: RF ramos laterales sacros, RF fría (o enfriada del inglés cooled-rf), RF bipolar en "empalizada" y RF mediante el dispositivo "Simplicity".
Radiofrecuencia de ramos laterales sacros
Se coloca al paciente en decúbito prono. Se intenta visualizar, de la mejor forma posible, los forámenes posteriores, teniendo en cuenta que el foramen mayor es el ventral en una proyección anteroposterior. Para ello se da una inclinación caudo-craneal hasta lograr visualizar de la mejor manera todo el disco L5-S1. Se marcan las siguientes dianas:
- Ramo posterior de L5: en la unión del ala sacra y la raíz del proceso articular superior de S1. Se lesiona 80o-90", tras estímulo sensitivo positivo < 60 V y negativo motor > 1,5 V para miembro inferior (mi).
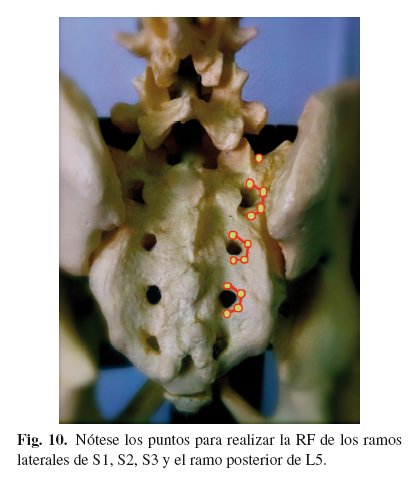
- Ramos laterales sacros de S1, S2 y S3: se marcan los siguientes puntos, teniendo como referencia el foramen sacro posterior (para una lesión de la ASI derecha): las 12, las 2, las 4 y las 6. Se introducen 4 agujas (punta activa de 10 mm) a unos 2 mm de cada punto en dirección alejada del foramen, perpendicular a la piel. Se realizan tres lesiones bipolares 12-2; 2-4; 4-6; tras estímulo sensitivo positivo, pero sobre todo negativo motor a > 1,5 V para el mi. En caso de disponer de generador de RF multicanal, se pueden hacer las tres lesiones por foramen a la vez, en caso de no disponer, se puede hacer primero 12-2, después 2-4, después 4-6 con una aguja activa, y la otra en la placa (51) (Fig. 10).

Radiofrecuencia fría (cooled RF)
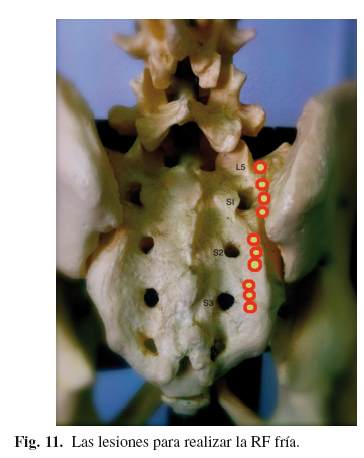
La RF Fría tiene la ventaja de realizar lesiones esféricas mayores, que las que se pueden conseguir con RF convencional (54). Sin embargo el material fungible, que precisa para enfriar la punta con suero, hace que sea un poco más farragosa. Se coloca al paciente en decúbito prono. Se intenta visualizar, de la mejor forma posible, los forámenes posteriores, teniendo en cuenta que el foramen mayor es el ventral en una proyección anteroposterior. Para ello se da una inclinación caudo-craneal hasta lograr visualizar de la mejor manera todo el disco L5-S1. Como la visualización a veces es difícil, se introducen en cada foramen una aguja de localización de 27 G. Se coloca una regla circular denominada regla epsilon (Epsilon RulerTM, Baylis Medical Inc, Montreal, Canada) para indicar a la distancia desde el foramen, a la que se tiene que realizar la lesión, que suele ser de 8-10 mm (50). Se introduce el electrodo hasta contactar con el sacro, y se retira unos 2 mm (no tiene que estar en contacto con el periostio). Se comprueba con una imagen lateral que no está en el canal sacro o en el foramen, y se comprueban impedancias, que deberían ser entre 100-500 Ω. Si fuesen superiores, se debería recolocar el electrodo. Una vez comprobado, se realiza la lesión 150", 60o (55). Se angula craneal 1 cm el electrodo sin sacarlo de la piel, y se realiza una segunda lesión. Se angula caudal 1 cm el electrodo sin sacarlo de la piel y se realiza una tercera lesión. El procedimiento se repite en S2 y S3 y se realiza una única lesión en ramo posterior de L5 (56) (Fig. 11).
Radiofrecuencia bipolar en empalizada
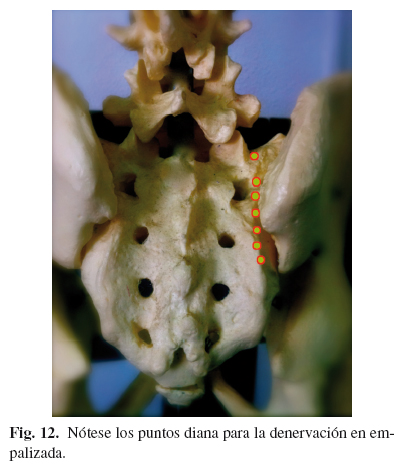
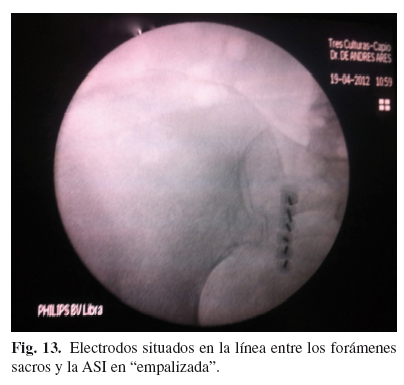
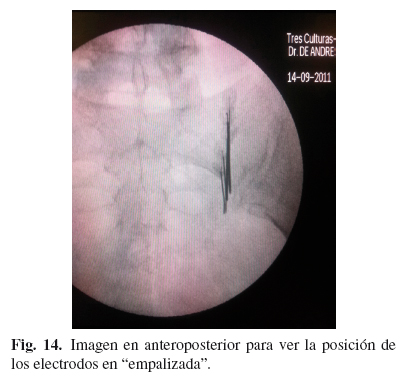
Técnica descrita por Cosman (57), sobre los artículos previos de Pino (58). La técnica se realiza de manera similar a las previas, con el paciente en decúbito prono, pero en este caso no se localiza el disco L5-S1, sino que se intenta que el haz de rayos entre perpendicular al sacro. Una vez conseguido esto, se localiza el foramen saco de S1 y 1 cm lateral a él se marcan 6 puntos separados 10 mm, en línea recta, de tal modo que el último, coincida con 1 cm del borde lateral de S3. Se introducen 6 electrodos y tras estimulación motora negativa a > 1,5 V para el miembro inferior en cada nivel, se realiza RF convencional bipolar 80o y 180". Seguidamente se realiza RF convencional 80o, 90" del ramo posterior de L5 (Figs. 12-15).

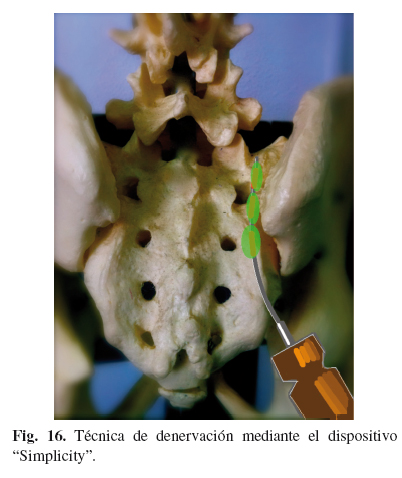
Radiofrecuencia mediante el dispositivo "SimplicityTM"
Consiste en realizar 6 lesiones bipolares mediante una única punción de un novedoso artefacto diseñado por Neurotherm. El dispositivo se introduce desde 1 cm lateral del foramen de S4, hasta contactar con periostio, para posteriormente dirigirlo cranealmente hasta que la punta alcance el borde lateral de S1. El generador de la misma casa comercial posee un programa espacial para realizar la denervación. Se producen 5 lesiones combinando los tres electrodos que posee (Fig. 16).
Radiofrecuencia pulsada
Se han realizado dos tipos de técnicas de RF pulsada:
- RF pulsada de las ramas laterales sacras y del ramo posterior de L5.
- RF pulsada intra articular de la ASI.
RF pulsada de ramas laterales sacras
Fue Vallejo (60) en 2006 el que describió la técnica de RF pulsada de las ramas laterales sacras. La técnica en principio se realizó en ramos posteriores de L4 y L5, así como en ramos laterales de S1 y S2. Se localizaban estos ramos por referencias anatómicas fluoroscópicas y se realizaba estimulación sensitiva a 50 Hz que debería ser positiva (sensación o dolor en zona de la ASI) a menos de 40 V. Una vez localizados, se realizaba la RF pulsada 45 V y 120". Los resultados fueron de alivio del dolor en un 41,3% y duradero más de 6 meses en un 12,96%.
RF pulsada intraarticular
Sluijter (61) en 2008 describió la posibilidad de que la RF pulsada, aplicada intra-articular, podría ser analgésica. Se describieron una serie de casos clínicos, uno de ellos de la ASI, en el que se lograba alivio del dolor. La técnica era la misma que para los bloqueos diagnósticos intra-articulares, pero una vez dispuesto el electrodo dentro de la ASI, se aplicaba RF pulsada con anchura de pulso de 10 ms, 2 Hz y 65 V durante 10 minutos.
Conclusiones
La ASI es una fuente importante de dolor axial y/o radicular (generalmente no más allá de la rodilla), muchas veces infravalorado, que suele responder muy bien a técnicas de denervación, siempre que haya uno o varios bloqueos diagnósticos previos positivos. Existen diversas técnicas de denervación de la ASI (ver resumen de algunas en Tabla III), las cuales, realizadas de manera adecuada, logran alivio duradero durante varios meses del dolor.
Conflictos de interés
los autores declaran no tener conflicto de interés alguno.
Bibliografía
1. Bernard TN, Cassidy JD. The sacroiliac syndrome. Pathophysiology, diagnosis and management. In: Frymoyer JW (editor). The adult spine: principles and practice. New York: Raven. 1991. p. 2107-30. [ Links ]
2. Bogduk N. The sacroiliac joint. In: Bogduk N (editor). Clinical anatomy of the lumbar spine and sacrum. 4th edition. New York: Churchill Livingstone. 2005. p. 173-81. [ Links ]
3. Puhakka KB, Melsen F, Jurik AG, et al. MR imaging of the normal sacroiliac joint with correlation to histology. Skeletal Radiol. 2004;33:15-28. [ Links ]
4. Schunke M, Schulte E, Schumacher U. Bones, ligaments, and joints. In: Lamperti E, Ross L (editors). Thieme atlas of anatomy: general anatomy and musculoskeletal system. New York: Thieme. 2007. p. 114. [ Links ]
5. Dijkstra PF, Vleeming A, Stoeckart R. Complex motion tomography of the sacroiliac joint: an anatomical and roentgenological study (in German). Rofo. 1989;150:635-42. [ Links ]
6. Ruch WJ. Atlas of common subluxations of the human spine and pelvis. Boca Raton, FL: CRC Press, 1997. [ Links ]
7. Mitchell FL Jr. The muscle energy manual, Vol. 1. East Lansing, MI: MET Press, 1995. [ Links ]
8. Bowen V, Cassidy JD. Macroscopic and microscopic anatomy of the sacroiliac joint from embryonic life until the eighth decade. Spine. 1981;6:620-8. [ Links ]
9. Yin W, Willard F, Carreiro J, et al. Sensory stimulation-guided sacroiliac joint radiofrequency neurotomy: technique based on neuroanatomy of the dorsal sacral plexus. Spine. 2003;28:2419-25. [ Links ]
10. Murata Y, Takahashi K, Yamagata M, et al. Sensory innervation of the sacroiliac joint in rats. Spine. 2000;16:2015-9. [ Links ]
11. Solonen KA. The sacroiliac joint in the light of anatomical, roentgenological and clinical studies. Acta Orthop Scand. 1957;27(suppl):1-27. [ Links ]
12. Ikeda R. Innervation of the sacroiliac joint: macroscopic and histological studies. J Nippon Med Sch. 1991;58:587-96. [ Links ]
13. Fortin JD, Kissling RO, O'Connor BL, et al. Sacroiliac joint innervation and pain. Am J Orthop. 1999;28:68-90. [ Links ]
14. Grob KR, Neuhuber WL, Kissling RO. Innervation of the sacroiliac joint in humans. Z Rheumatol. 1995;54:117-22. [ Links ]
15. Dreyfuss P, Dreyer SJ, Cole A, et al. Sacroiliac joint pain. J Am Acad Orthop Surg. 2004;12:255-65. [ Links ]
16. Walker JM. The sacroiliac joint: a critical review. Phys Ther. 1992;72:903-16. [ Links ]
17. White AA, Vanelderen P, Szadek K, et al. Sacroiliac Joint Pain. Pain Practice. 2010;10(5):470-8. [ Links ]
18. Panjabi MM. Clinical biomechanics of the spine. 2nd ed. Philadelphia: JB Lippincott, 1990. [ Links ]
19. Fortin JD, Kissling RO, O'Connor BL, et al. Sacroiliac joint innervation and pain. Am J Orthop. 1999;28(12):687-90. [ Links ]
20. Katz V, Schofferman J, Reynolds J. The sacroiliac joint: a potential cause of pain after lumbar fusion to the sacrum. J Spinal Disord Tech. 2003;16:96-9. [ Links ]
21. DePalma MJ, Ketchum JM, Saullo T. What is the source of chronic low back pain and does age play a role? Pain Med. 2011;12(2):224-33. [ Links ]
22. Slipman CW, Jackson HB, Lipetz JS, et al. Sacroiliac joint pain referral zones. Arch Phys Med Rehabil. 2000;81:334-8. [ Links ]
23. Merskey H, Bogduk N. Classification of chronic pain: Descriptions of chronic pain syndromes and definitions of pain terms, Seattle, WA, IASP Press, 1994. p. 190-1. [ Links ]
24. Szadeck K, Van der Wuff P, van Tulder MW, et al. Diagnostic validity of criteria for sacroiliac joint pain: a systematic review. J Pain. 2009:10(4):354-68. [ Links ]
25. Dreyfuss P, Michaelsen M, Pauza K, et al. The value of medical history and physical examination in diagnosing sacroiliac joint pain. Spine. 1996;21:2594-602. [ Links ]
26. Dreyfuss P, Dreyer S, Griffin J, et al. Positive sacroiliac screening tests in asymptomatic adults. Spine. 1994;19:1138-43. [ Links ]
27. Potter NA, Rothstein JM. Intertester reliability for selected clinical tests of the sacroiliac joint. Phys Ther. 1985; 65:1671-5. [ Links ]
28. Saal JS. General principles of diagnostic testing as related to painful lumbar spine disorders: a critical appraisal of current diagnostic techniques. Spine. 2002;27:2538-45. [ Links ]
29. Laslett M, Aprill CN, McDonald B, et al. Diagnosis of sacroiliac joint pain: validity of individual provocation tests and composites of tests. Man Ther. 2005;10:207-18. [ Links ]
30. Van der Wurff P, Buijs EJ, Groen GJ. A multitest regimen of pain provocation tests as an aid to reduce unnec- essary minimally invasive sacroiliac joint procedures. Arch Phys Med Rehabil. 2006;87:10-4. [ Links ]
31. Hansen HC, McKenzie-Brown AM, Cohen SP, et al. Sacroiliac joint interventions: a systematic review. Pain Physician. 2007;10:165-84. [ Links ]
32. Szadek KM, van der Wurff P, van Tulder MW, et al. Diagnostic validity of criteria for sacroiliac joint pain: a systematic review. J Pain. 2009;10:354-68. [ Links ]
33. Young S, Aprill C, Laslett M. Correlation of clinical examination characteristics with three sources of chronic low back pain. Spine J. 2003;3:460-5. [ Links ]
34. Elgafy H, Semaan HB, Ebraheim NA, et al. Computed tomography findings in patients with sacroiliac pain. Clin Orthop. 2001;382:112-8. [ Links ]
35. Rupert MP, Lee M, Manchikanti L, et al. Evaluation of sacroiliac joint interventions: a systematic appraisal of the literatura. Pain Physician. 2009;12(2):399-418. [ Links ]
36. Bigos S, Bowyer O, Braen G, et al. Acute low back pain problems in adults: assessment and treatment. Agency for Health Care Policy and Research. Clin Pract Guidel Quick Ref Guide Clin. 1994 Dec;(14):iii-iv, 1-25. [ Links ]
37. Berthelot JM, Labat JJ. Provocative sacroiliac joint maneuvers and sacroiliac joint block are unreliable for diagnosing sacroiliac joint pain. Joint Bone Spine. 2006;73:17-23. [ Links ]
38. Dussault RG, Kaplan PA, Anderson MW. Fluoroscopy-guided sacroiliac joint injections. Radiology. 2000;214:273-7. [ Links ]
39. Dreyfuss MD. Practice guidelines and protocols for sacroiliac joint blocks. In: International Spine Intervention Society, ed. ISIS 9th Annual Scientific Meeting. San Francisco, CA: ISIS. 2001. p. 35-49. [ Links ]
40. Maigne JY, Aivaliklis A, Pfefer F. Results of sacroiliac joint double block and value of sacroiliac provocation tests in 54 patients with low back pain. Spine. 1996;21:1889-92. [ Links ]
41. Dussault RG, Kaplan PA, Anderson MW. Fluoroscopy-guided sacroiliac joint injections. Radiology. 2000;214:273-7. [ Links ]
42. Vydyanathan A, Narouze SN. Ultrasound-guided caudal and sacroiliac joint injections. In: Narouze SN. Atlas of Ultrasound-Guided Procedures in Interventional Pain Management. Springer. 2011. p. 179-89. [ Links ]
43. Pekkafahli MZ, Kiralp MZ, Basekim CC, et al. Sacroiliac joint injections performed with sonographic guidance. J Ultrasound Med. 2003;22:553-9. [ Links ]
44. Harmon D, O'Sullivan M. Ultrasound-guided sacroiliac joint injection technique. Pain Physician. 2008;11:543-7. [ Links ]
45. Vanelderen P, Szadek K, Cohen SP, et al. Sacroiliac Joint Pain. Pain Pract. 2010;10(5):470-8. [ Links ]
46. Ferrante FM, King LF, Roche EA, et al. Radiofrequency sacroiliac joint denervation for sacroiliac syndrome. Reg Anesth Pain Med. 2001;26:137-42. [ Links ]
47. Cohen SP, Abdi S. Lateral branch blocks as a treatment for sacro-iliac joint pain: a pilot study. Reg Anesth Pain Med. 2003;28:113-9. [ Links ]
48. Buijs EJ, Kamphuis ET, Groen GJ. Radiofrequency treatment of sacroiliac joint-related pain aimed at the first three sacral dorsal rami: a minimal approach. Pain Clinic. 2004;16:139-46. [ Links ]
49. Gevargez A, Groenemeyer D, Schirp S, et al. CT-guided percutaneous radiofrequency denervation of the sacroiliac joint. Eur Radiol. 2002;12:1360-5. [ Links ]
50. Kapural L, Nageeb F, Kapural M, et al. Cooled radiofrequency system for the treatment of chronic pain from sacroiliitis: the first case-series. Pain Pract. 2008;5:348-54. [ Links ]
51. Burnham RS, Yasui Y. An alternate method of radiofrequency neurotomy of the sacroiliac joint: A pilot study of the effect on pain, function and satisfaction. Reg Anesth Pain Med. 2007;32:12-9. [ Links ]
52. Yin W, Willard F, Carreiro J, et al. Sensory stimulation guided sacroiliac joint radiofrequency neurotomy: technique based on neuroanatomy of the dorsal sacral plexus. Spine. 2003;28:2419-25. [ Links ]
53. Cosman E, Gonzalez C. Bipolar radiofrequency lesion geometry: implications for palisade treatment of sacroiliac joint pain. Pain Pract. 2011;11(1):3-22. [ Links ]
54. Watanabe I, Masaki R, Min N, et al. Cooled-tip ablation results in increased radiofrequency power delivery and lesion size in the canine heart: importance of catheter-tip temperature monitoring for prevention of popping and impedance rise. J Interv Card Electrophysiol. 2002;6:9-16. [ Links ]
55. Wright RE, et al. In vivo temperature measurement during neurotomy for sacroiliac joint pain using the Baylis SInergy Probe. Proceedings of the International Spine Intervention Society 15th Annual General Meeting. Baltimore, MD; 2007. [ Links ]
56. Kapural L, Stojanovic M, Sessler DI, et al. Cooled radiofrequency (RF) of L5 dorsal ramus for RF denervation of the sacroiliac joint: technical report. Pain Med. 2010;11:53-7. [ Links ]
57. Cosman ER Jr, Gonzalez CD. Bipolar radiofrequency lesion geometry: implications for palisade treatment of sacroiliac joint pain. Pain Pract. 2011;11(1):3-22. [ Links ]
58. Pino CA, Hoeft MA, Hofsess C, et al. Morphologic analysis of bipolar radiofrequency lesions: implications for treatment of the sacroiliac joint. Reg Anesth Pain Med. 2005 Jul-Aug;30(4):335-8. [ Links ]
59. De Witte J. Neurotherm Simplicity III manual. http://www.cadaverworkshop.info/wp-content/uploads/2012/03/Simplicity-III-Manual.pdf. [ Links ]
60. Vallejo R, Benyamin RM, Kramer J, et al. Pulsed radiofrequency denervation for the treatment of sacroiliac joint syndrome. Pain Med. 2006;7:429-34. [ Links ]
61. Sluijter M, Teixeira A, Serra V, et al. Intra-articular Application of Pulsed Radiofrequency for Arthrogenic Pain. Report of Six Cases. Pain Pract. 2008;8(1):57-61. [ Links ]
Recibido: 04-09-12.
Aceptado: 01-11-12.