INTRODUCCIÓN
El dolor es definido por la Asociación Internacional para el Estudio del Dolor (IASP) como “una experiencia sensorial y emocional desagradable asociada con daño tisular real o potencial, o descrita en términos de dicho daño” 1. Por su parte, el dolor agudo presenta un inicio súbito, tiene una duración limitada y es provocado por una lesión o enfermedad específica y además es prevalente hasta en el 70 % de los pacientes prehospitalarios y en el 60-90 % de aquellos que ingresan al servicio de urgencias 2. En Colombia, el Estudio Nacional de Dolor, realizado por la Asociación Colombiana para el Estudio del Dolor mostró una prevalencia en los últimos 6 meses del 76 %, con una prevalencia en pacientes hospitalizados del 67,5 % 3.
La dipirona (metamizol) es un medicamento derivado de la pirazolona que tiene propiedades analgésicas, antipiréticas y antiespasmódicas4. Tiene amplias indicaciones clínicas para el manejo del dolor y se ha comprobado su eficacia en pacientes con cefalea tipo tensión y migraña 5, así como en pacientes con dolor agudo postoperatorio 6. Su uso se ha descrito también en escenarios como el del dolor oncológico para el que puede ser una alternativa a otros analgésicos no opioides 7. A pesar de su amplia utilidad, múltiples estudios ponen en duda la seguridad de este medicamento, que es de venta con fórmula facultativa en algunos países como Colombia, y está prohibido en otros como en Estados Unidos. Entre las reacciones adversas medicamentosas (RAM) de mayor gravedad asociadas con la dipirona se encuentran efectos hematológicos (como la agranulocitosis), riesgo de alergias y choque anafiláctico, lesiones renales a largo plazo y erupciones cutáneas 8.
Con relación al reporte de RAM, Colombia cuenta con un marco normativo que determina el Programa Nacional de Farmacovigilancia bajo la coordinación del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA). El programa está basado en una red articulada de los prestadores de servicios de salud, los cuales deben realizar notificación inmediata (dentro de las primeras 72 horas) o periódica (dentro de los primeros cinco días del mes) de los eventos y problemas relacionados con los medicamentos (PRM) de acuerdo con su seriedad 9. Dicha notificación es electrónica a través de plataformas que para ello ha dispuesto la entidad reguladora 10.
El propósito del presente trabajo es describir los PRM (problemas relacionados con medicamentos) y RAM asociados con la dipirona en Colombia con base en la base de datos publicada por el INVIMA. De igual manera, se estima su incidencia y se elabora un modelo multivariado para RAM irreversibles.
MATERIALES Y MÉTODOS
Diseño del estudio y procedimientos generales
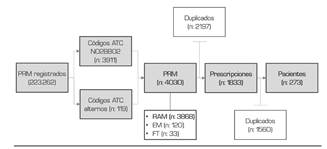
Se realizó una investigación observacional, analítica, de tipo cohorte retrospectiva, utilizando los reportes de farmacovigilancia presentados ante el INVIMA entre enero de 2018 y febrero de 2019. Posteriormente, estos reportes fueron consolidados por el ente regulador en una base de datos habilitada para libre consulta durante el primer semestre del último año en mención. La información fue ingresada de manera manual por los prestadores de servicios de salud y registrada en veintiún variables distintas de interés.
Para este estudio, se seleccionaron los PRM atribuidos a fármacos con la denominación ATC del subgrupo N02BB dentro del índice de la Organización Mundial de la Salud, que corresponde a analgésicos y antipiréticos tipo pirazolonas, entre las cuales se encuentra la dipirona 11. Dado que resulta posible prescribir a un mismo paciente más de un medicamento y que un mismo medicamento puede producir uno o más PRM, se eliminaron los duplicados. Para ello se consideraron ocho variables, obteniendo los registros de medicamentos únicos y, sobre esta depuración, se identificaron los pacientes únicos prescritos.
La dosis equianalgésica (DEQ) referida en miligramos equivalentes de dipirona se obtuvieron teniendo en cuenta los factores de conversión de las unidades de masa. La definición de reacciones adversas serias indicada por el ente regulador implica todas aquellas que cambien el curso de la hospitalización, produzcan malformación neonatal, generen otra condición médica importante o incapacidad y aumenten el riesgo de morir o sean letales. Con el fin de comparar la frecuencia de los PRM, se calculó su incidencia por 100.000 pacientes prescritos durante 2018. Se determinó como numerador el número de pacientes que presentaron un problema atribuible a dipirona y como denominador el número de pacientes únicos prescritos en el periodo, considerando la frecuencia relativa de los regímenes de aseguramiento (subsidiado y contributivo). La información utilizada para dicho propósito fue extraída de la base de datos del Ministerio de Salud, MEDCOL-STAT 12.
Siguiendo la línea de investigación que viene desarrollando nuestro grupo, esta investigación se adhiere al mismo diseño y metodología de análisis, los cuales se describen a profundidad en otra publicación 13.
Análisis estadístico
La distribución de las variables cuantitativas se analizó con la prueba de Shapiro-Wilk para definir las medidas de tendencia central y dispersión a calcular; las variables cualitativas se informaron por medio de porcentajes. La incidencia de PRM, total y por sexo, se calculó asumiendo una distribución de Poisson, como se ha discutido en publicaciones anteriores 14. Por otro lado, las inferencias se computaron por medio del coeficiente ρ de Spearman, el estadístico U de Mann-Whitney y el test de χ2 o la prueba exacta de Fisher.
Se elaboró un modelo logístico utilizando como variable dependiente la categoría compuesta por las opciones “no recuperado, no resuelto” y “fatal”, que se registraron como desenlace de RAM. Se consideraron de forma independiente los sistemas con ≥ 40 % de reacciones serias. El modelo final se depuró por medio del método de stepwise backward hasta obtener la significancia global e individual de cada variable. Se calculó el coeficiente de determinación (R2) y el área bajo la curva. Finalmente, se realizó una validación interna con bootstrapping a mil replicaciones, evaluando las variables que mejor se asocian con el desenlace en términos de razones de oportunidad (OR), con el respecto intervalo de confianza (IC) al 95 %. Se consideraron significativos los valores de p < 0,050.
Las pruebas estadísticas se realizaron en el paquete Stata, versión 14 (StataCorp, Texas, Estados Unidos).
RESULTADOS
Caracterización de los pacientes
La muestra correspondió a 273 pacientes (Figura 1) e incluyó 138 mujeres (54,55 %). La mediana de edad fue de 28 años (IQR 10-46) y fue mayor en las mujeres (32 años IQR 17-49 vs. 22 años IQR 7-45; p = 0,022). El 57,38 % pertenecía a las 10 ciudades más grandes del país.
Los diagnósticos sintomáticos más frecuentes fueron: dolor agudo (25; 9,88 %), dolor no especificado (22; 8,70 %) y fiebre no especificada (21; 8,30 %). Dentro de los síndromes dolorosos definidos topográficamente se incluyeron cefalea y migraña (13; 5,14 %), dolor abdominal localizado en parte superior y otros no especificados (10; 3,95 %), dolor en miembro (3; 1,19 %), dolor pélvico y perineal (3; 1,19 %) y lumbago (3; 1,19 %). Por subcapítulo de la Clasificación Internacional de Enfermedades (CIE-10), la mayor frecuencia se atribuyó a signos y síntomas no clasificados (107; 42,29 %), enfermedades de los sistemas osteomuscular y conectivo (20; 7,91 %), traumatismos (16; 6,32 %), enfermedades del sistema nervioso (14; 5,53 %) y aquellas del aparato respiratorio (12; 4,74 En 3 pacientes se anotó como diagnóstico el envenenamiento y efectos adversos de analgésicos o antipiréticos.
Perfil de prescripción de dipirona
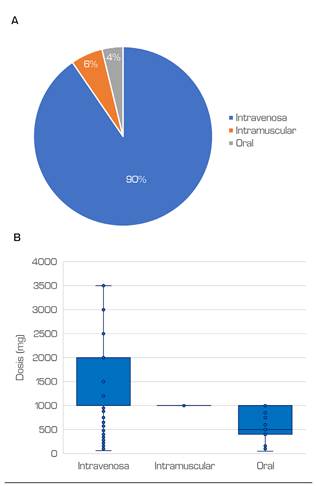
En la muestra estudiada se registraron 1833 prescripciones de dipirona. Tras el análisis se encontraron 69 esquemas posológicos diferentes, considerando la dosis y vía de administración. Las prescripciones indicaron administración por vía intravenosa en 1287 registros (90,44 %), intramuscular en 81 (5,76 %) y oral en 54 (3,79 %), siendo las dosis 1 g (IQR 1-2), 1 g (IQR 1-1) y 0,5 g (IQR 0,4-1), respectivamente (p < 0,001) (Figuras 2 A y B). Las pruebas estadísticas demostraron diferencias en la dosis prescrita por sexo (p < 0,001) y una correlación débilmente positiva con la edad (ρ = 0,153, p = 0,000). La media de las dosis fue 1,54 vs. 1,39 g a favor de las mujeres, en quienes se encontraron 5 valores por encima de 4 g.
Problemas asociados con dipirona
Del total de problemas relacionados con el medicamento (n: 4021), se encontraron 3868 reacciones adversas al medicamento (96,19 %), 120 errores de medicación (EM) (2,98 %) y 33 fallos terapéuticos (0,82 %). Para el año 2018, se calculó una incidencia de problemas relacionados con dipirona de 101 por cada 100.000 pacientes únicos prescritos (113 y 93 por cada 100.000 en hombres y mujeres, respectivamente), de acuerdo con la base de datos analizada.
Dentro de los errores de medicación, la fuente se documentó en 48 registros (40 %). Los más frecuentes fueron los errores de prescripción (32; 26,67 %) y dispensación (10; 8,33 %). La seriedad se registró para 41 (34,16 %) EM, siendo prioritariamente errores potenciales o no errores (categoría A: 24; 58,54 %). Solo en 10 registros se catalogó la seriedad como categoría G (24,39%) que denota la “contribución o causa daño permanente al paciente”.
Se identificaron 118 diferentes RAM, siendo las más frecuentes: erupción cutánea (905; 24,78 %), prurito (561; 15,36 %), urticaria (365; 9,99 %), alergia (337; 9,23 %), y reacción en el sitio de aplicación tipo flebitis (200; 5,48 %). Con base en la distribución de RAM por sexo, los registros de erupción cutánea (p = 0,023), reacción en el sitio de aplicación tipo flebitis (p = 0,007), edema (p = 0,020) y alteración de función renal (p = 0,004) fueron más frecuentes en los hombres. De manera complementaria, disnea (p = 0,048), lipotimia-síncope (p = 0,021), broncoespasmo (p = 0,016), ansiedad (p = 0,026), y malestar general (p = 0,009) fueron más frecuentes en mujeres. No hubo diferencias significativas por sexo para trastornos de células hematopoyéticas (p = 0,637).
Fueron consideradas 1030 RAM como serias (27,82 %), incluyendo, entre otras, anafilaxia (65; 6,77 %), edema facial (35; 3,65 %), arritmia cardiaca (21; 2,19 %) e hipotensión (20; 2,08 %). Con respecto a estas reacciones, en los hombres ocuparon los primeros lugares la erupción cutánea (95; 22,30 %), el prurito (53; 12,44 %) y la alergia (37; 8,68 %); datos similares se obtuvieron para las mujeres (erupción cutánea 102; 19,39 %, prurito 67; 12,74 %, y alergia 54; 10,27 %). Las reacciones serias tuvieron una frecuencia similar por sexo (p = 0,402), sin diferenciarse por edad (p = 0,456) o dosis (p = 0,233).
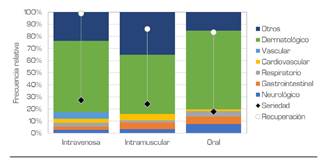
La frecuencia relativa de las RAM por sistema comprometido mostró una predominancia de los trastornos de piel y anexos (2219; 57,55 %), trastornos generales de todo el organismo (817, 21,19 %) y trastornos vasculares extracardiacos (193; 5,01 %) (Figura 3). Las principales diferencias porcentuales por sexo se encontraron para los trastornos vasculares extracardiacos (5,94 % vs. 4,26 %) a favor de los hombres, y para los respiratorios (3,78 % vs. 2,34 %) a favor de las mujeres. De esta manera, existieron más RAM vasculares periféricas (p = 0,017) y urinarias (p = 0,003) entre los hombres, y más respiratorias (p = 0,011), gastrointestinales (p =0,018) y psiquiátricas (p = 0,024), entre las mujeres. Los problemas serios, con topografía establecida, se concentraron en la piel y anexos (45,60 %), el sistema cardiovas-cular (5,97 %) y el sistema vascular extracardiaco (5,87 %).
Particularmente, solo 38 RAM comprometieron el sistema hematológico (0,98 %), reportándose en 30 registros alteración de las líneas celulares (0,82 %). El 56,66 % (17) ocurrieron en mujeres y el 53,33 % (16) fueron consideradas como serias.
El desenlace se documentó en 3806 registros, incluyendo 22 RAM fatales (0,58 %; el 68,18 % en mujeres) y 54 sin recuperación (1,42 %; el 62,96 % en mujeres). En 3 casos se anotó la recuperación con secuelas. El mayor porcentaje fue aportado por las RAM completamente resueltas o en proceso de resolución (3727; 97,92 %). Sin embargo, la atribución causal definitiva se logró únicamente para 84 (2,22 %), mientras que la mayoría se asignó como posible o probable (3603; 95,19 %). La causalidad definitiva no se registró en un sexo particular (p = 0,903) o de acuerdo con la seriedad de la RAM (p = 0,933). Ninguna de las reacciones fatales tuvo causalidad definitiva, y esta atribución solo se aplicó para una de las RAM sin recuperación (1; 1,19 %).
Factores asociados con la no recuperación
Las RAM sin recuperación más frecuentes fueron erupción cutánea (20; 29,4 1%), prurito (10; 14,71 %) y urticaria (10; 14,71 %) y los sistemas más comprometidos fueron el tegumentario (45; 59,21 %), el hematológico (5; 6,58 %) y el cardiovascular (4; 5,26 %).
Estas RAM fueron reportadas en el 1,56 % (27) de los hombres y el 2,37 % (49) de las mujeres (p = 0,078). Estas reacciones fueron más frecuentes en pacientes de mayor edad (44 RIC 29-69 vs. 38 RIC 24-56; p = 0,027). La no recuperación también se presentó con un porcentaje más alto entre las RAM serias (2,77 %
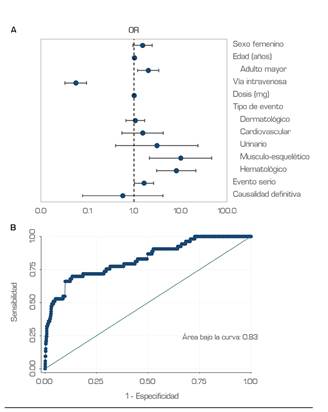
vs. 1,71 %; p = 0,041). En el análisis bivariado, llama la atención que las RAM registradas con dosis mayores se relacionaron con mejor desenlace (1 g IQR 0,4-2 vs. 1 g IQR 1-2; p = 0,001). Las razones de oportunidad ajustadas (previas a la depuración del modelo) para las variables de interés se presentan en la Figura 4A.
El modelo final muestra que las RAM hematológicas (OR 6,430 IQR 1,909-21,656; p = 0,003), el sexo femenino (OR 1,945 IQR 1,053-3,592), y la edad (OR 1,027 IQR 1,013-1,041; p = 0,000) se asocian con una menor probabilidad de recuperación. Por el contrario, la dosis en miligramos (OR 0,999 IQR 0,998-0,999; p = 0,025) y la administración por vía intravenosa (OR 0,061 IQR 0,032-0,116; p = 0,000), parecieran favorecer el buen desenlace. Teniendo en cuenta lo anterior, las reacciones adversas hematológicas que ocurren en mujeres se relacionan con una posibilidad 13 veces mayor de no recuperación (OR 14,522 IQR 5,246-40,204; p = 0,000). La curva ROC del modelo alcanzó un valor de 0,828, con un pseudo-R2 de McFadden de 0,222 (Figura 4B).
DISCUSIÓN
Este estudio corresponde a uno de los primeros análisis poblacionales en Latinoamérica de PRM relacionados con dipirona. En los pacientes evaluados en este estudio, el sexo femenino y los adultos jóvenes predominaron, así como los diagnósticos de dolor agudo y no especificado, y la administración por vía intravenosa. La reacción adversa más frecuente fue la erupción cutánea, seguida del prurito; los trastornos de piel y anexos fueron los más comunes, mientras que las reacciones hematológicas fueron infrecuentes. Una cuarta parte de las RAM fueron serias y se asociaron al sistema hematológico, la edad y el sexo femenino, con una menor probabilidad de recuperación.
Los resultados obtenidos muestran una edad y sexo de los pacientes similares a los de otro estudio publicado en Colombia por González-Cárdenas y cols.15. En este último, la incidencia de efectos adversos asociados a dipirona fue del 0,3 %, todas fueron cutáneas y no severas y en ningún caso se describió agranulocitosis. La principal indicación para el uso de dipirona en esta publicación fue el manejo analgésico y el servicio con mayores prescripciones fue el de cirugía general.
Otro estudio en Colombia evaluó 59 pacientes con reacciones adversas relacionadas con el uso de dipirona 16. La edad y el sexo de los pacientes fueron similares a las aquí reportadas, con una incidencia acumulada de reacciones adversas medicamentosas de 1,39 por 1000 pacientes/año. En este estudio de Machado-Alba y cols., la mayoría de las reacciones adversas fueron cutáneas y leves, pero a diferencia del anterior, se halló un caso de granulocitopenia asociada con el medicamento.
Como se mencionó anteriormente y lo demuestran los otros dos estudios colombianos, las RAM cutáneas fueron las más frecuentes. La dipirona ha sido implicada en una variedad de reacciones cutáneas como erupciones inespecíficas, urticaria, eritema, entre otras 8. Un estudio de la epidemiología de las reacciones adversas cutáneas a medicamentos (ACDR) de Hernández-Salazar y cols., mostró una incidencia del 0,7 % 17. En este estudio, la dipirona fue uno de los medicamentos con mayor asociación a ACDR, calculando un riesgo de 3,7 por 1000 dosis/día. Dentro de los efectos adversos más frecuentemente encontrados estuvieron el exantema morbiliforme, urticaria y eritema multiforme, con mayor afectación en el sexo femenino.
Otro estudio evaluó retrospectivamente datos clínicos de pacientes con hipersensibilidad a la dipirona 18. De los 239 pacientes estudiados, el 31,4 % presentó anafilaxia, y de estos pacientes, el 13,3 % correspondían a urticaria, un porcentaje un poco mayor al de nuestro estudio. Una investigación realizada en España consideró pacientes que desarrollaron hipersensibilidad a la dipirona 19. Se incluyeron 137 pacientes, con una edad media de 53 años y el 73,3 % fueron mujeres; la anafilaxia fue la reacción más frecuente (58,39 %), seguida de urticaria (30,65 %), angioedema (5,10 %) y exantema maculopapular (2,18 %).
Adicionalmente, se han descrito en diferentes países una asociación entre dipirona y RAM hematológicas como agranulocitosis. Hoffmann y cols. evaluaron reportes de agranulocitosis asociados a dipirona entre 1985 y 2017, identificando 1987 reportes provenientes de 31 países diferentes. En este estudio, la edad media fue de 53,6 años, 63,4 % fueron mujeres, la ruta de administración en el 79,2 % de los casos fue oral, la dosis promedio fue 1683,3 mg y un 16 % de los casos fueron fatales 20. Dentro de este grupo de pacientes con reacciones hematológicas, la edad media fue mayor, se registraron más comorbilidades y había una comedicación mayor con metotrexato. Al comparar con nuestra investigación, se destaca en dicho estudio un número mayor de RAM hematológicas, el predominio de la vía oral como vía de administración y una fatalidad más alta.
Blaser y cols.21 también evaluaron 1494 reacciones adversas hematológicas asociadas con el metamizol, el cual fue principalmente administrado por vía oral, aunque con dosis mayores administradas por vía intravenosa. Las RAM hematológicas fueron más frecuentes a mayor edad y en el sexo femenino, al igual que lo demuestran los datos de Colombia. Stammschulte y cols. describieron la asociación entre agranulocitosis y dipirona 22 al analizar 161 pacientes, de los cuales 63 presentaron un conteo de neutrófilos < 100/µl, 109 desarrollaron infecciones asociadas y la mortalidad se presentó en el 23,6 %. Otro estudio realizado en Suecia describió la asociación de discrasias sanguíneas con dipirona entre 1966 y 1999, refiriendo en 66 pacientes una incidencia estimada de 1:1.439 prescripciones 23; la dosis diaria fue 1,6 ± 1,3 g/día y el 23 % fueron casos fatales, letalidad similar a la informada por Stammschulte y cols.
Se ha sugerido que la variabilidad de la frecuencia de RAM hematológicas entre países puede tener un sustento étnico, dada por alelos en el complejo mayor de histocompatibilidad (HLA) 24. Un estudio de Vlahov y cols. 25 realizó una investigación con pacientes con agranulocitosis previa entre 1982 y 1987 en Bulgaria. Los investigadores analizaron nueve pacientes, de los cuales cinco estuvieron expuestos a metamizol, encontrando diferencias significativas en el antígeno leucocitario humano (HLA) y la frecuencia de anormalidades cromosómicas. En los pacientes expuestos al metamizol se encontró una mayor prevalencia del haplotipo A24-B7 y el antígeno HLA-DQwl.
Otros de los efectos adversos a la dipirona son de tipo gastrointestinal y hepático 26. Descripciones en modelos animales destacan un retraso en el vaciamiento gástrico, aunque sin úlceras 27. También se ha descrito la relación entre dipirona y daño hepático producido por fármacos (DILI), el cual puede alcanzar la insuficiencia hepática aguda en el 22 % 28. Los análisis aquí realizados muestran que los principales eventos gastrointestinales ocurren en el 2,71 % de los pacientes, con una frecuencia mínimamente mayor en mujeres (3,09 %).
Finalmente, fue llamativo que las dosis altas, administradas por vía intravenosa, representaran un factor relacionado con mejores desenlaces. Por el contrario, las reacciones no recuperables con vía de administración oral están asociadas a unas dosis más bajas. Lo anterior puede ser explicado por un pobre seguimiento a las dosis por toma y el intervalo interdosis cuando el metamizol es prescrito por vía oral.
Dentro de las fortalezas de este trabajo se encuentra el análisis de una base de datos con cobertura nacional, de recolección prolectiva, y cuya información es derivada del reporte de PRM en el marco del Programa Nacional de Farmacovigilancia de Colombia 11. Asimismo, las variables permitieron no solo identificar la frecuencia relativa de cada RAM, sino establecer la proporción de RAM serias y los factores asociados con la no recuperación. Por otra parte, se debe considerar un potencial sesgo de selección dado por la ventana temporal limitada y la inclusión de solo aquellos PRM que fueron recopilados dentro del sistema de salud, sin que se pueda descartar un importante subregistro. Tampoco se contó con información sobre pacientes prescritos con dipirona que no presentaron PRM, y por ello los resultados no son fácilmente extrapolables. Lo anterior también se relaciona con un escaso control de calidad de la información y la existencia variables latentes que pudiesen modificar los resultados del modelo multivariado.
CONCLUSIÓN
En Colombia, el sistema mayoritariamente comprometido en las RAM por metamizol fue el tegumentario. Las RAM asociadas con dipirona difieren de varios reportes internacionales dada la baja frecuencia relativa de alteraciones hematológicas, lo que podría estar explicado por características genéticas de nuestra población; no obstante, estas reacciones sí se asocian con una menor probabilidad de recuperación. Se requieren estudios adicionales que profundicen en los hallazgos aquí descritos buscando prevenir la aparición de RAM serias y no recuperables.