INTRODUCCIÓN
El dolor es un síntoma común en la mayoría de los pacientes oncológicos, con una prevalencia que oscila en torno al 50 %, y es mayor cuando el estadio clínico de la enfermedad es más avanzado 1. En la mayoría de los pacientes se consigue un buen control con el tratamiento analgésico convencional postulado por la escalera analgésica de la Organización Mundial de la Salud, pero en un 30 % la terapia farmacológica no es suficiente y se necesitan procedimientos intervencionistas que pueden ir desde tratamientos infiltrativos hasta complejas terapias de neuromodulación 2.
La terapia de infusión intratecal es ampliamente aceptada para el tratamiento del dolor oncológico, ya que logra una buena distribución de la medicación en la proximidad de los receptores sobre los que los fármacos tienen que actuar para modular la conducción de la señal nociceptiva a los centros supraespinales, donde va a generarse la experiencia dolorosa 3.
Para aplicar este tratamiento es necesario colocar un catéter en el espacio subaracnoideo, que se conecta a un sistema donde se almacenan de los fármacos. Según la complejidad de este sistema, los equipos de infusión intratecal pueden ser clasificados en 3 tipos: sistemas externos, dispositivos parcialmente externalizados (DPE) y dispositivos totalmente internalizados (DTI). Los sistemas externos son los más simples, el catéter intratecal se fija a la piel y los fármacos se administran por medio de una jeringa o por medio de bomba de infusión externa. En los DPE, el catéter se conecta a un puerto subcutáneo en la pared torácica anterior, y el fármaco o fármacos a infundir se almacenan en una bomba externa o en un infusor elastomérico. En los DTI, el catéter intratecal se conecta a una bomba interna, alojada en un bolsillo subcutáneo paraumbilical que tiene un receptáculo donde almacenar la medicación. Hay 2 tipos de bombas: 1. de flujo fijo que tienen un funcionamiento muy similar a las bombas de Shiley, utilizando una cámara de alojamiento del fármaco rodeada por una cámara donde un gas se expande a una velocidad constante que eyecta un volumen de fármaco diario fijo, y 2. bombas de flujo variable que tienen un microprocesador interno accesible para comunicación con telemetría, que permite realizar modificaciones en el flujo de la bomba 4.
Los DPE están indicados cuando la esperanza de vida es inferior a 3 meses4,5. Son tecnológicamente más simples, requieren menos tiempo quirúrgico para su implante y son más baratos, pero tienen menos precisión y necesitan un reservorio de fármaco externo conectado por medio de una aguja, con el potencial riesgo de colonización y de infección. Los DTI son más sofisticados y precisos, la técnica quirúrgica para el implante es más laboriosa y su coste puede ser un 80 % mayor que el de los DPE, pero al estar totalmente interiorizados el riesgo de migración del catéter es menor, así como el riesgo de infección del dispositivo, lo que hace que sean más apropiados para pacientes con mayor funcionalidad o con mayor expectativa de vida.
Las diferencias entre estos sistemas y los distintos perfiles clínicos de los pacientes en los que se indica cada uno de estos dispositivos pueden suponer un manejo diferente, tanto de los fármacos y dosis utilizadas como del seguimiento. El objetivo de nuestro trabajo es establecer las necesidades farmacológicas y de asistencia sanitaria de estos 2 tipos de dispositivos y determinar si existen realmente diferencias significativas entre ellos.
MATERIALES Y MÉTODOS
Realizamos un estudio observacional retrospectivo, en el que incluimos a todos los pacientes de la unidad del dolor de nuestro hospital que precisaron terapia de infusión intratecal para el tratamiento de un cuadro de dolor oncológico, entre junio de 2009 y junio de 2017. Los criterios de inclusión fueron tener 18 o más años y que se les hubiera implantado un dispositivo de flujo fijo (DPE o DTI) para el control del dolor oncológico. Se excluyeron todos los pacientes sometidos a terapia de infusión intratecal por un cuadro clínico no oncológico (dolor crónico benigno y/o espasticidad).
La terapia de infusión intratecal era indicada por uno de los facultativos de la unidad del dolor ante una situación de falta de eficacia del tratamiento analgésico sistémico, aparición de efectos adversos intolerables atribuibles a los mismos, o cuando se producía una combinación de ambos. El implante del dispositivo se realizaba bajo técnica aséptica en el quirófano, colocando el catéter bajo control fluoroscópico en el espacio subaracnoideo hasta dejar su extremo a nivel de la región metamérica donde el paciente tenía el dolor más intenso. En el caso de los DTI, el catéter se conectaba a una bomba de flujo fijo a 0,5 ml/día, que se implantaba en la pared abdominal a nivel periumbilical. En los DPE, el catéter se conectaba en un portal subcutáneo en la pared torácica anterior; y sobre el portal se conectaba un infusor elastomérico a 1,5 ml/h. En la elección del tipo de dispositivo a implantar se tenían en consideración criterios clínicos como el estado general del paciente, la localización y extensión del tumor, la proximidad del paciente al centro terapéutico, la funcionalidad y la expectativa de vida.
En algunas situaciones, se inició la terapia con un DPE y la supervivencia del paciente fue superior a lo esperado, pero en pocas ocasiones se reconvirtió a un DTI, ya que las características clínicas, sociosanitarias, etc. del paciente no lo recomendaban. En los casos en que sí se realizó la reconversión, estos pacientes no fueron incluidos en el estudio.
Tras el implante, se suspendían los opioides sistémicos pautados para el tratamiento basal y se iniciaba la terapia intratecal con morfina en todos los casos, permitiendo únicamente dosis de opioides sistémicos de rescate cuando eran necesarios. La dosis inicial de morfina intratecal se calculaba a partir de los requerimientos sistémicos diarios de opioides inmediatamente antes del implante, convirtiendo la dosificación equipotente de morfina vía oral en intratecal de acuerdo con la regla de Krames 300:16. En algunos casos, se inició la terapia intratecal con una combinación de morfina y bupivacaína, a criterio clínico, debido principalmente a la detección de características de dolor neuropático o por la alta intensidad del dolor. En estos casos, cuando se trataba también al paciente con fármacos coadyuvantes, estos no fueron recogidos en nuestra base de datos.
Durante el seguimiento en la unidad del dolor, se realizaron los ajustes necesarios en la dosificación intratecal para mantener el control del dolor, en función de su evolución, consumo de opioides sistémicos de rescate, presencia de efectos adversos y otras consideraciones clínicas. Las variaciones en la dosificación intratecal se llevaban a cabo modificando la concentración de los fármacos, pero manteniendo constantes los flujos de cada tipo de dispositivo.
Se establecieron 4 puntos temporales a la hora del seguimiento de los pacientes: el momento previo al implante del dispositivo y los meses 1, 3 y 6 tras el implante. Estas referencias son similares a las publicados en la mayoría de los estudios sobre eficacia y seguridad en las terapias de infusión intratecal.
Se registraron datos relacionados con información demográfica y antropométrica, proceso oncológico, control del dolor, dosificación intratecal, modificaciones y número de ajustes de medicación intratecal, y visitas a la unidad del dolor y servicio de urgencias, tanto programadas como no previstas.
El análisis estadístico de los datos se realizó con el programa IBM SPSS Statistics 25, utilizando el test Chi-cuadrado para el contraste de las variables cualitativas, y el test de Fisher cuando las condiciones de los datos lo requerían. En el caso de las variables cuantitativas, el contraste se llevó a cabo con las pruebas t-student y ANOVA cuando seguían una distribución normal; y sus correspondientes alternativas no paramétricas (test U-Mann Whitney y test de Kruskal-Wallis) cuando no se distribuían con normalidad los datos.
Al tratarse de 2 dispositivos para la infusión intratecal, con un flujo diario tan distinto, se calculó el tamaño del efecto para expresar la magnitud de las diferencias entre unos y otros grupos. Este tamaño del efecto se expresó en R2 (escala 0-1) para poder ser comparado entre distintos tipos de datos en las variables y entre distintos tipos de test estadísticos. Cuando se compararon medias, R2 se calculó desde el valor “d” de Cohen. Cuando las variables fueron categóricas, R2 se calculó desde el coeficiente V de Cramer, similar al de Pearson pero específico para este tipo de datos. Y se consideró un tamaño del efecto pequeño cuando R2 era menor al 4 %, moderado entre el 4 y 12,5 %, grande entre 12,6 y 26,5 % y muy grande cuando era superior a 26,5 %.
Se establecieron modelos de regresión logística, univariantes y multivariantes, para la predicción de los pacientes que precisaron incrementar la dosis de morfina en el mes 1. La significación de los modelos se comprobó con el test Ómnibus y el ajuste con el test de Hosmer-Lemeshow. Los modelos multivariantes se construyeron con el método paso a paso hacia atrás con Wald, y se testaron posteriormente con el método de introducción directa. Todas las OR se acompañaron de su correspondiente intervalo de confianza al 95 %.
En todas estas pruebas estadísticas inferenciales se consideró significación con p < 0,05; muy significativo con p < 0,01 y alta significación con p < 0,001. En los modelos multivariantes, se tuvo en consideración la norma habitual de incluir los factores tendentes a la significación (p < 0,20). En los modelos predictivos uni-multivariantes, se consideró una eficacia predictiva pequeña cuando era menor del 5 %, moderada entre 5 y 12 %, elevada entre 12 y 25 % y muy elevada cuando era superior al 25 % 7,8.
Este estudio se realizó de acuerdo con la Declaración de Helsinki y fue aprobado por el Comité de Ética de la Investigación del Hospital.
RESULTADOS
Se incluyeron un total de 132 pacientes, un 65,2 % hombres y un 34,8 % mujeres, con una edad media de 60,4 ± 11,2 años y un intervalo entre 23 y 87. El proceso oncológico más frecuente fue el cáncer del pulmón (28,0 %), seguido por el de colon (18,9 %), páncreas (9,8 %), próstata (9,1 %), vejiga (7,6 %) y mama (5,3 %). Un 94,6 % de los pacientes tenían metástasis y en el 63,6 % existían metástasis óseas.
En la mayoría de los pacientes (63,6 %) el dolor se encuadraba desde un punto de vista fisiopatológico como mixto, detectándose características neuropáticas en el 37,9 %, sin que se objetivasen diferencias, en lo tocante a la presencia de estas características, entre los pacientes a los que se implantaba un DTI o un DPE (p = 0,41). El EVA medio previo al implante fue de 7,78 ± 1,64 puntos, oscilando entre 4 y 10. En el 97,5 % de los pacientes, el dolor oncológico de base se trataba con opioides sistémicos: fentanilo transdérmico (43,9 %), oxicodona (34,8 %), morfina vía oral (13,6 %), hidromorfona (4,5 %) y tramadol (0,8 %); con una dosis media equipotente de morfina antes del implante de 257,83 ± 168,43 mg, sin diferencias estadísticamente significativas en esta dosis media que se pudiera relacionar con el tipo de opioide sistémico que utilizaban para tratar el dolor basal antes del implante (K 9,39; p = 0,052).
En el 78,0 % de los pacientes, la falta de eficacia de la terapia opioide sistémica motivó la indicación de la terapia de infusión intratecal, y en el 21,3 % fue debido a la falta de eficacia de la medicación sistémica unido a la presencia de efectos adversos. La estimación de la supervivencia antes del implante se realizó con el índice de Karnofsky, que tuvo una puntuación de 53,62 ± 17,72 puntos. En 60 casos se implantó un DPE y en 72 un DTI.
Dosificación de la terapia
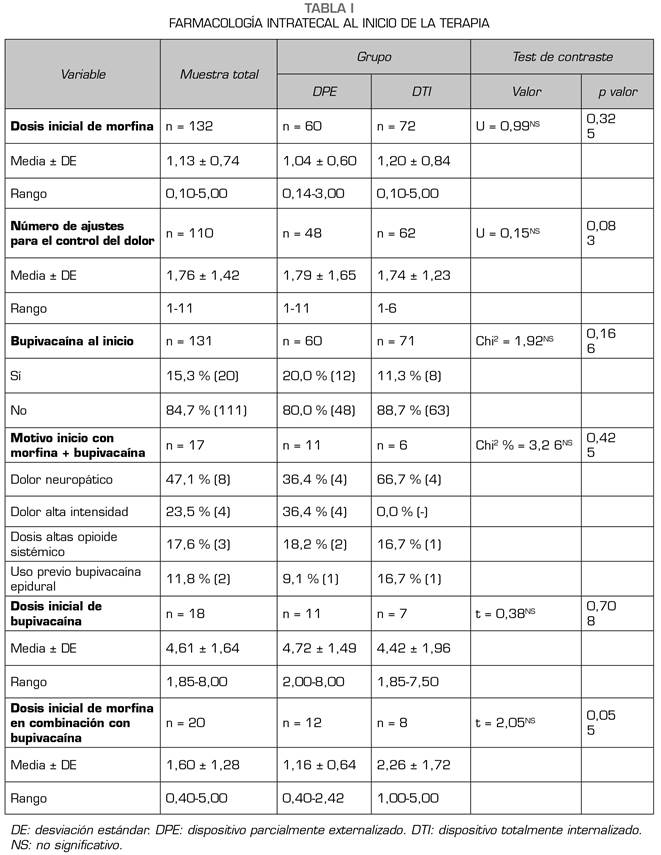
Tras el implante del dispositivo, se inició la terapia de infusión intratecal con morfina en todos los pacientes, con una dosis media de 1,13 ± 0,74 mg/día, una mediana de 1 mg/día y un intervalo entre 0,6 y 1,43, sin diferencias entre los grupos DPE y DTI. Tampoco se objetivaron diferencias en el número de ajustes iniciales de la medicación intratecal ni en el porcentaje de pacientes que iniciaron la terapia con una combinación de bupivacaína y morfina (Tabla I).
En la dosis de morfina intratecal al inicio de la terapia de infusión intratecal, tampoco se objetivaron diferencias entre los pacientes que recibían opioides sistémicos transdérmicos para el tratamiento del dolor de base antes del implante, ni aquellos que recibían opioides sistémicos vía oral (K 1,34; p = 0,931).
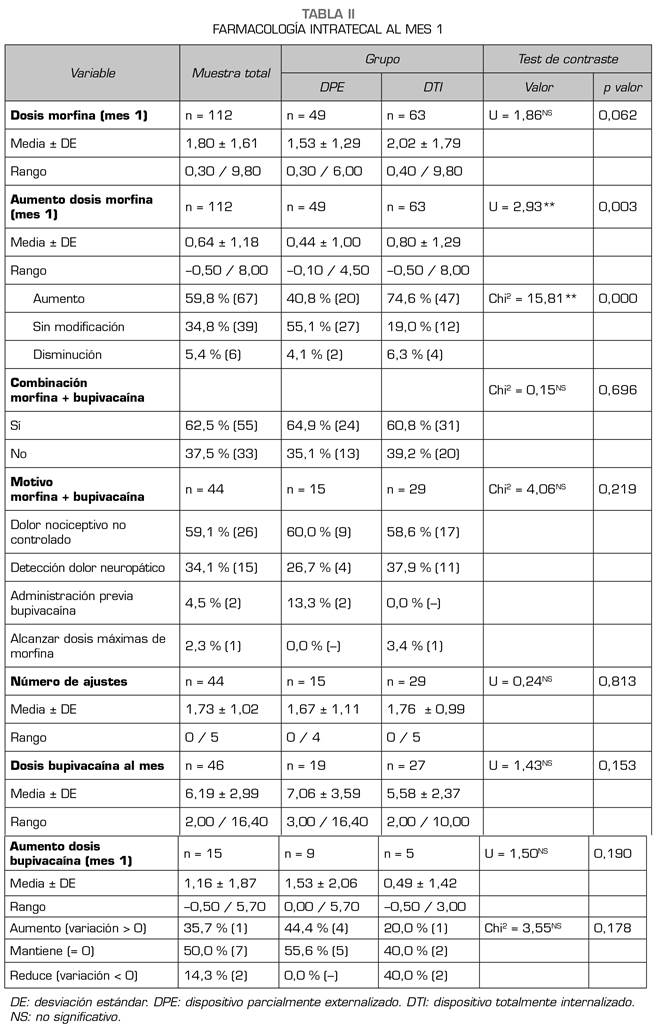
Al finalizar el primer mes tras el inicio de la terapia intratecal, y tras haber realizado los ajustes necesarios en la dosificación, la puntuación en la EVA había descendido desde 7,79 ± 1,64 hasta 3,02 ± 2,44, sin diferencias entre los grupos (DTI 3,37 ± 2,32; DPE 2,50 ± 2,57; p = 0,074), y la dosis media de morfina intratecal era de 1,80 ± 1,60 mg/día, lo que supone un incremento medio muy significativo con respecto a la dosis inicial. Cuando se realiza una comparación entre grupos, se observa que los pacientes a los que se implantó un DTI necesitaron incrementos en la dosis de morfina significativamente mayores que en los DPE (0,80 ± 1,29 mg vs. 0,44 ± 1,00). Adicionalmente, el porcentaje de pacientes del grupo DTI que necesitó incrementar la dosis de morfina intratecal fue casi el doble que el grupo DPE (74,6 % vs. 40,8 %) con una diferencia estadísticamente significativa y un tamaño del efecto elevado (R2 = 0,141; V Cramer = 0,38). Aunque el porcentaje de pacientes que precisaron una combinación de morfina y bupivacaína intratecal se incrementó con respecto al inicio de la terapia, no hubo diferencias entre los grupos, como tampoco hubo diferencias entre los grupos en el número de ajustes necesarios ni en la dosis media de bupivacaína intratecal (Tabla II).
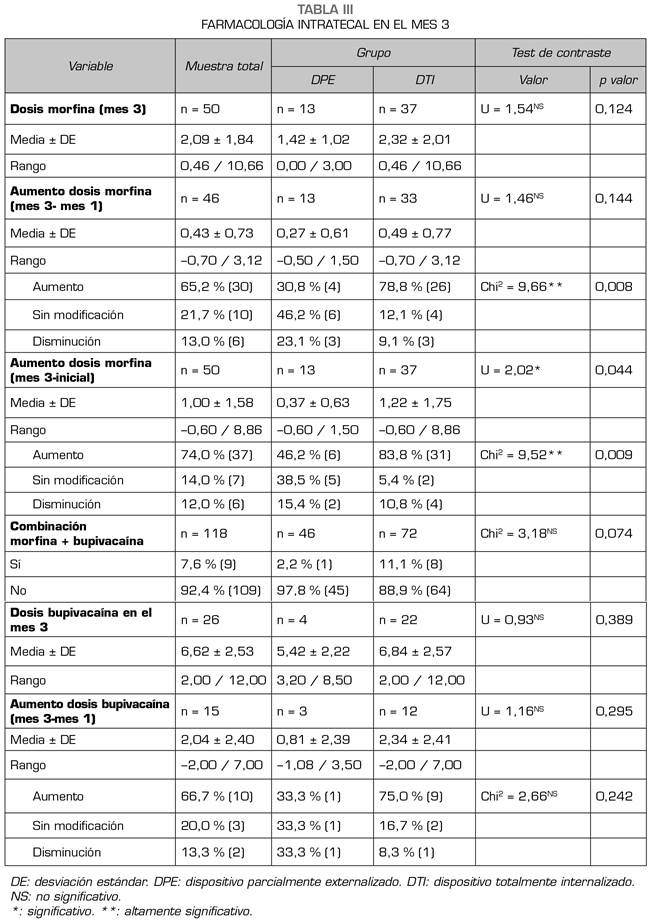
A los 3 meses del inicio de la terapia, persistía el buen control del dolor, con un EVA medio de 2,17. La dosis diaria de morfina intratecal era de 2,09 ± 1,84 mg, sin diferencias significativas entre los grupos DTI y DPE
(Tabla III), aunque el porcentaje de pacientes que precisaron incrementar la morfina en el grupo DTI fue del 78,8 % frente al 30,8 % en el grupo DPE. En los restantes aspectos concernientes a la medicación intratecal no hubo diferencias estadísticamente significativas (Tabla III).
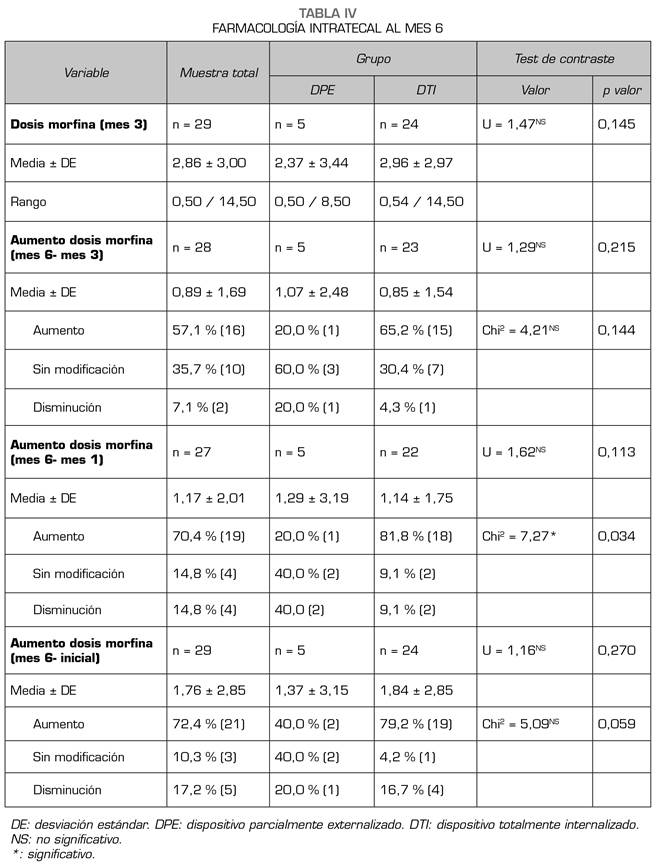
En el mes 6 desde el inicio de la terapia se objetiva un EVA medio de 2,06 ± 1,82, sin diferencia entre los grupos, y con una dosis media diaria de cloruro mórfico de 2,86 ± 3 mg. Esta dosis supone un incremento con respecto a la del mes 3, a la del mes 1 y a la del momento inicial de la terapia en 0,89 ± 1,69 mg; 1,17 ± 2,01 y 1,76 ± 2,85 mg/día, sin diferencias estadísticamente significativas entre grupos en ninguna de estas variables. Como ocurría en el mes 3 y en el mes 1, al mes 6 también es mayor del porcentaje de pacientes en el grupo DTI en el que fue necesario incrementar la dosis de morfina intratecal, sin diferencias estadísticamente significativas con respecto al grupo DPE, pero con un tamaño del efecto grande, sugiriendo que esta significación estadística no puede lograrse por el bajo tamaño muestral (Tabla IV).
Necesidades asistenciales
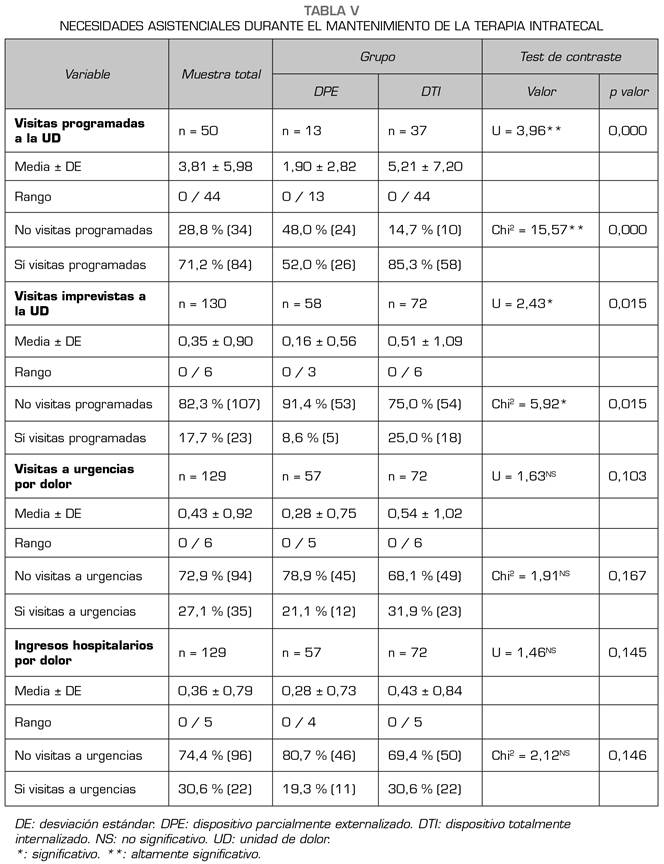
El número de visitas programadas a la unidad del dolor tras iniciar la terapia fue de 3,81 ± 5,98, con una diferencia estadísticamente significativa entre el grupo DTI (5,21 ± 7,20) y el DPE (1,90 ± 2,82) y un tamaño del efecto moderado (R2 = 0,075). Adicionalmente, un 48 % de los pacientes del grupo DPE no realizaron ninguna visita programada en la unidad del dolor, en contraste con el 14,7 % de los que tenían un DTI implantado. Esta diferencia es altamente significativa y se corresponde con un tamaño del efecto elevado (R2 = 0,132; V Cramer = 0,36) (Tabla V).
No hubo necesidad de hacer visitas imprevistas a la unidad del dolor tras el inicio de la terapia en el 82,3 % de los pacientes. Para aquellos que las necesitaron, la media en el grupo DTI (0,51 ± 1,09) fue superior al grupo DPE (0,16 ± 0,56), una diferencia aparentemente pequeña pero que alcanza significación estadística (p = 0,015) y se corresponde con un tamaño del efecto moderado (R2 = 0,040) (Tabla V).
Finalización de la terapia
La causa fundamental de finalización de la terapia fue el fallecimiento del paciente (95,4 %), pero en el 4,5 % terminó antes. Todos estos pacientes con final precoz de la terapia intratecal pertenecían al grupo DPE, y las causas fueron la migración del catéter, infección del dispositivo o rotura del sistema. En un 13,2 % de los pacientes, el fallecimiento se produjo de manera anticipada a lo previsible de acuerdo con la evolución natural de su enfermedad oncológica, sin diferencias estadísticamente significativas entre los grupos (14,3 % DTI vs. 11,9 % DPE; p = 0,685). El 72,7 % de los pacientes fallecieron en el hospital, y un 64,3 % precisaron sedación paliativa (DTI 57,8 % vs. DPE 72,5 %; p = 0,119), con una duración media de 2,73 ± 1,77 días, sin diferencias entre los grupos (DTI 2,89 ± 1,88 vs. DPE 2,57 ± 1,66; p = 0,459).
Análisis uni- y multivariante para detectar la necesidad de incrementar las dosis de morfina intratecal en el primer mes
El 59,8 % de los pacientes necesitaron aumentar la morfina intratecal en el primer mes, frente al 40,2 % de los pacientes a los que se les mantuvo o redujo la dosis. Al tratar de identificar por medio de un análisis univariante aquellas variables que podrían tener características predictivas sobre la necesidad de incrementar la dosis de morfina intratecal en el primer mes, se detectó significación en las siguientes variables que, por orden de mayor a menor peso, fueron:
Una mayor dosis de rescate de morfina sistémica en las primeras 24 h del postoperatorio del implante del dispositivo, que es muy significativa (p = 0,003) y con alta eficacia (15,5 %).
Ausencia de mejoría del control del dolor en el primer día tras la cirugía de implante del dispositivo. Es un factor estadísticamente predictivo con una elevada eficacia (15,4 %). Y en relación con este, también aparece la falta de mejoría en el día 2 (p = 0,004; y R2 = 13,4 %) y en el día 3 aunque con menos eficacia (p = 0,026; con R2 = 8,4 %).
Dispositivo DTI. Altamente significativo (p = 0,000) y con una eficacia grande (15,1 %) para predecir la necesidad de aumentar la dosis de morfina intratecal el primer mes.
Una mayor cantidad en el número de ajustes iniciales necesarios para lograr controlar el dolor al inicio de la terapia establece una predicción estadísticamente significativa (p = 0,011) y una eficacia grande del 13,4 %.
Falta de eficacia como indicación de la terapia de infusión intratecal (p = 0,011), con una eficacia moderada (8,5 %).
Mayor dosis de morfina (equipotente del opioide sistémico) antes de la terapia intratecal. Es un factor predictor significativo (p = 0,028) con una eficacia moderada 6,7.
Otras variables que han quedado cercanas a la significación estadística (p < 0,20) tras el análisis univariante han sido mayor puntuación de la escala EVA preimplante y la estimación de supervivencia mayor a 6 meses.
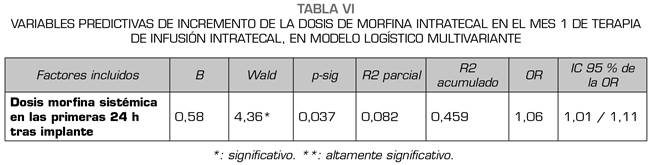
Con las variables descritas, significativas (p < 0,05) o próximas a la significación (p < 0,20) se construyó un modelo explicativo/predictor de tipo múltiple, que fue altamente significativo con p < 0,001 (test Ómnibus: valor = 27,38; p = 0,00000) y en el que no hubo diferencias significativas entre el estado real del caso (necesidad de aumento de dosis de morfina) y el estado que se predice desde el modelo, p > 0,05 (test de Hosmer-Lemeshow: valor = 11,02; p = 0,138).
Este modelo está formado solo por un factor (Tabla VI), la necesidad de una mayor cantidad de morfina de rescate administrada por vía sistémica en las primeras 24 h tras la cirugía, que mostró un 8,2 % de eficacia predictiva total. El resto de los factores anteriormente reseñados no tuvieron peso suficiente como para poder ser incluidos en el modelo.
DISCUSIÓN
El cloruro mórfico es considerado el fármaco referente en el tratamiento intratecal del dolor oncológico refractario 9 y también fue el utilizado como tratamiento en todos nuestros pacientes.
En el momento de empezar nuestro estudio, la Polyanalgesic Consensus Conference (PACC) más reciente publicada era la del año 2007, y recomendaba como línea 1 de tratamiento la morfina, hidromorfona o ziconotida, mientras que la línea 2 la constituían el fentanilo o la combinación de morfina/hidromorfona con ziconotida o morfina/hidromorfona con bupivacaína/clonidina 10. Es lógico que, apoyados por la literatura vigente en ese momento, en el 100 % de los casos de nuestro estudio se comenzase la terapia de infusión intratecal con morfina, por ser el fármaco más estudiado, conocido y utilizado previamente, y con un perfil de efectos adversos potenciales más habitual para los médicos dedicados al tratamiento del dolor oncológico. Otros fármacos de primera línea, como ziconotida, estaban limitados por su perfil económico más alto. En la PACC de 2016 (publicada unos meses antes de que finalizase la inclusión de los pacientes de nuestro trabajo) la morfina continuaba siendo fármaco de línea 1A para tratamiento intratecal del dolor oncológico, tanto localizado como difuso, con un nivel de evidencia I, grado de recomendación A y nivel de consenso fuerte 11.
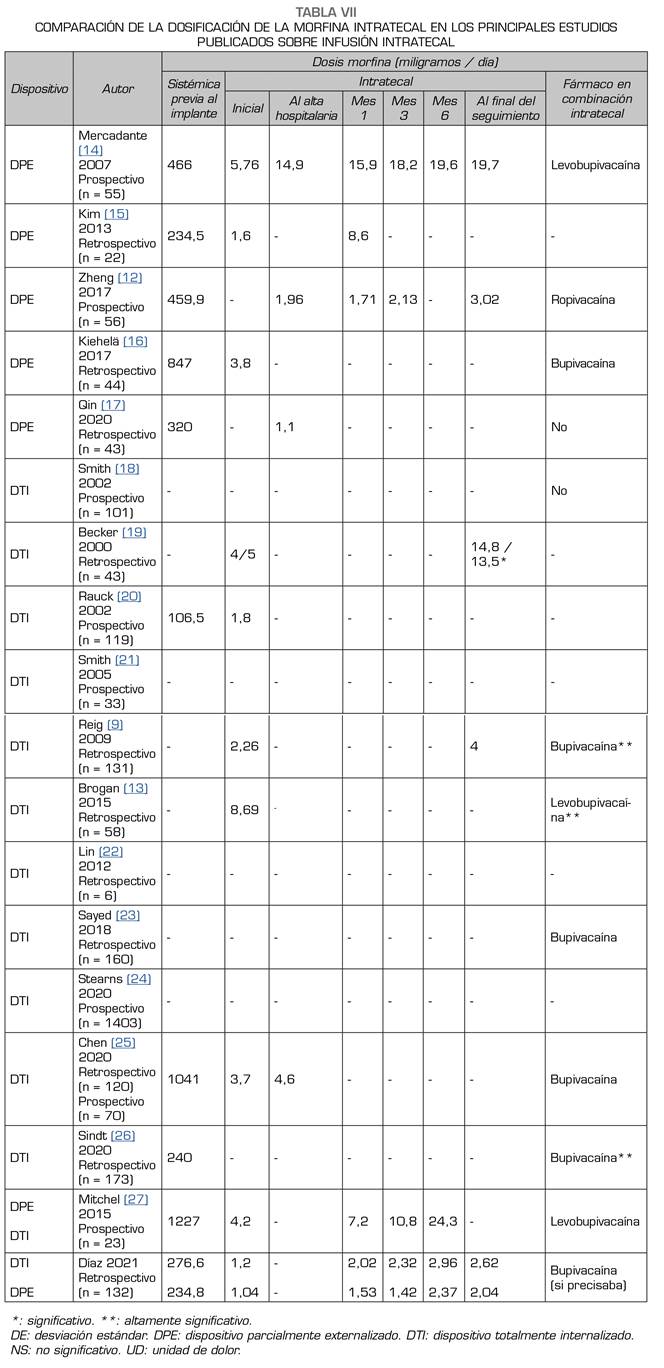
La dosis inicial de morfina intratecal en nuestro estudio fue de 1,13 mg/día, y en la literatura revisada esta dosis es muy heterogénea oscilando desde 1,69 (12) y 8,69 mg/día 13 (Tabla VII). Esta baja dosis de inicio en nuestros pacientes puede explicarse porque en 2007 las recomendaciones de la PACC remarcaban la importancia de la seguridad del paciente. El cálculo de nuestras dosis de inicio se realizó por estimación, teniendo en cuenta las tablas de equipotencia entre opioides sistémicos y la dosis sistémica (tanto basal como de rescate) en los días previos al implante, y realizando la conversión de morfina vía oral equipotente a intratecal con la regla 300:1 6, llevando a cabo ajustes de acuerdo con el juicio clínico del facultativo. No había diferencias estadísticamente significativas en la dosis media inicial de cloruro mórfico intratecal entre los grupos DPE y DTI, una situación totalmente esperable, puesto que tampoco había diferencias en la dosis media de morfina equipotente sistémica que consumían los pacientes de ambos grupos.
El 15,3 % de nuestros pacientes comenzó directa-mente la terapia con la línea 1B de tratamiento (correspondiente a línea 2 en el consenso del año 2007), con una combinación de morfina y bupivacaína. Aunque esta forma de iniciar la terapia intratecal puede parecer atípica, hay que tener en cuenta que en determinadas circunstancias la combinación de anestésico local y opioide puede ser más efectiva que utilizar un opioide solo, y nuestro porcentaje es muy inferior al reseñado en otros estudios retrospectivos 9,26. Los estudios de ciencias básicas han demostrado que el anestésico local puede fomentar la inhibición de la actividad de los canales de calcio por interferencia con la señal de transducción entre los receptores opioides y los canales de calcio28, y para muchos pacientes añadir un anestésico local puede significar una mejoría significativa en las escalas de dolor, nivel de actividad o calidad de vida 29.
Al mes de iniciar la terapia intratecal, la dosis de morfina se incrementó desde 1,16 mg/día hasta 1,80 mg/día. Este aumento fue muy superior en el grupo DTI, donde los pacientes pasaron de 1,2 mg día a 2,02 mg/día, lo que supuso un incremento del 68,3 % de la dosis de morfina inicial. En cambio, en el grupo DPE pasaron de 1,04 mg/día a 1,53 mg día, un incremento del 47,1 %. Esta diferencia en el incremento de dosis es casi un tercio mayor en el grupo DTI, con una diferencia estadísticamente significativa. No está claramente definido el motivo que lleva a un aumento tan relevante de las dosis en el primer mes, aunque algunos autores remarcan tanto la progresión de laenfermedad oncológica como el desarrollo de tolerancia a la morfina intratecal30. A diferencia de otros autores 12,15, nuestros pacientes no utilizabanbolos intratecales a demanda, por lo que no era un factor que pudiéramos utilizar para realizar el ajuste de dosis.
En la dosificación de la morfina tienen relevancia la concentración del fármaco, el volumen en el que se administra y el flujo de infusión, por lo que el tipo de dispositivo también puede tener un papel destacado Los diferentes flujos y volúmenes de administración del DPE con respecto al DTI pueden producir diferencias en la disponibilidad del fármaco a nivel intratecal. Aunque inicialmente se creía que un fármaco hidrosoluble como el cloruro mórfico podría circular durante varias horas por todo el sistema nervioso central diluido en el líquido cefalorraquídeo, actualmente se ha establecido que con dispositivos de infusión lenta como los utilizados para el tratamiento del dolor crónico, a 5 cm de la punta del catéter, la concentración de morfina en el líquido cefalorraquídeo se reduce a solo el 0,5 % de la administrada 31. La importancia de posicionar la punta del catéter a nivel de la metámera de la zona dolorosa del paciente 32 puede ser aún más relevante en los DTI, ya que es posible que en los pacientes con DPE, al utilizar más volumen (aproximadamente 80 veces mayor), se pueda enmascarar una punta de catéter un poco más alejada de la metámera deseada, o que logre que el fármaco alcance una zona dolorosa más amplia que abarque a varias metámeras. Administrar fármacos con un flujo mayor puede conseguir una mayor difusión, cubrir zonas más alejadas y controlar mejor el dolor, por lo que el paciente podría necesitar menos rescates, menos ajustes y menores incrementos en la dosis intratecal de morfina 33. Aunque las diferencias entre los dispositivos relativas a la necesidad de modificar las dosis son mayores en el primer mes, también se aprecian en el tercero y sexto, aunque con menor magnitud. Este evento de disminución de las diferencias entre un dispositivo y otro con el tiempo puede explicarse por una estabilidad del proceso álgico o por la optimización de la dosis precisa, aspectos que limitan la influencia de la diferencia de flujo entre los dispositivos.
Para decidir qué dispositivo era el más apropiado en cada paciente se tuvieron en cuenta muchos factores. Además de la expectativa de vida del paciente y los factores económicos, también se evaluaron las necesidades que el sistema de infusión intratecal iba a generar al paciente. En el caso del DPE, el fármaco se almacenaba en un infusor elastomérico con un volumen de 250 ml que liberaba el fármaco a 1,5 ml/h, por lo que la duración del infusor era de 7 días. Esto implicaba que cada 7 días el paciente o un familiar tenía que ir a recoger un recambio del infusor a nuestra unidad del dolor. Adicionalmente, la aguja de conexión al portal necesitaba cambiarse cada 2 semanas para minimizar el riesgo de contaminación o infección del dispositivo, lo que obligaba al paciente a acudir como mínimo cada 2 semanas a la unidad del dolor, o a que el personal de hospitalización domiciliaria o cuidados paliativos se desplazasen a su domicilio para realizar el cambio, sobre todo en los pacientes con dificultades de movilidad, ya que el cambio de la aguja no podía resolverse acudiendo un familiar a recoger el infusor elastomérico. En el caso del DTI, en nuestro estudio se utilizaron bombas de flujo fijo de 35 o 40 ml que liberaban el fármaco a 0,5 ml/día, por lo que el paciente tenía que acudir a la unidad del dolor para rellenar el reservorio de la bomba antes de que transcurriesen 70 u 80 días. También el personal de hospital de día - cuidados paliativos estaba entrenado para poder realizar estas funciones en el domicilio del paciente, y evitarle el desplazamiento a la unidad del dolor cuando este era muy dificultoso para el paciente. Al tratarse de un dispositivo asistencial no dependiente de la unidad del dolor, no disponemos de registro de las atenciones clínicas realizadas a estos pacientes por la unidad de hospitalización a domicilio.
Esta vinculación de los pacientes implantados con la unidad del dolor era muy importante para ajustar las expectativas, mejorar la adaptación a la terapia y lograr una mayor implicación en la misma. Estas circunstancias también deben tenerse en cuenta en la decisión sobre el dispositivo a implantar. En nuestro estudio, se apreciaron diferencias entre los dispositivos en lo que respecta a las necesidades asistenciales, incluyendo el número de visitas programadas e imprevistas a la unidad del dolor, la asistencia a los servicios de urgencias por dolor e incluso ingresos hospitalarios.
Detectamos que los pacientes con DTI tuvieron una media de visitas a la unidad del dolor 5,21 muy superior a los pacientes con DPE 1,9, pero en esta diferencia puede contribuir tanto el mayor tiempo de supervivencia tras el implante en los DTI como que los pacientes con DPE podían ser manejados en domicilio con más facilidad por el equipo de cuidados paliativos.
Un 82,3 % de los pacientes de nuestro estudio no necesitó realizar visitas no programadas a la unidad del dolor, lo que da idea de la eficacia y seguridad de esta terapia. No obstante, el 27 % acudió en alguna ocasión a los servicios de urgencias hospitalarios por dolor, con porcentajes ligeramente superiores en el grupo DTI. Nuestra unidad del dolor no presta atención de forma urgente, por lo que, fuera del horario laboral habitual, el único recurso que tenían los pacientes cuando necesitaban algún tipo de asistencia médica urgente relacionada con el dolor era acudir al servicio de urgencias del hospital. Si se tiene en cuenta que el horario habitual únicamente cubría 35 h a la semana y dejaba descubiertas 133, se puede entender que la terapia de infusión intratecal es muy segura y que conlleva muy pocas asistencias extraordinarias en el servicio de urgencias. Los datos de frecuentación no se reseñan habitualmente en los estudios publicados, y generalmente solo se hacen referencias ocasionales a las valoraciones realizadas, pero sin exponer datos concretos del número de visitas regladas o programadas a la unidad del dolor, asistencias en los servicios de urgencia o ingresos hospitalarios. El detalle que exponemos de estos aspectos constituye uno de los puntos de interés de nuestro estudio.
Un 72,7 % de nuestros pacientes fallecieron en el hospital, lo que supone un porcentaje excesivamente alto si tenemos en cuenta que uno de los motivos por el que muchos pacientes deseaban tener un buen control del dolor era poder pasar sus últimos días de vida en su hogar. En una revisión publicada en 2017, se reseñaba que el 59,9 % de los pacientes quería fallecer en su casa, pero solo lo conseguía el 40 %, una cifra ligeramente superior a la de nuestro estudio. Muchos factores pueden influir en no conseguir el deseo del paciente de fallecer en su domicilio, entre los que destacan la necesidad de cuidados sanitarios paliativos hospitalarios, la claudicación familiar y el desconocimiento de la situación experimentada por el propio paciente y su entorno 34. En nuestro estudio, el 64,3 % de los pacientes necesitaron sedación en estos últimos momentos de vida, y esta necesidad de sedación paliativa se debió a la presencia de síntomas refractarios. El síntoma que más comúnmente se describe en la literatura como motivo para iniciarla es el delirio 35, pero es un aspecto que no podemos contrastar porque en nuestro trabajo no se recogió la causa para iniciarla.
El análisis multivariante nos sugiere prestar atención a los rescates con opioides sistémicos en las primeras 24 h, al ser un factor predictivo sobre la necesidad de incrementar el primer mes la dosis de morfina intratecal para lograr mantener el control del dolor, ya que fueron los pacientes que precisaban dosis mayores de morfina sistémica como rescate del dolor en el primer día del postoperatorio de implante del sistema de infusión intratecal y también primer día de inicio con la terapia infusión intratecal los que precisaron aumentar la dosis de morfina intratecal en el mes 1.
Nuestro estudio presenta debilidades, principalmente en relación con su carácter retrospectivo, pero también otras que pueden aumentar la heterogeneidad como la recogida de datos en un periodo de tiempo largo, las diferencias en el tratamiento y manejo etiológico de las patologías oncológicas y el gran número de facultativos que indican, implantan y manejan la terapia de infusión intratecal sin la utilización de protocolos estandarizados. Pero estas debilidades constituyen también parte de sus fortalezas ya que al tratarse de un estudio retrospectivo pudo alcanzarse un gran tamaño muestral, lo que permitió obtener una gran cantidad de datos, que nos posibilitaron la realización de un análisis estadístico muy meticuloso logrando extraer información acerca de la dosificación intratecal, de su variación durante la evolución del paciente y de la utilización de combinaciones de fármacos a nivel intratecal, permitiéndonos un mejor entendimiento de la terapia.
La principal conclusión que podemos extraer es que, en los pacientes con dolor oncológico refractario a tratamiento antiálgico sistémico, la terapia de infusión intratecal es eficaz, pero es necesario aumentar significativamente las dosificaciones intratecales con el paso del tiempo. En los meses iniciales, los pacientes con un DTI necesitan mayores incrementos y dosis de morfina intratecal con respecto a los DPE, pero a medida que pasa el tiempo, esta diferencia va siendo menos marcada, para perder la significación estadística al mes 6. Estos hallazgos refuerzan las propuestas de que en los pacientes con una esperanza de vida inferior a 3 meses puede estar más indicado un DPE, al conseguir una estabilización en la dosis efectiva intratecal más rápida. Sugerimos utilizar la necesidad de rescates con opioides sistémicos en las primeras 24 h como factor predictor de la necesidad de incrementar la dosis de morfina intratecal en el mes 1, al ser la única variable predictiva identificada. Al tener una relevancia clínica limitada creemos necesarios estudios adicionales, más amplios y prospectivos, enfocados no solo hacia estas variables predictivas, sino también a poder identificar el dispositivo idóneo para implantar en los distintos estados evolutivos.