INTRODUCCIÓN
Las heridas crónicas son un problema de salud significativo, especialmente en personas ancianas e individuos con lesión de la médula espinal u otras enfermedades que cursan con limitación de la movilidad, donde las lesiones por presión (LPP) hacen a la cronicidad. Las modalidades tradicionales de tratamiento de las LPP incluyen el uso de superficies de apoyo, cambios de posición, equilibrio nutricional, cambios frecuentes en el apósito, hidroterapia, desbridamiento y reconstrucción quirúrgicos. Las heridas abiertas crónicas a menudo requieren muchos meses de tratamiento y reducen la calidad de vida de los pacientes ya enfermos1,2,3. El progreso generalmente es lento y, a menudo, incompleto. Con demasiada frecuencia, en pacientes con arteriopatía periférica diabética, la amputación de un miembro afectado se convierte en la única alternativa4.
Las lesiones complejas de la piel constituyen una patología que presenta una prevalencia creciente en este tipo de heridas, con el consecuente retraso en la cicatrización, que constituye un importante problema de salud pública5. La principal secuela es el retardo en el proceso cicatricial, como consecuencia de una disminución importante en la calidad de vida de estos pacientes y la de sus cuidadores1.
Estas lesiones también representan una enorme carga económico-financiera para el sistema de salud y para los pacientes. Pelham et al.6 señalaron que, aunque los costes específicos asociados con las LPP son difíciles de determinar debido a comorbilidades en individuos con enfermedades crónicas, el cuidado hospitalario de pacientes con LPP cuesta un 50% más que el cuidado de pacientes sin úlceras. Hirshberg et al.7 concluyen que el gasto hospitalario promedio es de 48 934 dólares por paciente para el tratamiento de las úlceras, que no incluía el tratamiento antes de la hospitalización o el coste de los productos farmacéuticos. Otros estudios estiman los costes de tratamiento en miles de millones de dólares por año en los Estados Unidos8,9. Existe la necesidad de un tratamiento eficaz que disminuya el tiempo de cicatrización y la gravedad de las úlceras, sea fácil de usar y sea rentable.
La formación de la regeneración en el proceso de cicatrización de las heridas transcurre después de la finalización de la fase de remodelación; la cicatriz entra en el denominado estado maduro según el esquema propuesto por el Panel Consultivo de la International Advisory Panel on Scar Management10. La cicatriz no debe tener apéndices epidérmicos y mostrar un patrón de colágeno de fibras densamente empaquetadas. La resistencia a la retracción de la piel de la herida alcanza a la primera capa de piel o epidermis y no en la propia lesión11. Además, la cicatriz suele estar debilitada y con menos elasticidad que la piel normal12.
Los factores de crecimiento que estimulan las células necesarias para la reparación de tejidos se han identificado a nivel molecular. En las heridas crónicas, estas moléculas son deficientes, y se interrumpe la señalización de fibroblastos y células endoteliales (entre otras) para proliferar y comenzar el proceso de cicatrización13,14.
Las lesiones de extremidades inferiores (úlceras arteriales y venosas crónicas) se pueden considerar como procesos inflamatorios desregulados producidos por un suministro inadecuado de sangre, anoxia tisular, edema, muerte celular e infección, entre otros factores15. Estos cambios alteran la interacción entre los componentes estructurales de los tejidos afectados y entre estos y las células inmunes de una manera que impide la cicatrización de las heridas. Las hipótesis sobre la fisiopatología de las ulceraciones de miembros inferiores se centran en efectos locales inducidos por alteraciones hemodinámicas16,17,18,19,20,21,22. Hay tratamientos en la actualidad centrados en el alivio de estos cambios locales que incluyen medidas preventivas hemodinámicas, vendajes para úlceras, tratamientos tópicos y reparación quirúrgica o endovascular16,17. Los tratamientos experimentales exitosos incluyen transferencia génica intramuscular23, piel alogénica Graft24 y campos electromagnéticos directamente aplicados (ELF)25,26.
Parece que la estimulación eléctrica produce una reducción significativamente mayor en el área de superficie y cicatrización más completa de las LPP de categoría II a IV en comparación con la terapia habitual, y en pacientes con arteriopatía periférica diabética según la clasificación de Meggitt-Wagner (grado 0 a 2)23. La eficacia de otros tratamientos complementarios, como la terapia electromagnética para mejorar el cierre completo de las LPP y promover las fases de curación de heridas, se ha utilizado en forma de microcorriente electromagnética24. La radiofrecuencia comenzó a utilizarse en la práctica clínica al inicio de los años cincuenta. Sin embargo, en los últimos años, debido a la aparición de nuevos equipos y material, se ha conseguido disminuir los efectos secundarios, lo cual ha permitido que su empleo comenzara a generalizarse.
La regeneración de estructuras complejas sigue un proceso de morfostasis, definida como la forma en múltiples escalas de tamaños y niveles de organización en que un sistema biológico se adapta a las condiciones del entorno y gracias al recambio celular, lo que permite hacer frente al envejecimiento de los tejidos, a la remodelación y cicatrización de heridas y a las lesiones mayores que requieren regeneración. Los campos electromagnéticos parecen actuar facilitando estos procesos de regeneración a través de los mecanismos electrofisiológicos; esto se denomina potencial transepitelial (PTE). La cicatrización de heridas y la regeneración de tejidos son impulsadas por un sistema de autorreparación de circuito cerrado que utiliza señales (eléctricas) para iniciar la reparación después de una lesión27. Estas intervenciones biofísicas parecen modular los campos electromagnéticos endógenos alterados y ayudar en el restablecimiento de los procesos de cicatrización28. El ultrasonido y las terapias de presión y de luz han demostrado tener beneficios clínicos, y sus mecanismos moleculares parecen implicar alteraciones tanto biofísicas como bioquímicas.
OBJETIVOS
El objetivo de este estudio es evaluar el efecto que la aplicación de radiofrecuencia a baja intensidad (frecuencia) y con efectos no térmicos tiene sobre los diferentes componentes del mecanismo del proceso de cicatrización de lesiones de difícil cicatrización.
METODOLOGÍA
En el estudio fueron incluidos 36 pacientes del Hospital de Guadarrama en Madrid (España) que pasaron por la consulta durante el periodo de septiembre de 2018 a junio de 2019 (tabla 1). Trece hombres y 10 mujeres tenían diabetes mellitus.
Tabla 1. Características basales de la población de estudio.
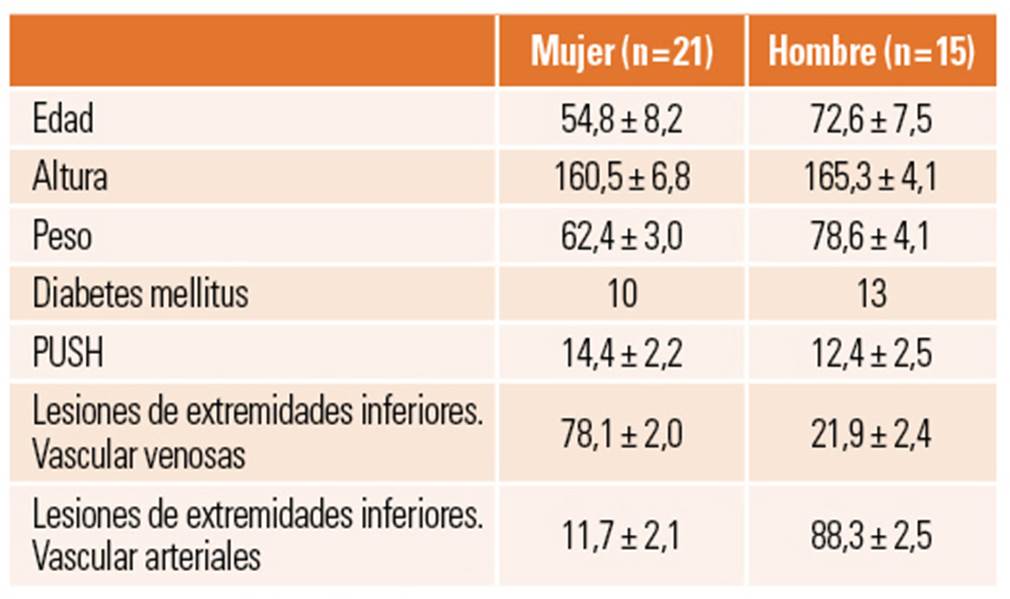
Datos expresados con media ± desviación típica. PUSH: Pressure Ulcer Scale for Healing.
Criterios de inclusión: lesiones de larga evolución, difícil cicatrización, evolución tórpida, y que solo con el tratamiento convencional no ha finalizado el proceso.
Los participantes del estudio fueron debidamente informados sobre los objetivos del estudio y los posibles riesgos y beneficios. Todos ellos firmaron el formulario de consentimiento libre, previo e informado tan pronto como aceptaron participar en el estudio, cumpliendo así con la Declaración de Helsinki y según lo aprobado por el Comité de Ética en Investigación del Hospital Puerta de Hierro de Madrid (acta n.º 02.18). Fue registrado en ClinicalTrials.gov (NTR: 03048799).
Diseño
Estudio unicéntrico, observacional analítico, prospectivo, de cohorte única dinámica con diseño de antes-después y medidas repetidas a lo largo del mismo. Está investigación tiene un enfoque clínico en el que la unidad de análisis serán las úlceras que presenten los pacientes tratados.
Para poder participar en el estudio, los pacientes han cumplido los criterios de inclusión siguientes: a) Comprender y firmar voluntariamente los correspondientes consentimientos informados y hoja de información antes de que se realice ninguna evaluación/procedimiento relacionado con el estudio. b) ser hombre o mujer ≥ 18 años y ≤ 90 años en el momento del consentimiento. c) Tener el diagnóstico de herida de larga evolución, difícil cicatrización y de evolución tórpida, que con tratamientos convencionales no ha llegado al final del proceso. d) Primera vez en el Hospital Guadarrama para recibir tratamiento.
Criterios de exclusión: a) portador de marcapasos o b) implantes metálicos locales.
Intervención
Para el tratamiento, se utilizó un dispositivo de tecarterapia C200 CAPENERGY Vascular (CE120). Las sesiones de radiofrecuencia se administraron con el aparato Tecarterapia C200 con sonda de pie modelo C-Boot, en el caso de lesiones en la planta del pie, o con placas capacitivas en el resto de las zonas corporales (fig. 1). Los parámetros dispuestos fueron una potencia del 60% y una frecuencia de 1,2 MHz durante 30 minutos, que genera una sensación de calor que nunca supera el umbral de tolerancia del paciente.

Figura 1. Dispositivo en forma de bota para usar con CAPENERGY C-200, para aplicar tratamiento de radiofrecuencia en el pie diabético.
Se aplicaron un total de 10 sesiones de radiofrecuencia con una periodicidad de 1 vez a la semana, con una potencia del 60% y una frecuencia de 1,2 MHz durante 30 minutos, colocándose sobre la lesión el cabezal de tratamiento y administrándose una dosis atérmica de hasta 37 °C.
Variables del estudio
Tras cada sesión de tratamiento se administró la escala Presure Ulcer Scale Healing (PUSH)29. Esta escala consta de tres parámetros o subescalas: área de la herida, relacionado con la superficie de la lesión; longitud × anchura (en dirección cefalocaudal y su perpendicular) en centímetros cuadrados; cantidad de exudado y apariencia local presente en la lesión, según el tipo de tejido en el lecho de la herida, pudiendo variar desde el tejido necrótico hasta el tejido epitelial o cicatrizado. Cada parámetro se puntúa según un sistema de puntuación, se suman las puntuaciones de la subescala y se obtiene una puntuación total del estado de la lesión. Las puntuaciones pueden oscilar entre 0 (cicatrizado) y 17 puntos (peor estado de la lesión posible).
Para evaluar el dolor se usó la escala visual del dolor (EVA 10)30,31,32,33,34. Dicha escala mide la intensidad del dolor y consiste en una línea horizontal de 10 cm. En la izquierda se ubica la ausencia o menor intensidad y en la derecha la mayor intensidad. La valoración será: 1 = dolor leve si el paciente puntúa el dolor como menor de 3; 2 = dolor moderado si la valoración se sitúa entre 4 y 7; y 3 = dolor intenso si la valoración es igual o superior a 8.
Como variable de la disminución y proporción de pacientes con edema al principio y al final del estudio, sin tratamiento de vendaje compresivo de multicomponentes.
Análisis estadístico
Para el análisis estadístico se utilizó el programa R (Versión 3.5.1). El nivel de significación se estableció en p < 0,05.
La distribución de las variables cuantitativas, tanto basales como de resultado, se testó con la prueba de Shapiro-Wilk.
Las variables cualitativas se describieron en valores y frecuencias absolutos, y las variables cuantitativas con media y desviación típica o con mediana y rango intercuartílico (IQR) en función de presentar o no una distribución normal.
Para las variables cualitativas pre-postratamiento se utilizó el test de McNemar y de McNemar-Bowker en función de presentar una o más categorías.
En el caso de las variables cuantitativas repetidas a lo largo de las sesiones se utilizó la prueba de Friedman con test post hoc con corrección de Bonferroni; en caso de no encontrarse diferencias, se aplicaron correcciones menos estrictas: Holm, Benjamini & Hochberg y Tukey. En caso de que la prueba de Friedman no mostrarse diferencias significativas, se aplicó un Anova robusto de medidas repetidas con medias truncadas al 20% y bootstrap.
El tamaño de efecto en las variables cuantitativas se definió, en las comparaciones pre-postratamiento, con la D de Cohen, definiéndose como 0,2 a 0,5 (pequeño), 0,5 a 0,8 (moderado) y más de 0,8 (grande), y en las medidas repetidas como W de Kendall: menor de 0,10 (pequeño), 0,10 a 0,20 (mediano) y más de 0,20 (grande). La fuerza de asociación en las variables categóricas G de Cohen se definió como menos de 0,15 (pequeño), 0,15 a 0,25 (moderado) y más de 0,25 (grande).
RESULTADOS
La presencia de edema, observada en todos los pacientes en la región de la extremidad inferior, desapareció en 29 de los 36 pacientes; tratamiento habitual sin vendaje compresivo. Se encontraron diferencias significativas a lo largo del tratamiento [χ2(2) = 62,242, p < 0,001] y un tamaño de efecto grande y significativo (W de Kendall = 0,864, p < 0,001) con una reducción progresiva en las mediciones de 125 [intervalo de confianza (IC) al 95%: 122,75 a 134,00 inicial vs. 120 (118,75 a 127,75) final].
Este resultado se confirmó mediante mediciones de ultrasonido en las que el edema medio del tejido celular subcutáneo disminuyó en 1,73 cm (Prueba de Friedman p = 0,000). La temperatura del área tomada antes y después del tratamiento se incrementó en un promedio de 1,4 °C. Evidentemente, es debido a la mejora de la circulación distal y no a un proceso de infección. Estas diferencias son estadísticamente significativas (Wilcoxon p = 0,001) (fig. 2).
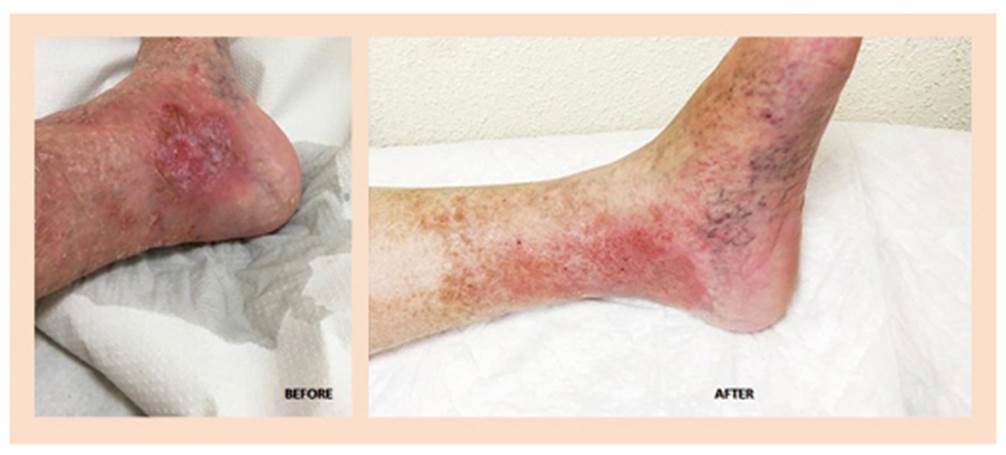
Los pacientes que terminaron el proceso de cicatrización fueron 6, con una tasa de cicatrización porcentual del 60%. En la figura 3 se observa la evolución clínica de la úlcera de un paciente después del tratamiento con radiofrecuencia, con mejoría evidente en la lesión.
El dolor se redujo de manera significativa a lo largo del tratamiento [χ2(9) = 261,24, p < 0,001] con un tamaño de efecto grande y significativo (W de Kendall = 0,64, p < 0,001), observándose una reducción progresiva en las mediciones de 7 (IC 95%: 4,75 a 7) inicial vs. 3 (2-4) final. Asimismo, en la Escala PUSH (Pressure Ulcer Scale for Healing) se encontraron diferencias significativas a lo largo del tratamiento [χ2(9) = 284,16, p < 0,001] y un tamaño de efecto grande y significativo (W de Kendall = 0,789, p < 0,001) con una reducción progresiva en las mediciones de 10,5 (IC 95%: 7,5, 14,25) inicial vs. 4 (4, 6)] final (fig. 4).
DISCUSIÓN
Los resultados presentados muestran los beneficios del uso de la radiofrecuencia en el tratamiento de úlceras tanto en pacientes diabéticos como no diabéticos. Una característica importante es que no es invasivo, no es doloroso, es bien tolerado y los resultados son evidentes: las mejoras de la lesión y subjetivamente el aumento de la calidad de vida de estos pacientes.
En nuestro estudio, en las lesiones se produjeron cambios significativos en la proporción de pacientes con úlcera al principio y al final del estudio, con una reducción en el número de pacientes que la presentaban y un tamaño de efecto grande y significativo. Estos resultados concuerdan con el estudio de George et al.9 en el que introdujeron un enfoque terapéutico que utiliza la radioterapia para estimular endógenamente la producción de factores de crecimiento e incitar la mitosis en el lecho de la herida. En estudios in vitro, los fibroblastos primarios humanos y las células epiteliales se trataron con PRFE durante varios periodos y a varias dosis, con proliferación celular evaluada cuantitativamente por recuento directo y análisis espectrofotométrico 24 horas después del tratamiento. Los resultados se compararon con los controles tratados con suero. Los investigadores encontraron un aumento significativo de la proliferación frente al control después de un tratamiento de PRFE de 30 minutos (p < 0,001).
Además, sus resultados indicaron que el tratamiento con PRFE induce la producción de factor de crecimiento y estimula la replicación celular a través de una vía intracelular mediada por calcio. Los resultados indican que el tratamiento con PRFE puede ser de valor en el proceso reparador de heridas crónicas. Para probar esta hipótesis, las frecuencias que se utilizan en la radiofrecuencia se aplicaron a pacientes con úlceras crónicas en los miembros inferiores en una zona alejada del sitio de la lesión. Los efectos clínicos inmediatos que se monitorizaron, con resultados idénticos a este estudio, son los que describe la terapia efectiva en pacientes seleccionados con úlceras arteriales y venosas crónicas35,36,37,38.
Las lesiones de extremidades inferiores se pueden considerar como procesos inflamatorios desregulados producidos por un suministro inadecuado de sangre, anoxia tisular, edema, muerte celular e infección, entre otros factores15. Estos cambios alteran la interacción entre los componentes estructurales de los tejidos afectados y entre estos y las células inmunes de una manera que impide la cicatrización de las heridas. Las hipótesis sobre la fisiopatología de las ulceraciones de miembros inferiores se centran en efectos locales inducidos por alteraciones hemodinámicas. Hay tratamientos en la actualidad centrados en el alivio de estos cambios locales que incluyen medidas preventivas hemodinámicas, vendajes para lesiones de larga evolución y tórpidas, tratamientos tópicos y reparación quirúrgica o endovascular20,21,22,23,24,25,26.
Así, comparativamente con nuestros hallazgos, se produjeron cambios significativos en la proporción de pacientes con edema al principio y al final del estudio. Nos encontramos con una respuesta clínica buena, en la disminución del edema, medimos con eco-Doppler, y se hallaron diferencias significativas a lo largo del tratamiento y un tamaño de efecto grande y significativo con una reducción progresiva en las mediciones. Se ha demostrado que la radiofrecuencia puede tener un efecto sobre los diferentes componentes del mecanismo del proceso de cicatrización. En particular, se refiere a la aplicación de bajas frecuencias y efectos no térmicos. Se ha planteado la hipótesis de que la radiofrecuencia puede influir en la señalización del óxido nítrico, la modulación de los perfiles de citoquinas, la expresión de los factores de crecimiento, la migración celular y la proliferación, y la regulación de la proteína quinasa activada por mitógenos/quinasa regulada por señales extracelulares39,40. La aplicación de la radiofrecuencia para la cicatrización de heridas puede proporcionar efectos antiinflamatorios junto con la mejora del proceso de reepitelización y mejorar sus efectos en la cicatrización de heridas a través de la regeneración tisular41.
Perspectivas futuras
El empleo de la radiofrecuencia en medicina regenerativa abre una nueva vía para el tratamiento de diversas enfermedades. Debido a su naturaleza no invasiva, su uso tiene ventajas evidentes en comparación con los métodos químicos, biológicos y físicos actuales de regeneración de tejidos y curación de heridas. Teniendo en cuenta el gran potencial clínico de la radiofrecuencia, podemos esperar un aumento en las nuevas técnicas para la regeneración de tejidos y la cicatrización de heridas en una perspectiva cercana. Dicha estrategia permite combinar esta técnica con diversas modalidades químicas, físicas y biológicas para proporcionar bioefectos sinérgicos deseados y una mayor eficacia del tratamiento.
CONCLUSIONES
La mayor rapidez en la cicatrización de la herida presentada puede explicarse por el efecto antiinflamatorio causado por los cambios en los sistemas de coagulación y anticoagulación, la mejora de la microcirculación y la excreción hormonal. Juntos, contribuyen al aumento de la reactividad inmunológica.
La influencia del campo magnético en el sistema microcirculatorio puede explicar el hecho a menudo citado de que los campos magnéticos tienen efectos antiedematosos, analgésicos y antiinflamatorios, que es una de las razones de su amplia aplicación en la cirugía.
Después de la finalización del tratamiento de radiofrecuencia, parece que puede reducir el largo proceso de cicatrización de las lesiones de evolución tórpida, y nos encontramos con unas diferencias significativas, con un tamaño de efecto pequeño y no significativo, con una reducción progresiva en las mediciones y con una energía absorbida donde hay diferencias significativas a lo largo del tratamiento.
De todas formas, hay que seguir investigando la radiofrecuencia en las heridas, para crear mayor evidencia científica y acercarse a los resultados clínicos.