INTRODUCCIÓN
La invasión de Aedes albopictus (Skuse, 1894), conocido como mosquito tigre asiático, ha sido reportada en casi todo el planeta1. Su reconocida importancia clínica radica en su potencial para transmitir diversos patógenos que causan enfermedades, como la dirofilariosis, así como arbovirosis antroponóticas, incluyendo el dengue (DENV), el chikungunya (CHIKV) o el Zika (ZIKV)2 3 4 5. El elevado riesgo de transmisión de estas enfermedades se debe a varias razones concomitantes, incluyendo factores climáticos y socioeconómicos, el transporte y comercio internacional, y los sistemas de salud pública6. En este contexto, países mediterráneos como Italia, Francia, Croacia y España han declarado casos autóctonos de transmisión de DENV, CHIKV y ZIKV en los últimos años5 7 8 9 10. La situación del DENV es particularmente preocupante, dado que el dengue ha emergido recientemente como la enfermedad viral más importante transmitida por mosquitos a nivel mundial11. En el sur de Europa se han dado varios episodios de transmisión autóctona de dengue12, siendo España en 2015 el primer lugar de Europa en que se detectaron mosquitos Ae. albopictus infectados con DENV13. Las medidas tradicionales de control para reducir las poblaciones de mosquito incluyen la reducción de criaderos disponibles, la educación pública y la aplicación rutinaria de insecticidas, implementada por cientos de municipios de toda Europa14. Sin embargo, en algunos casos, el porcentaje de éxito se ve limitado por los bajos niveles de participación comunitaria, la falta de coordinación entre las diferentes administraciones y las prácticas deficientes en la aplicación de los insecticidas. Por otra parte, la posibilidad de desarrollo de resistencia a insecticidas supone un problema adicional que impide conseguir resultados óptimos en el control de Ae. albopictus en Europa15. Por todo ello, hay un elevado grado de consenso en la comunidad científica acerca de la necesidad de buscar métodos innovadores y complementarios para el control de esta especie de mosquito en ambientes urbanos.
La presencia de Ae. albopictus fue descrita por primera vez en España en 200416. Desde entonces, se ha extendido desde Cataluña al resto del área mediterránea, incluidas las Islas Baleares17, así como a otras regiones del interior y norte de España como Madrid, Extremadura y País Vasco18 19 20. En 2015 se detectó por primera vez en la ciudad de València21. A partir de ese momento, su control poblacional se ha convertido en un objetivo prioritario para los servicios públicos municipales de salud22. Las principales medidas de control incluyen el tratamiento de los criaderos y zonas de refugio con insecticidas químicos, la participación comunitaria, así como otras estrategias de origen biológico. Estas últimas evitan algunos de los inconvenientes del uso de insecticidas químicos convencionales, como son su falta de especificidad contra un insecto concreto, su toxicidad para los humanos y el medio ambiente, así como la posibilidad de facilitar la aparición de resistencias6 23.
A nivel mundial se han utilizado diferentes estrategias biológicas24, tales como la aplicación de biolarvicidas basados mayoritariamente en formulaciones de Bacillus thuringiensis, la Técnica del Insecto Estéril (TIE) mediante la liberación de machos irradiados, la obtención de insectos transgénicos mediante modificación genética, o el uso de endosimbiontes como Wolbachia para provocar la muerte de los embriones por Incompatibilidad Citoplasmática (CI) entre los gametos parentales (conocida como Técnica del Insecto Incompatible [IIT])25 26. La IIT tiene la ventaja de que no implica la liberación de organismos mutantes o manipulados genéticamente. La supresión de la población de mosquitos Aedes mediante la implementación de una estrategia basada en Wolbachia se considera un método de gran impacto para el manejo de la resistencia a los insecticidas27.
Wolbachia pipientis (Alphaproteobacteria: Rickettsiales) es un endosimbionte transmitido por vía materna que se estima que puede infectar hasta el 66% de las especies de insectos conocidas28. Esta única especie reconocida del género Wolbachia se clasifica en supergrupos de la A a la U29. Los supergrupos A y B infectan solo a artrópodos, donde actúan principalmente como parásitos reproductivos. En estos casos, distintas cepas de Wolbachia provocan diferentes alteraciones en sus hospedadores para aumentar su transmisión a la siguiente generación, siendo la CI la manipulación más frecuente30. Wolbachia se ha utilizado para el control de plagas y vectores de enfermedades porque no solo altera la reproducción del hospedador, sino que también bloquea la replicación y transmisión del virus31. Por esta razón, poblaciones infectadas con este endosimbionte se liberan al campo con dos posibles objetivos: reemplazamiento o supresión de poblaciones32. El éxito de ambos enfoques se basa en la capacidad de la nueva cepa introducida de Wolbachia para inducir CI en la población de mosquitos nativos. Por lo tanto, la presencia natural de determinadas infecciones de Wolbachia en poblaciones silvestres de mosquitos podría interferir con los programas de control, haciendo que el reemplazo o la supresión de la población sea difícil o incluso resulte imposible.
La presencia de las cepas wAlbA y wAlbB de Wolbachia, pertenecientes a los supergrupos A y B respectivamente, ha sido ampliamente descrita en poblaciones naturales de Ae. albopictus33 34, donde los individuos infectados suelen portar una o ambas cepas35. No se han encontrado otras cepas de forma natural en esta especie de mosquito, aunque no se puede descartar, ya que se sabe que Wolbachia se transmite horizontalmente entre especies de insectos filogenéticamente distantes36. Estudios pioneros realizados en Italia han descrito la generación en laboratorio de una nueva línea ARwP de Ae. albopictus en la que se han sustituido las cepas naturales de Wolbachia por la cepa wPip obtenida de Culex pipiens (Linnaeus, 1758)37; muy recientemente, el mismo grupo informó sobre el primer experimento de campo en Europa para evaluar la incapacidad de los mosquitos macho de la línea ARwP para producir descendencia viable tras su apareamiento con hembras silvestres de Ae. albopictus38. Estos estudios refuerzan la IIT como enfoque adecuado para reducir y/o suprimir las poblaciones de mosquito tigre asiático en el área mediterránea.
En el presente estudio, como primer paso hacia la implementación de una estrategia IIT similar a la exitosa antes mencionada, se investigó la presencia de Wolbachia en poblaciones naturales de Ae. albopictus en la ciudad de València (España).
MATERIALES Y MÉTODOS
Muestreo de mosquitos.
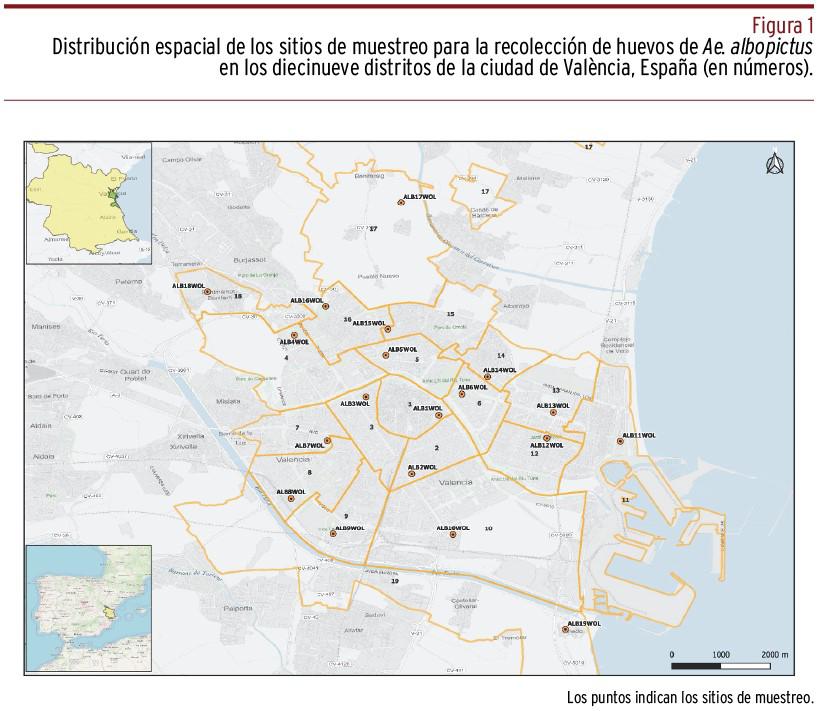
Los huevos se recogieron mediante el uso de trampas de oviposición estándar9. Se utilizaron contenedores de plástico negro (volumen: 0,4 L) llenos de agua (2/3 de capacidad) y complementados con un palo de madera como soporte para la oviposición. El muestreo se llevó a cabo entre mayo y octubre de 2019, coincidiendo con el periodo de actividad más importante de la especie, en los diecinueve distritos de la ciudad de València [Figura 1]. El muestreo se realizó espaciotemporalmente de la siguiente manera: mayo, distritos 1, 2 y 3 del centro urbano; junio, distritos urbanos periféricos 4, 5 y 6; julio, distritos urbanos periféricos 7, 8 y 9; agosto, distritos urbanos periféricos 10, 11 y 12; septiembre, distritos urbanos periféricos 13, 14, 15 y 16; octubre, distritos rurales periféricos 17, 18 y 19. El número de huevos colectados con ovitrampas por distrito osciló entre nueve y ciento doce. Los microhábitats específicos donde se instalaron las ovitrampas se caracterizaban por ser lugares umbríos bien cubiertos por vegetación. Los huevos recolectados se criaron en condiciones de laboratorio hasta la emergencia del adulto, como se había descrito anteriormente39. Insectos adultos de siete a diez días, tanto machos como hembras, se congelaron a -20 °C para fijarlos y se preservaron en el congelador hasta la extracción del ADN total. La identificación de especie y sexo se confirmó bajo microscopio binocular según los criterios de Schaffnet et al.40 La selección de individuos para los análisis de presencia de Wolbachia se hizo aleatoriamente, eligiendo al menos un macho y una hembra por distrito.
Genotipado de Wolbachia: Extracción de ADN total, amplificación, secuenciación y análisis filogenético.
Mosquitos adultos individuales se lisaron y homogeneizaron en 200 μL de tampón fosfato salino (PBS) con la ayuda de palillos estériles. Tras centrifugar a baja velocidad (800 xg) durante veinte min, se extrajo el ADN total (ADNt) utilizando el kit DNeasy Blood and Tissue (Qiagen, Hilden, Alemania), siguiendo el protocolo del fabricante y utilizando un volumen de elución final de 100 μL. La calidad y cantidad de ADN se determinó con un espectrofotómetro NanoDrop ND-1000.
Todas las muestras de ADNt se analizaron para detectar la presencia de Wolbachia mediante la reacción en cadena de la polimerasa (PCR) para la amplificación de los marcadores moleculares wsp (cebadores: 81F, 5'-TGGTCCAATAAGTGATGAAGAAAC-3'; 691R, 5'-AAAAATTAAACGCACTCCA-3') y el gen de ARNr 16S (cebadores: WolbF, 5'-GAAGATAATGACGGTACTCAC-3'; WspecR, 5'-AGCTTCGAGTGAAACCAATTC-3')41. Las muestras negativas se analizaron con cebadores para amplificar el gen ribosomal S7 del hospedador de cara a evaluar la calidad del ADN (5'-ATGGTTTTCGGATCAAAGGT-3' y 5'-CGACCTTGTGTTCAATGGTG-3')42. Las muestras positivas se analizaron con cebadores directos de wsp específicos para las cepas wAlbA (328F, 5'-CCAGCAGATACTATTGCG-3') y wAlbB (183F, 5'-AAGGAACCGAAGTTCATG-3'), junto al antes mencionado cebador reverso 691R35. Brevemente, las amplificaciones de PCR se realizaron sobre 2-5 µL de ADNt del insecto en 50 μL de reacción con 0,2 μM de cada cebador adecuado, 1x Key Buffer, 2,5 mM MgCl2, 0,2 mM de cada dNTP, una unidad de Taq DNA Polymerase (VWR) y agua purificada para PCR hasta completar el volumen final. Se añadió DMSO 4% a la mezcla de reacción cuando la primera amplificación fallaba. El perfil de las temperaturas utilizadas fue el siguiente: un ciclo inicial de desnaturalización durante 4 min a 95 °C, seguido de cuarenta ciclos de desnaturalización a 95 °C durante 1 min, unión a cebador a 55 °C durante 1 min, y extensión a 72 °C durante 1 min, más un ciclo de extensión final a 72 °C durante 10 min. Se hicieron dos réplicas para cada muestra y todos los experimentos de PCR incluyeron controles positivos y negativos. Como control positivo utilizamos ADNt de una línea de Ae. albopictus coinfectado con Wolbachia wAlbA y wAlbB, proporcionado por las Dras. Nuria Busquets y Sandra Talavera (Centro de Investigación en Salud Animal IRTA-CReSA, Barcelona). En el control negativo, el ADNt molde era sustituido por agua. El tamaño de los amplicones se comprobó mediante electroforesis en gel de agarosa al 2%, teñido con SafeView™ Classic stain (NBS Biologicals, Huntingdon, Reino Unido), y visualizado con luz UV.
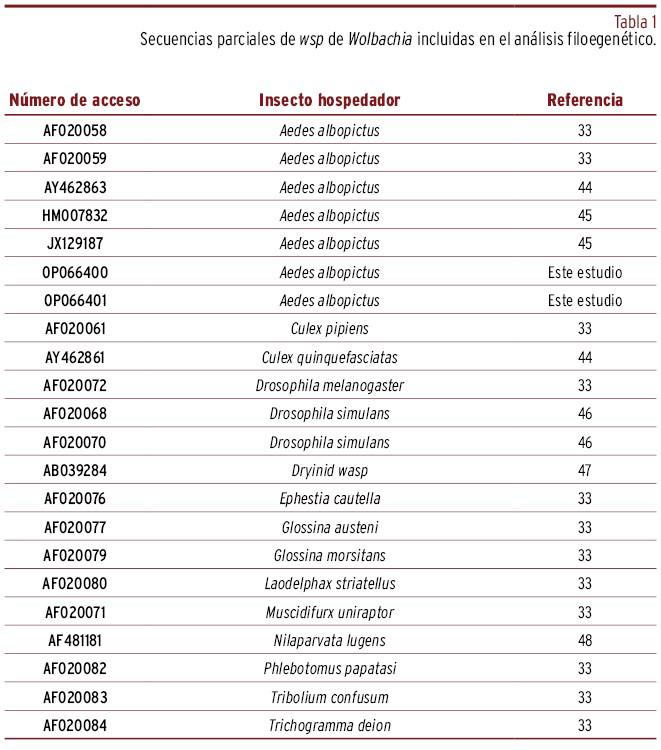
La secuenciación ABI de amplicones seleccionados para confirmar su identidad se llevó a cabo en la Sección de Genómica de la Universitat de València (Servicio Central de Soporte a la Investigación Experimental, SCSIE). Las lecturas fueron inspeccionadas y ensambladas con el Paquete Staden (http://staden.sourceforge.net)43 y posteriormente comparadas con secuencias de Wolbachia disponibles en GenBank mediante BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi)44. Las secuencias de ADN determinadas en este estudio han sido depositadas en GenBank (números de acceso indicados en la Tabla 1). Utilizamos secuencias de Wolbachia seleccionadas obtenidas de GenBank [Tabla 1] para realizar los alineamientos con MEGA45. El análisis filogenético se realizó por máxima verosimilitud con el modelo GTR+G+I. El análisis Bootstrap se realizó con 1.000 repeticiones. Utilizamos el software FigTree v1.4.0 (http://tree.bio.ed.ac.uk/software/figtree/) para visualizar y editar los árboles filogenéticos obtenidos.
RESULTADOS
Nuestros datos revelaron que el 94% de las muestras analizadas portaban Wolbachia de manera natural, de las cuales el 72,3% estaban superinfectadas con las cepas wAlbA y wAlbB [Tabla 2]. Se investigó la presencia de Wolbachia mediante PCR en un total de cincuenta insectos adultos (veinticinco hembras y veinticinco machos) utilizando cebadores wsp genéricos. De estas, cuarenta y siete muestras (veinticuatro hembras y veintitrés machos) dieron resultados positivos, revelando una tasa de infección muy alta. La posibilidad de resultados negativos debido a un problema de amplificación causado por una baja calidad del ADNt purificado se descartó, ya que las tres muestras negativas fueron positivas para el gen ribosomal S7 del hospedador. Dado que la coinfección con las cepas wAlbA y wAlbB se ha encontrado con frecuencia en todo el mundo33, las muestras positivas se analizaron posteriormente con cebadores específicos para cada cepa en reacciones separadas35. Todas las muestras amplificadas y secuenciadas demostraron ser idénticas a las secuencias wsp de wAlbA y wAlbB encontradas en GenBank, y se agruparon con las secuencias correspondientes en un análisis filogenético [Figura 2].
Tabla 2. Estado de infección de los mosquitos Aedes albopictus adultos individuales analizados en este estudio.

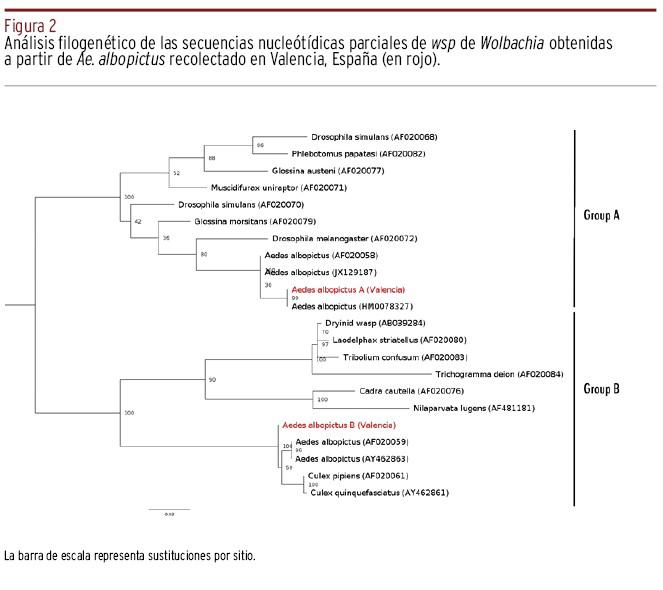
Figura 2. Análisis filogenético de las secuencias nucleótídicas parciales de wsp de Wolbachia obtenidas a partir de Ae. albopictus recolectado en Valencia, España (en rojo).
Los resultados obtenidos en nuestro estudio confirmaron la posibilidad de implementar el IIT basado en la liberación machos de Ae. albopictus infectados con wPip en la ciudad de València en un futuro próximo, ya que las poblaciones salvajes de mosquito tigre asiático no estaban infectadas de forma natural por esta cepa endosimbionte. Nuestros próximos pasos se centrarán en la selección de subcepas de wPip apropiadas que infecten de forma natural a las poblaciones de Cx. pipiens autóctonas y transferirlas por microinyección a Ae. albopictus, con el fin de obtener y mantener en cautividad una colonia artificial cuyos machos puedan ser liberados en el ambiente urbano y causar CI tras su apareamiento con hembras silvestres. Estudios recientes en Italia respaldan la liberación de machos de una línea de Ae. albopictus infectada con Wolbachia wPip (ARwP) para llevar a cabo estrategias de supresión autocida contra el mosquito tigre asiático51 52, siendo conveniente antes de iniciar la IIT proceder con una detección e identificación de las cepas de Wolbachia presentes en las poblaciones locales de Ae. albopictus para prevenir efectos inesperados, como una ineficiente pérdida de compatibilidad53.
Esta alta tasa de infección por Wolbachia en una población silvestre de Ae. albopictus (94%) detectada en nuestro estudio es similar a la prevalencia encontrada en países asiáticos como China (93,3 y 95,52%)54 55, Tailandia (100%)56 o Corea del Sur (99%)57, así como en los Estados Unidos (95%)58 y Brasil (99,3%)59, y lejos de la baja prevalencia encontrada en México (38%)60. Se han publicado muy pocos informes en los países mediterráneos, con grandes diferencias encontradas en diferentes lugares de Francia (metropolitana y Córcega)53 61 y Grecia53.
En nuestro estudio, el estado infeccioso de machos y hembras difirió significativamente (p-valor: 0,0067, utilizando la prueba exacta de Fisher). La mayoría de las hembras de mosquito infectadas portaban superinfecciones (84%); en el caso de los machos, el 54% de ellos eran portadores también de ambas cepas de Wolbachia, pero el 36% de ellos presentaron infección única con wAlbB. Estos resultados están de acuerdo con lo que se había encontrado previamente, con superinfecciones prácticamente fijadas entre las hembras33 35 56(33,35,56) y pérdida de wAlbA con la edad en los machos53.
Un trabajo reciente que utilizó machos de la línea ARwP liberados en áreas urbanas de Roma (Italia) confirmó la viabilidad de la IIT como una forma de controlar poblaciones de Ae. albopictus38. Los autores obtuvieron resultados prometedores, ya que el 30% de las hembras recolectadas en los puntos de liberación eran estériles, y el 20% tenía una fertilidad muy reducida en comparación con los controles. Además, la longevidad de estos machos no se vio afectada por la infección de wPip, ya que sobrevivieron hasta dos semanas después de la liberación, lo que se considera adecuado para la preservación de la aptitud reproductiva en los machos, y muy similar a los machos de mosquitos tigre asiáticos silvestres en condiciones normales62. Estos resultados van en la misma línea que los encontrados en un estudio anterior realizado por el mismo grupo en condiciones de laboratorio63, donde no se encontraron diferencias estadísticamente significativas con respecto a longevidad, tasa de apareamiento, capacidad espermática y competitividad de apareamiento entre machos de Ae. albopictus mantenidos en condiciones de laboratorio o en invernaderos.
Finalmente, es importante abordar el estado actual de la regulación del uso de enfoques de control basados en Wolbachia en Europa. Cualquier producto que se vaya a utilizar para controlar organismos no deseados (mosquitos incluidos) que sean nocivos para la salud humana o animal, o para el medio ambiente, o que simplemente puedan causar daños a las actividades humanas, debe ser registrado en Europa como biocida según el Reglamento de Productos Biocidas 528/2012 de la UE64. Después de recopilar información sobre el uso de Wolbachia como potencial biocida en Europa, la Comisión Europea dictaminó recientemente su uso declarando lo siguiente: Las bacterias del género Wolbachia, o cualquier preparación que contenga esas bacterias, utilizadas con el propósito de inocular esas bacterias en mosquitos, con el objetivo de crear mosquitos no infectados de forma natural con fines de control de vectores, se considerará un biocida; mientras que los mosquitos no infectados de forma natural, independientemente de la técnica de infección utilizada, no se considerarán ni un producto biocida ni un artículo tratado65. Teniendo en cuenta estas regulaciones, existe una hoja de ruta para la introducción de Wolbachia en los programas de control de vectores en Europa de acuerdo con las leyes europeas. En este contexto, el Ayuntamiento de València apoya una iniciativa pionera en España para la implantación de cepas de Wolbachia como sistema de control de las poblaciones de Ae. albopictus.
AGRADECIMIENTOS
Los autores quieren agradecer a los técnicos de Lokímica SA por su colaboración en el análisis y recogida de muestras en campo; a las Dras. Nuria Busquets y Sandra Talavera, del Centro de Investigación en Salud Animal IRTA-CReSA (Barcelona, España), por su guía y provisión de muestras de control positivo. Este trabajo se realizó en el marco de la Acción AIM-COST CA17108 y ha sido parcialmente financiado mediante diferentes contratos específicos por parte del Servicio de Sanidad y Consumo del Ajuntament de València.