INTRODUCCIÓN
La viruela del simio (Mpox) es una zoonosis causada por un virus de la familia orthopoxvirus1. El 14 de mayo de 2022, la Agencia de Seguridad Sanitaria del Reino Unido (UKHSA) notificó dos casos sin antecedentes de viajes a zonas endémicas ni contacto con casos importados2. Desde entonces, y hasta el 28 de febrero de 2023, se habían notificado 25.843 infecciones por el virus de Mpox, que fueron confirmadas por laboratorio en cuarenta y cinco países de la región europea3. La mayoría de casos han sido diagnosticados en hombres de entre dieciocho-cincuenta años (87%), principalmente gais, bisexuales y hombres que tienen sexo con hombres (GBHSH). La incidencia de casos se incrementó globalmente a partir de abril, alcanzando el pico máximo entre julio y septiembre de 2022. España ha sido uno de los países que ha presentado un mayor número de casos. A fecha de 13 de diciembre de 2022 se habían notificado 7.415 casos confirmados de Mpox. Desde entonces, la tendencia global ha sido de disminución progresiva de casos3,4,5,6.
El objetivo de este estudio fue describir las características clínico-epidemiológicas de los casos confirmados en las Islas Canarias, así como describir las principales dificultades encontradas en la vigilancia epidemiológica de esta enfermedad emergente.
SUJETOS Y MÉTODOS
Este es un estudio retrospectivo observacional descriptivo, llevado a cabo en casos confirmados de Mpox y sus contactos estrechos en la Comunidad Autónoma de Canarias (España), identificados a través del Sistema de Vigilancia Epidemiológica de Canarias. Se consideró caso confirmado, de acuerdo con la definición publicada por el Ministerio de Sanidad, aquella persona con diagnóstico por detección de genoma de virus Mpox mediante PCR para Orthopoxvirus en muestra clínica7.
Se consideraron contactos estrechos aquellas personas que habían estado en contacto con un caso confirmado desde el momento de aparición de los primeros síntomas, en las siguientes circunstancias: contacto cercano y prolongado (inferior a un metro en la misma habitación) con un caso confirmado; o contacto directo con ropas, ropa de cama o fómites usados por un caso confirmado de Mpox durante el periodo infeccioso.
Se incluyeron en el estudio de contactos los mamíferos domésticos convivientes, de acuerdo con las recomendaciones internacionales8.
Se utilizó la información disponible a partir de las encuestas epidemiológicas realizadas por el servicio de epidemiología y la información disponible en la historia clínica electrónica.
Se realizó un análisis descriptivo, indicando frecuencias y porcentajes para las variables cualitativas y, mediana y rango intercuartílico (RIC) para las variables cuantitativas.
RESULTADOS
Descripción de casos.
A 31 de octubre de 2022 se habían notificado ciento setenta y seis casos confirmados y un caso probable en las Islas Canarias. Noventa y ocho casos se produjeron en Gran Canaria (55%), setenta y cuatro en Tenerife (42%), dos en Lanzarote, dos en Fuerteventura y uno en La Palma. La mediana de edad fue de 39 años (RIC 32,8-48,3); ochenta y dos casos (46,6%) eran seropositivos y doce casos (6,8%) tenían nacionalidad extranjera. Treinta y siete casos habían sido vacunados contra la viruela en la infancia, y uno en el contexto actual del brote. El método diagnóstico utilizado principalmente fue la PCR de muestra de lesión cutánea en ciento setenta y seis pacientes. Uno de los pacientes fue considerado como caso validado, a pesar de ser un caso probable sin confirmación mediante prueba de laboratorio, dado que presentaba clínica característica y vínculo epidemiológico, pero no se pudo realizar toma de muestra por ausencia de lesiones en el momento de la cita para realización de la misma. Se realizaron ciento ochenta y cuatro PCR ya que a algunos pacientes se les realizó PCR de diferentes lesiones de forma simultánea. De ellas ciento veintiuna fueron PCR de orthopoxvirus y sesenta y tres PCR específicas frente a Mpox.
Los síntomas del primer caso comenzaron el 15 de mayo [Figura 1]. En las Islas Canarias todos los casos confirmados presentaron clínica a lo largo de su proceso, siendo el exantema anogenital el síntoma más frecuente observado (68,8 %) seguido de la fiebre (67,6 %) [Tabla 1]. El tiempo medio entre el inicio de los síntomas y la aparición del exantema fue de 1,5 días (RIC 0-2, máximo veintitrés días). El exantema al diagnóstico se localizó con mayor frecuencia en el área genital (66,5%) y en estadio de pústulas (61,4%). Tres casos desarrollaron infección bacteriana secundaria, y uno de ellos requirió ingreso hospitalario; ninguno de estos casos había recibido la vacuna de la viruela.
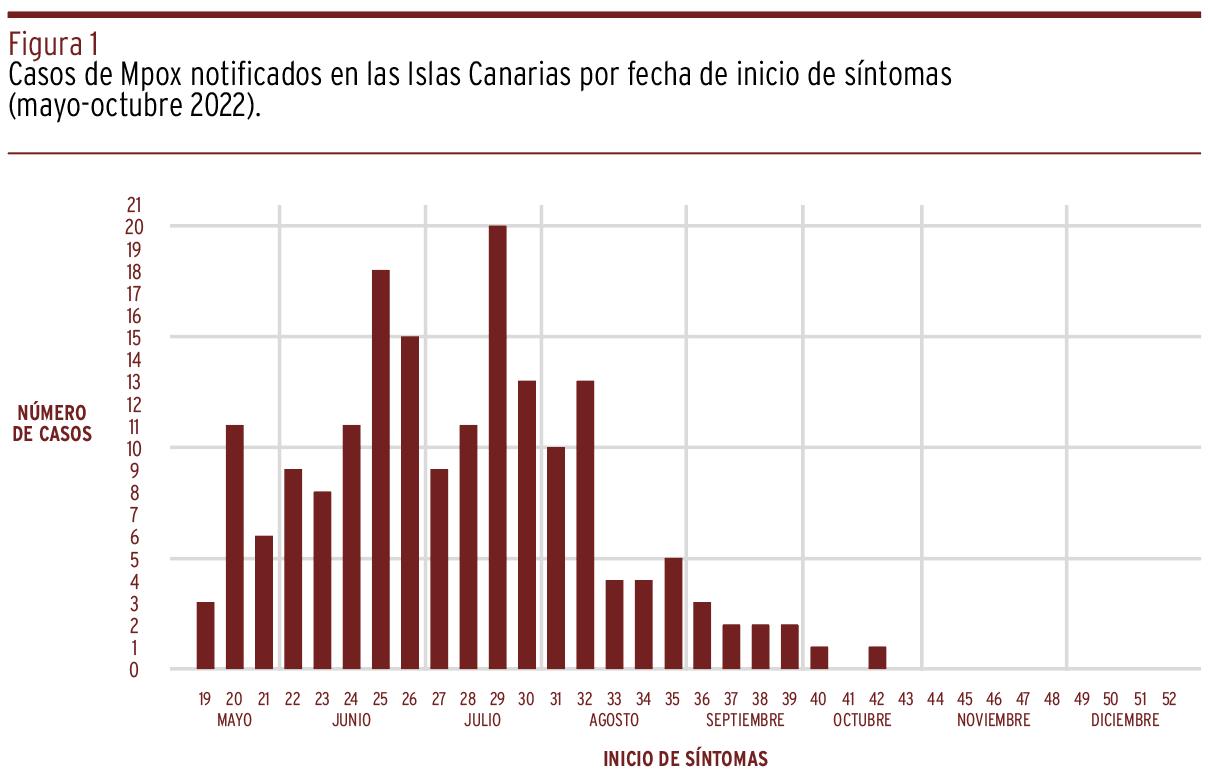
Figura 1. Casos de Mpox notificados en las Islas Canarias por fecha de inicio de síntomas (mayo-octubre 2022).
Con respecto a los antecedentes de exposición de riesgo, de los ciento setenta y siete casos se pudo constatar que ciento tres casos referían como posible mecanismo de transmisión un contacto sexual previo (58,19%), diez personas referían un contacto estrecho no sexual en entorno familiar/social (5,6%) y en sesenta y cuatro casos no se pudo objetivar el posible foco epidemiológico (34,5%). De los ciento tres pacientes que reconocieron un mecanismo de transmisión sexual, noventa y siete (94,2%) se identificaron como GBHSH. No se disponía información en el resto de los casos. Un total de veintisiete pacientes refirieron ser conocedores de haber tenido contacto estrecho con un caso confirmado de Mpox (15,3%).
En relación a la asistencia de eventos multitudinarios, treinta y nueve pacientes reconocieron haber acudido a alguno en los veintiún días previos a la fecha de inicio de síntomas (22%). Los eventos referidos fueron el Gay Pride de Maspalomas, los carnavales de Las Palmas de Gran Canaria, los de Santa Cruz de Tenerife y Maspalomas, el Gay Pride de Madrid y el Gay Pride de Torremolinos. Uno de los casos refirió haber estado presente en los dos focos identificados como origen de los dos primeros brotes identificados en España (Madrid e Islas Canarias).
En relación a posibles casos importados, catorce pacientes refirieron haber realizado un viaje en los veintiún días previos a la fecha de inicio de síntomas (8%), pudiéndose confirmar como importados tres casos (1,7%).
Seguimiento y rastreo de contactos.
Cuando aparecieron los primeros casos, aún no se había publicado el protocolo de actuación nacional. Los pacientes, al reconocer síntomas clínicos compatibles, y conscientes de su exposición a prácticas sexuales de riesgo, contactaron con el servicio de vigilancia epidemiológica a través de canales no oficiales. Los médicos de Atención Primaria notificaron los casos a medida que fueron apareciendo y estos acudieron a sus centros sanitarios en busca de atención médica.
Se contactó por teléfono con los casos sospechosos para realizarles la encuesta epidemiológica y darles las recomendaciones de aislamiento, higiene y de cuándo solicitar atención médica. También se les dieron instrucciones de acudir a su hospital de referencia para la toma de la muestra, que era enviada posteriormente al centro nacional de microbiología para la confirmación diagnóstica. Como parte de la entrevista, se preguntó a los casos sobre los posibles lugares donde pudieron haber estado expuestos y sus contactos.
Contactos identificados.
De los ciento setenta y seis casos confirmados, cincuenta y tres (30%) colaboraron en la identificación de sus contactos estrechos, aunque solo en los de ámbito familiar o laboral. En total se identificaron setenta y ocho contactos estrechos, de los cuales, uno requirió vacunación como profilaxis postexposición. Dos casos refirieron tener el mismo contacto sexual extranjero, originario de Ucrania y, además, fueron contactos entre sí y estaban incluidos en el balance global de contactos.
Se identificaron cuatro mamíferos convivientes con los casos, tres perros y un gato.
DISCUSIÓN
La aparición de una nueva enfermedad emergente supone un desafío para los sistemas de vigilancia9. Como la viruela del simio rara vez se observa fuera de África Occidental y Central10, muchos médicos no tienen experiencia en reconocer esta enfermedad o dar las indicaciones apropiadas. Es necesario preparar al sistema sanitario para la identificación y vigilancia de casos, mediante formación para los profesionales sanitarios, tanto en el reconocimiento de las lesiones de Mpox como en las recomendaciones y manejo de los casos.
En el momento del diagnóstico, la mayoría de los casos de nuestro estudio presentan el exantema en el área genital, como ya se ha descrito en la literatura11,12,13, y la mayoría refiere conductas sexuales de riesgo6,14. La viruela del mono generalmente se propaga a través del contacto cercano y los aerosoles respiratorios, pero en 2017 se sugirió que también era posible la transmisión sexual a través de úlceras genitales14. La actividad sexual de los casos en España y Bélgica planteó la misma hipótesis15,16. Además, Adler et al. sugirieron la posible existencia de un reservorio genital del virus10.
El principal problema que encuentra el sistema de vigilancia es la imposibilidad de rastrear los contactos estrechos, ya que en muchas ocasiones los casos no podían identificarlos17. La mayoría de los casos refieren tener prácticas sexuales de riesgo con frecuencia y, principalmente, en el evento multitudinario al que asistieron. Dado que no fue posible identificar a muchos de los contactos, es posible que repitan el mismo patrón conductual en próximos eventos multitudinarios, como carnavales, las celebraciones del Orgullo Gay del mes de junio o los festivales de verano. Por esta razón, es prioritario reforzar la prevención en los colectivos de mayor riesgo, divulgar cómo se presenta la enfermedad y la importancia de acudir a un centro sanitario ante un síntoma de sospecha, y la necesidad de mantener rigurosamente el aislamiento domiciliario18. Teniendo en cuenta que la identificación de contactos seguirá representando un problema en el futuro, se hace más necesario fomentar las prácticas sexuales seguras mientras exista el riesgo.
Dificultades en el rastreo de contactos.
Debido a las características de transmisión y exposición, se encuentran varios impedimentos a la hora de realizar el estudio de contactos:
Dificultad para establecer comunicación con los casos, tanto sospechosos, como probables y confirmados. En muchas ocasiones, los casos no se muestran receptivos a ser contactados, por lo que son informados de las recomendaciones de aislamiento y medidas de higiene con retraso.
Dificultad en el rastreo de contactos. En la mayoría de los casos, las personas involucradas en las prácticas sexuales de riesgo conciertan su encuentro a través de aplicaciones móviles o en el propio evento multitudinario, por lo que no disponen de datos de identificación fiables. Si bien a través de las aplicaciones es posible volver a contactar con la persona expuesta, muchos de los casos se muestran reacios a comunicar sus contactos.
Dificultad para comunicar las medidas de aislamiento tras el primer contacto con los servicios sanitarios. Algunas de las manifestaciones clínicas iniciales de los casos se presentan como lesiones poco específicas o lesiones con las que los profesionales sanitarios aún no están familiarizados. Esto da lugar a que, a pesar de solicitar la toma de muestras para el diagnóstico, en algunos casos no se indican a los pacientes las medidas de aislamiento necesarias.
Aumento de solicitudes de pruebas y estudio de pacientes con síntomas cutáneos inespecíficos o sin criterio Mpox (reacciones urticariformes, tiña, etc.), guiadas por la inercia terapéutica o una excesiva práctica clínica defensiva.
Retraso en el procesamiento de las muestras dado que no se realiza localmente, sino que es necesario enviarlas al Centro Nacional de Microbiología, localizado en Madrid.
Como limitaciones de este trabajo, dada la falta de colaboración de algunos casos y contactos, así como la imposibilidad de identificar muchos de los contactos de riesgo, es posible que haya más casos afectados que no pudieron ser contactados. Como la vigilancia depende de que los casos acudan voluntariamente a sus centros sanitarios, es muy probable una subestimación de la incidencia.
A modo de conclusión, la manifestación clínica más frecuente es el exantema genital, siendo las pústulas el estadio más frecuente en el momento del diagnóstico. Muchos de los casos reportan relaciones sexuales de riesgo y haber asistido a eventos multitudinarios. Las principales barreras en el rastreo de contactos son la dificultad para contactar con los casos, la falta de datos de identificación de los contactos y la inexperiencia de los profesionales sanitarios.















