INTRODUCCIÓN
En 2020, en todo el mundo se diagnosticaron de cáncer de mama a 2,3 millones de mujeres y 685.000 fallecieron por esa enfermedad1. En España, las cifras son similares y según la International Agency for Research on Cancer se diagnosticaron 34.088 nuevos cánceres de mama, lo que supone 1.000 casos más respecto al año anterior y, todos ellos, en mujeres2. La tasa de incidencia nacional se sitúa en torno al 13,8 por cada 100.000 habitantes. No obstante, es un cáncer con una supervivencia elevada (89,5%)3. En el caso de los hombres, esta patología se considera rara, representando menos del 1% del total de cánceres4.
El diagnóstico del cáncer de mama puede derivar en un tratamiento único o combinado. Entre las diversas modalidades de tratamiento, actualmente la administración de quimioterápicos es la elección principal, concretamente los incluidos en el grupo de los taxanos5, que actúan deteniendo el ciclo celular específicamente6.
Los dos fármacos más utilizados dentro del grupo de los taxanos son el paclitaxel y el docetaxel7. Estos agentes quimioterápicos gozan de numerosas ventajas en cuanto a su administración, pero cabe destacar que el 90% de pacientes a los que se les administran estos fármacos presentan complicaciones durante y postratamiento6.
La administración de taxanos induce neuropatía periférica tanto sensitiva como motora, con efectos tales como parestesia, disestesias, disfunción autonómica (arritmias e hipotensión ortostática), dolor neuropático, pérdida de la sensación de pinchazo y reflejos alterados, iniciándose en las falanges y extendiéndose en las extremidades tanto superiores como inferiores6,8. Se ha descrito que el paclitaxel, en dosis en torno a 250-300 mg/m2, puede provocar artralgias y mialgias debido a la alteración que produce al inhibir la sustancia P (mecanismo del dolor). El tratamiento con este fármaco causa una morbilidad significativa, aumentando la incidencia de ésta hasta un 70%9. Como consecuencia, este fármaco incrementa el dolor neuropático, que puede aparecer hasta tres días después de la infusión del medicamento6 y predominar meses después de la finalización de la terapia10. Esto repercute en la percepción continua de malestar del paciente, incidiendo en una grave alteración de su calidad de vida9.
El docetaxel es el otro fármaco que pertenece al grupo de los taxanos y que sus efectos secundarios no están descritos a nivel individual, sino en su conjunto con otros fármacos del mismo grupo11. No obstante, el uso de docetaxel y paclitaxel aumenta el riesgo de mielosupresión y de padecer neuropatía periférica y onicólisis12.
Los análisis de calidad de vida realizados en pacientes diagnosticadas de cáncer de mama, una vez finalizados los tratamientos, indican una modificación negativa en las dimensiones de función física, rol, imagen corporal, preocupaciones económicas, al igual que síntomas como fatiga, dolor, disnea y los relacionados con la mama, brazo y efectos adversos de las terapias sistémicas13. Si el análisis se centra en el tratamiento con quimioterapia y en los efectos secundarios que produce, las alteraciones más relevantes se producen en los dominios que incluyen la calidad de vida global, física, de cognición, la fatiga, el funcionamiento físico, de roles, emocional y social14. Muchos son los fármacos que se han probado para disminuir o mitigar la aparición de neuropatía periférica. Sin embargo, los estudios realizados para valorar su eficacia no han arrojado luz, demostrando en muchos casos su nula efectividad15.
Los objetivos del estudio fueron describir los efectos secundarios (neuropatía periférica sensitiva y motora, además de onicólisis), midiendo su grado de afectación, y relacionarlos con las dosis recibidas de fármaco quimioterápico tipo taxanos y con la calidad de vida relacionada con la salud.
SUJETOS Y MÉTODOS
Se realizó un estudio observacional longitudinal prospectivo con muestreo consecutivo de cincuenta mujeres recién diagnosticadas de cáncer de mama no metastásico, sin neoplasias previas, que recibieron tratamiento quimioterápico del grupo taxanos (docetaxel y/o paclitaxel), y se efectuó el seguimiento en la unidad de Hospital de Día de Oncología del Hospital Universitario Miguel Servet de Zaragoza (España) durante el periodo 2019-2020 (nivel de confianza del 95%, un error del 5% y una potencia del 80%). Las pacientes que presentaron Fenómeno de Raynaud, patología o lesión ungueal previa (micosis, psoriasis, distrofias, etc.), afectación sensitiva y/o motora, y linfoedema en fase avanzada fueron excluidas del estudio. La participación final fue de cuarenta y tres mujeres.
La captación de las mujeres participantes en el estudio se realizó a través de la consulta de oncología médica del hospital.
A las mujeres que decidieron participar, en la primera visita y antes de la infusión del fármaco quimioterápico, una enfermera realizó la valoración de la neuropatía periférica (motora y sensitiva) y valoró el estado de las uñas mediante la escala Common Terminology Criteria for Adverse Events (CTCAE v.5.0)16 y el test del monofilamento (MF) de Semmes Weinsten17. El grado de calidad de vida se evaluó mediante la escala Eastern Cooperative Oncology Group (ECOG)18.
La escala CTCAE se compone de múltiples eventos adversos en función de su fisiopatogenia, de la anatomía o de ambas. Cada evento adverso es una representación puntual de un evento específico que resulta apropiado para el análisis científico. En su apartado de eventos dermatológicos (trastornos de la piel y del tejido subcutáneo) se valoró como grado 1 los cambios ungueales (si existe cambio), la decoloración ungueal (asintomática, observación clínica o diagnóstica solamente) y pérdida ungueal (asintomática con separación parcial o total de la uña) y como grado 2 la sintomática con separación parcial o total de la uña, limitando las actividades de la vida diaria.
El test MF de Semmes Weinsten consistió en aplicar perpendicularmente un monofilamento a la piel del paciente hasta que este se doblara. En las extremidades inferiores, el examen se realizó sobre cuatro puntos plantares de cada pie: en el primer dedo (falange distal), en las bases del primer, tercer y quinto metatarsianos. Para cada una de estas localizaciones se puntuó con valor 1 o 0, según si el paciente fuese o no sensible. La suma de valores dio como resultado el índice de sensibilidad al MF (de 0 a 8). El paciente se consideró sensible sólo cuando la puntuación obtenida fuese de 8/8. Para las extremidades superiores se valoraron 3 puntos palmares para cada una: la base del primer dedo de cada mano, la de la tercera y quinta falange de forma aleatoria.
La escala ECOG valoró la calidad de vida relacionada con la salud, siendo calificada como: grado 0 (el paciente se encuentra totalmente asintomático y es capaz de realizar un trabajo y actividades normales de la vida diaria); grado 1 (el paciente presenta síntomas que le impiden realizar trabajos arduos, aunque se desempeña normalmente en sus actividades cotidianas y en trabajos ligeros. El paciente sólo permanece en la cama durante las horas de sueño nocturno); grado 2 (el paciente no es capaz de desempeñar ningún trabajo, se encuentra con síntomas que le obligan a permanecer en la cama durante varias horas al día, además de las de la noche, pero que no superan el 50% del día. El individuo satisface solo la mayoría de sus necesidades personales); grado 3 (el paciente necesita estar encamado más de la mitad del día por la presencia de síntomas. Necesita ayuda para la mayoría de las actividades de la vida diaria como, por ejemplo, el vestirse); grado 4 (el paciente permanece encamado el 100% del día y necesita ayuda para todas las actividades de la vida diaria); grado 5 (fallecido).
Las valoraciones del grado de neuropatía periférica (motora y sensitiva) y onicólisis en aquellas mujeres cuyo tratamiento quimioterápico fue el paclitaxel se realizaron en los ciclos 1, 4, 7, 10 y 12. Para las mujeres cuyo tratamiento consistió en la administración de docetaxel, dichas valoraciones se realizaron en los ciclos 1, 3, 4 y 6. Se unificaron criterios de valoración estableciéndose el ciclo 1 y el ciclo 4 como ciclos conjuntos de evaluación. Al mes de haber finalizado el tratamiento y a los seis meses se les realizó una nueva valoración (se denominaron como ciclo 8 y ciclo 9, respectivamente).
La introducción de los datos en la hoja de recogida de datos de las mujeres participantes en el estudio fue anónima y confidencial. A cada participante se le asignó un código del estudio. Las variables registradas en la hoja de recogida de datos fueron la edad (años), tipo de fármaco administrado (docetaxel y paclitaxel), dosis de fármaco administrado por sesión (categorizado en mg/m2), presencia de enfermedades concomitantes (hipertensión, diabetes e hipercolesterolemia), presencia de alteración ungueal (decoloración y pérdida de uñas categorizadas en grado 1 y grado 2) y presencia de hábitos tóxicos (alcohol por unidades de bebida, tabaquismo en cigarrillos/día), grado de neuropatía periférica motora (NPM), grado de neuropatía periférica sensitiva (NPS) y onicólisis.
El estudio fue aprobado por la comisión de investigación del Hospital Universitario Miguel Servet (07-2019E), por la Agencia Española del Medicamento y Productos Sanitarios (DMG-DOC-2019-01) como estudio posautorización de seguimiento prospectivo (EPA-SP) y por el Comité de Ética de la Investigación de la Comunidad Autónoma de Aragón (EPA19/0029).
El análisis estadístico de los datos se realizó con el programa Jamovi 1.2®. Las variables cualitativas se presentaron mediante la distribución de frecuencias de los porcentajes de cada categoría y las cuantitativas se indicaron mediante su tendencia central (media) y de dispersión (desviación estándar). Para la asociación de las variables estudiadas (siendo una cuantitativa) se utilizó la t de Student (distribución normal) y el test de la U de Mann-Withney (distribución no paramétrica), pero siendo ambas cualitativas se utilizó la chi-cuadrado, y si las frecuencias observadas fueron inferiores a cinco se aplicó el test exacto de Fisher. Se utilizó el test de Mc.Nemar para el análisis y asociación de variables cualitativas. Para el cálculo de la probabilidad de ocurrencia del evento se utilizó el test de Odds Ratio. Los efectos se consideraron significativos si p<0,05.
Tanto el autor como el equipo investigador declaran no tener ningún conflicto de intereses.
RESULTADOS
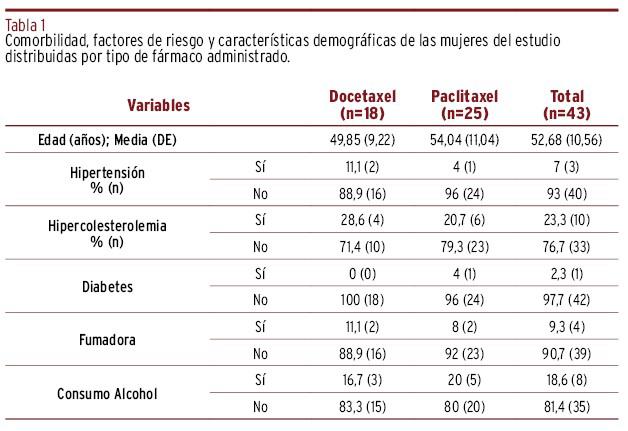
Inicialmente se incluyeron cincuenta participantes en el estudio, siendo todas ellas mujeres. Durante el estudio, se excluyeron a siete participantes (tres por datos incompletos al realizar las valoraciones, tres por cambios de tratamiento y una por cambio de residencia y de hospital de tratamiento y seguimiento). La participación total fue de cuarenta y tres mujeres con una media de edad de 52,7±10,6 años. Como antecedentes patológicos previos, el 7% presentaban hipertensión arterial, el 2,3% diabetes y el 23,3% hipercolesterolemia. En relación con los hábitos tóxicos, el 9,3% manifestaron ser fumadoras activas, con una media de 16,3±7,5 unidades/día de cigarrillos, y el 18,6% ingerían al menos una unidad de alcohol diaria [Tabla 1].
Tabla 1. Comorbilidad, factores de riesgo y características demográficas de las mujeres del estudio distribuidas por tipo de fármaco administrado.
Al 58,1% de las participantes en el estudio se les administró paclitaxel, con una media total de fármaco acumulado de 621±96,1 mg/m2, y al 41,9% se les administró docetaxel, con una media de fármaco total acumulado de 446±70,5 mg/m2 [Tabla 2].
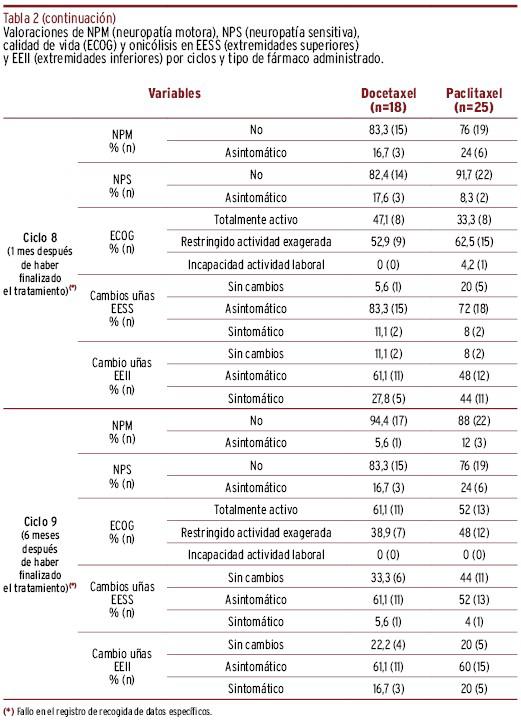
Tabla 2. Valoraciones de NPM (neuropatía motora), NPS (neuropatía sensitiva), calidad de vida (ECOG) y onicólisis en EESS (extremidades superiores) y EEII (extremidades inferiores) por ciclos y tipo de fármaco administrado.
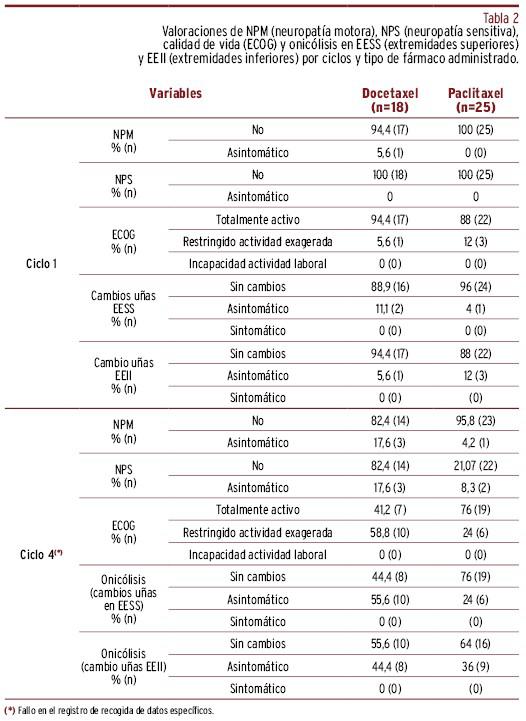
Previo al inicio del tratamiento (ciclo 1), el 97,7% (cuarenta y dos) no presentaron signos de neuropatía motora, el 100% no presentaron signos de neuropatía sensitiva y, en relación a la onicólisis, el 93% y el 90,7% no presentaron cambios en EESS y en EEII, respectivamente. El 90,7% presentaron un grado ECOG totalmente activo.
En el ciclo 4, la media total de días posteriores a la infusión del primer fármaco fue de 39,6±19,8 días, con una media de 131±12 mg/m2 de fármaco acumulado. La media de días desde el inicio de tratamiento y la media de fármaco acumulado en el grupo docetaxel y en el grupo paclitaxel fue de 62±5,68 días; 130,8±10,66 mg/m2 y 23,5±4,44 días; 132±13,14 mg/m2, respectivamente. El 9,8% presentaron neuropatía motora, el 12,2% neuropatía sensitiva, el 37,2% presentaron separación total o parcial de las uñas en EESS (χ2=11,3; p<0,001) y el 39,5% presentaron separación total o parcial de las uñas en EEII (χ2=13; p<0,001) en comparación con el ciclo 1.
Las mujeres a las que se les administró paclitaxel tuvieron una probabilidad mayor en sufrir cambios en las uñas en EESS (OR=3,96; IC 95%:1,07-14,62; p=0,039).
El 38,1% presentó un grado ECOG restringido a actividad exagerada, hallándose diferencias estadísticamente significativas en relación al ciclo 1 (χ2=10,3; p=0,001). Las mujeres a las que se les administró paclitaxel presentaron más cambios que las de docetaxel (OR=4,52; IC 95%: 1,19-17,14; p=0,026).
En relación a la dosis acumulada de fármaco, en el caso del docetaxel se hallaron diferencias estadísticamente significativas en neuropatía motora, onicólisis en EESS, onicólisis en EEII y ECOG (χ2=294, p<0,001; χ2=814, p<0,001; χ2=917, p<0,001; χ2=1.165, p<0,001, respectivamente) en comparación con el ciclo 1.
En el caso de paclitaxel, se hallaron diferencias estadísticamente significativas en onicólisis en EESS, onicólisis en EEII y ECOG (χ2=648, p<0,001; χ2=814, p<0,001 y χ2=269, p<0,001, respectivamente) en comparación con el ciclo 1.
En el ciclo 8 (visita al mes de finalizar el tratamiento), la media total de días posteriores en relación a la infusión del primer fármaco fue de 141±60,8 días, con una media de 547±122,3 mg/m2 de fármaco acumulado. La media de días desde el inicio de tratamiento y la media de fármaco acumulado en el grupo docetaxel y en el grupo paclitaxel fue de 138±40,8 días; 446±70,5 mg/m2 y 143±72,7 días; 621±96,1 mg/m2,respectivamente. El 20,9% presentaron neuropatía motora y el 32,6% neuropatía sensitiva. Se observaron diferencias estadísticamente significativas entre las puntuaciones obtenidas de neuropatía sensitiva en la visita 8 con la visita 4 (χ2=6,23; p=0,013). En EESS, el 76,7% presentaron separación total o parcial de las uñas y el 9,3% perdió la uña observándose diferencias estadísticamente significativas con la visita anterior (χ2=6,07; p=0,048; coeficiente de contingencia: 0,352); en EEII, el 53,5% presentó separación total o parcial de la uña y el 37,2% la perdió totalmente. Se observaron diferencias estadísticamente significativas en relación a la visita anterior (χ2=10,1; p=0,006; coeficiente de contingencia: 0,436).
El 58,5% presentó un grado ECOG restringido a actividad exagerada y el 2,4% presentó incapacidad para la actividad laboral, observándose diferencias estadísticamente significativas con asociación moderada entre las puntuaciones obtenidas en comparación con la visita 4 (χ2=8,47; p=0,014; coeficiente de contingencia: 0,42).
En relación a la dosis acumulada de fármaco, en el caso del docetaxel se hallaron diferencias estadísticamente significativas en neuropatía sensitiva y ECOG (χ2=62,3, p<0,001; χ2=347, p<0,001, respectivamente) y, en el caso de paclitaxel, se hallaron diferencias estadísticamente significativas en neuropatía motora y neuropatía sensitiva (χ2=3,438, p<0,001 y χ2=5,393, p<0,001, respectivamente) en comparación con el ciclo 4.
En el ciclo 9 (visita a los seis meses después de finalizar el tratamiento), la media total de días posteriores a la infusión del primer fármaco fue de 291±55,4 días. La media de días desde el inicio de tratamiento en el grupo docetaxel y en el grupo paclitaxel fue de 279±30,1 días y 299±67,5 días, respectivamente. El 9,3% presentaron neuropatía motora, el 20,9% neuropatía sensitiva, hallándose diferencias estadísticamente significativas en NPM (χ2=5,00; p=0,025) en comparación con la visita anterior. En EESS, el 55,8% presentó separación total o parcial de las uñas y el 4,7% perdió la uña, hallándose diferencias estadísticamente significativas con la visita anterior (χ2=9,53; p=0,023); en EEII, el 60,5% presentó separación total o parcial y el 18,6% perdió la uña. El 44,2% presentó un grado ECOG restringido a actividad exagerada, observándose diferencias estadísticamente significativas con asociación moderada entre la visita 2 postratamiento en relación a la visita postratamiento (χ2=8,58; p=0,014; coeficiente de contingencia: 0,416).
Comparando los fármacos docetaxel y paclitaxel para cada uno de los ciclos de evaluación, a las personas que se les administró docetaxel se hallaron diferencias estadísticamente significativas entre la valoración de NPM8-NPM 9 (χ2=5,29; p=0,02) y en el cambio de uñas en EEII entre las visitas 4 y 8 (χ2=9,16; p=0,010). En el caso de paclitaxel, se observaron diferencias estadísticamente significativas entre NPM8-NPM 9 (χ2=10,8; p=0,001), entre NPS8-NPS9 (χ2=11,842; p=0,001) y entre cambio en las uñas en EEII en las visitas 1 y 4 (χ2=6,06; p=0,037).
DISCUSIÓN
El presente estudio describe y compara el grado de calidad de vida, la aparición de neuropatía periférica motora y sensitiva y la onicólisis con la administración de docetaxel y paclitaxel en mujeres diagnosticadas de cáncer de mama. Las mujeres, desde el inicio del tratamiento hasta su finalización, presentan cambios en la calidad de vida relacionados con la administración de ambos fármacos13,14, habiéndose detectado en nuestra muestra unos resultados similares y observándose un aumento de estos en los ciclos posteriores. Al año de seguimiento, y sin tratamiento activo, no se han recuperado los parámetros de calidad de vida reflejados en el momento inicial, observándose una disminución de esta en las mujeres tratadas con docetaxel a mitad de tratamiento. Sin embargo, esta tendencia se invierte a los seis meses de inicio del mismo. Este dato indica una modificación negativa en las dimensiones de función física, rol, imagen corporal, preocupaciones económicas y síntomas como fatiga, dolor, disnea y los relacionados con la mama, brazo y efectos adversos de las terapias sistémicas13. Se estima que entre el 30%-40 % de pacientes a los que se les administre un agente citostático desarrollan neuropatía periférica8, resultado prevalente similar a nuestra población de estudio. En términos de neuropatía motora y sensitiva, al mes de haber finalizado el tratamiento hay mayor repercusión, siendo el paclitaxel el que presenta más nocividad que el docetaxel. No obstante, en otros estudios19 este dato se produce de manera inversa. El docetaxel y el paclitaxel son dos de los fármacos del grupo taxanos más utilizados para el tratamiento del cáncer de mama7, siendo el paclitaxel un determinante mayor en inducir neuropatía periférica20, desconociéndose así los efectos, a nivel individual, del docetaxel11. No obstante, en la muestra de estudio, los resultados son similares en ambos fármacos. La prevalencia de presentar neuropatía periférica en el caso del fármaco paclitaxel puede ascender hasta un 60%-70%21. Como efecto secundario, se ha observado que al mes de haber finalizado el tratamiento los síntomas y signos han perdurado debido a que la administración del fármaco, al cabo del tiempo, se acumula tanto en EESS como en EEII6,10 produciendo dolor, neuropatía y onicólisis12. A nivel descriptivo, más de la mitad de la población a estudio no ha recuperado los valores iniciales, tanto en EESS como en EII. Los efectos de ambos fármacos en las EESS son similares; no obstante, el paclitaxel en las EEII presenta un efecto adverso mayor que el docetaxel. Existen diversos mecanismos capaces de disminuir los efectos secundarios de los taxanos. En los últimos quince años se ha comenzado a incluir, en el tratamiento de estas pacientes, el uso de guantes y botas con un claro potencial efecto frío para reducir estos efectos no deseados22 y, en la última década, otras investigaciones en torno a los efectos de la crioterapia han determinado que el uso de gorro con efecto frío es un potente mecanismo de prevención de la alopecia, llegando a utilizarse como tratamiento preventivo en más de treinta países, disminuyendo hasta un 50% la pérdida de cabello23. La creciente prevalencia de aparición de neuropatía periférica exige un enfoque objetivo para identificar a los pacientes en riesgo a fin de prevenir o limitar la progresión y aliviar eficazmente los síntomas asociados24,25.
Las limitaciones que presenta este estudio son: la selección de las participantes se realizó mediante muestreo consecutivo y con una baja muestra de estudio. No obstante, en la literatura científica publicada, la cantidad de participación en estos estudios es similar. Al realizar el seguimiento de las valoraciones de neuropatía periférica motora y sensitiva, estas se compararon por ciclos, siendo desiguales estos en la administración de los tratamientos para cada uno de los fármacos estudiados (docetaxel y paclitaxel). No obstante, el cálculo de la dosis recibida fue similar en ambos grupos de estudio y en el corte de valoraciones que se presentan.
La continuidad de este estudio para obtener resultados más alentadores y mejorar así la calidad de vida relacionada con la salud en mujeres diagnosticadas de cáncer de mama y en tratamiento con fármacos del grupo taxanos pasa por plantear dos ejes fundamentales como líneas futuras de investigación. Se plantea como primer eje la realización de un ensayo clínico aleatorio multicéntrico con aplicación de crioterapia y presoterapia, con el fin de evitar o mitigar la aparición de neuropatía periférica motora y sensitiva, así como para mejorar la calidad de vida relacionada con la salud. Como segundo eje, se plantea realizar las valoraciones realizadas atendiendo dos criterios de elección: o por dosis de fármaco acumulado o por día de valoración que acuda la paciente al Hospital de Día de Oncología.
Toda intervención capaz de prevenir un efecto secundario derivado de un tratamiento se convierte en un aliado para mejorar la calidad de vida percibida por los pacientes o, en el peor de los casos, para conseguir que dicha calidad de vida no se vea alterada por causas no relacionadas con los signos y síntomas de la propia patología.














