INTRODUCCIÓN
A lo largo de la historia los humanos hemos afrontado una constante batalla contra los microorganismos, en particular las bacterias, causantes de una morbimortalidad significativa en diferentes poblaciones de todo el mundo. Para combatir esto, los medicamentos conocidos como antibacterianos han salvado millones de vidas pero, además, han supuesto una revolución en la medicina. Existen varios tipos de agentes naturales, semisintéticos y sintéticos, que tienen mecanismos de acción distintos, capaces de causar alteraciones importantes a nivel metabólico y fisiológico; sin embargo, el uso inadecuado de los mismos ha llevado a la generación de resistencia bacteriana, la cual es considerada un problema de salud que se encuentra en constante evolución, y a medida que se utilizan más antibacterianos en todo el mundo se ofrece una mayor oportunidad a las bacterias de desarrollar una resistencia contra esos antibióticos, lo que genera un reto mayor para el futuro.
Desde el descubrimiento de la penicilina en 1928, hasta la fecha, se han realizado múltiples investigaciones, sobre todo para conocer los mecanismos y las causas que hacen posible esta resistencia, así como la creación de nuevas estrategias para limitar el daño, ya sea por medio de nuevos productos farmacéuticos o mediante programas de optimización de los mismos. En México, la investigación sobre la resistencia bacteriana a los antibióticos se ha enfocado en la generación de reportes y en la descripción de aislamientos provenientes, principalmente, de muestras de pacientes con infecciones hospitalarias; pese a las estrategias para mitigar el daño, los perfiles de sensibilidad continúan disminuyendo, advirtiendo del paso a la ya presente era postantibiótica, hasta tal punto de carecer por completo de tratamientos disponibles. Sumado a esto, la sociedad actual está experimentando una diseminación generalizada del nuevo coronavirus SARS-CoV-2, amenazando a la Salud Pública y aumentando el grado de complejidad sobre la resistencia bacteriana, debido a la sobreinfección bacteriana en el marco de la enfermedad de la COVID-19.
Dicho lo anterior, en el presente trabajo se abordó un panorama general de la resistencia bacteriana con el objetivo de entender los mecanismos de la misma y el impacto que ha generado a lo largo de la historia, así como elaborar estrategias para su contención.
HISTORIA DE LOS ANTIMICROBIANOS
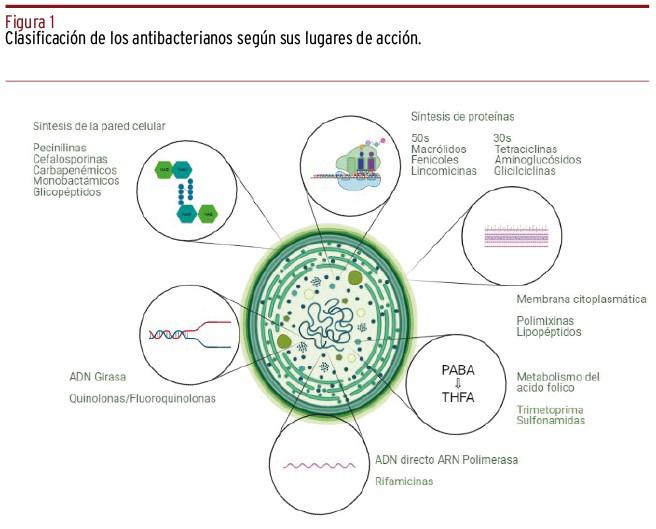
En 1947, S.A. Waksman definió por primera vez a los antibióticos como sustancias que presentan la capacidad de destruir, imposibilitar o retardar el crecimiento de las bacterias2; sin embargo, según su uso se denominan como antibacterianos, antivirales, antifúngicos y antiparasitarios. Se clasifican de acuerdo al espectro y clase, la vía bioquímica en la que interfiere, así como su estructura química [Figura 1]. Se dividen tanto en bactericidas como en bacteriostáticos; los bacteriostáticos detienen el crecimiento bacteriano y su replicación a concentraciones séricas, delimitando así el proceso infeccioso, mientras que los bactericidas destruyen las bacterias3.
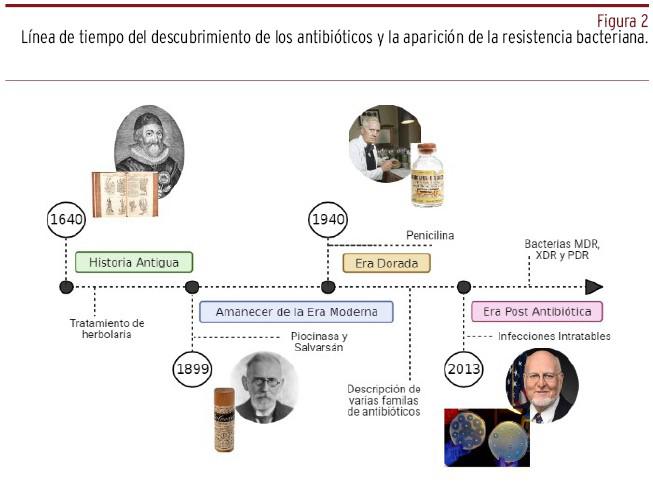
Los antibióticos han sido medicamentos que transformaron la medicina y que han salvado millones de vidas, a la vez que han permitido el desarrollo de procedimientos médicos complejos como los trasplantes y las amputaciones. El amanecer de la era moderna de los antibióticos da inicio en 1899 con la piocinasa, descubierta por Rudolf Emmerich (1856-1914) y Oscar Löw (1844-1941), siendo el primer antimicrobiano que se usó para el tratamiento de infecciones humanas; sin embargo, el primer antimicrobiano moderno e industrializado fue el salvarsán, medicamento descrito por Paul Ehrlich (1854-1915) en 1909, utilizado para el tratamiento de la sífilis; aun así, se tiene registro del tratamiento de infecciones en la historia antigua en Egipto, Grecia y China, donde aplicaban de forma tópica moho de pan o algunos otros productos naturales, por ejemplo hierbas, tal como lo plasma John Parkinson (1567-1640) en su libro Theatrum Botanicum, publicado en 16404. La penicilina, descubrimiento realizado por Sir Alexander Fleming en 1928, marca el inicio de la era de los antibióticos y, posteriormente, los siguientes veinte años se convirtieron en la era dorada, fecha en la que se describieron varias familias de antibióticos. Sin embargo, cuando se pensó que la guerra contra las bacterias había sido vencida, el uso indiscriminado de los antimicrobianos y la presión selectiva impuesta por su amplio uso y abuso fue desencadenando el fin de la era de oro con la aparición de cepas multirresistentes, con resistencia extendida y panresistentes, llevando a la actual era postantibiótica que marca su inicio en 20135, fecha en la que las infecciones comunes se vuelven intratables, tal y como lo menciona Robert R. Redfield, director del Centro para el Control y Prevención de Enfermedades (CDC) de Estados Unidos6 [Figura 2].
MECANISMOS DE RESISTENCIA
La resistencia a los antimicrobianos se refiere a los procesos que presentan los microorganismos (bacterias, virus, hongos o parásitos), que inciden y hacen ineficaces a los medicamentos utilizados en su tratamiento7.
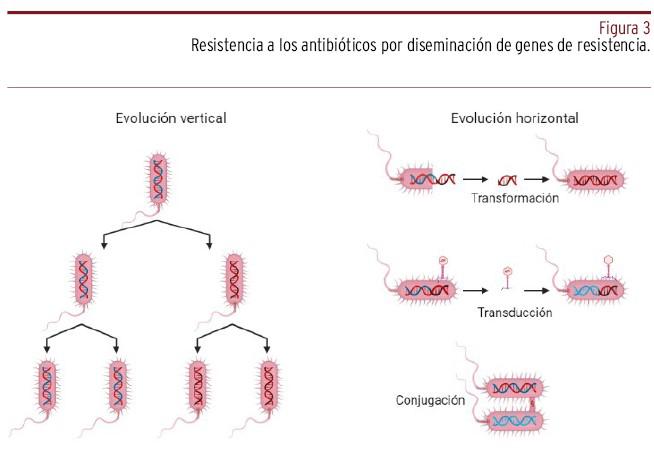
La resistencia bacteriana se define, más específicamente, como la capacidad de la bacteria para sobrevivir a las concentraciones terapéuticas utilizadas de un medicamento particular. A nivel genético se han identificado diferentes procesos para el intercambio de información entre bacterias que se han asociado a la resistencia [Figura 3], es decir7:
Conjugación: intercambio de material genético entre dos bacterias mediante contacto físico.
Transformación: que consiste en la incorporación por una bacteria de ácido desoxirribonucleico (ADN) libre en el medio, como resultado de la lisis de otras bacterias.
Transducción: transferencia de ADN cromosómico o plasmídico de una bacteria a otra, utilizando como vehículo un bacteriófago.
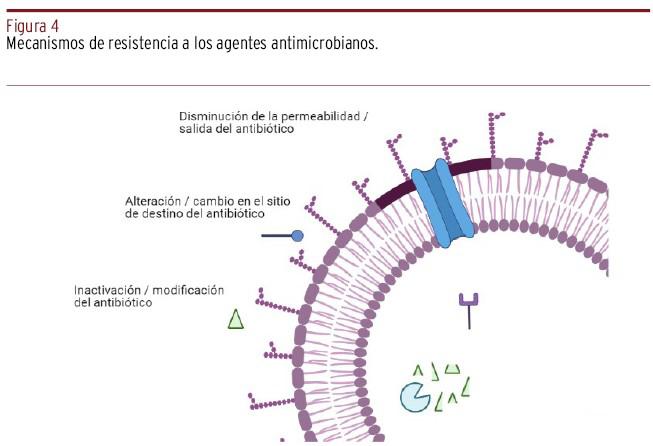
La resistencia bacteriana puede ser natural (o intrínseca) y adquirida (o extrínseca)8. La resistencia intrínseca surge de manera natural, siendo una propiedad innata de la bacteria, es decir, en ausencia de mecanismos de presión de selección antimicrobiana, y se caracteriza por ser inherente a una especie en particular8; por su parte, la resistencia extrínseca es un cambio en la composición genética, y los mecanismos por los cuales ocurre [Figura 4] son:
Expulsión del antibiótico por un sistema de eflujo, limitando la concentración intracelular del fármaco.
Neutralización del antibacteriano mediante enzimas que lo inactivan. Ejemplo de ello son las betalactamasas, betalactamasas de espectro extendido (BLEE).
Alteración o modificación del sitio de unión, que se traduce en una pérdida de la afinidad y, por ende, de la acción del antibiótico, o la alteración de la permeabilidad bacteriana, limitando el ingreso del fármaco.
EVOLUCIÓN DE LA RESISTENCIA BACTERIANA
En 1928, casi en conjunto con la llegada de los antibióticos, se data el inicio de la resistencia bacteriana. Se menciona la resistencia en la literatura desde el inicio de los años 40, teniendo reporte de un Staphylococcus resistente a la penicilina9, y en 1962 se reportó el primer caso de Staphylococcus aureus resistente a meticilina (MRSA) en la Unión Europea y en 1968 en los Estados Unidos10. Subsecuentemente, en 1964 fueron registrados por primera vez en Escherichia coli las BLEE, que son fenotípicamente resistentes a las penicilinas y cefalosporinas9. En México, durante 1960 se realizó un estudio de susceptibilidad donde se encontraron cepas de Escherichia coli resistentes a penicilinas de amplio espectro, y en 1973 apareció una publicación relacionada a la resistencia en bacterias causantes de cuadros diarreicos, aislando cepas de Salmonella Typhi resistentes a cloranfenicol, tetraciclinas, estreptomicina y a las sulfas.
Desafortunadamente, la crisis antibiótica ha avanzado al mismo ritmo, e incluso mayor, que el descubrimiento de las nuevas estrategias para la resistencia bacteriana, tal como fue el caso en 1972 con la introducción de la vancomicina en la práctica clínica; para 1979 ya se habían descrito casos de Staphylococos coagulasa negativos resistentes10. Y en 1999 se describió la multirresistencia9 en bacterias Gram negativas10. Sumado al problema de la creciente resistencia, como se reporta en un informe de 2018 de la Organización Mundial de la Salud (OMS) (que informa de un 82% de aumento en infecciones resistentes, lo que corresponde a la existencia generalizada de resistencia a los antibióticos en 500.000 personas de 22 países), en los últimos años se han encontrado cepas de SARM con resistencia a la ceftarolina, que se ha asociado con cambios aminoacídicos en la proteína PBP-2a11. Por otro lado, se ha encontrado evidencia de diversas bacterias resistentes a varios antibióticos en lugares aislados del exterior durante al menos cuatro millones de años; de las bacterias encontradas, Streptomyces spp mostró resistencia a catorce antibióticos12.
Dentro de las bacterias con mayor resistencia a los antibióticos, se encuentran las señaladas con el término ESKAPE13 14; es decir, en el grupo de las Gram positivas se encuentran Staphylococcus aureus y Enterococcus spp., las cuales constituyen una grave amenaza para la Salud Pública debido a la alta tasa de resistencias, siendo necesarias nuevas terapias y haciéndose especial hincapié en los nuevos mecanismos descritos tanto para antibióticos de amplio uso como para los más nuevos agentes lipopéptidos, lipoglucopéptidos, glicilciclinas u oxazolidinonas15; mientras que, en el grupo de las bacterias Gram negativas, actualmente de mayor interés, se encuentran las productoras de betalactamasas de espectro extendido, las enterobacterias (que causan infecciones nosocomiales), entre las que cabe destacar a Pseudomonas aeruginosa, a Acinetobacter baumannii, a Enterobacter spp., y a Klebsiella pneumoniae16, señalando la alta complejidad de sus mecanismos de resistencia, lo que dificulta su tratamiento17.
CLASIFICACIÓN DE LA RESISTENCIA BACTERIANA
No existe una definición universalmente aceptada aplicable a un microorganismo multirresistente. Sin embargo, un grupo de expertos internacionales se reunieron a través de una iniciativa conjunta del ECDC (European Centre for Disease Prevention and Control) y del CDC (Centers for Disease Control and Prevention) de Estados Unidos para crear una terminología internacional normalizada aplicable (18), que es:
Multirresistencia (MDR): ausencia de sensibilidad a al menos un antibiótico de tres o más familias consideradas de utilidad para el tratamiento de las infecciones producidas por cada una de las especies bacterianas consideradas.
Resistencia extendida (XDR): ausencia de sensibilidad a al menos un antibiótico de todas las familias excepto una o dos.
Panresistencia (PDR): ausencia de sensibilidad a todos los antibióticos de todas las familias habitualmente utilizadas en el tratamiento de la bacteria considerada.
IMPACTO DE LA RESISTENCIA BACTERIANA
La resistencia bacteriana es uno de los mayores desafíos de Salud Pública mundial de nuestro tiempo, ya que cada cuatro horas los laboratorios del CDC detectan un germen resistente6 y cada día mueren 2.000 personas19. Proyecciones recientes indican que se producirán para 2050 más muertes por esta causa que las ocasionadas actualmente por el cáncer, y que podrían ascender a diez millones de muertes si no se hace nada para revertir la tendencia. Además de estos problemas serios, la resistencia bacteriana tiene un impacto económico negativo en las comunidades, lo que lleva a enormes costos anuales, casi similares a los de la crisis financiera mundial, y que según un estudio reciente en el Reino Unido costará a la economía mundial un estimado de 100 billones de dólares 93 billones de euros) anualmente20.
Igualmente, a pesar del inminente problema que la resistencia bacteriana representa, varias empresas farmacéuticas han cerrado su desarrollo de antibióticos para invertir en medicamentos redituables donde el retorno de dicha inversión esté asegurado, como, por ejemplo, para los padecimientos crónicos degenerativos. Lo anterior se debe a que el costo-beneficio de producción de nuevos antibióticos es muy bajo debido al poco uso que se le da al antimicrobiano antes de generar resistencia, de ahí que la producción de nuevos medicamentos sea lenta21.
MEDIDAS DE CONTENCIÓN DE LA RESISTENCIA BACTERIANA
Algunos investigadores han planteado la utilización de marcadores biológicos, por ejemplo, la proteína C reactiva, el receptor desencadenante soluble expresado en las células mieloides-1 o la pro calcitonina (PCT), que podrían facilitar mejor las decisiones terapéuticas con respecto a los regímenes de tratamiento con antibióticos22.
La prevención de la infección puede disminuir significativamente la resistencia, al eliminar la necesidad de antibióticos en primer lugar. La higiene diligente de las manos, antes y después de todas las interacciones con el paciente que tienen lugar durante la prestación de atención médica, es fundamental para reducir el riesgo de transmitir patógenos bacterianos, tanto resistentes como susceptibles a antibióticos, así como la higiene de la infraestructura por parte del personal de limpieza, ya que sé que, por ejemplo, A. baumannii es un patógeno nosocomial que puede sobrevivir largo tiempo en superficies expuestas al medio ambiente, lo cual dificulta la prevención de la transmisión nosocomial del microorganismo23.
La veloz aparición de bacterias multirresistentes y panresistentes es un fenómeno mundial, cuestionando la eficacia antibiótica. Implementar protocolos y recomendaciones, como la adopción de programas de administración de antibióticos, la actualización de las prácticas diagnósticas y/o la optimización de los regímenes terapéuticos son medidas que se espera que disminuyan la transmisión de infecciones y la propagación de la resistencia.
La correcta administración de antibióticos implica comprometerse a usarlos solo cuando sea necesario, elegir el medicamento adecuado y administrar la dosis necesaria en la duración adecuada en cada caso. En el caso de patologías como la sepsis, donde el tiempo de inicio de la terapia antibiótica es primordial, el no utilizar antimicrobianos de manera empírica es algo aún imposible, y para hacerlo de manera correcta es necesario conocer los antecedentes personales, incluyendo el historial de alergias u otras reacciones adversas a los antimicrobianos, la situación clínica del paciente, que haya una buena tolerabilidad al antibiótico empleado y que tenga pocos efectos adversos; pero, además, es importante conocer el perfil de resistencias de los microorganismos implicados, sabiéndose que en los últimos años se han detectado descensos significativos en la sensibilidad microbiana a diversos antibióticos24.
De acuerdo con las directrices elaboradas por la OMS, se debe: utilizar siempre un antibiótico para el que haya sido comprobada la sensibilidad del germen causante de la infección a tratar; de no ser posible, utilizar uno que razonablemente lo sea; utilizar siempre, dentro de lo posible, aquel antibiótico que presente un espectro antimicrobiano más estrecho; administrar el fármaco elegido en la dosis y por la vía adecuada; administrar el antibiótico durante el tiempo más corto posible, dentro de las posibilidades; no utilizar nunca dos antimicrobianos de una misma familia; prescribir un bactericida junto a un bacteriostático en caso de utilizar dos; y beneficiarse del sinergismo de las drogas utilizadas25, como en el caso de las nuevas combinaciones de betalactámicos con inhibidores de betalactamasa, ceftolozano-tazobactam y ceftazidima-avibactam, que podrían mostrar actividad en cepas resistentes, como se reporta en algunos estudios26.
RESISTENCIA BACTERIANA Y COVID-19
La infección por el SARS-COV-2 ha sido posiblemente uno de los más importantes desafíos de los sistemas de salud en el mundo en más de un siglo; sin embargo, se estima que, antes de la aparición de la COVID-19, tres millones de estadounidenses se infectaron cada año con un patógeno resistente de alta prioridad, de acuerdo a las categorías de la OMS27.
Durante la pandemia, los objetivos de la administración de antimicrobianos permanecieron sin cambios, es decir, limitar el uso de la exposición a los antimicrobianos para prevenir la resistencia a los mismos; de igual forma, el uso de antibioticoterapia empírica no estaba recomendada en los pacientes con COVID-19, debido a la baja prevalencia de coinfección y sobreinfección bacteriana, así como por el aumento del riesgo de resistencia bacteriana28. Sin embargo, es necesario resaltar que hay casos en que esta terapia se encuentra justificada debido a la acumulación de factores de riesgo para presentar una sobreinfección, como lo son la estancia prolongada en UTI, las enfermedades cardiovasculares, la enfermedad pulmonar obstructiva crónica (EPOC), el uso previo de antibióticos, etc.29. En una revisión de estudios se notificó una sobreinfección bacteriana del 3,5% al 16% de los pacientes con COVID-1930. En otros estudios se informaron infecciones secundarias del 5% al 27% de los adultos infectados con SARS-CoV-2 en varios hospitales. El tipo de infección más común era la neumonía bacteriana o fúngica. En Francia, uno de cada tres pacientes con COVID-19 grave fue diagnosticado de coinfección secundaria por A. baumanni y A. flavus31. En un informe de 552 hospitales, el 58% de los pacientes fueron tratados con antibióticos empíricos, probablemente se generalizaron porque los pacientes mostraban evidencia de sepsis y era muy difícil excluir infecciones bacterias o fúngicas basadas en signos y síntomas31; debido a esto, es razonable anticipar que se producirán infecciones resistentes en un apreciable número de pacientes hospitalizados31.
CONCLUSIONES
Aunque la primera parte del siglo XX fue testigo de uno de los eventos más importantes para la Salud Pública mundial, es decir, el descubrimiento de varios antibióticos, y a pesar de que la ciencia se encuentra en constante evolución en materia de investigación de nuevas opciones terapéuticas y diagnosticas, se necesita redoblar esfuerzos dada la urgente necesidad de combatir la resistencia bacteriana. Y no solo en el ámbito de la salud, sino también en la aplicación de un modelo complejo que abarque ámbitos sociales, económicos y políticos, usando como punto de partida la teoría ecosocial de Nancy Kriger, como comentan Venegas-Múnera y Jiménez-Quiceno5, en la que se pueden desarrollar herramientas metodológicas dada la complejidad del problema, ocasionado por la interacción de factores biológicos y sociales a diferentes niveles e inmersos, además, en un contexto histórico y del curso de la vida actual. De no ser así, el impacto que generará será tal que podría considerarse a la resistencia bacteriana como la pandemia con más morbimortalidad.
Por último, y sin olvidar las palabras de Sir Alexander Fleming, el científico que dio inicio a la era de los antibióticos, “existe el peligro de que un hombre ignorante pueda fácilmente aplicarse una dosis insuficiente de antibiótico, y, al exponer a los microbios a una cantidad no letal del medicamento, los haga resistentes".