Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.26 no.2 Pamplona may./ago. 2003
REVISIONES
Tumores quísticos pancreáticos y lesiones pseudotumorales
Cystic pancreatic tumours and pseudo-tumoural lesions
F.J. Jiménez Mendióroz, I. Tolosa, A. De Blas, J. García Sanchotena, T. Cabada, J. Olier
| RESUMEN Las lesiones quísticas de páncreas son infrecuentes, estimándose en sólo un 1% de todos los tumores pancreáticos y en un 10% de todos los quistes pancreáticos. El diagnóstico preoperatorio es importante para un adecuado tratamiento, existiendo en la actualidad valiosas técnicas radiológicas como son los ultrasonidos, la tomografía computarizada y la resonancia magnética. A pesar de todo tenemos que aceptar que nos encontramos ante un grupo de tumores de difícil diagnóstico, debido a la gran variedad de tipos celulares que existen en los mismos. Palabras clave. Tumor quístico de páncreas (TQP). Ultrasonidos (US). Tomografía computarizada (TC). Resonancia magnética (RM). | ABSTRACT Cystic lesions of the pancreas are infrequent, estimated at only some 1% of all pancreatic tumours and at some 10% of all pancreatic cysts. The pre-operational diagnosis is important for a suitable treatment, with valuable radiological techniques available today such as ultrasound, computerised tomography and magnetic resonance. In spite of this we have to accept that we are facing a group of tumours whose diagnosis is difficult, due to the great variety of cellular types existing within them. Key words. Cystic pancreatic neoplasms. Ultrasonides. Computerized tomography. Magnetic resonance. |
| Servicio de Radiología. Hospital de Navarra Aceptado para su publicación el 7 de mayo de 2003. | Correspondencia Fco. Javier Jiménez Mendióroz Servicio de Radiología Hospital de Navarra Irunlarrea, 3 31008 Pamplona E-mail: fjimenem@cfnavarra.es |
INTRODUCCIÓN
La patología tumoral pancreática representa la cuarta causa de muerte por patología tumoral y la segunda causa, después del cáncer colorrectal entre los tumores digestivos. El adenocarcinoma ductal puede representar el 90% de todos los tumores de dicho órgano. Dentro del 10% restante están los tumores endocrinos que aunque infrecuentes tienen importancia por la clínica que producen, y los tumores quísticos de páncreas, pequeño grupo con entidad propia y tradicionalmente olvidados. Hasta ahora hablábamos del cistadenoma seroso y mucinoso. En la actualidad esto no es así y recientemente se ha establecido1 una nueva clasificación según la OMS. Se estima que representan el 1% de todos los tumores pancreáticos y el 10% de todos los quistes del páncreas. El avance en las técnicas radiológicas ha contribuido a conseguir una mayor precisión en la morfología macroscópica y en su aproximación diagnóstica. Siguiendo el aspecto radiológico prevalente de estas lesiones se han dividido en dos grupos: tumor sólido pancreático2 y tumor quístico pancreático (Tabla 1).
Tumores exocrinos benignos
Los tumores primarios benignos del páncreas exocrino son: el cistadenoma seroso y el tumor quístico mucinoso (TQM).
Cistadenoma seroso
Es un tumor benigno productor de líquido seroso que se encuentra en mujeres en la 5ª década de la vida. Aparece aislado o asociado al síndrome de Von Hippel Lindau3.
La presentación clínica es inespecífica o relacionada con el efecto de presión sobre las estructuras adyacentes. El resto son hallazgos incidentales durante una exploración radiológicas por otras razones. La predilección por la cabeza pancreática no implica la presencia de ictericia.
Microscópicamente se reconocen dos tipos: a) el clásico o variante microquística, bien delimitado, con quistes finos (menos de 2 cm), cicatriz central y apariencia en esponja, b) el macroquístico u oligocítico, caracterizado por la presencia de uno o más quistes (mayores de 2 cm), con cicatriz central y márgenes mal definidos. Pueden alcanzar un tamaño importante (hasta 15 cm). Incluso puede existir un patrón mixto (variedad micro y macroscópica).
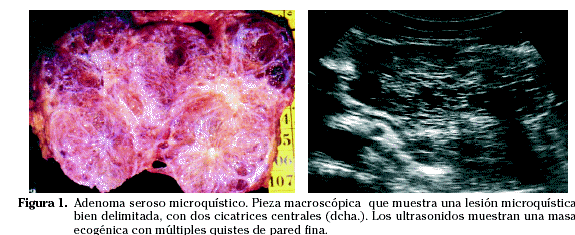
Microscópicamente los quistes tienen una fina capa de células epiteliales con núcleos redondeados y citoplasma rico en glucógeno, y septos fibrosos vascularizados con aspecto de rueda de carro convergente hacia la cicatriz central que a su vez puede mostrar calcificaciones (Fig. 1).
Los estudios radiológicos muestran en la variante microquística un aspecto sólido con los ultrasonidos. Con la TC se demuestra el realce tras la administración i.v. de contraste además de las calcificaciones de la pared o la propia cicatriz (Fig. 2).
Si la técnica empleada es la RM, el contenido líquido brilla en T2 e incluso en T1 debido al aumento de contenido proteico, siendo el realce con el contraste paramagnético similar al realce con la TC. La variedad macroquística de este tumor es indistinguible de otros tumores quísticos pancreaticos4,5. La biopsia aspiración con aguja fina o la biopsia intraoperatoria pueden ser interesantes en la variedad macroquística ya que procedimientos conservadores (bypass biliar o quistoyeyunostomía) pueden ser considerados en pacientes con alto riesgo quirúrgico.
Tumor quístico mucinoso
Este tumor uni o multilocular está formado por un epitelio secretor de mucina. La incidencia es casi exclusiva en mujeres entre 20 y 80 años, de tal forma que aquellos que en el pasado se adjudicaron a varones, en la actualidad se consideran tumores mucinosos papilares intraductales (TMPI)6,7.
Clínicamente si el tumor es pequeño, será un hallazgo incidental. Si es voluminoso se presentará como una masa palpable o con síntomas por efecto compresivo sobre las estructuras adyacentes. En las formas malignas puede haber una elevación de marcadores tumorales como el CEA o el Ca 19-9.
Macroscópicamente estos tumores son redondeados, y presentan una superficie lisa y una pseudocápsula fibrosa con calcificaciones focales. Los espacios quísticos contienen mucina, sangre o material necrótico. El tamaño del quiste es muy variable, desde 1 mm hasta 30 cm. No existe conexión del tumor con el conducto pancreático. La maligninidad se correlaciona con la presencia de proyecciones papilares y/o nódulos murales. Se localizan preferentemente en el cuerpo y cola del páncreas.
Microscópicamente los quistes presentan dos elementos distintos: un epitelio interno y un estroma celular. En base a las atipias celulares, los tumores son clasificados en adenoma, bordeline y carcinoma aunque en el pronóstico lo más importante es la extensión del carcinoma invasivo (afectación de la cápsula y del tejido adyacente).
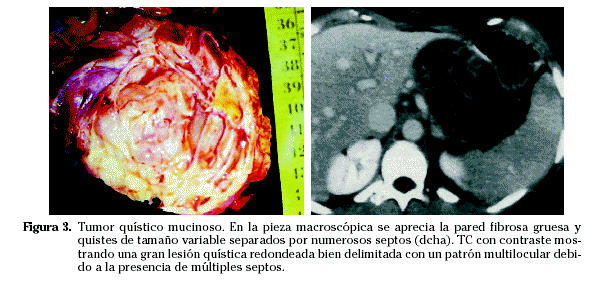
Aunque es fácil diferenciarlo de otros tumores quísticos, no lo es tanto con el tumor mucinoso papilar intraductal (TMPI) y el pseudoquiste (arquitectura multilocular8, nódulos parietales y sin clínica de pancreatitis aguda o crónica). En los estudios radiológicos como los US o la TC (Fig. 3) podemos apreciar una pared gruesa fibrosa (que puede tener calcificaciones) y quistes de diferentes tamaños separados por septos. Si se analiza con RM se observa una alta señal en T1 por la presencia de sangre o contenido proteico. La presencia de arquitectura multilocular, pared gruesa y septos con calcificaciones sugiere malignidad. La arquitectura unilocular sin nódulos es similar a todas las lesiones quísticas pancreáticas.
TUMORES EXOCRINOS BORDELINE
Dentro de los tumores primarios exocrinos y en el grupo bordeline (cierto potencial maligno) hay dos variedades: el tumor mucinoso papilar intraductal (TMPI) y el tumor sólido pseudopapilar:
Tumor mucinoso papilar intraductal
Este es un tumor joven ya que el primero se describió en 19809. Durante mucho tiempo se ha incluido en la pancreatitis crónica o en los tumores quísticos mucinosos. En la literatura esta entidad se ha descrito de diferentes maneras10,11. Las peculiaridades de este tumor son: 1) ligera prevalencia en hombres, pico de incidencia alrededor de los 60 años; 2) dilatación del conducto pancreático/o de las ramas colaterales sin estenosis y la presencia de defectos de replección que corresponden a acúmulos de mucina o proliferaciones papilares dentro del conducto en la ERCP; 3) dilatación de la papila mayor y/o menor con salida de mucina; 4) sintomatología clínica de pancreatitis aguda o crónica debido a la excesiva producción de mucina.
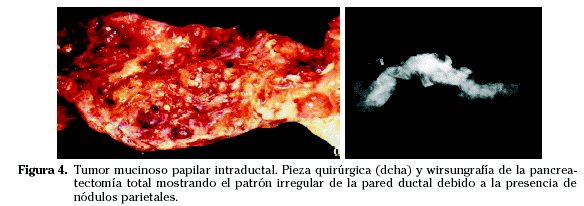
Macroscópicamente el dato característico es la dilatación segmentaria o difusa del conducto principal o secundario sin estenosis (Fig. 4).
Se pueden distinguir dos tipos: 1. ectasia ductal secretor de moco con el conducto relleno de mucina y la línea epitelial lisa o con unas finas papilas microscópicas; y 2. el velloso papilar con proliferaciones polipoideas papilares y con material mucoide en el conducto pancreático que a su vez está dilatado. En estadios avanzados hay dilataciones quísticas (frecuentemente en el proceso uncinado) y una protrusión de la papila de Vater en la luz duodenal. Muy raramente pueden presentar fístulas (entre el wirsung-vía biliar y wirsung-duodeno) y diseminación mucinosa peritoneal (pseudomixoma peritoneal).
Microscópicamente el TMPI muestra proliferaciones papilares de células productoras de mucina originadas en el epitelio ductal. Las células tumorales muestran un amplio espectro de cambios displásicos, desde la apariencia benigna hasta la maligna. De esta manera los tumores pueden ser benignos (adenomas), bordeline y malignos.
El principal diagnóstico diferencial de esta entidad ha de plantearse con: 1) El TQM, que afecta casi exclusivamente a mujeres, se localiza en la cola pancreática y no comunica con el sistema ductal. 2) El carcinoma ductal que se presenta como un tumor sólido que compromete al conducto, 3) La pancreatitis crónica que muestra una ectasia ductal distorsionada e histológicamente la proliferación papilar nunca es la lesión dominante.
En el pasado este tumor se diagnosticaba casi exclusivamente con ERCP, apreciándose una papila dilatada con protrusión en la luz duodenal y salida de mucina, dilatación del wirsung/ramas colaterales y múltiples defectos de llenado en la pancreatografía (proliferaciones papilares o bolas mucinosas).
Actualmente el diagnóstico puede realizarse con la TC (Fig. 5) y la RM, mostrando los cambios morfológicos antes mencionados.
La RM (incluida la colangio-pancreato-resonancia magnética-(CPRM) puede demostrar la comunicación entre el tumor y el conducto principal. Existen publicaciones que comparan ambas técnicas11 aunque la ERCP es superior en la demostración de la comunicación directa de la lesión con el conducto pancreático.
El pronóstico depende de la transformación maligna y de la afectación difusa de la glándula, siendo en este caso la pancreatectomía total el mejor tratamiento siempre que las condiciones clínicas del paciente lo permitan12. La resección parcial se indicará ante una afectación segmentaria. Hay que tener especial cuidado con los focos de displasia para asegurar los márgenes quirúrgicos. En los últimos años y gracias a las técnicas radiológicas, especialmente la CPRM, se han recopilado un mayor número de pequeños tumores o multicéntricos de ramas colaterales, sobre todo en la población de edad avanzada. Si la lesión es menor de 2,5 cm, es regular y no existen defectos de replección endoluminales, se aconseja controles radiológicos y no realizar cirugía13.
Tumor sólido pseudopapilar (Neoplasia epitelial sólida y papilar)
Se presenta en mujeres jóvenes, y lo hace más frecuentemente como un patrón quístico que como un tumor sólido, debido a la presencia de hemorragia y necrosis e incluso con una cápsula gruesa que puede calcificar. Lo podemos ver como un tumor quístico único o multilocular, indistinguible de cualquier masa quística en los estudios radiológicos14.
TUMORES EXOCRINOS MALIGNOS
Los tumores malignos del páncreas exocrino son: el adenocarcinoma ductal y el carcinoma anaplásico.
Adenocarcinoma ductal
El adenocarcinoma ductal es él más frecuente de todos los tumores pancreáticos ya que representa el 80-90%. Generalmente se presenta como una masa sólida aunque puede aparecer con cambios quístico-degenerativos (necrosis y hemorragia), sobre todo en los tumores grandes. En estos casos puede haber errores diagnósticos con otras entidades como los tumores quísticos (mucinosos y serosos).
Carcinoma anaplásico
El carcinoma anaplásico es un tumor muy raro que debido a la necrosis puede aparecer como cualquier TQP.
TUMORES ENDOCRINOS
Los tumores endocrinos tienen una incidencia muy baja (1-2% de todos los tumores pancreáticos)15. Tanto los funcionantes como los no funcionantes se presentan generalmente con tumores sólidos, aunque en menos del 1% de los casos aparecen similares a cualquier tumor quístico.
Tumores quísticos
Los tumores quísticos secundarios del páncreas exocrino son: el pseudoquiste, el quiste congénito y el quiste linfoepitelial.
Pseudoquiste
Es la lesión quística más frecuente del páncreas ya que representa el 90% de todas ellas. Presenta una pared fibrosa sin lámina epitelial. Se puede localizar fuera del páncreas (especialmente en el desarrollo de una pancreatitis aguda necrotizante) o ser intrapancreática (en asociación con la pancreatitis crónica).
Cuando la lesión presenta septos es indistinguible de los tumores quísticos, especialmente con el TQM y el tumor pseudopapilar en su variante quística. El curso clínico de pancreatitis nos ayudará en el diagnóstico de esta entidad. Si el pseudoquiste se asocia al adenocarcinoma ductal, éste puede pasar desapercibido14.
Quiste congénito
Generalmente es pequeño. Su característica fundamental es la falta de comunicación con el árbol ductal y la presencia de una lámina epitelial. La mayoría de las veces es un hallazgo incidental. Pueden ser únicos, planteándose el diagnóstico con el TMPI (la ERCP y la CPRM son las técnicas que pueden demostrar si hay o no comunicación ductal). Si las lesiones son múltiples generalmente se asocian a la enfermedad de Von Hippel Lindau o a la enfermedad poliquística del adulto.
Quiste linfoepitelial
El quiste linfoepitelial generalmente es un hallazgo incidental, presentándose como una masa quística con pared fina e indistinguible de otras lesiones quísticas pancreáticas (Fig. 6).
Otras lesiones pancreáticas
Existen otras lesiones quísticas raras como el quiste endometrial, parasitario, enterógeno, etc. que pueden ser similares en su presentación y el diagnóstico lo confirmará el estudio histológico. El absceso puede resultar fácilmente diferenciable del tumor por la historia clínica (pancreatitis aguda, fiebre) y los hallazgos radiológicos (burbujas de gas en un 25% de los casos).
Puede ocurrir que a pesar de los datos clínicos y hallazgos radiológicos nos encontremos sin un diagnóstico preoperatorio. En estos casos se puede realizar una biopsia percutánea con aguja fina/gruesa guiada por ecografía/TC o mediante ultrasonografía endoscopica (USE), cada vez más utilizada. En este sentido, la combinación de hallazgos citológicos, nivel de antígeno carcinoma embrionario y la viscosidad pueden diferenciar los quistes mucinosos de los no mucinosos. Los niveles de marcadores tumorales como el Ca 15-3 y Ca 7-4 son útiles para predecir la malignidad. Los marcadores tumorales incluyendo NB/70K y niveles enzimáticos pueden identificar la presencia de pseudoquistes, siendo los tumores serosos generalmente un diagnóstico de exclusión16.
CONCLUSIONES
Con el progreso de las técnicas radiológicas (principalmente los US, la TC y la RM) conseguimos diagnosticar un gran número de tumores pancreáticos. No obstante, a pesar de los datos clínicos, radiológicos e incluso los hallazgos citológicos nos podemos encontrar sin un diagnóstico de certeza. Esto es debido a la gran variedad de tipos celulares existente, siendo en muchos casos un verdadero reto diagnóstico. La colaboración multidisciplinar y en equipo de todos los servicios implicados como digestivo, cirugía, oncología, radiología y anatomía patológica, nos permitirá un adecuado diagnóstico y tratamiento de estos pacientes con tumores quísticos de páncreas.
BIBLIOGRAFÍA
1. Klöpel G, Solcia E, Longnecker DS, Capella C, Sobin LH. Histological typing of tumors of the exocrine pancreas. 1996; Springer, Berlin Heidelberg New York. [ Links ]
2. Paker SL, Tong T, Bolden S. Cancer statistics. Ca Cancer J Clin 1997; 47: 5-27. [ Links ]
3. Horton WA, Wong V, Eldrige R. Von Hippel-Lindau disease. Clinical and pathological manifestation in nine families with 50 affected members. Arch Int Med 1976; 136: 769-777. [ Links ]
4. Procacci C, Graziani R, Bicego E, Bergamo-Andreis IA, Guarise A, Valdo M et al. Serous cystadenoma of the pancreas: report of 30 cases with emphasis on the imaging findings. J Comput Assist Tomogr 1997; 21: 373-382. [ Links ]
5. Curry CA, Eng J, Horton KM, Urban B, Siegelman S, Kusky BS et al. CT of primary cystic pancreatic neoplasm: can CT be used for patient triage and treatment? Am J Roentgenol 2000; 175: 99-103. [ Links ]
6. Solcia E, Capella C, Klöppel G. Tumors of the pancreas. Atlas of Tumor Pathology, 3rd Series. Nº 20. Armed forces Institute of Pathology, Washington, DC 1997. [ Links ]
7. Zamboni G, Scarpa A, Bogina G, Iacono C, Bassi C, Talamini G et al. Mucinous cystic tumors of the pancreas: clinicopathological features, prognosis and relationship to other mucinous tumors. Am J Surg Pathol 1999; 23: 410-422. [ Links ]
8. Procacci C, Biasiutti C, Carbognin G, Accordini S, Bbbicego E, Guarise A et al. Characterization of cystic tumors of the pancreas: CT accuracy. J Comput Assisted Tomogr 1999; 23: 906-912. [ Links ]
9. Ohashi K, Takagi K. ERCP and imaging diagnosis of pancreatic cancer. Gastroenterol Endosc 1980; 1439-1495. [ Links ]
10. Rickaert F, Cremer M, Deviére J, Tavares L, Lambilliotte JP, Schröder S et al. Intraductal mucin-hypersecreting neoplasms of the pancreas. A clinicopathologic study of eight patients. Gastroenterology 1991; 101: 512-519. [ Links ]
11. Itai Y, Ohhashy K, Nagai H, Murakami Y, Kokubo T, Makita K et al. Ductectatic mucinous cystadenoma and cystadenocarcinoma of the pancreas. Radiology 1996; 161: 697-700. [ Links ]
12. Traverso LW, Peralta EA, Ryan JA Jr, Kozarek RA. Intraductal neoplasms of the pancreas. Am J Surg 1998; 175: 426-432. [ Links ]
13. Yamaguchy K, Ogawa Y, Chijiiwa K, Tanaka M. Mucin- hypersecreting tumors of the pancreas: Assesing the grade of malignancy preoperatively. Am J Surg 1996; 171: 427-431. [ Links ]
14. Procacci C, Biasiutti C, Carbognin G, Accordini S, Bicego E, Guarise A et al. Characterization of cystic tumors of the pancreas: CT accuracy. J Comput Assisted Tomogr 1999; 23: 906-912. [ Links ]
15. Klöppel G, Heitz PU. Pancreatic endocrine tumors. Pathol Res Pract 1998; 183: 155-168. [ Links ]
16. K Lewandrowsku J Lee, Southern J, Centeno B, Warhaw A. Cyst fluid analysus in the differencial diagnosis of the pancreatic cysts: a new aproach to the preoperative assessment of pancreatic cystic lesions Am J Roentgenol 1995; 164, 815-819. [ Links ]