Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.31 supl.3 Pamplona 2008
Manifestaciones clínicas de la oftalmopatía tiroidea
Clinical manifestations of thyroid ophthalmopathy
R. V. Fernández-Hermida, S. Pinar, N. Muruzábal
Servicio de Oftalmología. Hospital de Cruces. Baracaldo. Vizcaya.
Dirección para correspondencia
RESUMEN
La oftalmopatía es una manifestación común de la enfermedad tiroidea autoinmune. El edema periorbitario, la retracción palpebral, el exoftalmos y las alteraciones visuales son signos y síntomas frecuentes. De un 25 a un 50% de los pacientes con hipertiroidismo de Graves tendrán algunas manifestaciones de oftalmopatía. Todos los síntomas clínicos visuales significativos y los hallazgos de los pacientes con oftalmopatía de Graves pueden ser englobados dentro de dos fenómenos: el engrosamiento del espacio retrobulbar debido al depósito de glicosaminoglicanos (GAG) o a la restricción de la motilidad extraocular, que se atribuye a un engrosamiento inicial y posterior fibrosis.
Los pacientes con enfermedad de Graves típicamente se quejan de dolor ocular o periocular, lagrimeo, fotofobia, visión borrosa, diplopia, o percepción cromática alterada. A la exploración, muestran congestión orbitaria, proptosis, neuropatía óptica, restricción de la motilidad ocular extrínseca, ejes visuales divergentes, exposición corneal, retracción palpebral y edema periorbitario.
En este trabajo se describen las principales manifestaciones clínicas de la oftalmopatía de Graves con el objetivo de establecer unas clasificaciones medibles y reproducibles que puedan ser empleadas en la clínica diaria para objetivar cambios y guiar y adecuar la terapia. Finalmente, recomendamos el uso de medidas objetivas para la proptosis, movimientos extraoculares, alteraciones corneales y del nervio óptico, usando una escala de actividad clínica o cambios en medidas objetivas para poder establecer la actividad de la enfermedad, y finalmente, reflejar la percepción de los pacientes de su estado de enfermedad.
Palabras clave: Enfermedad de Graves. Oftalmopatía. Exoftalmos. Retracción palpebral. Descompresión orbitaria.
ABSTRACT
Ophthalmopathy is a common manifestation of autoimmune thyroid disease. Periorbital swelling, eyelid lag, exophthalmos, and impaired vision may occur. From 25% to 50% of patients with Graves hyperthyroidism will have some features of ophthalmopathy. All of the clinically significant eye symptoms and findings among patients with Graves ophthalmopathy can be traced to one of two phenomena: swelling in the retrobulbar space due to deposition of glycosaminoglycans (GAG) or restriction of extraocular muscle motion, which is attributed to initial swelling and later fibrosis.
Patients with Graves eye disease typically complain of ocular or periocular pain, lacrimation, photophobia, blurred vision, diplopia, or impaired perception of colour. On examination, they exhibit orbital congestion, proptosis, optic neuropathy, restricted gaze, divergent visual axis, corneal exposure, lid retraction, and periorbital edema.
This paper describes the main clinical features of Graves ophthalmopathy, in order to establish measurable and reproducible classifications that can be used in the surgery setting to record changes and to guide and assess therapy. Finally, we recommend the use of objective measurements for proptosis, extraocular movements, corneal alterations, and the optic nerve, using the clinical activity scale or a recorded change in objective measurements to document disease activity, and lastly, documenting the patients perception of their disease status.
Key words: Graves disease. Ophthalmopathy. Exophthalmos. Lid retraction. Orbital decompression.
Introducción
La asociación clínica de bocio tóxico y oftalmopatía fue descrita por Parry en 1786. Graves fue el primer autor que reconoció el papel etiológico principal del tiroides, y Basedow quien, de forma más meticulosa y completa, analizó las manifestaciones de esta enfermedad. Se trata de un proceso multisistémico clásicamente caracterizado por la triada de bocio hiperfuncionante, oftalmopatía y de manera inconstante, mixedema. Aunque hay un alto grado de evidencia para considerarse un fenómeno autoinmune, aún no ha sido probado, y es mínima la posibilidad etiológica de causa infecciosa.
Los anglosajones han elegido el término de enfermedad de Graves, los franceses se refieren a ella como disfunción tiroidea, y otros europeos la llaman enfermedad de Basedow. Dos entidades deben de ser diferenciadas: la tirotoxicosis y la orbitopatía distiroidea, aunque muchas veces se encuentran asociadas.
La tirotoxicosis es la entidad más prevalente con una predominancia en el sexo femenino de 8:1, más frecuentemente entre los 30 y 50 años. A partir de los 50 años se afectan por igual ambos sexos. La oftalmopatía de Graves es menos prevalente, con una relación 5,5:1 a favor del sexo femenino, y asociándose frecuentemente a la tirotoxicosis. Los signos de hipertiroidismo son bastante evidentes: sudación, pérdida de peso, irritabilidad, nerviosismo e incremento del metabolismo basal. Los signos oculares son discretos: retracción palpebral, -que aumenta con la fijación-, edema palpebral, pigmentación cutánea, insuficiencia de convergencia, etc. La exoftalmía es relativamente poco frecuente y los signos conjuntivales aparecen más evidentes en las zonas de inserción muscular1. Lo más característico de la oftalmopatía tiroidea es el remodelamiento de los tejidos conectivos orbitarios, debido a la infiltración inducida por los fibroblastos orbitarios. Esta infiltración es debida a la acumulación de células inflamatorias y de glicosaminoglicanos (GAG) y la consecuente retención hídrica en el espacio retrobulbar. Una gran variedad de citoquinas inflamatorias estimulan la secreción de GAG por los fibroblastos orbitarios, que expresan en su superficie altos niveles de CD40, activándose la expresión de diversos genes de fibroblastos orbitarios por la unión con su ligando natural, el CD1542.
En el curso natural de la enfermedad, no existe necesariamente un desarrollo paralelo entre la tirotoxicosis y la oftalmopatía. El eutiroismo es bastante frecuente (15-30%) en pacientes con un cuadro florido de oftalmopatía y por el contrario, la tirotoxicosis no siempre se acompaña de manifestaciones oculares3.
Aunque el exoftalmos bilateral con retracción palpebral es casi patognomónico de oftalmopatía tiroidea, son muchos los pacientes referidos a un oftalmólogo con proptosis que no tienen historia evidente de enfermedad de Graves-Basedow. Según Char4, menos del 60% de los pacientes con oftalmopatía tienen elevada la T3 ó T4, en el momento de la aparición del cuadro clínico.
Todos los signos y síntomas oftalmológicos evidentes en la oftalmopatía de Graves pueden ser incluidos dentro de dos fenómenos principales: infiltración y edema del espacio retrobulbar, debido al depósito de GAG, altamente hidrofílicos y restricción de la motilidad ocular extrínseca, debido a la infiltración y posterior fibrosis musculares.
A menudo, pacientes con oftalmopatía tiroidea tienen una patología asimétrica. Un músculo engrosado, generalmente el recto inferior, simula una masa orbitaria cuando los estudios de TC no están bien hechos5. Pacientes con miopatía (engrosamiento de un músculo) y ausencia de masa orbitaria tienen test negativos al estudiar la función tiroidea por lo que son considerados como una oftalmopatía eutiroidea; pero en los siguientes años, más del 40% de ellos desarrollarán hipertiroidismo.
La evaluación analítica para el diagnóstico de hipertiroidismo incluye: T3 libre (FT3), T4 libre (FT4) y si la TSH está en el límite normal-bajo, se realiza el test de TRH. Se debe estudiar, también, el título de anticuerpos antitiroideos (anti-TPO, anti-TBG, anti r-TSH). Pueden ayudar al diagnóstico la gammagrafía y ecografía tiroideas y la captación de I 131 ó TC 99.
En lo que respecta a concepto y nomenclatura es importante distinguir la oftalmopatía de Graves de la enfermedad de Graves (tirotoxicosis con o sin oftalmopatía).
Descripción del cuadro clínico
Existe una gran variabilidad en cuanto a la expresión clínica, incluyendo desde pequeñas alteraciones anatómicas que rozan la diversidad interindividual hasta grandes deformaciones subsidiarias de recibir los más agresivos tratamientos quirúrgicos y radioterápicos6.
Párpados
La retracción palpebral, es un signo cardinal de afectación. Ocurre más frecuentemente en el párpado superior. La zona del limbo corneal, correspondiente a las doce horas, normalmente cubierto 1 mm por el párpado, queda al descubierto. El mecanismo es mixto: por un lado, existe hipertonía simpática del músculo de Müller, por otro, fibrosis y adherencias en los retractores palpebrales, así como hiperfunción del complejo recto superior-músculo elevador secundaria a la fibrosis del recto inferior. La fibrosis del elevador da lugar a una excursión palpebral en resorte y una asinergia en la mirada inferior7.
En casos de severa proptosis puede producirse la desinserción de la aponeurosis del elevador, apareciendo ptosis del párpado. Esto nos plantea un interesante diagnóstico diferencial con la ptosis de la miastenia gravis, proceso autoinmune no pocas veces asociado a la enfermedad de Graves-Basedow. Así, entre un 15 y 20% de los pacientes con miastenia gravis presentan enfermedad tiroidea, incluso tiroiditis eutiroideas diagnosticadas por la presencia de autoanticuerpos.
Proptosis
Se trata del signo más típico de la oftalmopatía de Graves. Se encuentra presente en un 40 a 65 % de aquellos pacientes diagnosticados de Graves. En la estimación de la proptosis influyen variabilidades anatómicas individuales, el sistema de medición y la experiencia del propio examinador. Estadísticamente, se considera normal una medición igual o inferior a 21 mm, y clínicamente significativa una diferencia entre ambos ojos mayor de 2 mm (causas de seudoexoftalmos son la craneosinostosis, ptisis bulbi del ojo adelfo, miopía magna anisometrópica etc.). Frecuentemente el exoftalmos es axial y bilateral (80-90% de los casos) aunque puede ser asimétrico. No son raros los desplazamientos del globo en eje vertical u horizontal cuando existe un engrosamiento particularmente intenso de algún músculo extraocular, con el consiguiente efecto masa. La asimetría es mucho más marcada si existe retracción palpebral; la hendidura palpebral se agranda y parece que hay más exoftalmos del que realmente se mide8.
La proptosis se produce por un conflicto de espacio en la cavidad orbitaria, en el que participan la oftalmopatía infiltrativa de la grasa, de los músculos y glándulas lagrimales (linfocitos, células plasmáticas y mucopolisacáridos que son muy hidrófilos) (Fig. 1). A esto se añade un trastorno mecánico de retorno venoso, con el consiguiente edema en el territorio de la vena oftálmica superior, por un doble mecanismo: aumento de la presión hidrostática por el efecto masa de todas las estructuras hipertrofiadas e hidrofilia de los mucopolisacáridos y proteínas del infiltrado.
Músculos extraoculares
Aparece una gran hipertrofia muscular por infiltración de vainas y fibras, que característicamente, afectan más a la porción ventral (carnosa) y a menudo a la inserción muscular en el ápex orbitario.
El tendón de inserción escleral siempre está respetado, aunque microscópicamente es apreciable la hiperemia de la tenon y de la conjuntiva que lo recubren.
Se produce una evolución secuencial en el músculo, secundaria al proceso inmunológico: presencia de leucocitos, incremento de la permeabilidad vascular y producción de glicosaminoglicanos por los fibroblastos9. La miositis originada por este proceso inflamatorio, cuando se hace crónica, puede desembocar en un cuadro de atrofia y en la proliferación de tejido conjuntivo con la consiguiente fibrosis y establecimiento de una oftalmopatía restrictiva o incluso en la aparición de zonas de atrofia (zona de músculo sin fibras). La miopatía aparece cualquiera que sea la situación metabólica del paciente: hiper, hipo o eutiroideo.
La diplopia, referida por algunos pacientes como visión borrosa o desenfocada, aparece en casos de más larga evolución, en los que la infiltración linfoplasmática y el edema de la fase subaguda, dan paso al predominio celular fibroblástico. Los músculos son menos distensibles, aparecen restricciones en los movimientos del globo y esto da lugar a diversos cuadros de oftalmoplegía por efecto mecánico (oftalmopatía restrictiva). El engrosamiento de los músculos rectos interfiere el drenaje uveoescleral en diferentes posiciones de mirada, contribuyendo a la hipertonía del humor acuoso y al desarrollo de neuropatía óptica. Entre el 25 y 65% de los exoftalmos endocrinos tienen elevada la presión intraocular en posición primaria de la mirada.
Grasa orbitaria
Aparece aumento de volumen de la grasa en los compartimentos extracónico y preseptal (oftalmopatía infiltrativa de la grasa, con o sin afectación muscular, que puede ser inaparente). El aumento de volumen de la grasa se produce por infiltración celular y edema de sus tabiques conectivos, no existiendo hiperplasia de la misma (igual cantidad de grasa pero con mayor volumen), lo cual constituye un factor etiológico de primer orden en la alteración del retorno venoso en el territorio de la vena oftálmica superior. En el área preseptal, la hernia grasa y el edema dan lugar a bolsas que recuerdan una blefarochalasia. El edema de larga evolución, ocasiona hiperpigmentación cutánea periocular más acusada por las mañanas y dan al paciente una gran sensación de presión periocular10.
Glándulas lagrimales
Al igual que en la grasa, la oftalmopatía infiltrativa produce una hipertrofia de la glándula, que se hace palpable en su porción palpebral. Aparece móvil, de consistencia firme y no dolorosa a la presión. En fase de infiltración fibroblástica, se produce destrucción de los acinos y déficit de secreción acuosa, lo que agrava las manifestaciones de la enfermedad en el polo anterior.
Córnea y conjuntiva
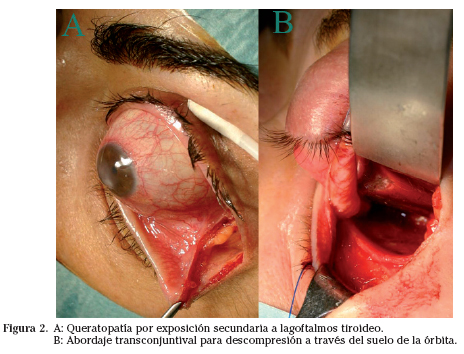
La exoftalmía, la disminución del parpadeo espontáneo y la retracción palpebral, producen una queratopatía por exposición de gravedad variable (Fig. 2). En las formas leves, apenas una fina desepitelización puntiforme en la hemicórnea inferior (más expuesta por el lagoftalmos nocturno) y conjuntiva bulbar adyacente. Si la exposición es mayor, la desepitelización córneo-conjuntival se amplía al área de la hendidura palpebral, pudiendo, en los casos más desafortunados, ulcerarse el estroma, e incluso perforarse la córnea. La situación se agrava si también hay fibrosis de la glándula lagrimal.
Son muy llamativas la hiperemia conjuntival crónica (más acusada en al región de los músculos rectos horizontales) y la quemosis conjuntival. Los pacientes se quejan de picazón, arenas, epífora, fotofobia y sensación de cuerpo extraño. Esto se produce por evaporación acelerada del componente acuoso de la lágrima por agrandamiento de la hendidura palpebral.
A la oftalmopatía de Graves se asocia la queratoconjuntivitis límbica superior de Theodore. No está clara la relación entre ambas entidades (casual o por un mecanismo de la oftalmopatía aún no descubierto que ocasiona alteración local del tono vasomotor de la conjuntiva).
Nervio óptico
La neuropatía óptica que se produce en la oftalmopatía de Graves es de tipo compresivo y aparece en el 3-5% de los pacientes con oftalmopatía. Sucede en aquellos casos de mayor afectación en el vértice de la órbita. Curiosamente, no suelen ser pacientes con gran exoftalmía. Además de la compresión directa del nervio en su porción apical, contribuyen al daño del mismo, el trastorno del retorno venoso, el estiramiento que sufre el nervio en la órbita perdiendo su trayectoria sinuosa y la hipertonía del humor acuoso. Cuando predomina la compresión apical del nervio, la papila puede aparecer de aspecto normal, edematosa o ligeramente isquémica. Las alteraciones más precoces, se producen en la esfera de la percepción cromática, por ser los axones que proceden de la mácula, los más sensibles al daño. La progresión de la neuropatía a escotoma absoluto, atrofia-excavación, y estasis dependerán de la propia oftalmopatía de Graves y de la situación circulatoria previa del nervio (mayor sensibilidad a la isquemia-compresión en pacientes con antecedentes de patología vascular).
La oftalmopatía no aparece en los ojos más exoftálmicos con mayor congestión orbitaria, sino más bien en pacientes de media a moderada oftalmopatía. Suele asociarse a cierta sensación dolorosa. El paciente siente molestias o disconfort en el transcurso de la progresiva pérdida de visión que se asocia inicialmente a escotomas relativos reflejándose posteriormente en su campo visual. Una vez ha sido corregida su oftalmopatía con tratamiento médico o quirúrgico los escotomas son reversibles, así como la neuropatía en el transcurso de meses, en algunos casos.
La pérdida de visión por neuropatía puede ser lenta o brusca y establecerse en un plazo de 1 a 2 semanas. Se asocia a trastornos en la visión de colores, trastornos pupilares aferentes, alteración el PEV, etc. El edema de papila e incluso la atrofia óptica tienen una incidencia muy variable (del 16 al 50%).
Al estar muy engrosados los músculos en el ápex orbitario (hasta 6-7 veces su diámetro) se va a producir una gran compresión sobre el nervio, tal como se demuestra en imágenes de scanner. Estas mismas imágenes demuestran que la neuropatía no tiene nada que ver con exoftalmos marcados. Por ello, se deduce que para mejorar la neuropatía la descompresión tiene que hacerse en el tercio posterior de la órbita y lo más próxima al anillo de Zinn (etmoides posterior).
La alteración de las reacciones fotomotoras (reflejo paradójico de Marcus-Gunn) es otro dato clínico a tener en cuenta en caso de evaluación de neuropatía óptica (casos muy graves). En casos de exoftalmía moderada o grave, un posible hallazgo funduscópico, junto con las alteraciones papilares y del árbol venoso, son los pliegues retinocoroideos por compresión directa del polo posterior.
Cuadros clínicos
Oftalmopatía no infiltrante
Los síntomas son discretos: retracción palpebral, asinergia oculomotora, mirada fija, etc. Estos síntomas pueden involucionar al ser tratada la enfermedad general e incluso espontáneamente en los meses siguientes tras conseguir el estado eutiroideo en los pacientes.
No existe apenas patología muscular, aunque pueden tener un discreto engrosamiento muscular en el scanner. Existe la posibilidad, dado lo inicial del cuadro, de que aparezca mejoría espontánea dentro de los 6 primeros meses de evolución.
Oftalmopatía infiltrante
Puede afectar a las estructuras que se encuentran dentro de la cavidad orbitaria, esto es, la musculatura ocular extrínseca y los tejidos blandos, siendo de especial gravedad el desarrollo del denominado síndrome del vértice orbitario.
Miopatía
Cuando los pacientes tienen alteraciones en los músculos por inflamación, edema y posterior fibrosis, se producen trastornos de la fusión de imágenes, con aparición de diplopia. Puede aparecer espontáneamente, más acentuada por la mañana, mejorando a lo largo del día, debido al intento de fusión que hace y que no siempre consigue.
El músculo recto inferior es el más afectado, seguido del recto interno, recto superior y recto lateral. La miopatía se asocia también a trastornos en el resto de los tejidos orbitaros con edema, inflamación, etc. El cuadro clínico va progresando y se origina quemosis, congestión y dolor al realizar los movimientos oculares, e incluso puede terminar en una oftalmoplegía dolorosa (10-15%). En el scanner, el engrosamiento muscular tiene una incidencia que oscila entre un 60 y 95% de los pacientes. La limitación de la mirada hacia arriba es 4 veces más frecuente que en otras versiones. No es infrecuente la asociación de hipertiroidismo con la miastenia Graves.
Tejidos blandos orbitarios
El ataque y la afectación de los tejidos blandos se produce de manera subaguda o crónica. Puede durar meses y puede ser intermitente y variable en su evolución. El edema palpebral, quemosis, congestión venosa, lagrimeo e inflamación y aumento de volumen de las glándulas lagrimales van a producir malestar y disconfort. Los pacientes se encuentran peor por la mañana y van mejorando a lo largo del día. La fotofobia es continua y los trastornos de drenaje venoso por engrosamiento de los músculos pueden desencadenar un cuadro de congestión orbitaria.
Síndrome del ápex orbitario
La hipertensión que se produce en el ápex por incremento de volumen en los músculos y tejidos blandos va a originar un verdadero síndrome compresivo a nivel del vértice orbitario (también llamado Crowded orbital apex síndrome en la literatura anglosajona). Se produce en un 5-6% de los pacientes con oftalmopatía de Graves con buena visión previa, perdiéndola progresiva o rápidamente. Raramente se produce neuropatía en ausencia de signos congestivos11. En fondo de ojo aparece edema de papila en un 25-30% de casos, y palidez papilar en un 10-20%. Hallin y Feldon12 estudiaron un grupo de pacientes con neuropatía previa a la descompresión, y mostraron pérdida de visión en el 72% de los casos, defectos campimétricos en el 80%, y alteración en los colores en el 80%.
Clasificación
Uno de los principales retos para enfocar la orbitopatía tiroidea es cómo clasificar y graduar sus distintas manifestaciones clínicas. En las pasadas décadas se han descrito numerosas clasificaciones, como la clasificación NO SPECS de Werner13,14, la clasificación de Bahn y Gorman basada en la medición de criterios objetivos y reproducibles15, y las clasificación de Mourits para la cuantificación de la actividad presente en las fases inflamatorias de la enfermedad16.
Nosotros recomendamos para la evaluación clínica de esta patología la clasificación VISA desarrollada por el grupo dirigido por Dolman y Rootman, basada en el registro de los cambios clínicos, con el fin de poder adecuar correctamente el tratamiento17. Nos ayuda, asimismo, en cuanto a la predicción de severidad en la fase inflamatoria, una buena anamnesis, haciendo especial hincapié la fecha y el intervalo de tiempo entre el establecimiento de la enfermedad sistémica y la orbitaria.
Esta clasificación se basa en los cuatro puntos cardinales de la enfermedad, de ahí, el acrónimo en inglés V-I-S-A (Vision, Inflammation, Strabismus y Appearance/Exposure).
Visión
Valoramos en este apartado, especialmente la presencia y/o el grado de neuropatía que pudiera presentar el paciente. La forma de monitorizar la evolución consisten en toma de agudeza visual de lejos, reflejo fotomotor, estudio de la función visual cromática mediante el test de Ishihara, estudio de la papila y sólo en casos de sospecha clínica, la práctica de TAC para descartar la presencia de un síndrome del ápex orbitario. La aparición de signos de neuropatía óptica indicará la necesidad urgente de tratamiento con altas dosis intravenosas de corticoides, radioterapia y descompresión orbitaria quirúrgica.
Inflamación
Entre los síntomas de inflamación de tejidos blandos orbitarios aparecen el dolor en reposo o con los movimientos, el edema palpebral o conjuntival y la hiperemia.
Nos resulta útil la siguiente clasificación UBC por permitirnos cuantificar el grado de inflamación y aportar reproducibilidad intra e inter-observador (Tabla 1).
En esta clasificación no se tiene en cuenta el edema de carúncula como un signo independiente, ya que se considera un grado de quemosis. Así, la quemosis se puntúa como 1 si llega a la línea gris del párpado, y 2 si la sobrepasa. El edema palpebral se puntúa como 1 si está presente, pero no produce redundancia cutánea, y 2 si aparecen pliegues en la piel de los párpados.
La actitud terapéutica variará en función del grado de inflamación y la evidencia de progresión. Si la puntuación total es menor de 4/8 y no hay evidencias de empeoramiento clínico, tomaremos una actitud conservadora con compresas frías, medidas posturales, colocando la cabecera de la cama elevada, y antiinflamatorios no esteroideos. En cambio, si el grado de inflamación es ≥ 5, o si hay evidencia objetiva/subjetiva de progresión inflamatoria, deberíamos ofrecer terapias más agresivas, incluyendo corticoides intravenosos, inmunosupresores, o radioterapia.
Estrabismo
Los síntomas a evaluar en el apartado de estrabismo incluyen la progresión de un estado de no-diplopía, diplopía con movimientos horizontales o verticales y la presencia de diplopía en posición primaria de la mirada.
Existen distintas modalidades de evaluación del grado de estrabismo, como son el reflejo de Hirschberg, el test de Cover corregido con prismas y el test de Hess-Lancaster.
En general, se adopta una actitud conservadora para el manejo de la diplopía en fases activas de la enfermedad, como es el uso de oclusiones o prismas ajustables en gafa para corrección óptica (Fresnel).
Sin embargo, cuando no se evidencia inflamación y la enfermedad se encuentra en situación estable, se puede recurrir a correcciones más definitivas mediante prismas, o a la cirugía del estrabismo.
Aspecto/Exposición
En este apartado incluimos síntomas como la proptosis ocular, retracción palpebral, el engrosamiento de paquetes de grasa preaponeurótica, y los síntomas derivados de la exposición como son la sensación de cuerpo extraño, fotofobia, sequedad ocular y lagrimeo secundario.
Existen formas objetivas de cuantificación, como son los milímetros de retracción palpebral, la proptosis en milímetros mediante la exoftalmometría de Hertel. También es útil documentar la presencia o no de pliegues cutáneos redundantes, de herniación de grasa orbitaria y la presencia de tinción corneal por desepitelización.
Estos signos y síntomas pueden hacernos adoptar distintas actitudes terapéuticas según la fase de actividad frente a la que nos encontremos. En fases inflamatorias, se tenderán a emplear lágrimas artificiales y pomadas lubricantes, y en raras ocasiones será precisa la práctica de tarsorrafias o descompresiones orbitarias urgentes ante severas úlceras corneales secundarias a la exposición. Una vez que la fase inflamatoria aguda se ha resuelto y nos encontremos ante una situación estable, el manejo de la proptosis incluiría técnicas quirúrgicas como la descompresión orbitaria (Figs. 3-6), cirugía de la retracción palpebral mediante müllerectomía o plastias de elongación palpebral mediante materiales espaciadores. Asimismo, en esta fase no debemos olvidar el empleo de agentes lubricantes para la superficie ocular.



Pruebas complementarias en la oftalmopatía tiroidea
A pesar de la importancia del diagnóstico clínico, distintas pruebas de imagen permiten descartar patologías que forman parte del diagnóstico diferencial con la oftalmopatía tiroidea, y apoyan en la confirmación diagnóstica.
Ecografía
La ultrasonografía es un método no invasivo válido para descartar la presencia de tumores orbitarios y para evaluar la ecogenicidad interna de los músculos extraoculares y la grasa orbitarias. Es aconsejable el uso de ecografía bidimensional en modo A.
Se detecta un engrosamiento del músculo en su vientre mientras la inserción escleral apenas se modifica. Se ha hipotetizado que la reflectividad interna de las ondas sería baja en pacientes con enfermedad activa, debido al edema muscular, y alta e irregular en enfermedad ocular inactiva debido a la fibrosis muscular. No es infrecuente la asociación de una escleritis que aparece como un anillo rodeando al nervio óptico (forma de letra T), lo que indica exudación dentro de la cápsula de Tenon. La principal ventaja de la ultrasonografía modo-A es debida a ser una técnica no invasiva, muy accesible para cualquier oftalmólogo, pero, sin embargo, no es tan efectiva como el TC si no hay gran experiencia y además, no aporta buenas imágenes del tercio posterior de la órbita, por la pérdida de respuesta ecogénica que se va produciendo a través de los tejidos (atenuación), así como su difícil acceso para evaluar el músculo recto inferior (el más frecuentemente afectado) y su escasa reproducibilidad.
Las imágenes ultrasónicas de la oftalmopatía con componente muscular mostrarán engrosamiento de los músculos rectos inferiores, internos y superiores y del elevador. Con menor frecuencia oblícuos y rectos laterales. Cuando hay engrosamiento muscular también puede aparecer incremento de volumen de grasa, con lo que aparece una imagen ecográfica orbitaria mayor de lo normal.
La oftalmopatía infiltrativa de la grasa da lugar a un aumento de volumen de los espacios extracónico y preseptal, que puede ponerse de manifiesto en modos A y B. La infiltración celular en los tabiques conectivos de la grasa refuerzan las interfases acústicas del tejido adiposo, que aparece más heterogénico y con media-alta reflectividad interna. La inserción escleral de los músculos extraoculares aparece de grosor normal, en contraste con una porción ventral muy engrosada, dándole al músculo una típica configuración fusiforme (oftalmopatía infiltrativa muscular).
No es infrecuente la aparición de una glándula lagrimal de mayor tamaño o una vena oftálmica superior más ancha o dilatada por el edema originando en el apex al incrementar la compresión, lo cual también puede producir engrosamiento de las vainas del nervio por la mayor presencia de líquido cefalorraquídeo.
Tomografía computarizada
La tomografía computarizada (TC) y los ultrasonidos son técnicas diagnósticas complementarias que han revolucionado la exploración y la evaluación de la exoftalmía al mismo tiempo que muestran imágenes claras que eliminan la necesidad de hacer biopsia orbitaria. El scanner diferencia los tejidos normales de las estructuras patológicas al mostrar imágenes de diferentes densidades. La grasa orbitaria tiene densidad negativa (-80 a -100 NHU), los músculos y nervio óptico densidad positiva (+20 +45 NHU), debido a esto, no es necesario utilizar habitualmente inyecciones de contraste en la exploración de exoftalmos endocrino, pues no nos aportan información adicional (la inyección de contraste sólo muestra hipervascularización muscular).
El estudio de TC en la oftalmopatía tiroidea se practica en cortes axiales secuenciados cada 3-5 mm, y coronales cada 5 mm desde el párpado hasta el seno esfenoidal utilizando el plano de centrado de Salvolini-Cabanis (cuadro neuroocular).
Los hallazgos que aparecen en la TAC son característicos: exoftalmos, engrosamiento del vientre muscular, compresión del nervio óptico a nivel del vértice orbitario por músculos engrosados que originan la neuropatía, abombamiento óseo de las paredes etmoidales en oftalmopatías de larga evolución, imágenes pseudotumorales en el tercio posterior de la órbita producidas por el músculo recto inferior engrosado (aparece esta imagen cuando en la TC no está bien centrado el plano neuro-ocular). En los cortes axiales, se aprecia incremento de volumen de grasa e imágenes de atrofia dentro del músculo en cuadros de larga evolución (señal hipodensa dentro del músculo, que corresponden a acúmulos de linfocitos o depósitos de mucopolisacáridos según Rootman)18. Además de lo expuesto, la TAC excluye la presencia de tumor en la órbita y aporta información para elegir el tratamiento apropiado ya sea médico o quirúrgico5.
Algunos autores no consideran necesaria la práctica sistematizada de una exploración TC en todos los pacientes afectos de una oftalmopatía de Graves, puesto que la bilateralidad y el aspecto clínico, a menudo no ofrecen duda diagnóstica. Existen distintas razones que lo hacen, sin embargo, útil. En primer lugar por un motivo médico-legal, puesto que da un soporte a nuestro diagnóstico y en segundo lugar, es necesaria en aquellos casos en los que, aún conociendo el diagnóstico de la enfermedad de Graves, el proceso orbitario se presenta con una clínica da gran asimetría, pobreza de signos, y pérdida de visión (neuropatía). En tercer lugar, si se va a plantear una descompresión orbitaria, es imprescindible la práctica en el preoperatorio de un estudio TC en proyecciones axial y coronal, de manera que el cirujano obtenga una buena visión espacial de las áreas que va a descomprimir y que serán ocupadas por los tejidos orbitarios.
El trastorno del retorno venoso y la oftalmopatía infiltrativa producen: un aumento de volumen de los compartimentos grasos preseptal y extracónico, conservando valores de densidad normal (-80 a -110 NHU), engrosamiento homogéneo de las glándulas lagrimales y de la musculatura extrínseca. En los casos más graves de neuropatía óptica, el cono muscular (en cortes coronales posteriores), se asemeja una gran masa tumoral que engloba al nervio óptico y simula un tumor5,18,19. En casos de muy larga evolución (oftalmopatía restrictiva), la fibrosis de los haces musculares degenera en un proceso de necrosis en el vientre muscular, manifestándose en estos casos como áreas de hipodensidad e incluso con ocasionales focos de calcificación distrófica. En la oftalmopatía infiltrativa de larga evolución, los músculos aparecen engrosados de forma más marcada en su porción ventral, lo cual puede producir, en el caso de ambos rectos, una excavación sin osteolisis de las paredes orbitarias internas. El macizo nasoetmoidal, en cortes axiales, adquiere una silueta muy semejante a la que tienen las botellas de Coca-Cola (según la literatura americana).
Por fin, el aumento de volumen de todo el contenido orbitario proyecta el globo en sentido anterior, estirando al nervio óptico. Éste, dependiendo del grado de exoftalmía, pierde su trayectoria sinuosa apareciendo estirado y engrosado por acumulación de líquido en el espacio subaracnoideo. Este dato es más marcado en su porción apical, exactamente donde sufre de la compresión muscular por ensanchamiento de los músculos al insertarse en el vértice. La acumulación de líquido no ocasiona, sin embargo, cambios en la densidad radiológica del nervio (puesto que, ya existe normalmente líquido cefalorraquídeo en el interior de las vainas). El engrosamiento de los músculos en el ápex también puede producir compresión del nervio óptico con papila normal.
En nuestra experiencia, casi el 90% de los pacientes tiroideos estudiados en el TC muestran anormalidades. Entre el 70 y 75% tienen afectación muscular, con mayor incidencia del recto inferior y después del recto interno. No es infrecuente el engrosamiento del bloque que corresponde al músculo recto superior y elevador del párpado.
En un estudio hecho por Enzmann19 en 116 pacientes, el músculo recto inferior aparecía afectado en el 80% de los casos, el recto interno en el 75% y el recto superior y lateral en el 50%. El músculo recto inferior era el único músculo afectado en el 10%. En los exoftalmos clínicamente unilaterales, el 50% tenían en el TC signos de bilateralidad, mientras que Trokel y Hilal20 encontraban un 95% de bilateralidad en el TC de los pacientes con manifestaciones clínicas unilaterales.
Generalmente, en la oftalmopatía infiltrativa el grado de exoftalmía guarda relación con el engrosamiento de los músculos, que pueden alcanzar hasta 6 veces su diámetro original. En la oftalmopatía no infiltrativa, hay más incremento de volumen de grasa que engrosamiento muscular. La glándula lagrimal se afecta con mayor frecuencia en la forma infiltrativa.
Si el retorno venoso está comprometido, la vena oftálmica superior se observa con un diámetro muy superior al normal en cortes axiales y coronales.
Resonancia magnética
No presenta ventajas importantes frente a la tomografía para el diagnóstico de oftalmopatía tiroidea, aunque si se considera que permite discriminar entre edema y fibrosis, obteniéndose un mayor tiempo de relajación en secuencias T2 debido al alto contenido de agua de los tejidos. Se considera, asimismo, que la RMN presenta mayor sensibilidad para el diagnóstico en las fases inactivas de la enfermedad que las fases activas edematosas. Entre sus ventajas están la ausencia de radiación ionizante y la capacidad para delimitar estructuras orbitarias. Sus principales desventajas son el elevado coste, así como una menor disponibilidad y la mala calidad de imágenes para el estudio de la pared ósea etmoidal (excavada o descomprimida) puesto que la resonancia no define el hueso21.
Puede ser interesante su utilización para el diagnóstico difererencial ante una miositis inflamatoria no tiroidea al mostrar ésta, hiposeñal evidente en T2.
Inmunoglobulinas estimulantes de tiroides
El receptor de TSH es un autoantígeno potencial en la oftalmopatía de Graves, y los anticuerpos contra el receptor de TSH pueden desempeñar un papel importante en la inmunopatogénesis de la enfermedad ocular. Algunos, pero no todos los estudios al respecto, muestran una relación directa entre la concentración sérica de los anticuerpos contra el receptor de TSH y la severidad de la enfermedad ocular.
Bibliografía
1. Char DH. The ophthalmopathy of Graves disease. Med Clin North Am 1991; 75: 97-119. [ Links ]
2. Mourits M. Zur Pathogence der endokrinen orbitopathie (conferencia). ESOPRS. Rostock (Alemania) 1995. [ Links ]
3. Gorman CA. Temporal relationship between onset of Grave´s ophtalmopathy and diagnosis of thyrotoxicosis. Mayo Clin Proc 1983; 58: 1515-1519. [ Links ]
4. Char DH. Thyroid eye disease. New York. Ch. Livingstone. 2ª ed. 1990: 35-85. [ Links ]
5. Char DH. Clinical ocular oncology. New York. Ch. Livingstone 1989: 297-302. [ Links ]
6. Werner SC. Ocular manifestations. En: Werner SC, Ingbar SH. The Thyroid. A Fundamental and Clinical Text. New York: Harper & Row 3ª ed. 1971: 528. [ Links ]
7. Rootman J, Patel S, Berry K, Nugent R. Pathological and clinical study of Muller´s muscle in Graves´ ophthalmopathy. Can J Ophthalmol 1987; 22: 32-36. [ Links ]
8. Pérez Moreiras JV, Prada Sánchez MC, Coloma J, Prats J, Adenis JP, Rodríguez F et al. Oftalmopatía distirioidea. En: Pérez Moreiras JV, Prada Sánchez C. Patología orbitaria. Exploración, diagnóstico y cirugía. Barcelona: Edika Med 2002; 2: 940-990. [ Links ]
9. Kendall-Taylor P. The pathogenesis of Grave´s ophthalmopathy. Clin Endocrinol Metab 1985; 14: 331-349. [ Links ]
10. Wiersinga WM, Smit T, Van Der Gaag R, Kornneef L. Clinical presentation of Grave´s ophthalmopathy. Ophthalmic Res 1989; 21: 73-82. [ Links ]
11. Neigel JM, Rootman J, Belkin RI, Nugent RA, Drance SM, Beattie CW et al. Disthyroid optic neuropathy. The crowded orbital apex syndrome. Ophthalmology 1998; 95: 1515-1521. [ Links ]
12. Hallin ES, Feldon SE, Luttrell J. Graves ophthalmopathy: III. Effect of transantral orbital decompression on optic neuropathy. Br J Ophthalmol 1988; 72: 683-687. [ Links ]
13. Werner SC. Modification of the classification of the eye changes of graves disease; recomendations of the ad-hoc commite of the American thyroid Association. J Clin Endocrind Metab 1977; 44: 203-204. [ Links ]
14. Wiersinga WM. Classification of eye changes of Grave´s disease. Thyroid 1992; 2: 235-236. [ Links ]
15. Bahn RS, Garrity JA, Bartley GB, Gorman CA. Diagnostic evaluation of Graves ophthalmopathy. Endocrinol Metab Clin North Am 1988; 17: 527-545. [ Links ]
16. Mourits MP, Hooruneef L, Wiersinga WM, Prummel MF, Berghont A, Van Der Gaag R. Clinical criteria for the assesment of disease activity in Graves ophthalmopathy: a novel approach. Br J Ophtalmol 1989; 73: 639-644. [ Links ]
17. Rootman J. Thyroid orbitopathy. En: Orbital disease. Present status and future challenges. Taylor & Francis 2005: 147-310. [ Links ]
18. Moseley I, Sanders M. Diseases of the orbit. En: Computerized tomography in neuroophthalmology. Chapman and Hall. 1982: 20-28. [ Links ]
19. Enzmann DR, Donaldson SS, Kriss JP. Appearance of Graves disease on orbital computed tomography. J Comput Assist Tomogr 1979; 3: 815-819. [ Links ]
20. Trokel SL, Hilal SK. Recognition and differential diagnosis of enlarged extraocular muscles in computed tomography. Am J Ophthalmol 1979; 87: 503. [ Links ]
21. Sato M, Hiromatsu Y, Tanaka K, Novaka K. Role of magnetic resonance imaging in thyroid associated ophtalmopathy. Prediction of therapeutic outcome of active eye disease. Thyroid 1992; 2: 299-305. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Unidad de Órbita y Oculoplástica.
Servicio de Oftalmología. Hospital de Cruces
Plaza de Cruces s/n
48903 Cruces. Baracaldo. Vizcaya