INTRODUCCIÓN
La anemia aparece en cerca del 50% de los pacientes con cáncer en algún momento de la evolución de la enfermedad o del tratamiento, siendo la complicación hematológica más frecuente observada en estos pacientes1. Sin embargo, la anemia como síndrome paraneoplásico es mucho más infrecuente y, en la mayoría de las ocasiones, se asocia a neoplasias linfoproliferativas2.
Presentamos un caso de anemia hemolítica paraneoplásica asociada a un cáncer de próstata localizado, con buena respuesta al tratamiento esteroideo y permitiendo la continuidad del tratamiento oncológico hasta su finalización. Si bien hay dos casos descritos en la literatura de anemia hemolítica autoinmune (como síndrome de Evans) asociados a cáncer de próstata3,4, ambos han sido diagnosticados en enfermedad metastásica avanzada por lo que, en nuestro conocimiento, este caso de anemia hemolítica paraneoplásica asociada a un estadio precoz de cáncer de próstata constituye la primera descripción en la literatura.
CASO CLÍNICO
Paciente varón de 71 años, exfumador, no bebedor, sin antecedentes clinicos de interés, remitido a la consulta de urología por su médico de Atención Primaria (MAP) en julio de 2021 por hematuria, prostatismo y valores elevados de antígeno prostático específico (PSA, 60 ng/mL; valor normal, VN: 0-4 ng/mL).
La ecografía mostró una vejiga con sospecha de lesión tumoral de 0,8 cm en el fondo vesical y una próstata de características ecográficas normales. Posteriormente, se realizó una cistoscopia que mostró la presencia en el fondo de la vejiga de un tumor sésil de unos 2,5 cm, que fue intervenido mediante resección transuretral (RTU) a principios de septiembre. El diagnóstico anatomopatológico de la tumoración en localización anterior y lateral izquierda fue de carcinoma papilar infiltrante de alto grado (grado 3) que no alcanzaba la muscular propia (pT1). Se completó el tratamiento con instilaciones intravesicales de bacilo de Calmette y Guérin (BCG), semanalmente durante las seis primeras semanas y mensualmente durante un año.
En septiembre de 2021 se biopsiaron ambos lóbulos prostáticos, con diagnóstico de adenocarcinoma de próstata estadio cT1cN0cM0, Gleason 7 (3+4 en el lóbulo izquierdo, 4+3 en el derecho), observándose la presencia de infiltración perineural bilateral. El estudio de extensión se completó con una tomografía axial computarizada (TAC) tóraco-abdominal y una gammagrafía ósea, que fueron normales. Durante el mismo mes comenzó tratamiento hormonal con bloqueo androgénico con triptorelina semestral. El paciente optó por tratamiento conservador por lo que fue enviado al servicio de Oncología Radioterápica donde, tras descartar tratamiento con braquiterapia por el elevado volumen prostático, se planificó el tratamiento radioterápico basado en tres fases hasta alcanzar un total de 78 Gy sobre la próstata, 54 Gy sobre las vesículas seminales, y 44 Gy sobre los ganglios pélvicos (ilíacos internos, ilíacos externos, presacros y obturatrices).
En febrero de 2022, a mitad del tratamiento radioterápico, el paciente ingresó por debilidad general y anemia. Refería astenia de unos diez días de evolución, con disnea de mínimos esfuerzos. No presentaba dolor torácico ni palpitaciones, únicamente mareo ortostático.
La exploración física evidenció un buen estado general a pesar de que el paciente, algo ictérico, mostraba palidez marcada; la auscultación cardiopulmonar y la exploración abdominal fueron normales. El hemograma mostró valores bajos de hematíes (0,9/mm3, VN: 4,5-5,9), hemoglobina (4 g/dL; VN: 13-17,5) y linfocitos (0,4/mm3), valor aumentado de volumen corpuscular medio (VCM) (138,5 fL; VN: 80-100), y valores normales de leucocitos, neutrófilos, plaquetas y tiempo de protrombina. Destacaba un índice de reticulocitos muy elevado (14,9%, VN: 0,4-2).
El resto de la analítica sanguínea mostró unas cifras elevadas de bilirrubina indirecta (6,6 mg/dL; VN: 0,2-1,2 mg/dL) y de lactato deshidrogenasa (LDH) (269 U/L; VN: 140 a 280) y reducidas de haptoglobina (<8 mg/dL). Los niveles de vitamina B12 y de ácido fólico, así como el resto de parámetros bioquímicos, estaban dentro de límites normales.
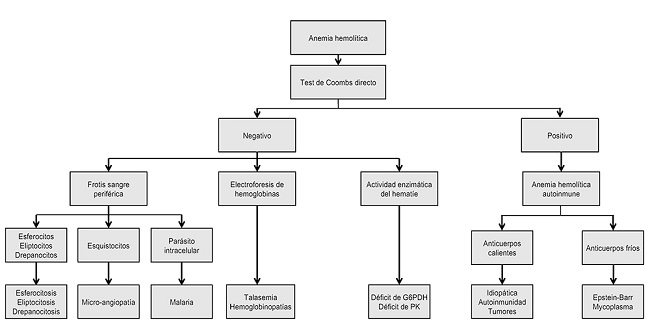
Por tanto, nos encontramos ante un paciente con un cáncer de próstata en tratamiento oncológico con radioterapia y bloqueo androgénico, asociado a una intensa anemia macrocítica (grado 4 según la Common Terminology Criteria for Adverse Events, CTCAE, v5.0) (Fig. 1). Tras revisar sus antecedentes clínicos, se descartaron causas como alcoholismo o hepatopatía. Siguiendo el algoritmo diagnóstico de las anemias hemolíticas (Fig. 2) se solicitó un test de Coombs directo que resultó fuertemente positivo (++++/++++) por lo que se estableció el diagnóstico de anemia hemolítica autoinmune (AHAI) IgG-C3d por anticuerpos calientes como síndrome paraneoplásico del adenocarcinoma de próstata.
El paciente comenzó el tratamiento habitual (prednisona 1 mg/Kg/día con pauta descendente) supervisado por Hematología. La analítica sanguínea mostró una buena respuesta (hemoglobina: 11,5 g/dL, reticulocitos: 4 %, bilirrubina: 1,4 mg/dL, LDH: 205 U/L, y haptoglobina normal) mantenida en el tiempo, por lo que el tratamiento fue suspendido en julio de 2022.
DISCUSIÓN
Los síndromes paraneoplásicos son un conjunto de síntomas que aparecen en localizaciones alejadas de un tumor o de sus metástasis y, por tanto, no atribuibles a su efecto directo. Aunque los primeros fueron descritos hace más de 100 años5, el conocimiento de su etiopatogenia es mucho más reciente; sus síntomas pueden ser secundarios a sustancias secretadas por el tumor (péptidos, hormonas, citoquinas) o a anticuerpos dirigidos contra tejido tumoral que presenta reacción cruzada con otros tejidos normales6,7.
En general, la anemia relacionada con el cáncer es un problema multifactorial en el que están implicados componentes inmunitarios, nutricionales y metabólicos que pueden afectar a su gravedad.
En nuestro caso se descartó que la AHAI estuviera en relación con el tratamiento radioterápico, ya que la anemia se detectó antes de iniciarlo. Tras revisar los tratamientos del paciente, también se descartó su asociación con el tratamiento hormonal o con el resto de medicación; no obstante, se cambió la medicación hormonal por otra con similar mecanismo de acción y actividad.
En la valoración de las causas de anemia en paciente con cáncer deben considerarse tres situaciones:
Sangrado (anemia por pérdidas sanguíneas),
Descenso de la producción de hematíes o anemia arregenerativa, que incluye la anemia de la enfermedad crónica8 y la aplasia pura de células rojas9.
-
Aumento de la destrucción de hematíes o anemia regenerativa, que incluye la AHAI, la anemia hemolítica microangiopática (AHMA) y el síndrome hemofagocítico, según la causa de la hemólisis:
-
- En la AHAI la destrucción de hematíes se produce por células del sistema inmune mediada por anticuerpos dirigidos contra antígenos de los hematíes del paciente10. Se caracteriza por la presencia de inmunoglobulina (IgG, IgA, IgM) o complemento (C3d) en la superficie de los hematíes circulantes11, demostrado por la positividad del test de Coombs directo, presencia de policromasia en la extensión de sangre periférica, reticulocitosis y datos bioquímicos de hemólisis (aumento de LDH y bilirrubina indirecta junto con el descenso de la haptoglobina), como se observó en el caso presentado. Según el rango térmico del autoanticuerpo, las AHAI se clasifican en por anticuerpos calientes y por aglutininas frías11. El paciente del presente caso mostró AHAI por anticuerpos calientes.
La AHAI paraneoplásica puede aparecer en cualquier momento durante el curso de la enfermedad, y no es un factor pronóstico adverso11. Aunque su incidencia es mayor en los síndromes linfoproliferativos, también se ha asociado a otros tumores como carcinomas de células escamosas, adenocarcinomas (como en el caso presentado), mieloma múltiple, o síndrome mielodisplásico10,11. Aunque el tratamiento de la neoplasia puede resolver la anemia, en general es necesario el tratamiento específico de la anemia con inmunosupresores (esteroides como en el caso de nuestro paciente, ciclosporina, etc.). La mayoría de las AHAI asociadas a tumores son producidas por anticuerpos calientes; las AHAI por aglutininas frías pueden utilizar su concentración plasmática como marcador tumoral12, ya que las aglutininas resultan de la proliferación neoplásica; la principal recomendación terapéutica consiste en evitar el frío y, en general, los corticoides son inefectivos13.
- En la AHMA la fragmentación de eritrocitos es resultado de lesiones microvasculares14; cuando se asocia al cáncer es un tipo de microangiopatía secundaria que puede deberse al propio tumor o a los tratamientos, y que tiene en general mal pronóstico15. Cursa con anemia hemolítica, Coombs directo negativo, trombopenia, datos bioquímicos de hemólisis (aumento de LDH y bilirrubina indirecta, y descenso de haptoglobina) y es característica la presencia de esquistocitos (fragmentos de hematíes) en la extensión de sangre periférica16. Los tumores sólidos más frecuentemente implicados con la AHM son los adenocarcinomas mucinosos: gástrico, mama, páncreas, próstata y pulmón17.
- El síndrome hemofagocítico es una enfermedad poco frecuente que se produce por la activación descontrolada del sistema inmune18; puede ser primario (causado por una mutación genética) o secundario (relacionado con infecciones, especialmente por el virus Epstein Barr); también puede ser debido a enfermedades reumatológicas o a neoplasias.
-
En conclusión, las anemias hemolíticas asociadas al cáncer constituyen síndromes paraneoplásicos hematológicos poco frecuentes pero que pueden aparecer en cualquier tumor sólido o, más frecuentemente, en síndromes linfoproliferativos. En nuestro caso, la asociación de una AHAI por anticuerpos calientes y cáncer de próstata y vejiga localizados constituye el primer caso descrito hasta la fecha en la literatura.