Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Pediatría Atención Primaria
versión impresa ISSN 1139-7632
Rev Pediatr Aten Primaria vol.16 no.63 Madrid jul./sep. 2014
https://dx.doi.org/10.4321/S1139-76322014000400012
El comportamiento fetal: una ventana al neurodesarrollo y al diagnóstico temprano
Fetal behavior: a window to neurodevelopment and early diagnosis
J. Cabanyes Truffino
Departamento de Neurología. Clínica Universidad de Navarra. Madrid. España.
Dirección para correspondencia
RESUMEN
La evaluación neurológica del feto es una medida necesaria para el seguimiento del embarazo y la identificación temprana de patologías. La introducción de técnicas de mayor resolución espacial y temporal, particularmente la ecografía en tres y cuatro dimensiones, está aportando interesantes conocimientos sobre el comportamiento fetal (CF) y su estrecha relación con el neurodesarrollo. A su vez, diferentes factores, intra- y extrauterinos, pueden inducir respuestas del feto que tienen consecuencias inmediatas y conforman una predisposición futura definida como programación fetal. En consecuencia, el estudio del CF representa una ventana abierta al diagnóstico temprano y hacia un atractivo y prometedor campo de conocimiento: el neurodesarrollo.
Palabras clave: Comportamiento fetal. Neurodesarrollo. Programación fetal. Ecografía 4D.
ABSTRACT
The neurological assessment of the fetus is a necessary measure to monitor the pregnancy and early identification of diseases. The introduction of techniques for greater spatial and temporal resolution, particularly ultrasound in three (3D) and four dimensions (4D), is providing interesting insights into the behavior of the fetus and its close relationship with neurodevelopment. In turn, several factors can induce fetal responses that have immediate consequences and further comprise a predisposition defined as fetal programming. Consequently, the study of fetal behavior represents a window on the early diagnosis and to an attractive and promising field of knowledge: neurodevelopment.
Key words: Fetal behavior. Neurodevelopment. Fetal programming. 4D ultrasonography.
Introducción
En 2004, Legido et al.1 realizaron una interesante revisión de la evaluación neurológica del feto en la que describieron las formas de realizarla y las técnicas complementarias, al tiempo que mostraban un nuevo campo de estudio y actuación.
Durante muchos años, la ecografía bidimensional ha sido la técnica de evaluación más accesible e inocua, aunque la calidad de las imágenes era limitada. La ecografía en tres dimensiones (E3D) ha mejorado notablemente la obtención de información estructural y la asociación de la variable tiempo, en la llamada ecografía en cuatro dimensiones (E4D), está suponiendo una revolución en el conocimiento de los aspectos dinámicos del feto. Si bien la E4D no es auténticamente en tiempo real y no logra identificar movimientos fetales breves (de menos de dos segundos), tiene suficiente resolución temporal para detectarlos desde antes de la semana 20 de gestación2. De este modo, se están sentando las bases de un nuevo campo de conocimiento denominado comportamiento fetal (CF).
El CF ha quedado definido como el patrón de movimientos del feto, incluyendo tanto los movimeintos espontáneos como los que son respuesta a estímulos3. A su vez, estos movimientos -el CF- están vinculados con el neurodesarrollo y son indicadores de una cierta predisposición para un amplio espectro de manifestaciones futuras4.
Programación fetal
El concepto de programación fetal (PF)5 representa la inducción de respuestas fetales, por el entorno uterino, que condicionan cambios, estructurales y funcionales, en el propio feto con repercusiones a corto y largo plazo. Durante toda la gestación, el feto mantiene una continua interacción con el entorno uterino que, a su vez, actúa como catalizador de factores ambientales. Esta compleja dinámica se lleva a cabo a través de un enorme abanico de factores psicobiológicos con manifestaciones inmediatas y en el futuro6.
En la PF parecen intervenir factores genéticos del feto (genes relacionados con el desarrollo y cambios epigenéticos en la regulación de los genes), los sistemas endocrino e inmunitario maternos y fetales, y una gran variedad de posibles noxas (gérmenes, hipoxia, hiperglucemia, hipotiroidismo, alcohol, tabaco, drogas, tóxicos, fármacos, etc.)7. Estas noxas actúan, directa e indirectamente, a nivel molecular y celular, alterando el neurodesarrollo e induciendo una configuración cerebral vulnerable8. De este modo, las respuestas fetales a estímulos tempranos van estableciendo una protección o vulnerabilidad ante determinados factores, o bien modulan la expresión futura en cuestiones tan diversas como las repercusiones de la hipercolesterolemia, la sobrecarga de estrés o el sistema de señalización serotoninérgica9.
Numerosas evidencias señalan que algunos procesos implicados en el desarrollo de funciones neuropsicológicas complejas se inician mucho antes del nacimiento y conforman una predisposición a determinadas estrategias de aprendizaje, sistemas de autocontrol, recursos de interacción, modos de control de las emociones y de obtención de gratificaciones y estilos de afrontamiento que conformarán su fenotipo10.
En consecuencia, algunas de las manifestaciones observadas tras el nacimiento (es decir, congénitas, tanto temperamentales como patológicas) no son simplemente genéticas, sino fruto de una compleja programación temprana que pone de manifiesto las repercusiones a medio-largo plazo de las situaciones presentes.
Movimientos fetales
Entre la tercera y la octava semanas de gestación, a partir de la placa neural, se desarrolla el sistema nervioso siguiendo un complejo proceso de diferenciación celular, migración neuronal, muerte neuronal programada, sinaptogénesis y mielinización, que es consecuencia de la interacción entre factores genéticos y microambientales.
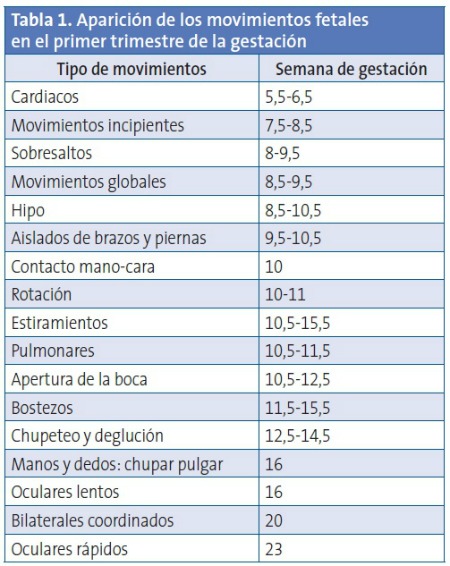
Poco antes de la séptima semana de gestación, el primitivo corazón, constituido por una única cámara, comienza a bombear sangre, al tiempo que la E4D identifica movimientos vermiculares del embrión. A partir de entonces, y hasta el momento del parto, en correlación con la edad gestacional, se observa una progresiva complejidad y una mayor elaboración de los movimientos fetales (Tabla 1), que están estrechamente vinculados con el neurodesarrollo y con los factores ambientales11. Así, a partir de la semana diez, se identifican movimientos de las extremidades y, desde la semana 11, estos movimientos se van haciendo más finos y complejos y comienzan a verse movimientos faciales11.
Los movimientos del embrión son expresión de su neurodesarrollo, si bien los primeros en observarse son poco específicos y tienen carácter automático. De hecho, a partir de la semana 7,5 de gestación, se identifican respuestas reflejas con un patrón de movimiento global. Estos movimientos tienen su origen en las primitivas estructuras espinales y mesencefálicas. Progresivamente, se observa un incremento del tono fetal en relación con la maduración musculoesquelética y con el desarrollo de las estructuras cerebelosas11.
Entre las semanas 11 y 13,5 de gestación, la ratio de sinapsis axosomáticas se incrementa notablemente11. Por ello, en la semana 11,5, la respuesta refleja solo aparece al estimular estructuras proximales del feto pero, a partir de la semana 12,5, se recogen respuestas reflejas a la estimulación distal. Inicialmente, el movimiento está limitado a ladear la cabeza pero, progresivamente, incluye el tronco y las extremidades.
Desde la semana 16 de gestación, los movimientos gruesos van disminuyendo, aumentan los más finos y específicos de las extremidades y comienzan a observarse movimientos de los dedos y de la cara12. Los movimientos unilaterales de la mano a la cabeza se identifican desde la semana 12 y tienden a ser bilaterales a partir de la semana 3613.
Progresivamente, los movimientos del feto adquieren más complejidad motora y funcional, son más variados, van teniendo características de reactividad intencional y muestran componentes interactivos. En este sentido, el CF se va haciendo más singular y manifiesta rasgos específicos, como se evidencia en los estudios con gemelos14. Intuitivamente, se otorga una diferencia en el CF vinculada al sexo; sin embargo, no hay una clara constatación experimental15. Con todo, la testosterona parece ejercer un efecto diferenciador en la lateralización motora y del lenguaje por una posible sensibilidad del cuerpo calloso o la corteza cerebral a los andrógenos16.
Por otra parte, tanto en el feto de 30 semanas como en el recién nacido, se observa un predominio funcional del hemisferio derecho asociado a una mayor reactividad del hemisferio izquierdo a la vocalización materna, pero sin que se haya podido demostrar una clara dominancia motora17,18. Estos datos sugieren que la lateralización motora se inicia más tardíamente, en el periodo posnatal, y que, por el contrario, la dominancia para el procesamiento verbal es temprana, antes del nacimiento.
La ontogenia de los movimientos fetales sigue una dinámica bastante bien identificada a lo largo de la gestación, de tal modo que pasan de ser bruscos y aislados en las primeras etapas, a ser suaves y coordinados en el periodo final del embarazo. Sin embargo, el nacimiento no supone un cambio sustancial en el comportamiento del feto, mostrando una marcada continuidad entre el comportamiento en la semana 30 de gestación y el observado en el nacimiento11: movimientos de las manos hacia diferentes partes del cuerpo, parpadeos aislados, apertura de la boca y de los ojos, bostezos, protrusión de la lengua, sonrisas y fruncimiento del ceño. Por tanto, el nacimiento no supone un cambio en el neurodesarrollo ni una aceleración en la maduración4 aunque, indudablemente, es un notable cambio de circunstancias que conlleva y exige respuestas específicas.
Movimientos faciales
Los movimientos faciales se inducen en los núcleos de los pares craneales y tienen una regulación cortical con la participación del sistema límbico en las expresiones emocionales.
Desde la semana diez de gestación, el feto abre la boca y a partir de la semana 12 tiene movimientos de chupeteo y deglución. Progresivamente, los movimientos faciales muestran una mayor diversidad y elaboración: apertura y cierre palpebral, protusión de la lengua, movimientos oculares etc.12. A partir del final del segundo trimestre, en paralelo con una progresiva disminución de los movimientos corporales y un incremento de los faciales, se identifican expresiones que sugieren sonrisa y enfado11.
Los estudios con E4D evidencian la evolución de las expresiones faciales, desde las meramente reflejas hasta las de contenido social, llegando a identificarse el espectro completo que puede mostrar el adulto2.
A partir del tercer trimestre, los movimientos faciales y cefálicos son un índice del estado fetal2,11, que se puede evaluar con el sistema de puntuaciones propuesto por Kurjak19, y que podría anticipar manifestaciones futuras.
Actividad sensitivo-sensorial del feto
En las primeras semanas de gestación ya están formados los receptores cutáneos y, a partir de la 4.ª semana comienza el desarrollo de los oídos y los ojos20. Entre la semana 24 y la 32 se produce un rápido crecimiento de fibras talamocorticales20.
Hay muchas evidencias de la sensibilidad cutánea del feto, incluso dolorosa21, y de la respuesta de los receptores gustativos y olfatorios a cambios moleculares del líquido amniótico12.
La funcionalidad visual prenatal es aún poco conocida; sin embargo, hay bastantes estudios sobre la actividad auditiva del feto12. Estudios con magnetoencefalografía señalan una progresiva maduración de las vías auditivas desde la semana 27 de gestación hasta casi los dos años del nacimiento22. Mediante resonancia magnética funcional (RMf), en la semana 33 de gestación, se recoge activación de la corteza auditiva primaria en respuesta a sonidos23.
Desde la semana 26 de gestación se pueden recoger cambios en el patrón cardiaco y en los movimientos fetales ante estímulos vibroacústicos que atraviesan la pared abdominal y el líquido amniótico. A partir de la semana 28 se observan respuestas de activación o de inhibición del feto ante sutiles diferencias en las características de la estimulación vibroacústica. Ya en la semana 32, el feto puede habituarse a los estímulos e identificar cambios en ellos. Al final de la gestación, es sensible a estímulos complejos (variaciones en la música, trasposición de sílabas) y, desde los primeros días del nacimiento, muestra una clara preferencia por la voz de la madre24.
Memoria y aprendizaje fetal
Desde el estudio pionero de Spelt25, que ponía de manifiesto el aprendizaje condicionado del feto, ha aumentado considerablemente la investigación sobre el aprendizaje y la capacidad mnésica del feto en el último trimestre de la gestación26,27. Estos estudios constatan que las respuestas del feto cesan tras varias series similares de estímulos vibroacústicos, que se mantiene la falta de respuesta en intervalos prolongados (más de 24 horas) de ausencia de estimulación y que los cambios en las características del estímulo inducen una nueva respuesta del feto. Todo ello sugiere que las respuestas fetales no son meramente reactivas sino que representan una cierta discriminación y diferenciación temporal asociadas a la memoria y al aprendizaje.
En las últimas semanas de gestación, el feto es capaz de discriminar entre distintos sonidos de vocales, diferenciar voces femeninas y masculinas y reconocer la voz de su madre12.
Por otra parte, estudios de RMf están aportando datos interesantes sobre la activación cerebral del feto ante determinados estímulos28. Las dificultades en la resolución espacial, derivadas del movimiento fetal y de los cambios neuroevolutivos, están encontrando solución con la elaboración de atlas de neurodesarrollo, centrados en los surcos y circunvoluciones, y con el perfeccionamiento de los métodos de análisis multivariado de series temporales29. Además, está demostrando interés el estudio de los "estados de reposo" que representan la identificación de cambios en las señales d resonancia magnética (RM) en ausencia estímulos específicos. Estas diferentes señales RM están asociadas a subestructuras neurales que son base del procesamiento contingente y representan características anatomofuncionales tempranas vinculadas al CF30.
Con todo, las limitaciones en este campo son evidentes y es importante diferenciar entre la evaluación del CF y los estudios sobre la memoria y el aprendizaje del feto, sin que exista aún un modelo útil de correlación.
Evaluación del comportamiento fetal
En las primeras semanas de gestación, la actividad del feto es irregular y poco definida. Progresivamente, los movimientos fetales se van elaborando más, alternan con periodos de quietud y se asocian a los ritmos cardiacos y al desarrollo de movimientos oculares. La correlación entre estas tres variables es estrecha y caracteriza el CF12.
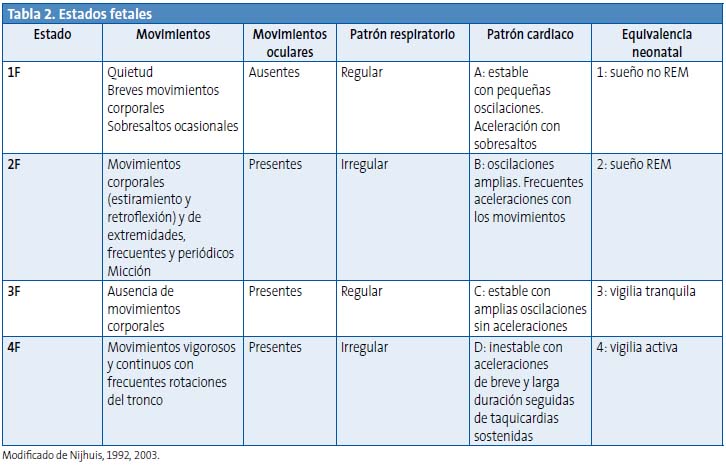
A partir de la semana 25 de gestación, la observación ultrasonográfica del feto (movimientos corporales y oculares), junto con el registro de su actividad cardiaca, permite definir cuatro estados fetales (1F, 2F, 3F y 4F; Tabla 2) en concordancia con los descritos en el neonato4,12. Estos estados se suceden de forma cíclica y son regulares a lo largo de la gestación, con respecto a la duración y la alternancia, hasta llegar al periodo inmediatamente pretérmino, que se caracteriza por la ausencia de movimientos corporales y oculares, y por una actividad cardiaca tipo A (ritmo estable, con pequeñas oscilaciones, y aceleración en relación con sobresaltos)31.
Cada estado posee una alta consistencia entre las características de las variables que lo definen, de tal modo que la disociación entre ellas sugiere una alteración del estado del feto. El paso de un estado fetal a otro se denomina estado de transición y su duración es de alrededor de tres minutos.
Los estados 1F y 2F se consideran situaciones de sueño del feto, equivalentes a las observadas en el neonato; mientras que los estados 3F y 4F representan situaciones de vigilia32. La distinción entre ambas situaciones está respaldada por datos de magnetoencefalografía fetal33.
En las últimas semanas del desarrollo intrauterino, los estados de sueño (especialmente el 2F) van disminuyendo y aumentan los de vigilia, hasta el punto de que en los fetos postérmino predominan los estados 3F y 4F32.
En la evaluación del CF los aspectos cuantitativos son importantes, pero tienen más relevancia sus características cualitativas (velocidad, amplitud, duración, etc.). El protocolo de evaluación del CF propuesto por el grupo de Morokuma34 ha demostrado una alta sensibilidad y especificidad en la identificación temprana de afectación neurológica del feto. Con todo, aún quedan por definir los criterios cualitativos del CF.
Factores muy diversos (momento del día, ruido ambiental, comidas, tabaco, etc.) inducen cambios en los estados del feto12. Con todo, la variable que tiene más peso es la edad gestacional, de tal modo que hay grandes diferencias en el CF entre la semana 20 y la 364.
Por otra parte, diversas noxas y situaciones patológicas causan cambios en los estados fetales y en las características de los estados de transición12.
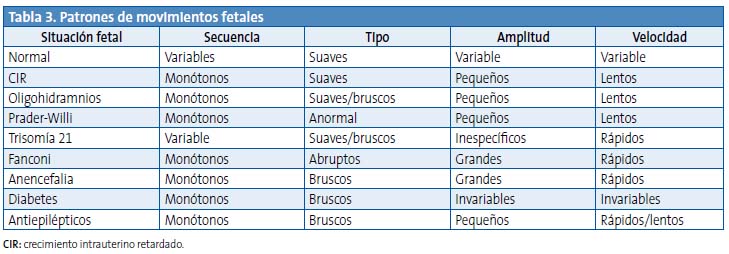
En líneas generales, se señalan tres grandes grupos de factores con repercusión sobre el CF y, por tanto, sobre el neurodesarrollo: maternos, tóxicos y fetales (Tabla 3).
Factores maternos
La situación fisiológica (metabólica, hormonal, inmunitaria, hemodinámica, etc.) de la madre tiene repercusiones en el desarrollo fetal35. Así, por ejemplo, el ejercicio materno moderado parece inducir un mayor desarrollo del control autonómico cardiaco del feto, que tendría consecuencias en su estado cardiovascular futuro a través los procesos de PF36. Del mismo modo, los estados de estrés y ansiedad maternos repercuten en el CF por medio del eje hipotálamo-hipofisario-suprarrenal y del sistema de endorfinas, correlacionando con la actividad autonómica materno-fetal37. De hecho, se observa una influencia positiva de las técnicas de relajación, tanto sobre los síntomas maternos como sobre las manifestaciones fetales38.
Por otra parte, cualquier patología materna es un potencial riesgo que, con frecuencia, se manifiesta en el CF. Así, por ejemplo, la diabetes materna se asocia a un retraso en el inicio de la actividad motora (salvo la respiración) con un desfase en la elaboración de los estados fetales12. Lo mismo se puede decir de otras situaciones de descompensación metabólica u hormonal como las asociadas a patologías tiroideas o del sistema inmunitario12.
Tóxicos
El efecto teratogénico de diferentes productos está demostrado. En muchos casos, se pueden identificar, tempranamente, alteraciones en el CF. Sin embargo, hay un amplio número de sustancias que, sin ocasionar graves consecuencias inmediatas, influyen en el CF y, a través de los procesos de PF, pueden tener repercusiones a largo plazo.
La naturaleza de la sustancia es la variable más importante en relación a las repercusiones fetales, si bien en muchos casos los mecanismos de acción son aún poco conocidos. Por otra parte, las causas de la ingesta de sustancias tóxicas para el feto pueden ser muy diversas (hábitos, adicciones, accidentes, tratamientos), pero lo relevante es el momento de la gestación, la cantidad ingerida y la duración del consumo.
El tabaco, el alcohol y las drogas ejercen una clara influencia sobre el CF además del riesgo de desarrollo de patologías específicas12,39.
Los corticoides, frecuentemente utilizados en los embarazos con riesgo de parto pretérmino, tienen como contrapartida un efecto sobre el eje hipotálamo-hipofisario-suprarrenal que se traduce en cambios en el estado fetal con potenciales implicaciones a largo plazo sobre el control motor y el sistema de atención40.
Por su parte, el consumo de antidepresivos serotonérgicos durante el embarazo se ha asociado a aumento de la actividad motora del feto, reducción de los movimientos respiratorios, mayor variabilidad del patrón cardiaco y disminución de los movimientos oculares rápidos41. La significación de estos cambios es aún incierta pero se asocian a la configuración de los sistemas de neurotransmisión implicados en los procesos de PF.
En consecuencia, aunque muchas sustancias no parecen causar daños inmediatos en el feto ni estar directamente asociadas a teratogénesis, su presencia induce cambios en el CF que pueden tener relevancia a largo plazo.
Patologías fetales
Un amplio número de enfermedades y síndromes congénitos y distintas situaciones patológicas se asocian a cambios en el CF que, sin ser específicos, pueden ser muy sugestivos y son siempre indicadores tempranos de afectación neurológica.
La hipoxemia induce en el feto diferentes respuestas de adaptación: variaciones en la frecuencia cardiaca, redistribución del flujo sanguíneo, cambios en la motricidad, etc. Todas ellas operan favorablemente siempre que la duración e intensidad de la hipoxia sea limitada. Durante la hipoxemia aguda se suprimen los movimientos fetales; sin embargo, cuando la hipoxemia se desarrolla gradualmente, se mantiene el patrón de CF normal hasta que se llega a la anoxia42. Por tanto, en estas situaciones, es importante evaluar el resto de las variables (patrón cardiaco, movimientos oculares y respiratorios) y su integración en el estado fetal, ya que la normalidad de los movimientos fetales puede encubrir la situación. Además, aunque los periodos de ausencia de movimientos fetales suelen ser breves (menos de seis minutos), a partir de la semana 32 se prolongan y pueden oscilar entre 15 y 40 minutos42.
El crecimiento intrauterino retardado (CIR) es una situación inespecífica de causas muy diversas (infección, tóxicos, anomalías congénitas, etc.), si bien la más comúnmente identificable es la insuficiencia uteroplacentaria. El CIR se asocia a una restricción de los movimientos fetales, tanto cuantitativa como cualitativamente, junto con un retraso en del desarrollo y evolución de los estados fetales y de la capacidad de habituación12. También se ha asociado al CIR y a la hidrocefalia una disminución de los movimientos oculares rápidos43.
La escasez de movimientos, en un feto de crecimiento normal asociado a malformaciones faciales, sugiere la presencia distrofias miotónicas congénitas o diferentes formas de artrogriposis12. En la forma más grave de atrofia muscular espinal (tipo I; enfermedad de Werdnig-Hoffmann) se identifica tempranamente una reducción de la actividad motora del feto. La ecografía bidimensional no permite diferenciar las formas graves y las menos graves pero la E4D podría llegar a discriminarlas precozmente44.
En general, las anomalías congénitas se asocian a un CF bizarro y a disociaciones con el patrón cardiaco45. Así, por ejemplo, la anencefalia se acompaña de un pobre repertorio de movimientos (ausencia de flexión cefálica, apertura de la boca, chupeteo y deglución), de carácter abrupto y amplio que causan cambios en la posición del feto, junto con alteraciones en el patrón cardiaco y ausencia de respuestas a la estimulación vibroacústica.
Consideraciones finales
Antes de la introducción de técnicas de evaluación funcional del feto, los nueve meses de gestación eran un periodo incierto, con connotaciones pasivas y cuyo resultado se iba vislumbrando a lo largo del periodo posnatal. Ese planteamiento ignoraba el despliegue de la actividad fetal, minusvaloraba la relevancia de los factores ambientales en interacción con el feto (sobredimensionando el componente genético) y conllevaba una inevitable demora en las estrategias de intervención en los casos que lo exigían.
El CF es una ventana abierta al neurodesarrollo, en continuidad con el comportamiento posnatal y en estrecha relación con la capacidad de aprendizaje y de interacción. El estudio del CF puede dar respuesta a importantes cuestiones sobre la vida prenatal y el desarrollo neurológico. Al mismo tiempo, lleva a conocer mejor las implicaciones futuras de los factores que inciden en la gestación, a detectar tempranamente problemas y a lograr una intervención más precoz.
En este sentido, la E4D es una herramienta útil para evaluar el CF y llevar a cabo una monitorización más estrecha del neurodesarrollo temprano.
Conflicto de intereses
El autor declara no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Abreviaturas:
CF: comportamiento fetal • PF: programación fetal • RMf: sonancia magnética funcional • RM: resonancia magnética • CIR: crecimiento intrauterino retardado • E3D: ecografía en tres dimensiones • E4D: ecografía en cuatro dimensiones.
Bibliografía
1. Legido A, Valencia I, Smith JD. Evaluación neurológica del feto. Rev Neurol. 2004;39:454-64. [ Links ]
2. Andonotopo W, Medic M, Salihagic-Kadic A, Milenkovic D, Maiz N, Scazzocchio E. The assessment of fetal behavior in early pregnancy: Comparison between 2D and 4D sonographic scanning. J Perinat Med. 2005;33:406-14. [ Links ]
3. Timor-Tritsch I, Monteagudo A, Pilu G, Malinger G. Ultrasonografía del cerebro prenatal. Madrid: Amolca; 2013. [ Links ]
4. Andonotopo W, Kurjak A. The assessment of fetal behavior of growth restricted fetuses by 4D sonography. J Perinatal Med. 2006;34:471-8. [ Links ]
5. Barker DJ. Intrauterine programming of adult disease. Mol Med Today. 1995;1:418-23. [ Links ]
6. Lombardo MV, Ashwin E, Auyeung B, Chakrabarto B, Lai MC, Taylos K, et al. Fetal programming effects of testosterne on the reward system and behavioral approach tendencies in humans. Biol Psychiatry. 2012;72:839-47. [ Links ]
7. Del Giudice M. Fetal programming by maternal stress: insights from a conflict perspective. Psychoneuroendocrinology. 2012;37:1614-29. [ Links ]
8. Li Y, Gonzalez P, Zhang L. Fetal stress and programming of hypoxic/ischemic-sensitive phenotype in the neonatal brain: mechanisms and possible interventions. Progr Neurobiol. 2012;98:145-65. [ Links ]
9. Oberlander TF. Fetal serotonin signaling: setting pathways for early childhood development and behavior. J Adolesc Health. 2012;51:S9-16. [ Links ]
10. Murphy Paul A. Origins: How the nine months before birth shape the rest of our lives. New York: Free Press; 2010. [ Links ]
11. Kurjak A, Andonotopo W, Hafner T, Salihagic-Kadic A, Stanojevic M, Azumendi G, et al. Normal standards for fetal neurobehavioral developments longitudinal quantification by four-dimensional sonography. J Perinatal Med. 2006;34:56-65. [ Links ]
12. Einspieler C, Prayer D, Prechtl HFR. Fetal behaviour: a neurodevelopmental approach. Londres: MacKeith Press; 2012. [ Links ]
13. de Vries JIP, Wimmers RH, Ververs IAP, Hopkins B, Savelsbergh GJP, van Geijn HP. Fetal handedness and head position preference: a developmental study. Dev Psychobiol. 2001;39:171-8. [ Links ]
14. Mulder EJH, Derks JB, Laat MWM, Visser GHA. Fetal behavior in normal dochorionic twin pregnancy. Early Hum Dev. 2012;88:129-34. [ Links ]
15. Robles de Medina PG, Visser GHA, Huizink AC, Buitelaar JK, Mulder EJH. Fetal behaviour does not differ between boys and girls. Early Hum Dev. 2003;73:17-26. [ Links ]
16. Lust JM, Geuze RH, Van de Beek C, Cohen-Kettenis PT, Bouma A, Groothuis TGG. Differential effects of prenatal testosterone on lateralization of handedness and language. Neuropsychology. 2011;25:581-9. [ Links ]
17. Chiron C, Jambaque I, Nabbout R, Lounes R, Syrota A, Dulac O. The right brain hemisphere is dominant in human infants. Brain. 1997;120:1057-65. [ Links ]
18. Emory E. A womb with a view: ultrasound for evaluation of fetal neurobehavioral development. Infant Child Dev. 2010;19:119-24. [ Links ]
19. Kurjak A, Miskovic B, Stanojevic M, Amiel-Tison C, Ahmed B, Azumendi G, et al. New scoring system for fetal neurobehavior assessed by three-and four-dimensional sonography. J Perinat Med. 2008;36:73-81. [ Links ]
20. Kostovic I, Jovanov-Miloševic N. The development of cerebral connections during the first 20-45 weeks' gestation. Semin Fetal Neonatal Med. 2006;11:415-22. [ Links ]
21. Bellieni CV, Buonocore G. Is fetal pain a real evidence? J Matern Fetal Neonatal Med. 2012;25:1203-8. [ Links ]
22. Holst M, Eswaran H, Lowery C, Murphy P, Norton J, Preissl H. Develoment of auditory evoked fields in human fetuses and newborns: a longitudinal MEG study. Clin Neurophysiol. 2005;116:1949-55. [ Links ]
23. Jardri R, Pins D, Houfflin-Debarge V, Chaffiotte C, Rocourt N, Pruvo JP, et al. Fetal cortical activation to sound at 33 weeks gestation: a functional MRI study. Neuroimage. 2008;42:10-8. [ Links ]
24. Kisilevsky BS, Hains SM, Jacquet AY, Granier-Deferre C, Lecanuet JP. Maturation of fetal response to music. Dev Sci. 2004;7:550-9. [ Links ]
25. Spelt DK. The conditioning of the human fetus in utero. J Exp Psychol. 1948;38:338-6. [ Links ]
26. Gonzales-Gonzales NL, Suarez MN, Perez-Pinero B, Armas H, Domenech J, Bartha JL. Persistence of fetal memory into neonatal life. Acta Obstet Gynecol Scand. 2006;85:1160-4. [ Links ]
27. Chantal E, Dirix H, Nijhuis JG, Jongsma HW, Hornstra G. Aspects of fetal learning and memory. Child Dev. 2009;80:1251-8. [ Links ]
28. Gowland P, Fulford J. Initial experiences of performing fetal fMRI. Exp Neurol. 2004;190:S22-7. [ Links ]
29. Dubois J, Benders M, Cachia A, Lazyras F, Ha-Vinh Leuchter R, Sizonenko SV, et al. Mapping the early cortical folding process in the preterm newborn brain. Cereb Cortex. 2008;18:1444-54. [ Links ]
30. Schöpf V, Kasprian G, Brugger PC, Prayer D. Watching the fetal brain at "rest". Int J Dev Neurosci. 2012;30:11-7. [ Links ]
31. Iko S, Akio I, Taro T. Longitudinal measurements of fetal heart rate (FHR) monitoring in second trimester. Early Hum Dev. 1992;29:251-7. [ Links ]
32. Van den Bergh BRH, Mulder EJH. Fetal sleep organization: a biological precursor of self-regulation in childhood and adolescence? Biol Psychol. 2012;89:584-90. [ Links ]
33. Haddad N, Govindan RB, Vairavan S, Siegel E, Temple J, Pressl H, et al. Correlation between fetal brain activity patterns and behavioral states: an exploratory fetal magnetoencephalography study. Exp Neurol. 2011;228:200-5. [ Links ]
34. Morokuma S, Fukushima K, Otera Y, Yumoto Y, Tsukimori K, Ochiai M, et al. Ultrasound evaluation of fetal brain dysfunction base don behavioral patterns. Brain Dev. 2013;35:61-7. [ Links ]
35. Challis JR, Lockwood CJ, Myatt L, Norman JE, Strauss III JF, Petraglia F. Inflammation and pregnancy. Reprod Sci. 2009;16:206-15. [ Links ]
36. Gustafson KM, May LE, Yeh H, Million SK, Allen JJB. Fetal cardic autonomic control during breathing and non-breathing epochs: the effect of maternal exercise. Early Hum Dev. 2012;88:539-46. [ Links ]
37. Brunton PJ, Russell JA. Neuroendocrine control of maternal stress responses and fetal programming by stress in pregnancy. Prog Neuropsychopharmacol Biol Psychiatry. 2011;35:1178-91. [ Links ]
38. Fink NS, Urech C, Fornaro I, Meyer A, Hoesli I, Bitzer J, et al. Fetal response to abbreviated relaxation techniques. A rendom controlled study. Early Hum Dev. 2011;87:121-7. [ Links ]
39. Hellemans KGC, Sliwowska JH, Verma P, Weinberg J. Prenatal alcohol exposure: fetal programming and later life vulnerability to stress, depression and anxiety disorders. Neurosci Biobehav Rev. 2010;34:791-807. [ Links ]
40. Kapoor A, Petropoulos S, Matthews SG. Fetal programming of hypothalamic-pituitary-adrenal (HPA) axis function and behavior by synthetic glococorticoids. Brain Res Rev. 2008;57:586-95. [ Links ]
41. Mulder EJ, Ververs FF, de Heus R, Visser GH. Selective serotonin reuptake inhibitors affect neurobehavioral development in the human fetus. Neuropsychopharmacology. 2011;36:1961-71. [ Links ]
42. Martin CB. Normal fetal physiology and behavior and adaptative responses with hipoxemia. Semin Perinatol. 2008;32:239-42. [ Links ]
43. Hepper PG. The behavior of the fetus as an indicator of neural functioning. En: Lecanuet JP (ed.). Fetal development: a psychobiological perspective. New Jersey: LEA; 1995. p. 405-18. [ Links ]
44. Parra J, Martínez-Martínez R, Also-Rallo E, Alias L, Barceló MJ, Amenedo M, et al. Ultrasound evaluation of fetal movements in pregnancies alt risk for severe spinal muscular atrophy. Neuromuscul Disord. 2011;21:97-101. [ Links ]
45. Hata T, Hanaoka U, Tenkumo C, Sato M, Tanaka H, Ishimura M. Three-and four-dimensional HDlive rendering images of normal and abnormal fetus: pictorial essay. Arch Ginecol Obstet. 2012:286:1431-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Cabanyes Truffino
jcabanyes@unav.es