Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Medicina Oral, Patología Oral y Cirugía Bucal (Ed. impresa)
versión impresa ISSN 1698-4447
Med. oral patol. oral cir. bucal (Ed.impr.) vol.10 no.4 ago./oct. 2005
Cuantificación de ADN como factor pronóstico en un caso de Carcinoma
de células Acinares de parótida diagnosticado por PAAF
DNA quantification as prognostic factor in a case of Acinar Cell Carcinoma of the parotid gland,
diagnosed by FNA
Javier Azúa Romeo (1), Juan Carlos Sánchez Garnica (2), Javier Azúa Blanco(3), Mayte Tovar Lázaro (4)
(1) Profesor Doctor, Departamento de Anatomía e Histología. Universidad de Zaragoza. Patólogo Investigador,
Instituto Aragonés de Ciencias de la Salud
(2) Especialista en Cirugía Oral y Maxilofacial. Zaragoza
(3) Profesor Doctor, Departamento de Anatomía e Histología. Universidad de Zaragoza
(4) Investigador asociado. Departamento de Anatomía e Histología. Universidad de Zaragoza
Correspondencia:
Javier Azúa-Romeo
Servicio de Anatomía Patológica. (Banco de Tumores)
Hospital Universitario Miguel Servet
Pº Isabel la Católica 1 y 3
50009 Zaragoza
Telf: 976 765553
Fax: 976379891
Email: javierazua@hotmail.com
Recibido: 4-04-2004 Aceptado: 21-11-2004
| Azúa-Romeo J, Sánchez-Garnica JC, Azúa-Blanco J, Tovar-Lázaro M. DNA quantification as prognostic factor in a case of Acinar Cell Carcinoma of the parotid gland, diagnosed by FNA. Med Oral Patol Oral Cir Bucal 2005;10:289-93. © Medicina Oral S. L. C.I.F. B 96689336 - ISSN 1698-4447 |
| RESUMEN Presentamos el caso de un varón de 43 años de edad que consulta por una tumoración preauricular derecha dolorosa a la palpación que, según refiere, tiene más de tres años de evolución. Se realiza punción aspiración con aguja fina que informa de compatible con carcinoma de células acinares, por lo que se realiza cuantificación de ADN por citometría de imagen. Los parámetros biológicos estudiados (ploidía, fase S, células por encima de 5c) indican que se trata de una lesión de bajo grado de malignidad. Palabras clave: Células acinares, PAAF, citometría, ploidía. | ABSTRACT Hereby we present a case of a 43-years-old male who complained of a three years history preauricular painful mass. Fine needle aspiration cytology was performed, diagnosing of compatible with acinar cell carcinoma, thus DNA quantification by image cytometry was carried out. Biological parameters studied (ploidy, S-phase, 5-c exceeding rate) showed that it is a low grade of malignancy lesion. Keywords: Acinar cells, FNA, cytometry, ploidy.
|
INTRODUCCIÓN
El adenocarcinoma de células acinares es una neoplasia maligna epitelial en la que las células neoplásicas muestran diferenciación acinar. La OMS en 1991 (1), revisó la clasificación de tumores de las glándulas salivares, redefiniendo esta lesión como carcinoma, puesto que clásicamente se denominaba tumor de células acinares. Tradicionalmente ha demostrado un bajo potencial de agresividad, con presencia de muy escasos criterios histológicos de malignidad, a pesar de que, desde 1950 (2) se conoce su posibilidad de recidiva y metástasis. Desde las primeras referencias se ha tratado de encontrar un protocolo diagnóstico más ajustado a la realidad biológica del tumor (3-7), así en la actualidad contamos con los marcadores inmunohistoquímicos de proliferación – p53, Ki67-, microscopía electrónica y la cuantificación de ADN por citometría de flujo e imagen.
CASO CLÍNICO
Se trata de un varón de 43 años que consulta por una tumoración palpable, dolorosa a la presión en región preauricular derecha. A la exploración física destaca una masa mal delimitada de 2 cm en área parotídea derecha, sin encontrar otros hallazgos significativos. El paciente no refiere antecedentes personales ni familiares de interés, únicamente el nódulo citado que, según indica, tiene una evolución de más de cinco años. Las pruebas de imagen realizadas, tomografía axial computerizada y ecografía, muestran una tumoración bien delimitada de 2,5 x 2 cm centrada en la parótida, que no afecta estructuras óseas o musculares, sugestiva de tumor de bajo grado (figura 1).
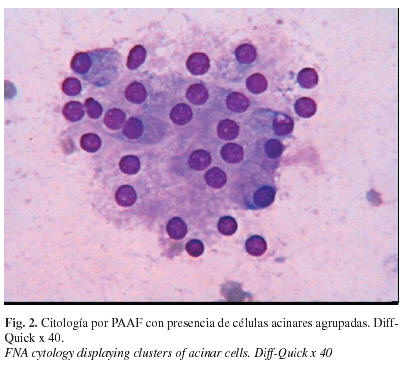
Se practica punción aspiración con aguja fina de la lesión, empleando el método rutinario de 3 pases con aguja de 23G, y ayuda del Cameco® (dispositivo de aspiración manual) tras lo cual se fijan en alcohol 2 portaobjetos para ser teñidos mediante la técnica de Papanicolaou y el resto (6 portas) se secan al aire para emplear la tinción de Diff-Quick. El examen de los extendidos muestra, sobre un fondo seroproteináceo, abundante celularidad de talla grande, con núcleos centrales y ocasionalmente periféricos, redondeados, de nucleolo poco patente y cromatina finamente granular. El citoplasma es muy característico, siendo abundante, pálido y espumoso de bordes imprecisos, vacuolizado y conteniendo abundantes gránulos violáceos. Las células se disponen en grupos más o menos compactos de grandes láminas bidimensionales, adoptando en ocasiones un patrón arquitectural acinar. Junto con esta celularidad predominante también se aprecian células de talla más pequeña, con escaso citoplasma y pequeño núcleo redondeado u oval, central. La imagen citológica resultó, por lo tanto, concordante con patología de células acinares de tipo seroso, probablemente carcinoma (figura 2), por lo que se propuso realizar cuantificación de ADN por citometría de imagen sobre extendidos citológicos. Dado que los frotis obtenidos en la primera punción no permitían una adecuada valoración se practicó una segunda PAAF con el propósito de procesar el material para la determinación citométrica, para ello se fijan en alcohol metílico de 99º, y posteriormente se realiza tinción de Hematoxilina progresiva de Gill.
Por medio del software TEXCAN® y a través de una cámara de vídeo integrada en el microscopio, que capta escalas de grises, se determinan los parámetros biológicos más relevantes, entre los que destacan la ploidía, fase S, y porcentaje de células por encima de 5c (aneuploidía)El resultado final, expresado en forma de histograma (IMAGEN 2), revela una euploidía de 2,1 sin actividad relevante de fase S y ausencia de células sobre 5c, por lo tanto, indica una baja agresividad (histograma tipo 1)según la clasificación de Azúa para citometría estática.
Con el diagnóstico citológico de carcinoma de células acinares y el índice pronóstico citométrico de bajo grado, se realiza intervención quirúrgica conservadora, con exéresis de la glándula parótida sin vaciamiento cervical y conservando el nervio facial.
Macroscópicamente nos encontramos con una pieza blanquecina, de morfología polilobulada, con un peso de 12 gramos y unas medidas totales de 8 x 4 x 3 cm. Al corte se evidencia una lesión nodular de 1,5 cm que no desborda los extremos de resección quirúrgicos, aparentemente no quistificada. Se realizan múltiples secciones paralelas de la muestra, que se incluyen en parafina para después teñir los cortes con hematoxilina-eosina convencional. El estudio histopatológico evidencia una neoformación microquística y sólida, bien circunscrita, compuesta fundamentalmente por células acinares que no desbordan la cápsula glandular. Los múltiples espacios quísticos de muy pequeña talla, dispersos entre las sábanas sólidas se forman por luces dilatadas tapizadas por células ductales intercaladas, aunque las células acinares también participan ocasionalmente (figura 3). Las células acinares son de secreción serosa, como se demuestra con la tinción de PAS (periodic acid Schiff) que pone de relieve los gránulos de zimógeno intracitoplasmáticos así como la secreción eosinófila intraquística. La neoplasia respeta los extremos de resección y no se evidencia infiltración vascular ni nerviosa.
El diagnóstico definitivo es, por tanto, Carcinoma de Células Acinares de bajo grado, bien delimitado, sin invasión de extremos quirúrgicos.
DISCUSIÓN
El adenocarcinoma de células acinares es una neoplasia maligna epitelial en la que las células neoplásicas muestran diferenciación acinar. Si bien es cierto que en las glándulas salivares existen dos tipos de células acinares, serosas y mucosas, se acepta que el término adenocarcinoma de células acinares se refiere específicamente a las de tipo seroso, caracterizadas por la presencia de gránulos citoplasmáticos secretorios de zimógeno. En la clasificación revisada de los tumores de glándula salivar publicada por la OMS en 1991 (1) se redefine esta entidad aplicándole el nombre actual de carcinoma, pues hasta entonces se conocía como tumor de células acinares. Esta definición atendía al bajo potencial de agresividad demostrado y a que habitualmente no se evidencian criterios de malignidad en el estudio histológico, no obstante, desde 1950 (2) se conoce su comportamiento biológico, con posibilidad de recidiva y metástasis, incluso evolución terminal en algunos pacientes. Esta dificultad en alcanzar un diagnóstico objetivo y ajustado a la realidad biológica del tumor hizo que se desarrollaran diferentes técnicas diagnósticas en la década de los 90 (3-7), entre las que se incluyen marcadores inmunohistoquímicos de proliferación – p53, Ki67-, microscopía electrónica y determinación de ADN y parámetros relacionados con la citometría de flujo e imagen.
En algunas series (8) de casos el adenocarcinoma de células acinares representa el tercer tumor epitelial maligno salivar por detrás del carcinoma mucoepidermoide y el adenocarcinoma, sin embargo, en nuestra serie (9) estaría por detrás del carcinoma escamoso, en frecuencia absoluta, y prácticamente menos frecuente si consideramos los casos diagnosticados por PAAF. En general la media de aparición estaría en, aproximadamente, un 10% de todos los tumores epiteliales de glándula salivar.
Se localiza de manera casi exclusiva en parótida, con un ratio mujer/hombre de 3 a 2, sin predilección por razas y un rango de edad desde niños a ancianos, con una edad media de 44 años (8).
Clínicamente se caracteriza por un lento crecimiento en forma de una masa levemente dolorosa en la región parotídea. El nervio facial se ve afectado en 5-10% de los pacientes.
El protocolo de diagnóstico más aceptado (10, 11) es la combinación de pruebas de imagen, habitualmente ecografía, con la realización de PAAF, que además de ser una prueba relativamente poco agresiva, obtiene una alta fiabilidad diagnóstica en un intervalo de tiempo muy corto, pudiendo dar el diagnóstico en menos de una hora (12), con lo que se disminuye notablemente el tiempo de espera quirúrgico y se evita la angustia de los pacientes.
Nuestro grupo de trabajo posee una amplia experiencia (13,14) en el manejo de la citometría estática, es por ello que nos inclinamos por su aplicación en este caso, a pesar de que la bibliografía respecto al uso de esta técnica en glándula salivar es contradictoria, sin alcanzar consenso sobre su representatividad. Mientras que para algunos autores (3,4) no influye en el pronóstico, otros (15-17), entre los que nos incluimos, consideran que la cuantificación de ADN por citometría en tumores de glándula salivar es una herramienta muy útil a la hora de predecir la evolución neoplásica. Revisando la literatura médica (3-7, 15-17) encontramos que la mayoría de carcinomas de células acinares mostraban una ploidía normal (2c) o casi normal, con escasa o nula actividad de fase S, mostrando una buena correlación con la supervivencia, mayor de 15 años tras el diagnóstico. Parece que los casos en los que existe discordancia citometría/supervivencia están más relacionados con factores extrínsecos, como exéresis insuficiente, mal estado general del paciente o enfermedad intercurrente no relacionada.
El caso que presentamos, demostró una ploidía dentro de la normalidad, siendo el resto de los parámetros moleculares normales también, lo que coincide perfectamente con la imagen histológica, en la que no aparecen signos de agresividad, es decir, no hay invasión vascular ni perineural, no desborda la cápsula en ningún punto ni metastatiza en ganglios regionales.
En el momento actual el paciente se encuentra asintomático y libre de enfermedad residual, si bien tan solo ha transcurrido un año desde la intervención y es obligatorio proseguir con un control estricto.
En conclusión, consideramos que la realización de punción aspiración con aguja fina y posterior cuantificación de ADN por citometría de imagen resultan el método óptimo de diagnóstico en el caso de tumoraciones de glándula salivar. Gracias a esta técnica conocemos de antemano el comportamiento de la neoplasia y, por tanto, se puede adecuar el tratamiento a la realidad biológica del tumor.
BIBLIOGRAFÍA
1. Seifert G, Sobin LH. Histologic typing of salivary gland tumours. In: World Health Organization international histologic classification of tumors. 2nd ed. Berlin: Springer-Verlag; 1991. p. 12-28. [ Links ]
2. Godwin JT, Foote FW, Frazell EL. Acinic cell adenocarcinoma of the parotid gland: report of twenty-seven cases.Am J Pathol 1954;30:465-77 [ Links ]
3. Hamper K, Mausch HE, Caselitz J, Arps H, Berger J, Askensten U, et al. Acinic cell carcinoma of the salivary glands: the prognostic relevance of DNA cytophotometry in a retrospective study of long duration (1965-1987). Oral Surg Oral Med Oral Pathol. 1990;69:68-75 [ Links ]
4. Lewis JE, Olsen KD, Weiland LH. Acinic cell carcinoma. Clinicopathologic review. Cancer. 1991;67:172-9 [ Links ]
5. Timon CI, Dardick I, Panzarella T, Thomas J, Ellis G, Gullane P. Clinico-pathological predictors of recurrence for acinic cell carcinoma. Clin Otolaryngol. 1995;20:396-401. [ Links ]
6. Gustafsson H, Lindholm C, Carlsoo B. DNA cytophotometry of acinic cell carcinoma and its relation to prognosis. Acta Otolaryngol. 1987;104:370-6 [ Links ]
7. Oliveira P, Fonseca I, Soares J. Acinic cell carcinoma of the salivary glands. A long term follow-up study of 15 cases. Eur J Surg Oncol. 1992;18:7-15. [ Links ]
8. Ellis G, Auclair P. Malignant epithelial tumors. Rosai J, editor. Tumors of the salivary glands. Third series. Washington: AFIP; 1996. p. 268-80 [ Links ]
9. Azúa J. Citología por punción aspiración con aguja fina. Salvat Editores 1987. [ Links ]
10. Shintani S, Matsuura H, Hasegawa Y. Fine needle aspiration of salivary gland tumors. Int J Oral Maxillofac Surg. 1997;26:284-6. [ Links ]
11. Nagel H, Laskawi R, Buter JJ, Schroder M, Chilla R, Droese M. Cytologic diagnosis of acinic-cell carcinoma of salivary glands. Diagn Cytopathol. 1997;16:402-12 [ Links ]
12. Azúa Romeo J, Azúa Blanco J.Tricks for obtaining better material in FNA. Acta Cytologica 2001;45:664-5. [ Links ]
13. Azúa-Romeo J, Azúa Blanco J, Romeo P. Image cytometry in nonproliferative fibrocystic changes of the breast: ploidy evaluation and epidemiological study. Anal Quant Cytol Histol 2001;23:129-34. [ Links ]
14. Azúa J, Romeo P, Morales M, Castiella T, Azúa-Romeo J. DNA Quantification as a Prognostic Factor in Colorectal Adenocarcinoma. Acta Cytol 2000;21:468-72. [ Links ]
15. Di Palma S, Corletto V, Lavarino C, Birindelli S, Pilotti S. Unilateral aneuploid dedifferentiated acinic cell carcinoma associated with bilateral-low grade diploid acinic cell carcinoma of the parotid gland. Virchows Arch. 1999;434:361-5. [ Links ]
16. Bang G, Donath K, Thoresen S, Clausen OP. DNA flow cytometry of reclassified subtypes of malignant salivary gland tumors.J Oral Pathol Med. 1994;23:291-7. [ Links ]
17. el-Naggar AK, Batsakis JG, Luna MA, McLemore D, Byers RM. DNA flow cytometry of acinic cell carcinomas of major salivary glands. J Laryngol Otol. 1990;104:410-6. [ Links ]











 texto en
texto en