INTRODUCCIÓN
La prevalencia de diabetes mellitus tipo 2 (DMT2) en España fue del 12 % en el año 20111. Esta enfermedad es un problema de salud pública en los países desarrollados, muy vinculada al envejecimiento de la población y con un coste sanitario elevado debido a sus frecuentes complicaciones y alta comorbilidad. Otro aspecto de gran repercusión es que los diabéticos tienen un riesgo de pre sentar algún tipo de discapacidad funcional que es 2-3 veces superior al de la población no diabética, aumentando en edades avanzadas2-4. Esto se traduce en pérdidas de la independencia y limitaciones de la movilidad que, sólo parcialmente, pueden ser explicadas por las complicaciones graves de la DMT2, además de otros factores relacionados de tipo cardiovascular y socioeconómico5-7. En las últimas décadas, diversos trabajos han constatado que el declive de la masa muscular y de la fuerza muscular durante el envejecimiento es más intenso y acelerado cuando se asocia con DMT28,9. La naturaleza de esta asociación aún no está completamente aclarada, pero sí disponemos de pruebas suficientes sobre la influencia de estos aspectos del músculo esquelético en el riesgo de discapacidad de los pacientes diabéticos10,11. En consecuencia, es inevitable preguntarse qué tipo de relación existe entre la sarcopenia y la DMT2. Para algunos autores ambas son el resultado de una serie de factores predisponentes y mecanismos patogénicos comunes, por lo que se trataría de las dos caras de una misma moneda12. Probablemente, el vínculo más importante entre diabetes y sarcopenia sea la resistencia insulínica, entendida como la pérdida de respuesta global a la insulina por parte de los tejidos diana (entre ellos el muscular esquelético). La insulina detenta un importante papel como estimuladora del anabolismo proteico muscular a través del sistema de señalización mTORC1. Es un mecanismo diferente al utilizado para la captación de glucosa aunque, posiblemente, los niveles permanentemente altos de esta hormona acaben por producir resistencia a la misma por parte del miocito para la captación de aminoácidos13,14. Otra línea de investigación considera que la sarcopenia está muy influida por las diversas alteraciones producidas por la DMT2, siendo las más relevantes la vasculopatía y neuropatía periféricas junto a la infiltración grasa intramuscular15-20.
Las definiciones actuales de sarcopenia, a pesar de incluir aspectos funcionales como el rendimiento muscular y la fuerza muscular, siguen basadas en un modelo teórico según el cual la pérdida de masa muscular es el punto de partida de todos los déficits funcionales que caracterizan a la sarcopenia21,22. Actualmente sabemos que la masa muscular y la fuerza muscular mantienen entre sí una compleja relación, de manera que el declive de una de ellas no va necesariamente acompañado del mismo proceso en la otra, ni siguen la misma evolución a lo largo del tiempo23,24. En la DMT2 ocurre una reducción de la fuerza muscular que es más precoz y acelerada que la que tiene lugar en la masa muscular. Por otro lado, el deterioro de la fuerza muscular supone en diabéticos un riesgo mucho mayor para presentar discapacidad y movilidad limitada que la pérdida de masa muscular25,26. Las pruebas proporcionadas por estudios tanto epidemiológicos como de intervención han motivado la propuesta de un nuevo término, dinapenia, para referirse exclusivamente al déficit de fuerza muscular debido al envejecimiento, de forma independiente al de la masa muscular27-29.
El objetivo de esta investigación fue conocer la prevalencia de la sarcopenia y la dinapenia en pacientes con DMT2 que son controlados en Atención Primaria, así como identificar a los factores de tipo clínico y sociodemográfico que pudieran estar asociados a la aparición de ambos síndromes.
MATERIAL Y MÉTODOS
Se trata de un estudio descriptivo transversal y de asociación cruzada. Los pacientes fueron seleccionados en tres centros de salud localizados en una zona rural al sur de Castilla-La Mancha y pertenecientes al Área Sanitaria de Puertollano (Servicio de Salud de Castilla-La Mancha). La población diana fueron las personas adultas con diagnóstico de DMT2. Los criterios de inclusión fueron: sujetos con edad mayor o igual a 30 años, registrados en la base de datos de alguno de los tres centros de salud referidos, y en cuya historia clínica informatizada estuviera codificado el diagnóstico de DMT2. Los criterios de exclusión considerados fueron: demencia o déficit cognitivo grave, oligofrenia, psicosis, enfermedad terminal, portador de marcapasos, amputación de alguna extremidad e ingreso hospitalario en las dos semanas previas. La muestra se obtuvo mediante aleatorización simple a partir del listado informatizado correspondiente a los códigos diagnósticos asignados a DMT2. El tamaño muestral se fijó en 291 participantes, asumiendo una prevalencia de sarcopenia en diabéticos del 15 % (la obtenida en el estudio KSOS30, ya que no disponemos en nuestro país de ningún estudio similar de referencia). De forma paralela, se seleccionó una segunda muestra de población no diabética que sirvió de grupo de comparación de los resultados principales (prevalencia de sarcopenia y dinapenia en pacientes diabéticos frente a la misma prevalencia en individuos sin DMT2). Para asegurar la comparabilidad, este grupo fue de igual tamaño, de tal manera que por cada paciente diabético incluido se seleccionó aleatoriamente otro de igual género y edad (± 2 años) que residiese en la misma localidad. Los criterios de exclusión aplicados fueron los mismos.
Todos los sujetos incluidos en el estudio otorgaron su consentimiento informado por escrito para participar en el mismo. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Área Sanitaria de Ciudad Real. Tras comprobar el cumplimiento de los criterios de inclusión y aceptar la participación en el estudio, los pacientes fueron citados en sus respectivos centros de salud para la entrevista clínica y la realización de las exploraciones y pruebas complementarias pertinentes. El período de estudio abarcó desde enero de 2013 hasta abril de 2014.
Para la valoración de sarcopenia se siguieron los criterios diagnósticos propuestos por el European Working Group on Sarcopenia in Older People (EWGSOP), que consisten en la demostración de pérdida de masa muscular, fuerza muscular y rendimiento muscular. El primero de ellos es condición imprescindible, junto a alguno de los otros dos21. La masa muscular esquelética (MME) se cuantificó mediante análisis de impedancia bioeléctrica (BIA), empleando un impedanciómetro Tanita® BC-420-S (Tanita Corporation, Japón), usando la ecuación predictiva de Janssen31:
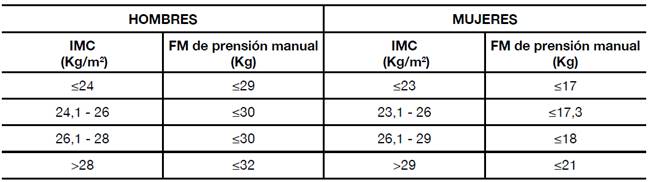
Posteriormente se calculó el índice de masa muscular (IMM), dividiendo la MME por el cuadrado de la talla (expresado en Kg/m2). Se determinó que existía pérdida de MME si el IMM era inferior a los puntos de corte obtenidos por Masanés en la población de Barcelona: 8,31 Kg/m2 en hombres y 6,68 Kg/m2 en mujeres32. La fuerza muscular (FM) de prensión manual se midió con un dinamómetro hidráulico de JAMAR®, modelo J00105 (Lafayette Instrument Company, EE.UU.), y se adoptaron los puntos de corte basados en el Cardiovascular Health Study33, recomendados por el EWGSOP (Tabla 1). Para el rendimiento muscular se empleó el test de la velocidad de la marcha en una distancia de 6 metros, tomando el valor más rápido de dos repeticiones. Se consideró que era anormal si dicha velocidad resultaba inferior a 0,8 m/s.
Tabla 1 Criterios para el diagnóstico de dinapenia, según la fuerza muscular de prensión manual ajustada por género e IMC.
La información de tipo sociodemográfico y la relacionada con la evolución de la DMT2 fue obtenida de la historia clínica de cada participante y mediante la entrevista clínica. En este apartado las variables fueron: edad, género, estado civil, consumo actual de tabaco y alcohol, hospitalizaciones en el último año, hiperfrecuentación en atención primaria (6 o más visitas/año al médico de familia), tiempo transcurrido desde el diagnóstico de DMT2, polifarmacia (5 o más fármacos en el tratamiento crónico), fármacos empleados, enfermedades crónicas más prevalentes, comorbilidad (según el índice de comorbilidad de Charlson ajustado por edad), complicaciones crónicas de la DMT2, neuropatía periférica (definida por una puntuación en la parte clínica del Michigan Neuropathy Screening Instrument superior a 2), malnutrición (puntuación inferior a 11 puntos en el Mini Nutritional Assessment-Short Form), índice de masa corporal (IMC), obesidad, índice cintura-cadera (ICC) y sintomalogía depresiva (mediante el Beck Depressión Inventory-II). Se tomó una muestra de sangre venosa en ayunas y orina espontánea para los parámetros analíticos: glucosa basal (mg/dL), insulina basal (µg/mL), resistencia insulínica (mediante la ecuación HOMA-IR), proteína C reactiva (mg/dL) y microalbuminuria (mg/dL).
Se consideró en las variables cuantitativas la asimetría de la distribución y el grado de apuntamiento respecto a la ley normal, con objeto de comprobar la idoneidad en la aplicación de posteriores pruebas estadísticas que exigen la normalidad de la distribución (prueba de Kolmogorov-Smirnov). Se construyeron los correspondientes intervalos de confianza al 95 % de las medidas de frecuencia estimadas y se describió la tasa de respuesta de los sujetos seleccionados. Las pérdidas del estudio se describieron según causa, edad y sexo. A continuación se realizó un análisis comparativo de la prevalencia de sarcopenia y dinapenia en sujetos con y sin DM2. El siguiente paso fue la comparación entre diabéticos según la presencia o ausencia en ellos de sarcopenia, por un lado, y de dinapenia, por otra parte, con la finalidad de establecer posibles diferencias estadísticamente significativas respecto a las variables independientes. En los casos en los que se realizaron múltiples comparaciones, se siguió el procedimiento de corrección de Bonferroni para controlar el error tipo I (división del nivel de significación α=0,05 por el número de comparaciones realizadas en cada apartado). En el análisis bivariante llevado a cabo para sarcopenia y dinapenia, de forma separada, ambas fueron consideradas como variables dependientes dicotómicas. Para las variables independientes de tipo cualitativo se utilizó el test χ2, o la prueba exacta de Fisher en el caso de que más del 25 % de los valores expresados fueran menores de 5. Cuando estas variables fueron cuantitativas y normales, se valoró su posible asociación con la dependiente mediante regresión logística simple, aceptándose las conclusiones sólo si el test de Hosmer y Lemes- how resultaba con una bondad de ajuste suficiente (p>0,05). En el caso de variables cuantitativas no normales, se optó por la categorización de las mismas y contraste mediante el test χ2. El análisis multivariante mediante regresión logística binaria se efectuó de forma independiente para la sarcopenia y la dinapenia. El primer paso fue la regresión logística simple con cada una de las variables que mostraron una asociación significativa en el análisis bivariante, prescindiéndose de aquellas cuya odd ratio no fuese significativa o que tuvieran un intervalo que incluyese la unidad. Posteriormente se realizó regresión logística binaria con todas las variables que superaron el requisito anterior (método: pasos adelante por razón de verosimilitudes). Finalmente, se procedió de igual forma respecto a las que permanecieron en la ecuación, pero mediante la introducción no automatizada y junto a otras variables de relevancia clínica que no alcanzaron el nivel de significación estadística exigido en el análisis bivariante previo. De nuevo se procedió a un ajuste, descartándose aquellas carentes de significación estadística o cuyas odds ratio presentaban las características anteriormente enunciadas.
RESULTADOS
De los 291 pacientes diabéticos seleccionados, lograron completar el estudio 211 (72,5 %). De los restantes hubo 42 que rechazaron la participación, 9 no cumplieron los criterios de inclusión, 28 presentaron criterios de exclusión y 1 exitus. La edad media fue de 69,03 años ± 11,32 DE, y la proporción de mujeres el 55 %. La edad superior o igual a 70 años representó el 52,6 % del total. Se completó una segunda muestra de comparación con 211 participantes no diabéticos, siguiendo los criterios de similitud expresados anteriormente.
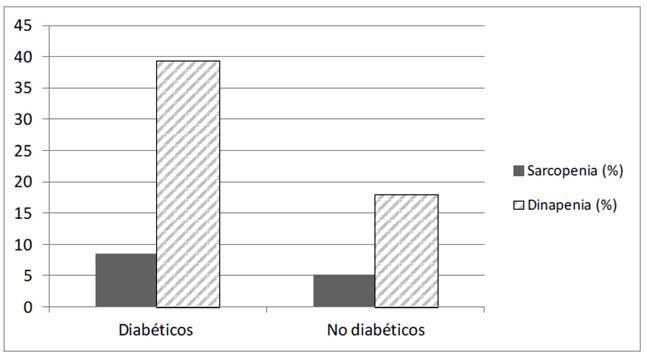
La prevalencia de sarcopenia en los pacientes con DMT2 fue del 8,5 % y en los no diabéticos del 5,2 %, sin que esta diferencia tuviese significación estadística. En cambio, la prevalencia de dinapenia sí fue significativamente diferente entre ambos grupos: 39,3 % en diabéticos frente al 18,0 % en no diabéticos (p<0,001) (Figura 1). Cuando la comparación se centró en la franja de edad > 70 años, la prevalencia de sarcopenia fue mayor (14,4 % en diabéticos y 8,0 % en no diabéticos), aunque sin alcanzar significación estadística. En el caso de la dinapenia, la prevalencia en los dos grupos fue superior en diabéticos (60,7 % en diabéticos y 31,0 % en no diabéticos, p<0,001) (Figura 2). Posteriormente se analizó, exclusivamente en participantes con DMT2, la posible relación de la sarcopenia y la dinapenia con ciertas variables de tipo sociodemográfico y clínico (Tabla 2).
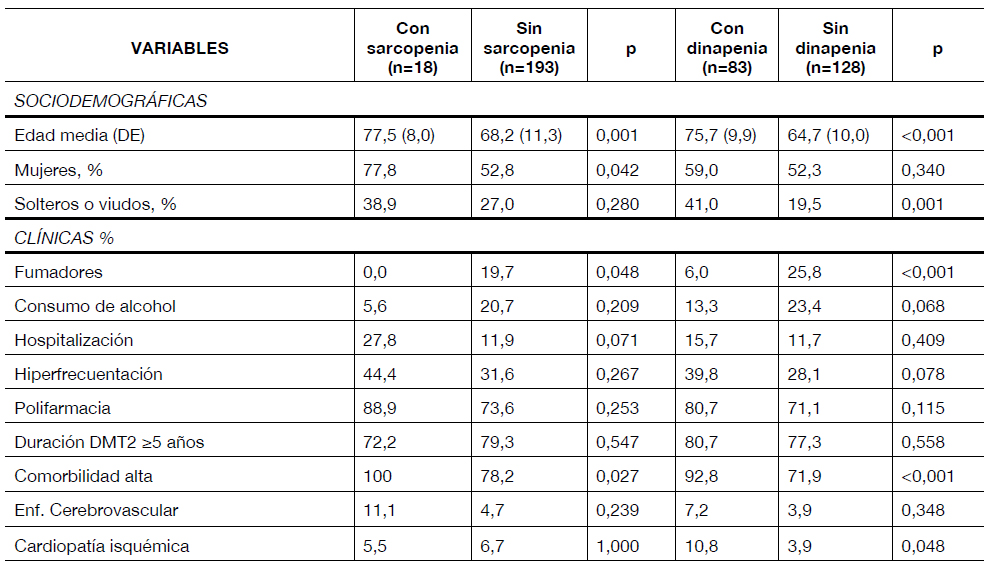
La edad media fue significativamente mayor tanto en los sujetos con sarcopenia (p=0,001) como en aquellos con dinapenia (p<0,001). Ambos síndromes fueron más frecuentes en mujeres, especialmente la sarcopenia (77,8 %), de manera que sólo en ésta la diferencia de género resultó estadísticamente significativa (p<0,05). El estado civil de soltero o viudo apareció en el 41,0 % de los diabéticos con dinapenia, frente al 19,5 % en quienes no la presentaban (p=0,001).
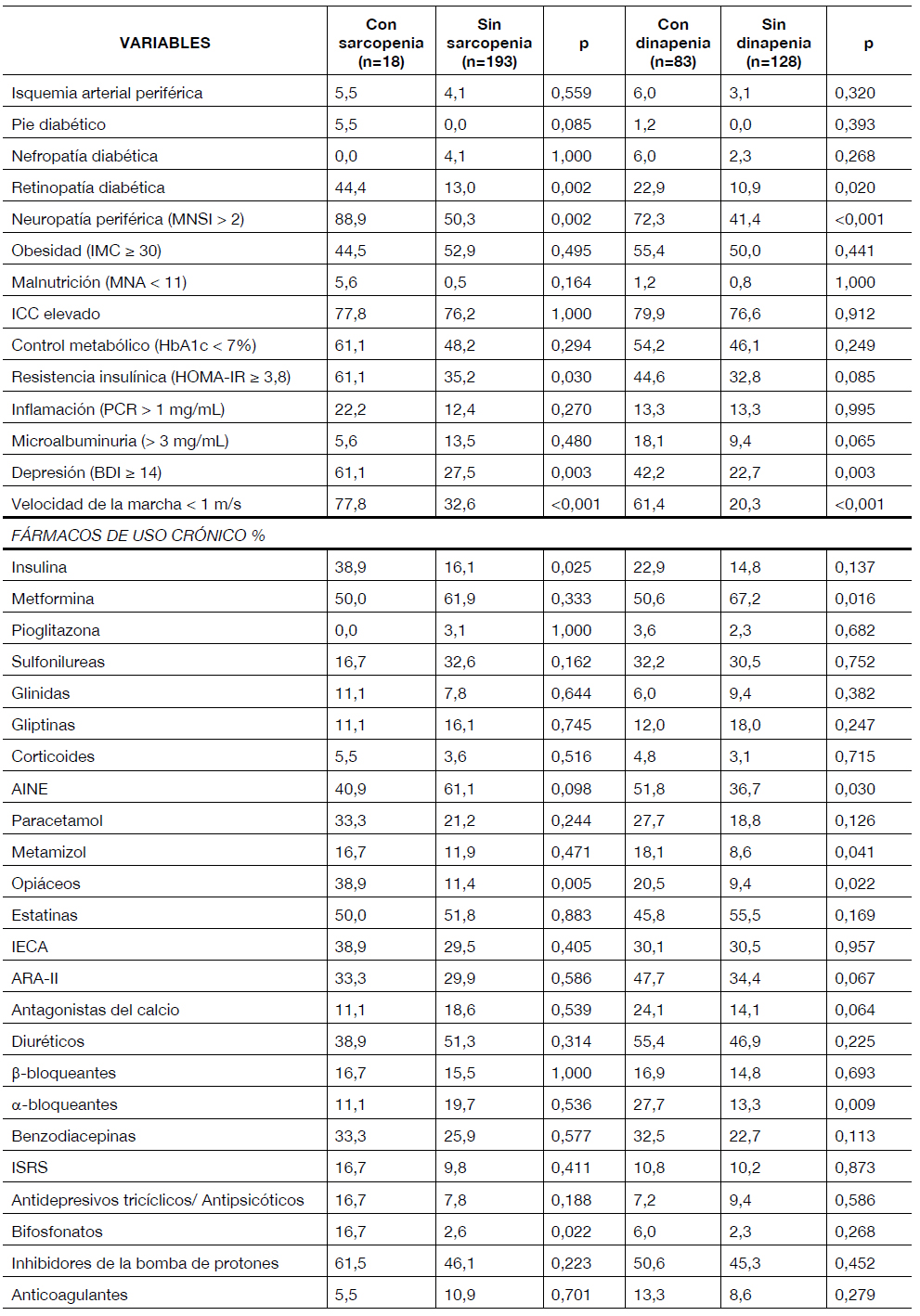
El análisis bivariante mostró un reducido número de variables clínicas que se asociaron de forma significativa tanto con sarcopenia como con dinapenia: comorbilidad elevada, retinopatía diabética, neuropatía periférica, depresión y no ser fumador en activo. Este hábito tóxico fue menos frecuente en pacientes con dinapenia. La velocidad de la marcha, admitiendo como punto de corte 1 m/s, mayor que el propuesto en la definición de sarcopenia, fue otra variable que resultó ser menor en presencia tanto de sarcopenia como de dinapenia (p<0,001 en ambos casos). La resistencia insulínica se asoció significativamente sólo a sarcopenia. La dinapenia mostró relación con la presencia de cardiopatía isquémica e insuficiencia cardíaca entre las enfermedades crónicas diagnosticadas. Ningún fármaco del tratamiento resultó significativo tras aplicar la corrección de Bonferroni.
Mediante regresión logística binaria se construyó un modelo de predicción, de forma separada para sarcopenia y dinapenia, a partir de las variables que resultaron significativas en el análisis bivariante para cada caso (Tabla 3). En el modelo de sarcopenia permanecieron en la ecuación: edad, osteoporosis, retinopatía diabética, glaucoma y resultado del BDI. El correspondiente a dinapenia mostró significación para las covariables: edad, gonartrosis, velocidad de la marcha elevada y anemia.
DISCUSIÓN
Una de las limitaciones del estudio ha sido la reducción de la muestra inicialmente seleccionada (27,5 %). La mayoría de sujetos que declinaron la participación o no acudieron a las citas del estudio fueron mayores de 80 años, lo cual ha podido condicionar una infraestimación de los síndromes musculo-esqueléticos analizados. A pesar de esta circunstancia desfavorable, la prevalencia de sarcopenia resultó similar a la obtenida en algunos países europeos como Francia o Bélgica39,40. En las publicaciones más recientes, además de factores regionales, se informa de resultados muy dispares dependiendo de los criterios y métodos diagnósticos empleados así como de la población estudiada36,41.
Nuestro estudio muestra que la DMT2 influye en el envejecimiento del músculo esquelético. Si bien la proporción de sarcopenia en diabéticos fue mayor, sin significación, la dinapenia alcanzó una prevalencia contundentemente superior respecto a la manifestada en los participantes no diabéticos. Aporta una prueba más a la información disponible hasta el momento, que desvincula la pérdida de fuerza muscular asociada a la edad del mismo proceso en la masa muscular, pareciendo que la DMT2 aumenta dicha desvinculación por su mayor impacto en la dinapenia. Por otro lado cabe preguntarse si la dinapenia comienza en edades más precoces que la sarcopenia. Al tratarse de un estudio transversal no podemos responder con seguridad a tal cuestión, pero sí podemos destilar alguna información indirecta que permita una aproximación. Si observamos los resultados de cada síndrome en los participantes no diabéticos menores de 70 años, la presencia de sarcopenia y dinapenia resultó muy similar. En la muestra de diabéticos no ocurrió así: mientras la sarcopenia volvió a tener una prevalencia del 2 %, la dinapenia aumentó al 16 %. Por tanto, la DMT2, además de asociarse a mayor prevalencia de dinapenia, probablemente anticipa su aparición.
Resulta un tanto arriesgado comparar nuestros resultados con los estudios publicados en esta materia. En aquellos llevados a cabo en países occidentales, se han analizado diversos indicadores musculares (entre ellos la masa y la fuerza muscular), comparando las diferencias entre participantes diabéticos y no diabéticos, sin referencias explícitas a los conceptos de sarcopenia o dinapenia. No obstante, parecen coincidir en la influencia que la DMT2 tiene en el deterioro muscular. Leerders y cols.10 encontraron un mayor descenso sólo en la MME apendicular, además de déficit en la FM de extensión de la rodilla. El InCHIANTI Study25 reveló que la MM era algo mayor en el grupo diabético, pero con menor densidad en cada zona anatómica valorada, explicable este hecho por la infiltración grasa muscular, más pronunciada en diabéticos. Tanto el Health ABC Study34,8,9 como el Hertfordshire Cohort Study35 observaron descensos más acusados de la FM de prensión manual en los participantes con DMT2. En algunos países asiáticos se han publicado estudios que abordan específicamente el diagnóstico de sarcopenia entre la población con DMT2, con prevalencias superiores a las nuestras: 15,7 % en Corea30 y 39,5 % en la India36.
Sarcopenia y dinapenia comparten una serie de factores asociados, como la edad y otros relacionados con complicaciones de la DMT2. Entre ellos destacamos la neuropatía periférica, que coincide con los estudios de Andersen y cols. (20 en el que sobresale la influencia que esta complicación tiene sobre el déficit muscular en diabéticos. El descenso del tono dopaminérgico central que caracteriza a la depresión repercute en la activación voluntaria del músculo esquelético37. Nuestro estudio ha detectado esta asociación de ambos síndromes con la sintomatología depresiva, con elevada significación estadística. También se confirma a la resistencia insulínica como alteración común a DMT2 y sarcopenia, pero no con la dinapenia. La insulina interviene en la síntesis de proteínas musculares por lo que una resistencia a la misma tendría una repercusión más directa en la masa muscular, y no en la generación de FM38.
Como conclusión, nuestros resultados confirman un mayor envejecimiento del músculo esquelético en pacientes con DMT2, especialmente importante en lo referente al déficit de FM o dinapenia. Se debería incorporar la exploración del sistema muscular esquelético en las revisiones de estos pacientes como método de prevenir futuras limitaciones funcionales. Este estudio proporciona una serie de características clínicas, fácilmente identificables en Atención Primaria, que aumentan la probabilidad de que los diabéticos presenten sarcopenia o dinapenia. Su mejor conocimiento permitiría incidir sobre aspectos de gran importancia en la evolución de ambas alteraciones, como el ejercicio físico y la dieta (especialmente la ingesta proteica), que no han sido abordados en la investigación por las limitaciones de la misma.