INTRODUCCIÓN
Las funciones de los aminoácidos en el organismo tienen un ámbito estructural como parte de las proteínas, energética como intermediarios en la gluconeogénesis y metabólica como reguladores de enzimas o como precursores de hormonas y neurotransmisores. Sin embargo, una tarea menos conocida es la importancia de ciertos aminoácidos como protectores renales en el tratamiento con radionúclidos receptores de péptidos (PRRT)1.
PRRT representa un enfoque terapéutico novedoso y eficaz frente a tumores sst2-positivos anteriormente incurables. La terapia PRRT tiene por objetivo mejorar la farmacocinética e incrementar la dosis de fármaco que alcanza el tejido diana en tumores neuroendocrinos (TNE). Una característica de este tipo de tumores es la sobreexpresión de los receptores de somatostatina (SSTR), cuyo tratamiento incluye análogos de la somatostatina o péptidos marcados con radionúclidos. La acción terapéutica de estos fármacos se inicia con su internalización, mediada por receptores, de estas sustancias marcadas radioactivamente y la posterior emisión radioactiva que destruye las células tumorales diana. El primer tratamiento de este tipo se realizó de forma experimental con indio (111In) pentetreotida, aunque actualmente sólo está autorizado en TNE gastroenteropancreáticos (TNE-GEP) bien diferenciados. Otro representante de esta familia ya autorizado es el lutecio (177Lu) oxodotreotida para el tratamiento de TNE-GEP con expresión de SSTR, bien diferenciados , progresivos, irresecables o metastásicos2.
Sin embargo, estos fármacos presentan efectos adversos graves, como mielosupresión o insuficiencia renal, que podrían limitar las dosis recibidas y comprometer su eficacia terapéutica3. Los pacientes más afectados por la nefrotoxicidad por este tipo de terapia suelen ser aquellos que presentan antecedentes de hipertensión arterial, diabetes, anormalidades morfológicas renales o administración previa de otros agentes nefrotóxicos4. Esta toxicidad renal se debe a que este tipo de fármacos hidrofílicos son rápidamente aclarados a través del glomérulo aunque un pequeño porcentaje es reabsorbido y retenido en los túbulos proximales corticales mediante la unión a receptores endocíticos en el que participa megalina. Tras degradarse en el interior celular, los conjugados de aminoácidos emiten una alta radiación que afecta a la corteza renal5.
Con el objetivo de reducir la toxicidad renal se ha intentado emplear expansores plasmáticos o albúmina en animales de experimentación6. Aunque la forma más extendida y utilizada en la práctica clínica suelen ser soluciones de aminoácidos catiónicos como Arginina y Lisina por vía intravenosa7,8. Estos aminoácidos, mediante una inhibición competitiva de la unión con megalina, evitan la reabsorción de los PRRT y, por tanto, incrementan su eliminación del organismo9,10. Con el objetivo de aprovechar estas propiedades, estos aminoácidos se administran previamente a la terapia PRRT, de forma que cuando el radionúclido alcance el riñón no puedan reabsorberse11. Una reducción en la nefrotoxicidad podría incrementar las dosis seguras empleadas en la terapia y aumentar su eficacia en la estrategia antitumoral12.
Ante la imposibilidad de disponer de soluciones compuestas exclusivamente por estos dos aminoácidos, se han empleado soluciones comerciales que presentan un contenido apto para su uso como nefroprotectores13 o incluso por vía oral, aunque esta última vía de administración sólo a nivel experimental14. Con este estudio se pretende revisar el contenido de L-Lisina y L-Arginina en la formulación de las soluciones de aminoácidos y de nutrición parenteral según la información contenida en las fichas técnicas de autorización de los productos comercializados en España por parte de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) o de la Agencia Europea del Medicamento (EMA) para describir los siguientes aspectos relevantes:
Nombre comercial de la solución de aminoácidos o fórmula empleada en nutrición parenteral que no tuviese otros macronutrientes o electrolitos añadidos a su formulación.
Contenido en L-Lisina y L-Arginina por presentación comercial, especificando el volumen de la solución y la cantidad de ambos aminoácidos.
Osmolaridad de las soluciones de aminoácidos. Tras esta recogida de datos, se compara con la composición de las soluciones de aminoácidos indicados en la ficha técnica de INN-lutetium (177Lu) con fines de protección renal.
MATERIAL Y MÉTODOS
Se realizó una búsqueda de soluciones de aminoácidos y nutriciones parenterales completas autorizadas y comercializadas en España hasta marzo de 2021 mediante la información disponible en las fichas técnicas de los medicamentos autorizados en España. Las bases de datos utilizados corresponden a la información disponible alojada en la página web tanto en AEMPS como en EMA.
En el caso de carecer de información disponible en estas fichas de autorización y comercialización se consultó literatura científica sobre estabilidad, compatibilidad y presentaciones comerciales de medicamentos, que arrojase información sobre el objeto de este estudio.
De acuerdo a la información recopilada fueron seleccionados aquellos medicamentos que cumplieran los siguientes criterios:
Autorizados y comercializados en España hasta la fecha del estudio (marzo 2021).
Disponibilidad de presentación cuya vía de administración fuera parenteral.
Información disponible de contenido de L-Lisina y LArginina en la ficha técnica, indicando volumen y osmolaridad de presentación comercial.
Aquellas presentaciones de las que no se disponga de información serán excluidas, ya sea en ficha técnica o bibliografía consultada.
En el caso de que hubiera más de una presentación con el mismo nombre comercial pero de diferente volumen, sólo se mostrará el contenido de aquella con el mayor volumen.
La revisión fue realizada por dos investigadores de forma independiente, las diferencias se resolvieron consultando de nuevo aquellas presentaciones objeto de discrepancia.
RESULTADOS
Tras realizar la búsqueda a través de la Agencia Española de Medicamentos y Productos Sanitarios, se analizaron 23.658 presentaciones comerciales comercializadas y autorizadas en España hasta marzo de 2021. Todas aquellas presentaciones comerciales que no fueran fórmulas de nutrición parenteral fueron descartadas. Así, tras esta primera fase, se seleccionaron 90 presentaciones comerciales. El resultante de esta primera clasificación fue sometido a otro cribado mediante la exclusión de todas aquellas presentaciones que tuviesen electrolitos u otros macronutrientes como glucosa o lípidos. Es importante señalar que existen presentaciones con cierto contenido en electrolitos que cumple una función de conservación y estabilidad de las soluciones y, en ningún caso, tienen un objetivo final terapéutico, de ahí que fueron incluidas.
Asimismo, aquellas soluciones que cumplían estos criterios pero con diferentes volúmenes de presentación, fueron incluidos sólo aquella que contenía mayor volumen. Tras confirmar que 18 presentaciones comerciales cumplían los criterios de inclusión, se analizaron sus fichas técnicas. Al revisar las fichas técnicas, se comprobó que existían diferentes formas en las cuales se incorporaba los aminoácidos en cuestión, ya sea en su forma racémica (L-Lisina o LArginina) o en forma de sal (por ejemplo, hidrocloruro de Lisina o Arginina). En el caso de que estuvieran incorporadas en forma de sal, se calculó el contenido de Lisina o Arginina de acuerdo al peso molecular del componente en cuestión en caso de que no lo indicase explícitamente la ficha técnica. Para un mejor enfoque y comparación entre diferentes presentaciones, se extrapoló a un volumen común de 1000 ml, tal y como se indica en la tabla 1.
La comparación del contenido de L-Arginina y L-Lisina de las soluciones incluidas en el estudio frente a las recomendadas en la ficha técnica se puede observar en la figura 1. Se ha empleado como límite el volumen de 2000 ml ya que así se indica como el volumen máximo potencialmente empleado para la protección renal. El contenido no es uniforme en todas las soluciones e incluso se da la circunstancia que existen soluciones que superan ampliamente el contenido de L-Arginina pero no se acercan al contenido mínimo requerido de L-Lisina. En términos cuantitativos el contenido mínimo en L-Arginina de las soluciones estudiadas es de 11,5 gramos en 2000 ml, muy inferior al requerido. De igual forma, el contenido mínimo de L-Lisina es de 2,78, en ambos casos corresponde a la misma presentación comercial. Como media de todas las soluciones incluidas en el estudio, el contenido de L-Arginina es superior a L-Lisina y sólo en tres presentaciones comerciales sucede lo contrario. Es de destacar que aunque algunas soluciones superan el contenido mínimo exigido, todas las que lo superan presentan una osmolaridad que requiere vía central, situación que es coherente con la alta carga osmolar que presentan todos los aminoácidos.
DISCUSIÓN
Debido a que la terapia PRRT tiene como uno de los principales efectos adversos la nefrotoxicidad se han empleado las soluciones de aminoácidos como forma de prevenir la reabsorción tubular del radionúclido. Esta reabsorción causa microangiopatía trómbica renal y representa una seria limitación para la terapéutica. Este estudio determina que existen soluciones de aminoácidos comercializadas en España que podrían cumplir con los requisitos exigidos de contenido en L-Lisina y L-Arginina, en caso de que no fuera posible su preparación por otros medios o no estuviera disponible una solución comercial de, exclusivamente, los dos aminoácidos.
Tabla 1. Contenido de Lisina y Arginina de las soluciones de aminoácidos que cumplen los criterios de inclusión para un volumen de 1000 ml
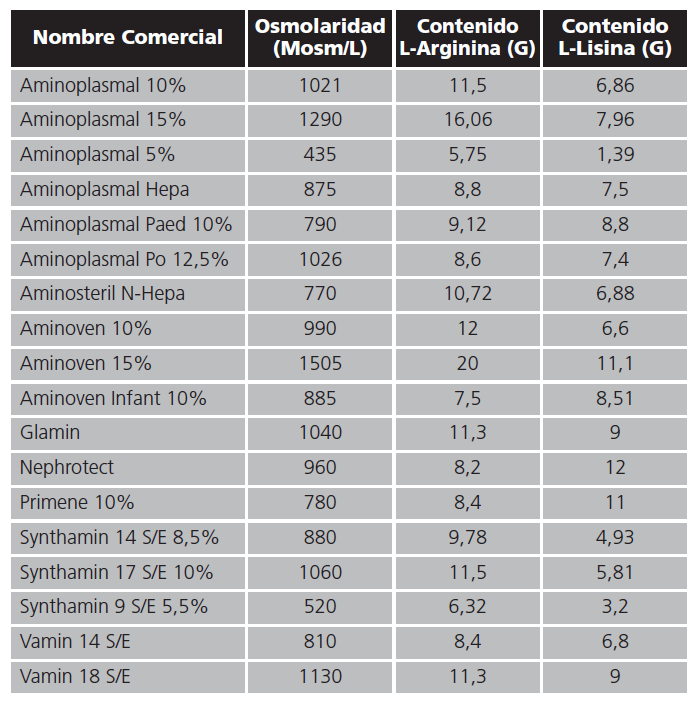
Uno de los posibles inconvenientes en la utilización de aminoácidos en este ámbito es que, a pesar de las cantidades indicadas en la ficha técnica, no existe un contenido en Lisina y Arginina plenamente establecido como eficaz ni tampoco la duración de perfusión de las soluciones de aminoácidos. Algunos autores han empleado un contenido inferior de ambos aminoácidos, llegando a un mínimo de 11,3 g de LArginina y de 9 g de L-Lisina y hasta un máximo de 50 g de L-Lisina y 50 g de L-Arginina8,10, si bien en estas circunstancias la perfusión se alargaba durante diez horas. Aún así, el contenido habitualmente empleado en esta terapia es de 25 g de L-Lisina y L-Arginina ya que a partir de esta cifra no aumenta la capacidad de inhibición de la reabsorción tubular del radionúclido. Sí se ha visto que a mayor tiempo de infusión de la solución de aminoácidos, menor es la reabsorción del radionúclido, y por lo tanto, permite aplicar tratamientos a dosis más altas del mismo11.
Actualmente, el empleo de soluciones de aminoácidos tiene varias desventajas, entre las que se incluyen náuseas, vómitos, cambios metabólicos (hiperpotasemia, hipofosfatemia) y la osmolaridad de la solución final que en el caso de una osmolaridad superior a 800 mOsm/l obligaría a cambiar la administración de vía periférica a vía central, tal y como indica la Sociedad Española de Nutrición Parenteral y Enteral15.
La hiperpotasemia constituye el problema más grave que acompaña a estas soluciones, estando relacionado con los aminoácidos Lisina y Arginina. Aunque existen diferentes factores que influyen en la aparición de la hiperpotasemia, parece ser que el mecanismo de acción principal se debe a las características cetogénicas de Lisina, que reduce el pH intracelular y causa la salida al exterior del potasio intracelular16.

Figura 1. Comparación de las soluciones incluidas con el contenido de Lisina y Arginina para un volumen de 2000 ml recomendado en ficha técnica de Lutecio
Otros factores de riesgo que causan hipercalemia son una tasa de filtrado glomerular baja, edad avanzada, niveles de creatinina y/o urea previamente altos o un ritmo alto de infusión de las soluciones de aminoácidos. La excreción reducida de potasio también podría ser también producida por la administración concomitante de fármacos como diuréticos ahorradores de potasio o antihipertensivos17. La hipofosfatemia podría ser debido a un incremento del anabolismo, un cambio intracelular relacionado con la acidosis o el descenso en la reabsorción de fosforo por un bloqueo tubular no específico. Todos estos cambios electrolíticos suelen desaparecer a las 24 horas tras el inicio de la administración y su duración no está influida por las cantidades relativas o absolutas de Lisina o Arginina18.
En cuanto a la osmolaridad, este estudio muestra que las soluciones de aminoácidos analizadas presentan una osmolaridad alta que requiere su administración por vía central que podría ser una de las causas de generar náuseas y/o vómitos. Esta osmolaridad es resuelta por otros autores mediante la combinación de aminoácidos con Ringer lactato19, fisiológico20 o expansores plasmáticos21. Aunque queda fuera del ámbito de este estudio, no se ha podido establecer la estabilidad o compatibilidad de las soluciones resultantes tras la adición de otros componentes o la mezcla de diferentes presentaciones comerciales.
CONCLUSIONES
Como conclusión de este estudio, se ha podido evaluar el contenido de L-Lisina y L-Arginina de las soluciones comerciales autorizadas en España que podrían ser potencialmente empleadas durante la PRRT. Es importante conocer las características de estas soluciones tanto en osmolaridad como en contenido no sólo con el objetivo de interferir en la reabsorción renal del radionúclido y, como consecuencia, reducir la nefrotoxicidad sino también conocer sus efectos adversos para disminuirlos o incluso prevenirlos en su totalidad.














