INTRODUCCIÓN
Los meningiomas son tumores que nacen de la duramadre y derivan de las células del recubrimiento meningotelial que residen en las cubiertas aracnoideas del encéfalo. Son una de las neoplasias cerebrales más frecuentes1,2, representando el 15-20% del total de neoformaciones primarias del sistema nervioso central en adultos3 y el 20-35%4,5,6,7 de las intracraneales. Afectan a 2 de cada 100.000 habitantes (excluyendo los casos asintomáticos) y han experimentado un incremento en su diagnóstico directamente proporcional al aumento de uso de técnicas de imagen3. Su incidencia aumenta con la edad, siendo más frecuentes a partir de la segunda década de vida8, con un pico de edad a los 50-60 años. El 90% son intracraneales y el 10% intrarraquídeos. Si diferenciamos en función del sexo, los meningiomas suponen el 20% de los tumores intracraneales masculinos y el 38% de los femeninos, con una relación mujeres-hombres de 2:1. Atendiendo a los intracraneales, constituyen el 7% de los tumores de la fosa posterior y entre el 3-12% de los tumores del ángulo pontocerebeloso, compartiendo esta localización con otras neoplasias intracraneales frecuentes como el schwannoma9. Asimismo, pueden extenderse a senos paranasales y cavidad nasal, desplazando el nervio y el quiasma óptico3. Son múltiples en un 5-15%, especialmente si se asocian a neurofibromatosis tipo 2.
La mayoría de los meningiomas son de estirpe benigna, pero existen casos de meningiomas atípicos y malignos suponiendo menos del 5% del total de los mismos4.
Etiología
Entre los factores que influyen en su etiología podemos destacar factores exógenos como la radiación a altas dosis, único factor de riesgo confirmado10, siendo en estos casos con mayor frecuencia múltiples, malignos y con tendencia a recidivar. Existen así mismo evidencias para atribuir a estos tumores un cierto componente hormonal (estrógenos y progesterona).
En su desarrollo interviene la activación de oncogenes y la desaparición de genes supresores de tumores: protooncogen c -cis y el gen NF2 (presente en casi todos los meningiomas familiares), lo cual explica que los pacientes con neurofibromatosis tipo 2 tengan más riesgo de padecerlos.
Algunos antígenos víricos tienen un papel importante en la etiología de estos tumores, como el virus herpes simple tipo 111. Otros factores como la obesidad están aún en fase de investigación, y existe controversia en su relación con los mismos10, al igual que ocurre con su asociación con traumatismos craneoencefálicos.
Manifestaciones clínicas
Una gran parte de los meningiomas son asintomáticos, descubriéndose de forma incidental mediante un estudio de Tomografía Computarizada (TC) o Resonancia Magnética (RM). Los síntomas que presentan este tipo de tumores dependen de la localización de los mismos: pueden causar compresión de las estructuras adyacentes, edema peritumoral11, desestructuración cerebral e invasión de la corteza cerebral y periostosis.
Los síntomas más frecuentes son cefalea, papiledema asociado a alteraciones visuales o anosmia por compresión de pares craneales, alteraciones cognitivas y de la conducta, hemiparesias y mareos3. Pueden cursar con hipertensión intracraneal y crisis convulsivas de años de evolución12.
Diagnóstico por imagen
Para el diagnóstico de tumores cerebrales la resonancia magnética y la tomografía computerizada son técnicas de uso obligatorio13. Es frecuente que tras la aparición de síntomas neurológicos en el contexto de una hemorragia intracraneal o de un ictus, la TC sea la primera prueba a realizar; sin embargo, en el diagnóstico de masa ocupante de espacio intracraneal la RM juega un importante papel14. La RM además está indicada para clasificarlos15, aportando información funcional acerca del tumor. Y no debemos olvidar que ha supuesto un avance de cara al tratamiento gracias a su diagnóstico precoz16.
El estudio anatómico de la imagen en RM se compone de secuencias T1, T2, secuencia de recuperación de inversión atenuada de fluido (FLAIR) y T1 con contraste13. Las imágenes potenciadas en T1 son las que demuestran una mayor correlación anatómica mientras que imágenes potenciadas en T2 demuestran mejor los cambios anatómicos relacionados con la patología. La secuencia FLAIR es una secuencia T2 potenciada con un mecanismo de inversión-recuperación que produce una supresión de la señal del líquido cefalorraquídeo (LCR), siendo útil para visualizar imágenes adyacentes a espacios que contienen LCR como las áreas periventriculares y de la convexidad17. El contraste que se utiliza en neuroimagen es el gadolinio y con su uso se consigue la determinación de elementos patológicos mediante su realce18.
Desde el punto de vista anatómico la RM muestra la relación del tumor con el tronco encefálico, con los pares craneales y con los vasos sanguíneos. Estos hallazgos son importantes porque explican tanto la clínica como el pronóstico del paciente, y pueden ayudar en la toma de decisiones respecto a su tratamiento. No siempre es sencilla su detección ya que tienen una localización, tamaño y forma variable, y su imagen en resonancia magnética puede ser muy heterogénea y confundirse con el tejido sano de alrededor19.
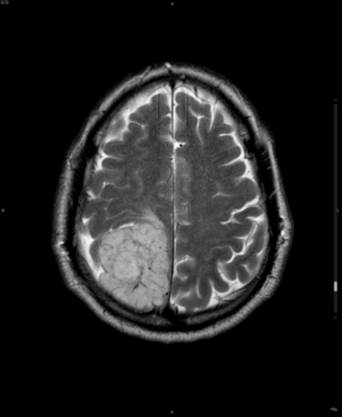
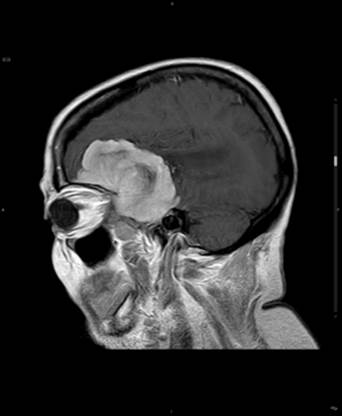
En el estudio de RM sin contraste la mayoría de los meningiomas presentan un aspecto redondeado homogéneo. En la secuencia potenciada en T1 son isointensos8 a la corteza cerebral adyacente en un 50% de los casos, o hipointensos8 en el 50% restante. En la secuencia potenciada en T2 podemos observar una tumoración hiperintensa8 en el 50% de los casos respecto a la sustancia gris adyacente (Figura 1), mientras que el 50% restante son isointensos. La presencia de heterogenicidad en T1 y en T2 se correlaciona con cambios intratumorales como presencia de grasa, quistes, calcificaciones y neoformación de vasos prominentes. Todos ellos presentan realce8 rápido, intenso y homogéneo9 tras la administración de contraste intravenoso (Figura 2), que permite detectarlos y localizarlos con exactitud. La localización y la invasión encefálica predicen la evolución clínica.
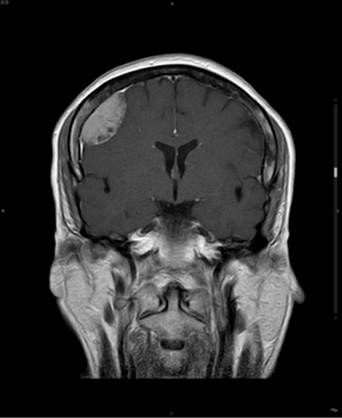
En el margen del tumor suele observarse la cola dural (extensión engrosada y ahusada de duramadre realzada por el contraste), que es un importante factor pronóstico (Figura 3). Así mismo, es fundamental en el estudio prequirúrgico para la correcta interpretación de los bordes de resección, ya que esta manifestación puede ser debida a infiltración tumoral o a reacción de la duramadre.
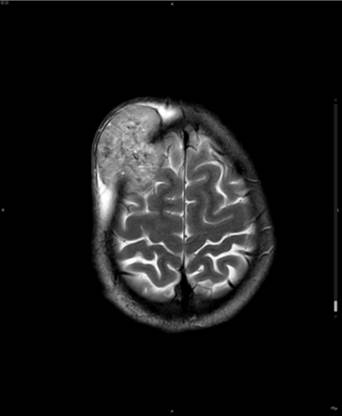
Muchos criterios de imagen sugieren una invasión encefálica y determinan el diagnóstico de tumor anaplásico o maligno. Algunos de ellos son márgenes tumorales irregulares o indistintos, extensión en forma de hongo, tumor opacificado y drenaje venoso prominente en sentido central. También es característico de los meningiomas atípicos y anaplásicos la presencia de quistes, hemorragias o necrosis, lo que produce una señal heterogénea dentro del tumor y reafirman los criterios de malignidad2. En los meningiomas malignos las características más frecuentes son la destrucción ósea (Figura 4), la necrosis, el realce irregular o la proyección encefálica. El edema marcado peritumoral es sugestivo de malignidad, interfieren en su formación, el tipo histológico, vascularización, factores de crecimiento endotelial, prostaglandinas y el nivel hormonal20, siendo menos relevante la compresión que ejerce localmente el tumor en su formación21. Destacar que el tamaño del tumor y su localización también intervienen en la formación del edema, siendo, en estos casos independiente de la malignidad del tumor.
Como se ha citado anteriormente, la RM ofrece además de un punto de vista anatómico un punto de vista fisiológico mediante técnicas específicas como son DWI (secuencia de difusión) y MRS (espectroscopia), esta última dando un enfoque metabólico a la prueba13. Es interesante destacar el uso de la técnica de difusión (DWI) con el fin de detectar isquemia. Esta secuencia es útil para detectar necrosis postradiación como causa de la aparición de meningiomas intracraneales16 convirtiéndose en algunos centros en una práctica rutinaria.
Estudio Histopatológico
El diagnóstico de confirmación de meningioma se obtiene mediante estudio Histopatológico2. Este estudio no se realiza de rutina, reservándose casi en su totalidad a los casos en los que se indique su resección para confirmar el grado de agresividad del mismo.
La realización de una biopsia de tejido cerebral no está exenta de riesgos, sobre todo en pacientes ancianos22 con alto riesgo médico-quirúrgico y en meningiomas de localizaciones de difícil acceso15. La amplitud y tiempo necesario para acceder al meningioma van a influir en la morbilidad22.
Macroscópicamente son tumores nodulares encapsulados y se encuentran adheridos a la duramadre, donde reside su vascularización. Son extraaxiales y suelen estar próximos a la sustancia gris, al hueso y al fluido cerebroespinal1. A veces se distribuyen en placas, pueden comprimir estructuras adyacentes y sufrir un fenómeno de hiperóstosis.
Microscópicamente son tumores generalmente benignos, de crecimiento lento1,23. El diagnóstico se basa en rasgos histopatológicos característicos como la presencia de remolinos de células aracnoideas que rodean un material hialino central los cuales se calcifican dando cuerpos de Psamoma, o la disposición de sus células en vainas separadas por trabéculas de tejido conjuntivo.
Existen varias clasificaciones según su histopatología, siendo la más importante la clasificación de la OMS 201624 la cual se basa en la proliferación celular medida mediante la proteína Ki6725, mitosis, y hallazgos histológicos tales como necrosis y la presencia de invasión encefálica. Según estos parámetros se clasifican en meningiomas grado I: típicos (o benignos), grado II: atípicos y grado III3: malignos.
Dentro de los clasificados como grado I encontramos los siguientes subtipos histológicos: meningotelial, fibroso (fibroblástico), transicional (mixto), psamomatoso, angiomatoso, microquístico, secretor, linfoplasmocítico y metaplásico23. Dentro de los grado II encontramos los subtipos cordoide, de células claras y atípico. Por último dentro de los grado III encontramos los subtipos papilar4, rabdoide y anaplásico23.
El 3% de los benignos (grado I) recidiva a los 5 años, mientras que los clasificados como grado II y III tienen un riesgo de recidiva del 78%, además la supervivencia en estos casos está disminuida23.
Existen tumores extraaxiales que pueden compartir características con los meningiomas; para diferenciarlos, la inmunohistoquímica es esencial23,26.
La expresividad de FAS (ácido graso síntasa) y BFABP (proteína ligadora de ácidos grasos cerebrales) es alta en invasión cerebral y recurrencias23,27,28, permitiéndonos diferenciar meningiomas grado I, de los grado II y III. La expresión de COX-2 es más frecuente en meningiomas grado II, y es un dato de mal pronóstico importante en los pacientes supervivientes de meningioma de este grado23,29. Otras proteínas correlacionadas con la malignidad de los meningiomas son la AKT-2 y NY-ESO-123.
Tratamiento
Para la decisión del tratamiento a realizar se requiere un conocimiento exhaustivo de la localización y extensión del tumor, de su grado en función de la clasificación de la OMS y de la actividad biológica y la funcionalidad del tejido cerebral circundante. Para todo ello las técnicas de elección son tanto la RM como la PET-TC13. La RM tiene una importante implicación a la hora de establecer el plan terapéutico, pero es especialmente esencial en el seguimiento posterapéutico, pudiendo monitorizar la aparición de recidivas y su progresión a mayor grado de agresividad tumoral14.
El tratamiento se basa en la resección quirúrgica en los casos sintomáticos y de gran tamaño, y en el seguimiento en los tumores asintomáticos y de pequeñas dimensiones. Puede utilizarse radioterapia de haz externo o radiocirugía estereotáctica (SRS) tras la cirugía para evitar la aparición de recurrencias. La quimioterapia no es efectiva en estos tumores, aunque han aparecido nuevas líneas de investigación que podrían ser eficaces16. La radioterapia no se utiliza como procedimiento primario. Es útil en tumores residuales después de la cirugía, en tumores malignos y en recidivas.
OBJETIVOS
Debido a la alta prevalencia de meningiomas intracraneales en la edad adulta y la disponibilidad para su estudio de una técnica poco cruenta como es la RM, se plantean los siguientes objetivos:
Determinar si la agresividad de los meningiomas intracraneales objetivada en función de los hallazgos observados en Resonancia Magnética es congruente con la agresividad objetivada mediante estudio histopatológico.
Revisar mediante RM los diferentes tipos de meningiomas intracraneales y sus características radiológicas en función de su agresividad.
MATERIAL Y MÉTODOS
Se realiza un estudio observacional transversal de pruebas diagnósticas en el que evaluamos la imagen de Resonancia Magnética y el resultado histopatológico de los distintos meningiomas. La población a estudio comprende aquellos pacientes pertenecientes al Hospital Central de la Defensa Gómez Ulla (procedentes del Sistema Nacional de Salud ó ISFAS), a los que les ha sido diagnosticado un meningioma intracraneal mediante un estudio de Resonancia Magnética por el Servicio de Radiodiagnóstico y posteriormente se ha llevado a cabo un estudio histopatológico por el servicio de Anatomía Patológica de dicho hospital. Se realiza una tabla donde se comparan las distintas variables determinadas en el estudio de diagnóstico por imagen con la variable correspondiente al grado de agresividad en el estudio histopatológico. Posteriormente se realiza el análisis estadístico de los datos recogidos.
RESULTADOS
Se han reclutado 14 pacientes con estudio de meningioma intracraneal mediante Resonancia Magnética y examen histopatológico de los mismos, de los cuales 8 (57,1%) eran varones y 6 (42,9%) mujeres comprendidos entre los 27 y los 81 años. La edad media al diagnóstico en nuestra muestra ha sido 60 años en varones y 66 años en mujeres. Del total de meningiomas estudiados, 4 (28,6%) fueron tipificados como meningiomas grado II y grado III según la clasificación de la OMS para su imagen histopatológica, clasificándolos como meningiomas agresivos, mientras que los 10 casos restantes (71,4%) se tipificaron como grado I según la misma clasificación, y por lo tanto benignos.
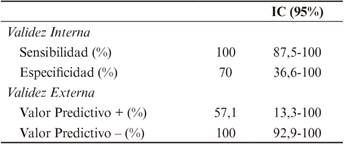
De los 14 meningiomas analizados, 7 (50%) fueron categorizados como agresivos acorde a las características radiológicas estudiadas en RM (prevalencia aparente de los agresivos en los pacientes de nuestra muestra), frente a los 4 (28,6%) IC95% (1,54-55,81%) que lo fueron mediante examen histopatológico (prevalencia real de meningiomas agresivos en los pacientes de nuestra muestra). Los resultados obtenidos en el estudio de validez de la Resonancia Magnética, tomando como gold standar el examen histopatológico con un IC de confianza del 95% fueron las siguientes: como datos de validez interna se ha obtenido una sensibilidad de un 100% IC95% (87,5-100), con la consiguiente ausencia de Falsos Negativos; especificidad de un 70% IC95% (36,6-100), contando con 3 Falsos Positivos. Como datos de validez externa se ha obtenido un Valor Predictivo Positivo (VPP) de 57,14% IC95%(13,3-100) y un Valor Predictivo Negativo (VPN) del 100% IC95%(92,9-100).
El Índice de Youden calculado fue 0,7 IC95% (0,42-0,98) y el índice de validez (Kappa) fue 78,6 IC95%(53,5-100) (Tabla 1 y Tabla 2).
Tabla 1 Estudio de Pruebas diagnósticas: datos obtenidos en el estudio por RM tomando como GOLD ESTÁNDAR el estudio Histopatológico.

Tabla 2 Validez Interna y Externa del estudio de la agresividad de meningiomas intracraneales por Resonancia Magnética.
*IC(95%): Intervalo de Confianza del 95%
Todas las variables utilizadas para la determinación de la agresividad mediante RM (márgenes irregulares, realce heterogéneo, invasión de hueso, necrosis, hemorragia y edema vasogénico peritumoral), se observaron en su totalidad (100% de los casos) en meningiomas agresivos (grados II, III), excepto el edema vasogénico peritumoral que se observó en 5 de los casos tipificados como no agresivos (grado I), siendo el 50% agresivos y el 50% no agresivos del total casos con edema.
Las únicas variables de medición del comportamiento radiológico del meningioma que consiguieron una adecuada significación estadística (p:0,05), medida mediante el test exacto de Fisher, acorde al estudio de agresividad, por RM fueron: márgenes tumorales irregulares (p:0,050) y realce heterogéneo (p:0,026), no consiguiendo ninguna de las dos significación estadística mediante el estudio histopatológico. La variable necrosis muestra un tendencia (p:0,070) mediante el estudio por RM.
Por otro lado, ninguna variable de comportamiento radiológico ha conseguido suficiente significación estadística acorde a los resultados de agresividad mediante estudio histopatológico. Sí existe una tendencia a demostrar agresividad en las variables: realce heterogéneo (p=0,095), infiltración de hueso (p=0,066), hemorragia intratumoral (p=0,066) y neoformación de vasos (p=0,095).
En el estudio de agresividad por RM, todas las variables de comportamiento radiológico se presentaron con mayor frecuencia en meningiomas agresivos a excepción del edema vasogénico que se presentó de la misma manera en meningiomas agresivos y no agresivos, y las variables calcificaciones intracraneales y degeneración quística, las cuales se presentaron con mayor frecuencia en meningiomas no agresivos de la siguiente manera: 2(66,7%) (p:1,000) y 1(100%) (p:1,000) respectivamente, destacando que la degeneración quística se presenta de manera exclusiva en meningiomas no agresivos.
En el análisis de las variables por estudio histopatológico, las variables se distribuyen de manera dispar a lo observado mediante el análisis por RM. En concordancia con el estudio por RM las variables realce heterogéneo, infiltración de hueso, hemorragia y neoformación de vasos se presentaron con mayor frecuencia en meningiomas agresivos, 3 (60%) (p:0.095), 2 (100%) (p:0,066), 2 (100%) (p:0,066) y 3(60%) (p:0,095) respectivamente. Las variables, calcificaciones y degeneración quística, concordaron con el estudio por RM, presentándose con mayor frecuencia en meningiomas no agresivos, 3 (100%) (p:0,505), 1(100%) (p:1,000) respectivamente. El resto de variables se distribuyeron de manera dispar al estudio por RM.
Las únicas variables que se distribuyeron con frecuencia exacta en el estudio por ambas técnicas fueron infiltración de hueso, degeneración quística y hemorragia intratumoral con la misma significación estadística sólo en el caso de la degeneración quística (p:1,000) (no significativo).
Las frecuencias absolutas y relativas de las características radiológicas según su presentación en meningiomas agresivos acorde al estudio realizado mediante RM y el y el estudio histopatológico, se representan en la Tabla 3.
DISCUSIÓN
Estudio de validez de la RM
La sensibilidad obtenida para la determinación de la agresividad de meningiomas intracraneales estudiando su imagen por RM fue de un 100% IC95% (87,5-100) de esto, se concluye que la tasa de falsos negativos (meningiomas catalogados como no agresivos mediante RM, resultando agresivos mediante el estudio con nuestro gold standard, el estudio histopatológico) es del 0%. Podemos afirmar que los casos en los que se concluye que el meningioma es no agresivo mediante el estudio por RM, lo es, con un 100% de probabilidad, en concordancia con el valor predictivo negativo (VPN) obtenido: 100% IC95%(92,9-100), sugiriendo la alta capacidad de la prueba como cribado de la agresividad del meningioma intracraneal con un intervalo de confianza estrecho.
Sin embargo, la especificidad obtenida resultó un 70% IC95% (36,6-100), según esto la tasa de falsos positivos (meningiomas catalogados como agresivos por RM, resultando no agresivos mediante el estudio Histopatológico) es de un 30%, siendo además el valor predictivo positivo de la prueba (VPP): 57,51% IC95%(13,3-100). Estos resultados parecen insuficientes para sugerir utilizar dicha prueba para confirmar el diagnóstico, siendo además poco precisos, existiendo intervalos de confianza para dichas mediciones demasiado amplios. No obstante, el resultado obtenido de especificidad de la prueba, es un valor destacable, susceptible de ser valorado con una muestra de mayor tamaño, que permita además estrechar su intervalo de confianza, consideradamente amplio en nuestro estudio.
Guzmán de Villoria, J. A. et al. realizaron un análisis de 129 pacientes en el que se estudió la agresividad de gliomas y tumores primarios cerebrales acorde a su presentación en RM convencional y potenciada, obteniéndose una sensibilidad y especificidad de 95,9% y 70% respectivamente mediante el estudio de RM convencional para el examen de tumores primarios cerebrales; datos similares a los nuestros, siendo la sensibilidad levemente inferior a la obtenida en nuestro estudio. En dicha publicación se concluyó que la RM es una prueba apta para graduar la agresividad en tumores cerebrales primarios30.
Concordancia en el análisis de variables de comportamiento radiológico
La mayoría de las variables utilizadas para determinar agresividad en nuestro estudio son compartidas con publicaciones anteriores con el mismo fin. En algunos de ellos los resultados obtenidos no difieren en demasía a los obtenidos en nuestro estudio. Por ejemplo, el análisis realizado por Liu Y. et al., obtuvo como resultados que el realce heterogéneo en T1 y el contorno irregular fueron los mejores predictores de meningiomas no grado I6. Estos resultados concuerdan con los obtenidos en nuestro estudio, siendo dicho realce heterogéneo y la presencia de bordes irregulares las únicas variables con p<0,05 en el estudio de agresividad por RM, aunque no se consiguió dicha agresividad por examen histopatológico.
En nuestro estudio, la baja significación estadística obtenida en el análisis de edema vasogénico peritumoral y necrosis peritumoral, tiene relación con la presencia de dichos procesos en meningiomas de gran tamaño, no necesariamente malignos debido a la compresión que ejercen sobre estructuras vecinas y por la isquemia subyacente a la gran masa tumoral que impide su correcta irrigación. Por estos motivos, estas variables no se incluyeron como suficientes para determinar agresividad tumoral si aparecen de forma aislada, en el diseño de nuestro estudio. Sin embargo, en el análisis realizado por Guzmán De Villoria et al., previamente citado, concluyó que la necrosis es un gran predictor de agresividad en tumores primarios cerebrales, considerando que la mayoría de tumores estudiados fueron gliomas (118, del total de 129), con una p=0,00130. Respecto al resto de variables de comportamiento radiológico, su significación podría incrementarse mediante la amplificación del tamaño muestral, por lo que sería interesante su reevaluación, especialmente de las variables que muestran tendencia en nuestro estudio. Además, el hecho de que existan variables con tendencia hacia la agresividad atendiendo al examen histopatológico pero no lo consigan mediante el estudio por RM, apoya la necesidad de revisar dichas variables con una muestra mayor.
En el estudio realizado por Varlotto et al, previamente citado, se observó que la degeneración quística y la progresión extracraneal son características que se observan más frecuentemente en meningiomas grado II, III15; sin embargo, en nuestro estudio sólo se observó un caso de degeneración quística el cual perteneció a los grado I. En este mismo estudio se determinó que la presencia de un índice de vascularización alto era más frecuente en meningiomas II, III, pudiendo correlacionarse con la variable neoformación de vasos de nuestro estudio la cual se observó en un mayor porcentaje de casos en meningiomas agresivos determinados por RM y examen histopatológico, en ambos casos como se ha apuntado anteriormente con p>0,05.
CONCLUSIONES
La RM tiene una alta capacidad como cribado inicial en el estudio de la agresividad de los meningiomas intracraneales, considerándose una muy buena elección para su diagnóstico, ya que nos aporta una aproximación inicial del grado de agresividad de los mismos, y discrimina entre meningiomas susceptibles de ser biopsiados o no, acorde a su grado de agresividad. Se puede así decir que los meningiomas que no muestran características de agresividad mediante su estudio con dicha prueba, no son agresivos con alto índice de probabilidad (100%), lo que excluye la necesidad de recurrir a la biopsia y exponer al paciente a las complicaciones que pueden derivar de la misma.
Sin embargo, la RM no sustituye a la biopsia a la hora de confirmar el diagnóstico en el caso de sospecha de agresividad; en estos casos la biopsia y posterior resección del mismo son necesarias.