INTRODUCCIÓN
En la actualidad, la mejor opción terapéutica para luchar contra la enfermedad grave causada por el virus SARS-CoV2 son las vacunas1. España dispone de cuatro vacunas autorizadas por la Comisión Europea: Pfizer/BioNTech (BNT162b2), autorizada el 21 de diciembre de 20202; Moderna (mRNA-1273) autorizada el 6 de enero de 20213; AstraZeneca (ChAdOx1nCoV-19), autorizada el 29 de enero de 20214 y Janssen (Ad26.COV2.S), autorizada el 11 de marzo de 20215. Las cuatro vacunas han mostrado niveles adecuados de eficacia y seguridad6.
Sin embargo, algunos estudios revelan que las respuestas de anticuerpos neutralizantes y la efectividad de las vacunas (EV), varían según el agente de la vacuna, disminuyen con el tiempo posterior a la vacunación y se ven afectadas negativamente por variantes emergentes7. Un ejemplo de esto es que la protección contra la infección durante el oleaje Delta fue menor en comparación con olas anteriores8. Además, se han identificado diferencias en las respuestas inmunitarias entre los tipos de vacunas, mostrando mejores resultados las de Pfizer y Moderna, seguidas de AstraZeneca y Janssen9.
El 26 de noviembre de 2021, la Organización Mundial de la Salud (OMS) anunció la aparición de un nuevo síndrome respiratorio agudo provocado por una variante de coronavirus, desconocida hasta el momento, que denominaron Ómicron (B.1.1.529)10. Este hecho generó gran preocupación ya que Ómicron presentó características diferentes respecto a las anteriores variantes: mayor transmisibilidad y un número inusualmente alto de mutaciones en la proteína de pico “S”. Esto le permitió evadir los anticuerpos generados por infecciones o las vacunas11. Desde el mes de diciembre de 2021, Ómicron paso a ser la variante predominante en España12. A este acontecimiento se le sumaba la aparición de nuevos estudios que observaban una disminución de la EV frente a la infección sintomática, la caída de la inmunidad con el paso del tiempo y un elevado número de reinfecciones7,13.
Durante el periodo comprendido entre el 26 de noviembre de 2021 y 28 de febrero de 2022, coincidiendo con la aparición de la variante Ómicron, sexta ola, se observó en nuestra Jefatura de Sanidad un elevado número de infecciones por SARS-CoV2 en sujetos con pautas completas de vacunación primaria. Nuestra hipótesis de trabajo es que el estudio del tiempo transcurrido entre la última dosis administrada y el momento de la infección nos puede orientar sobre si existen diferencias en los tiempos de inmunidad generadas por las pautas vacunales primarias. Además, según la pauta vacunal primaria de cada paciente, la sintomatología puede variar.
OBJETIVOS
Principal: determinar si existen diferencias significativas en el tiempo transcurrido entre la pauta de vacunación primaria y el desarrollo de la enfermedad entre las diferentes modalidades de vacunación.
Secundario: conocer si el tipo de pauta de vacunación primaria está relacionada con el desarrollo de enfermedad COVID-19 sintomática o asintomática.
MATERIAL Y MÉTODOS
DISEÑO: estudio descriptivo de supervivencia. Periodo comprendido entre el 26 de noviembre de 2021 y 28 de febrero de 2022.
POBLACIÓN: personal militar de la Armada destinado en unidades de tierra de la Base Naval de Rota que fue declarado caso confirmado de COVID 19 al Instituto de Medicina Preventiva de Defensa (IMPDEF) por la Jefatura de Apoyo Sanitario de Rota. Los criterios de inclusión fueron:
haber recibido cualquiera de las pautas vacunales primarias contra la COVID 19 propuestas por el Ministerio de Sanidad.
haber sido declarado caso confirmado por infección por SARS-CoV2 al IMPDEF durante el periodo de estudio.
personal con pauta primaria al que se le administró la dosis de recuerdo y se infectó durante los catorce días posteriores a su administración, el tiempo que se considera necesario para que la dosis de recuerdo se considere efectiva.
Se excluyó al personal no vacunado o parcialmente vacunado y sujetos con pautas de recuerdo que se infectaron a partir del quinceavo día tras su administración.
MUESTRA: se notificaron 132 casos al IMPDEF desde el 26 de noviembre de 2021 al 28 de febrero de 2022.
MATERIALES Y MÉTODO
Variables principales:
-
Tipo de pauta primaria: para registrar el tipo de pauta vacunal primaria completa se establecieron 4 grupos. GRUPO 1: Sujetos que recibieron dos dosis de Pfizer, Moderna o AstraZeneca o una dosis de Janssen (pautas homólogas); el GRUPO 2 los sujetos a los que se les había administrado primera dosis de AstraZeneca y una segunda dosis con Moderna o Pfizer (pautas heterólogas); GRUPO 3 englobaba a los sujetos que habían pasado la infección por SARSCoV2 y se les administró una dosis de vacuna; GRUPO 4 se recogieron los casos que tenían una dosis de vacuna, posteriormente pasaron la infección y, después, se les administró otra dosis de vacuna.
Se consideró pauta completa si transcurrió el intervalo óptimo de espera mínimo para la seroconversión, reflejados en las fichas técnicas de cada vacuna para considerarlas efectivas: Pfizer >7 días a partir de la última dosis, Moderna >14 días a partir de la última dosis, AstraZeneca >15 días a partir de la última dosis y Janssen >14 días.
Si la infección se produjo dentro de ese periodo, no se consideró al sujeto completamente vacunado.
Presentación clínica: se clasifican a los sujetos en sintomáticos y asintomáticos. En el primer grupo se hizo distinción en función de si la sintomatología era leve, entendiendo que cursase como un cuadro catarral sin evidencia de neumonía ni hipoxia; moderada, en la que el principal síntoma fuese la fiebre y pudiese estar acompañada de tos y/o taquipnea, pero sin signos de neumonía grave; y grave, aquellas personas que hubiesen necesitado ingreso hospitalario por presentar signos clínicos de neumonía.
Variables secundarias
Sociodemográficas: edad y sexo (hombre/mujer).
Fecha de inicio de enfermedad: en los casos sintomáticos se consideró la fecha de inicio el momento de aparición de los síntomas. En los casos asintomáticos fue la fecha de la realización de la Prueba de Diagnóstico de Infección Aguda (PDIA).
Fecha de última dosis administrada: pudiendo ser la fecha de la última dosis administrada de la pauta primario o la fecha de la dosis de recuerdo si fuera el caso.
Días transcurridos tras última dosis administrada e inicio de enfermedad: se calculó restando la fecha de inicio de enfermedad menos la fecha de la última dosis.
RECOGIDA DE DATOS: a través de la «ficha de notificación y recogida de información de casos de infección por COVID 19» obtuvimos los datos de los pacientes confirmados durante el periodo de estudio. Se creó una base de datos anonimizada en Microsoft Office Excel® para posterior análisis estadístico con SPSS®v22 en la que se registró la siguiente información de cada caso: sexo, edad, tipo de pauta vacunal, fecha de inicio de enfermedad, fecha última dosis, presentación clínica y se consultó el programa de vacunaciones del Ministerio de Defensa (CENDALA), en los casos donde la ficha no ofreció información completa respecto a la pauta vacunal del sujeto. Debieron cumplirse todos los criterios de inclusión y ningún criterio de exclusión.
ANÁLISIS ESTADÍSTICO: se realizó un análisis descriptivo de todas las variables recogidas. Las variables cualitativas se expresaron mediante frecuencias absolutas y porcentajes, mientras que, las cuantitativas, con la media y desviación típica. Para analizar el tiempo transcurrido entre las diferentes pautas vacunales y el momento de la infección, se usó la curva de supervivencia con el método no paramétrico de Kaplan-Meier. Para comparar las curvas de supervivencia correspondientes a cada pauta vacunal se aplicó el test de Log-Rank. Se realizó análisis de supervivencia para las diferentes pautas vacunales, utilizando la Regresión de Cox y se aplicó el Hazard Ratio para estudiar la función de riesgo de cada tipo de vacuna.
La medida de asociación entre dos variables categóricas se efectuó mediante la χ2 de Pearson, con su intervalo de confianza del 95 %. En todos los casos, como grado de significación estadística, se empleó un valor de p <0,05 y la aplicación estadística fue el paquete SPSS® versión 22.
CONSIDERACIONES ÉTICAS: el protocolo de estudio fue autorizado por el Comité de Ética e Investigación Clínica del Hospital Central de la Defensa Gómez Ulla.
En todo el proceso del trabajo, el equipo investigador ha asumido las Normas de Buena Práctica Clínica, las obligaciones establecidas en la Ley Orgánica 3/2018, de 5 de diciembre, de protección de datos personales y garantía de los derechos digitales y la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica; mediante el tratamiento de los datos debidamente anonimizados. Además, se actuó dentro de los marcos del Reglamento General UE 679/2016, la Ley 14/2007 de 3 julio de investigación biomédica y siguiendo las normas de buena práctica clínica y la declaración de Helsinki.
RESULTADOS
El total de casos de infección por SARS-CoV2 que fue declarado desde nuestra Jefatura al IMPDEF durante el periodo de estudio fue de 132 casos. Se excluyeron un total de doce sujetos: nueve de ellos por haberse infectado pasados catorce días tras recibir la dosis de recuerdo y tres por presentar negativa a la vacunación. Finalmente fueron incluidos en el estudio un total de 120 sujetos, correspondiente al 90,9 % de la muestra: 81 hombres (67,5 %) y 39 mujeres (32,5 %). La edad media de los mismos fue de 41,27 ± 6,96 años y el rango estuvo comprendido entre los veintisiete y sesenta y un años. De ellos, 116 (96,67 %) pertenecían al GRUPO 1 (pautas homólogas) de pauta de vacunación y cuatro (3,33 %) estaban incluidos en el GRUPO 3, (sujetos que recibieron una única dosis de vacuna porque previamente se habían infectado). No registramos casos de infección en sujetos del GRUPO 2 (pautas heterólogas) y del GRUPO 4 (una dosis inicial y una segunda dosis de vacuna posterior a la infección por COVID-19).
Al no conseguir una muestra suficientemente representativa en pautas vacunales que no sean las homólogas, se han centrado los objetivos en este tipo de vacunación primaria (GRUPO 1).
De los vacunados con pautas homólogas (GRUPO 1), setenta y ocho eran hombres (67,2 %) y treinta y ocho mujeres (32,8 %) con una edad media de 41 ± 6,98 y rango entre los veintisiete y sesenta y un años.
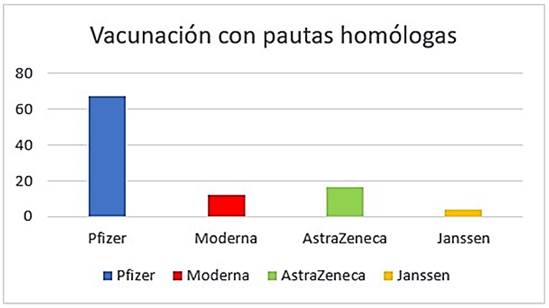
El 67,2 % habían recibido una pauta primaria completa con Pfizer, el 16,4 % con AstraZeneca, un 12,1 % con Moderna y el 4,3 % con Janssen.
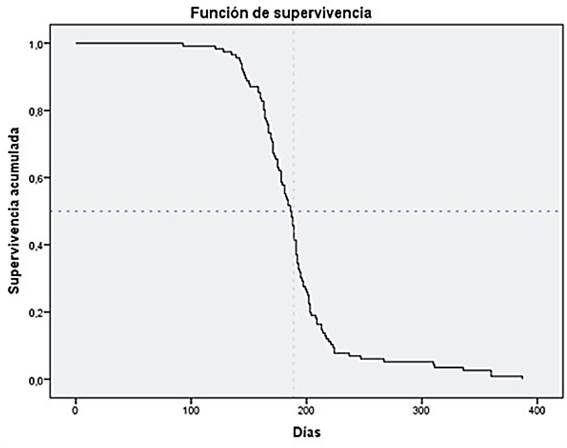
Para realizar una estimación del tiempo que transcurre entre la fecha en la que se administra la última dosis de vacuna y la probabilidad de infección por COVID 19, incluyendo en este análisis todos los tipos de vacunas homólogas, se realizó la curva de supervivencia de Kaplan-Meier. Se observó que, a partir de los 186 días postvacunación, la probabilidad de riesgo de infección era mayor del 50 %, con un intervalo de confianza del 95 % comprendido entre los 180,72 y 190,28 días.
Al aplicar el test de Log Rank se observó que existían diferencias estadísticamente significativas en la probabilidad de padecer la infección según el tiempo transcurrido desde la última dosis entre los diferentes tipos de vacunas (p <0,03).
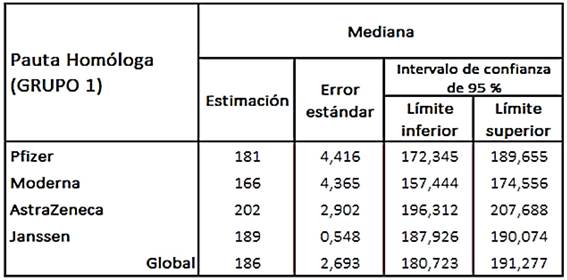
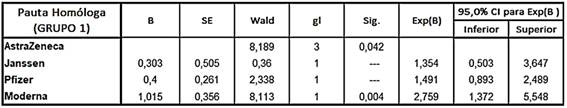
En la tabla 1 se muestran los tiempos estimados de supervivencia por cada tipo de vacunación homóloga. Se observa que la vacuna de AstraZeneca es la que tiene un tiempo de supervivencia mayor (202 días) y la vacuna de Moderna presentó menor tiempo (166 días).
El análisis de regresión de Cox describe el comportamiento de las curvas de supervivencia ajustadas a cada categoría de pauta homóloga, y mostró que existían diferencias significativas entre los diferentes tipos de vacunas (p <0,036).
El análisis de Hazard Ratios (HR) mostró que los pacientes vacunados con Moderna tenían un riesgo 2,759 veces mayor de padecer la infección por COVID-19 a los 186 días frente que aquellos a los que se le administró la pauta con la vacuna de AstraZeneca con un intervalo de confianza del 95 % comprendido entre 1,372 y 5,548 (p <0,004). No se encontraron diferencias estadísticamente significativas entre el resto marcas vacunales.
Al analizar el curso clínico de la infección por COVID-19 de manera global en los sujetos en estudio, se observó que el 47 % no tuvo síntomas. El porcentaje restante (53 %) cursó con algún tipo de síntoma. De estos, el 43 % sufrió infección moderada y el 10 % restante, infección leve. No se registraron pacientes que hubieran necesitado ingreso hospitalario, ni fallecimientos.
En la figura 4 se representa el recuento numérico de los sujetos por tipo de vacuna administrada y curso clínico de la enfermedad.
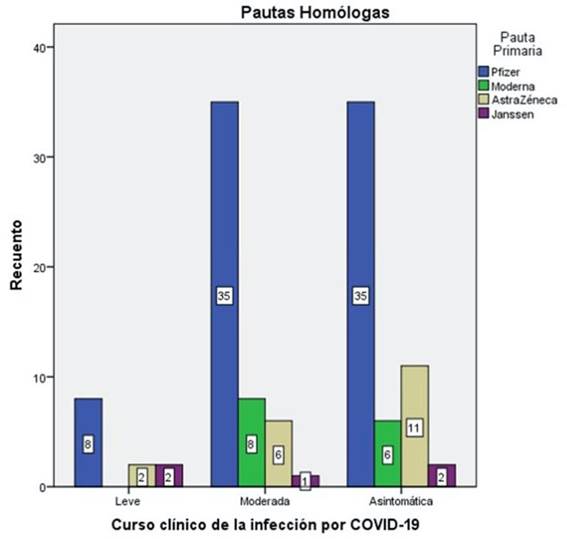
Figura 4. Distribución de la muestra según pauta administrada y curso clínico de la infección por COVID-19.
La vacuna de Pfizer presentó el mismo número de sujetos (treinta y cinco) que cursaron la infección asintomática o con clínica moderada. Solo ocho de ellos tuvo síntomas leves.
Los vacunados con Moderna estuvieron repartidos entre los grupos de asintomáticos (6) e infección moderada (8). Ninguno cursó con infección leve.
En los sujetos con pauta de AstraZeneca más de la mitad (once) cursó la enfermedad sin síntomas, seis sufrieron infección moderada y únicamente dos infección leve.
De los que se vacunaron con Janssen, dos de ellos cursaron con infección leve, otros dos de manera asintomática y uno de forma moderada.
La posible asociación entre el tipo de pauta vacunal homóloga y el curso clínico de la enfermedad se analizó mediante la χ2 de Pearson. No se obtuvieron diferencias estadísticamente significativas (p <0,22).
DISCUSIÓN
Al estudiar el tiempo transcurrido desde que el sujeto completa su vacunación con pautas homólogas y el momento de la infección, en nuestro estudio se observa que, a los 186 días, la probabilidad de infección aumenta en más del 50 %. Este resultado coincide con la bibliografía consultada en la que todos los artículos confirman que la protección de la inmunidad adquirida tras la vacunación decae a los seis meses14-16.
Antes de la aparición de la variante Ómicron, el meta-análisis realizado por Feikin D. et al., para estimar la EV con pautas homólogas, mostró que esta disminuía en un 20-30 %, a los seis meses17. Sin embargo, estudios posteriores centrados en la variante Ómicron reflejaron que para todas las pautas la EV no superaba el 10 % pasadas las veinticuatro semanas, EV mucho menor que la disminución producida durante la anterior variante Delta18.
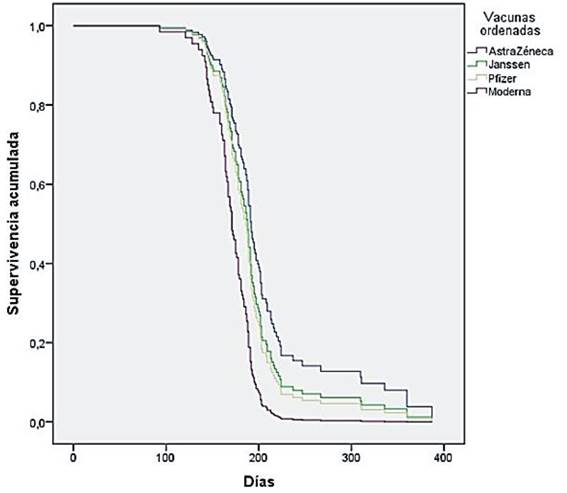
En nuestros resultados se observa un comportamiento muy similar en las curvas de supervivencia de los cuatro tipos de vacunas, sin embargo, sí hallamos diferencias en las estimaciones de los tiempos de supervivencia entre los sujetos vacunados con Moderna (166 días) y los sujetos vacunados con AstraZeneca (202 días) (p <0,004).
Hemos encontrado pocos estudios que comparen la EV de cada tipo de vacuna de las pautas homólogas exclusivamente durante la aparición de Ómicron, y los resultados de estos son diferentes entre sí. De entre los artículos consultados existe un estudio de cohortes retrospectivo, realizado en la República Checa que sí apunta a que la EV era ligeramente mayor en la pauta de AstraZeneca que la presentada por Moderna, del 51 % (IC 95 % 23-69) y 47 % (IC 95 % 45-49) respectivamente frente a la variante Ómicron, lo que coincide con nuestros resultados19.
En los resultados obtenidos, únicamente el 3,33 % de los infectados se encontraba en el grupo de vacunados con una única dosis de vacuna porque previamente habían pasado la enfermedad (GRUPO 3). Esta tasa tan baja de infectados puede estar relacionada con lo observado en estudios que demuestran que, las personas previamente infectadas por COVID-19 que reciben posteriormente una única dosis de vacuna, producen una «inmunidad híbrida» muy robusta, resultante de la combinación de la inmunidad natural y la inmunidad generada por las vacunas20. Estudios como el realizado por Y. Goldberg et al. Señalan que la «inmunidad híbrida», produce mayores niveles de anticuerpos neutralizantes y proporciona mayor protección contra infecciones que la inmunidad conferida por vacunación o infección sola21».
En las recomendaciones de vacunación frente al COVID-19 publicadas por el Ministerio de Sanidad de fecha del 22 de septiembre del presente año, pone de manifiesto el beneficio de este tipo de vacunación que además de presentar mejor protección frente a nuevas variantes del virus, sugieren que esta podría ser más duradera22.
Con respecto a las pautas heterólogas, aquellas que utilizan como primera dosis vacunas de vector de adenovirus y segunda dosis las vacunas ARNm, fueron una alternativa segura e indujeron incluso mejor respuesta inmune que las pautas homólogas23,24.
En nuestros resultados, no tuvimos ningún caso de infección por COVID-19 en sujetos con este tipo de pauta vacunal, lo que confirma de forma indirecta lo descrito en la literatura.
Prácticamente todos los artículos apuntan a la necesidad de ahondar en estudios que aclaren sobre los tiempos de inmunidad tras la infección, inmunidad natural o híbrida; lo que parece claro tanto en lo encontrado en nuestros resultados como en la literatura consultada es que, la protección frente a Ómicron por las series primarias de vacunación, sea cual sea su naturaleza, tiene una duración limitada estimada de seis meses25.
En los resultados obtenidos al comparar el curso clínico de la infección (asintomática, leve o moderada), no se encontraron diferencias estadísticamente significativas entre ellas.
No se notificó ningún paciente en el que cursara de forma grave la infección y no hubo fallecimientos. Este hecho concuerda con la literatura consultada que refiere que aunque se produce una debilidad de la inmunidad a partir de los seis meses tras la vacunación, los sujetos que recibieron dos dosis, muestran una elevada protección frente al riesgo de hospitalización y a la muerte por COVID-19, en comparación con las personas no vacunadas también con la variante Ómicron26.
LIMITACIONES
Principalmente la limitación más importante de nuestro estudio es el pequeño tamaño muestral conseguido en algunas pautas vacunales primarias. Muchos de los casos de infección por SARS-CoV-2 no fueron notificados al IMPDEF por dos motivos principales, el primero se debió a la autorización por parte del Ministerio de Sanidad del uso, a nivel particular, de los test de antígenos como método diagnóstico, lo que provocó que pacientes que dieron positivo en sus domicilios, no realizaran la comunicación de su infección por conducto militar, sino que lo hicieron directamente vía telefónica a través de sus seguros médicos. Por otro lado, muchos de los sujetos que se infectaron se encontraban disfrutando el permiso de Navidad fuera de la provincia y no notificaron su baja.
Otra limitación corresponde a que la franja de edad, por las características de la población estudiada, hace que los resultados no puedan extrapolarse a la población general.
Añadir que, nuestro estudio, muestra la situación en un momento puntual y dados los continuos cambios referentes a todo lo que tiene que ver con la pandemia y la vacunación, los datos obtenidos pueden variar en un corto espacio de tiempo.
CONCLUSIONES
Se produjo una disminución de la EV a los seis meses tras la vacunación en las pautas homólogas.
Los sujetos vacunados con AstraZeneca tuvieron menor probabilidad de infección a los 186 días que los vacunados con Moderna.
No se encontraron diferencias estadísticamente significativas en la forma clínica de cursar la infección por COVID-19 en relación con la pauta homóloga administrada.