ANTECEDENTES
Las plaquetas constituyen uno de los tres componentes principales (plasma, hematíes y plaquetas) necesarios para el tratamiento con éxito de aquellas bajas de combate con hemorragias masivas en el campo de batalla1,2.
Un pool de plaquetas frescas almacenadas a temperatura ambiente tiene una vida útil muy corta (entre cinco y siete días), motivo por el que la disponibilidad y el suministro de este hemocomponente en el teatro de operaciones se ve muy limitado.
Con el fin de conseguir un alargamiento de la vida útil de las plaquetas, en 1972 Handin y Valeri, del Naval Blood Research Laboratory del Hospital Naval de Boston (EE. UU.) desarrollaron el primer método de criopreservación de plaquetas3.
Este método requería de una velocidad controlada de disminución de la temperatura y un almacenamiento en la fase gaseosa del nitrógeno líquido a -150 °C, lo que conllevaba una producción lenta y costosa. Por ello, dos años más tarde, el capitán naval médico Robert Valeri publicaría un método simplificado en el que se utilizó dimetilsulfóxido (DMSO) al 6 % y la congelación se realizó colocando los concentrados de plaquetas después de agregar el DMSO en un congelador mecánico a -80 °C4. Sin embargo, tras la descongelación y antes de la transfusión, estas plaquetas requerían ser lavadas para eliminar la mayor parte del DMSO, debido a sus efectos tóxicos.
Tendrían que pasar 31 años hasta que el Dr. Valeri, director del Naval Blood Research Laboratory, publicó una modificación del segundo método, que consistía en concentrar las plaquetas y retirar, mediante centrifugación, el sobrenadante de DMSO antes de congelarlas5. Esta modificación suponía una significativa simplificación en el proceso de descongelación y adecuación de los concentrados de plaquetas antes de ser transfundidos.
Recientemente y en el ámbito de la sanidad militar española se ha evaluado in vitro la capacidad hemostática de concentrados de plaquetas frías, congeladas y frescas mediante pruebas de coagulación estandarizadas y tromboelastometría6. En su trabajo, Díaz-Valdés et al. realizan una amplia revisión del empleo de plaquetas congeladas por otros países aliados como Holanda7,8, República Checa9 o Australia10, durante los despliegues de sus ejércitos en misiones internacionales.
El objetivo de este trabajo es presentar el protocolo de validación desarrollado por el Centro de Transfusión de las Fuerzas Armadas (CTFAS) para el procedimiento de congelación de plaquetas, siguiendo las indicaciones de la Blood Guide que recoge las recomendaciones de grupos de expertos bajo la supervisión del European Committee on Blood Transfusion11.
Como objetivos secundarios se estudiarán y establecerán los parámetros del proceso con el fin de estandarizar el proceso de fabricación asegurando su reproducibilidad en el tiempo.
PROTOCOLO DE VALIDACIÓN DEL PROCEDIMIENTO DE CONGELACIÓN DE PLAQUETAS
Para la validación de este protocolo se realizaron determinaciones del recuento de plaquetas en el momento de su obtención, justo antes de la congelación, una vez descongeladas y reconstituidas, realizándose las determinaciones tras su descongelación y a las seis horas posteriores, con el fin de examinar la recuperación plaquetaria.
Se consideró como válido que el recuento de plaquetas una vez descongeladas fuese mayor que el 50 % del valor de precongelación, con un volumen de entre 50 y 200 ml.
De la unidad de plaquetas se realizó un recuento de estas, mediante la obtención de una muestra de un volumen de 3±1 ml. que se pasó a un tubo de etilendiaminotetraacético (EDTA) y se realizó su lectura en el analizador hematológico SISMEX XN 1000V del laboratorio del CTFAS. De ese modo y mediante el empleo de tecnología óptica, se evita cualquier tipo de error en la medición de la impedancia causados por eritrocitos fragmentados o microcíticos.
El listado de material y el equipamiento necesario para realizar el proceso viene detallado en la siguiente relación:
Campana de flujo laminar SAH100 TELSTAR.
Balanza Sartorius 84100.
Sistema de sellado de bolsas TERUMO T-SEAL II.
Sistema unión estéril TERUMO TSCDII.
Congelador de -80 °C Thermoscientific REVCO Modelo RDE400.
Guantes crioprotectores.
Centrífuga para bolsas de sangre HERAEUS Cryofuge 8000.
Agitador de vaivén SARSTED TPM-2
Prensa manual TERUFLEX ACS-201.
Dos viales de 10 ml. con la solución de DMSO Cryosure.
Envase de 500 ml de suero fisiológico para intravenoso.
Un envase de medio de cultivo aerobio y un envase de anaerobios, Bact/Alert FA Plus y FN Plus por cada una de las bolsas que se va a congelar.
Un microgotero CareFusion.
Bolsas de transferencia de 600 ml. TERUMO Teruflex.
Tubo etilendiaminotetraacético (EDTA) para recuento de plaquetas.
Cánister de congelación, uno por bolsa.
Analizador hematológico Sysmex modelo XN10.
Desarrollo del protocolo de validación del procedimiento de congelación de plaquetas:
Selección de diez unidades de plaquetas procedentes de pool o de aféresis validadas y de menos de veinticuatro horas desde la fecha de donación, que tengan un aspecto correcto (sin signo alguno de hematíes) y con un rendimiento mayor a 2,5 x 1011 plt/bolsa.
Unión, mediante sistema estéril, de la unidad de plaquetas a una bolsa de transferencia de 600 ml., que se cierra con una pinza para evitar el retorno del contenido y posterior centrifugación de la bolsa.
Una vez centrifugada la unidad se saca de la cubeta, se sitúa en la prensa manual y se realiza la extracción del sobrenadante.
Se resuspende el botón plaquetario y se deja reposar durante al menos treinta minutos a 22 °C. Pasado este tiempo se dispone en el agitador de plaquetas durante quince minutos.
Se prepara la solución crioprotectora de DMSO y NaCl y con la ayuda de un microgotero se va añadiendo solución crioprotectora a la unidad de plaquetas hasta obtener una concentración final de DMSO de 5-6 % en la unidad.
De esta unidad final se realiza un muestreo de control de calidad (consistente en un recuento de plaquetas y una toma de muestra para control microbiológico aeróbico y anaeróbico).
Por último, se procede a la congelación de las unidades en el interior de un cánister metálico a 80 °C en posición horizontal durante veinticuatro horas, pasado este tiempo se trasladan las unidades de plaquetas a su lugar de almacenamiento en un congelador eléctrico de -80 °C con un registro continuo de temperatura, con alarma visual y acústica, conectado a un sistema de energía eléctrica de reserva para evitar el deterioro de los productos en el caso de fallo eléctrico.
En la tabla 1 se describen los parámetros del proceso de la congelación, así como el rango de aceptación para cada uno de ellos.
Tabla 1. Parámetros del proceso de congelación y rangos de aceptación
| Parámetro | Rango de Aceptación |
|---|---|
| Rendimiento plaquetas/bolsa | >2,5 · 1011 plt/bolsa |
| PRIMER CENTRIFUGADO | |
| Tiempo reposo botón plaquetar una vez centrifugado | ≥30 min. a 22° C |
| Tiempo en agitación después del reposo | 15 min. |
| PREPARACIÓN SOLUCIÓN CRIOPROTECTORA | |
| Flujo de la solución crioprotectora | 1 gota cada 2 segundos |
| SEGUNDO CENTRIFUGADO | |
| Tiempo reposo botón plaquetar una vez centrifugado | ≥30 min. a 22° C |
| Tiempo en agitación después del reposo | 15 min. |
Desarrollo del protocolo de validación del procedimiento de descongelación de plaquetas:
Cada unidad se dispone en un baño termostatizado a 37 °C., introduciendo la bolsa de plaquetas congeladas protegida con una bolsa de plástico dentro del baño y agitándose hasta la descongelación de la misma, evitando que la bolsa supere los 24 °C.
Tras secar cada bolsa con papel, se rotula en una etiqueta la hora de descongelación de esta.
A cada unidad de plaquetas descongeladas se añaden 100 ml. de solución salina para inyección intravenosa.
Se almacenan las unidades de plaquetas en agitación a una temperatura de 22 ± 2 °C durante seis horas.
Desarrollo del protocolo de validación del procedimiento de almacenamiento de plaquetas congeladas:
Se utilizaron seis unidades de plaquetas congeladas almacenadas en contenedores modelo RCB25U de Dometic, utilizando hielo seco con el fin de mantener una temperatura adecuada en su interior.
El fondo del contenedor se cubre con la nieve carbónica, tras ello se disponen las bolsas de plaquetas congeladas (figura 1) y posteriormente se cubre todo con más nieve carbónica (en total 30 kg de hielo seco) (figura 2).
Se tapa con una lámina de plástico de burbuja y se cierra uno de los dos de los sistemas de cierre, dejando el otro abierto para permitir la evacuación de los gases sublimados.
Por último, se mantiene el contendor en una posición fija a una temperatura ambiente de 24 °C.
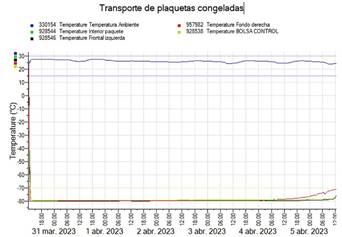
Para controlar la temperatura durante el proceso, se emplearon cinco registradores de temperatura calibrados modelo Tinytag Plus 2 TGP 4017 dispuestos en las siguientes posiciones, respectivamente: a temperatura ambiente; en el interior de la bolsa de plaquetas congeladas; en el interior del cánister metálico; en la parte trasera derecha del contenedor, y en la parte frontal izquierda del contenedor (próximo al sistema de cierre abierto para permitir la evacuación de gases).
VALIDACIÓN DEL PROCEDIMIENTO DE CONGELACIÓN DE PLAQUETAS
Los resultados de los parámetros de calidad de cada unidad de plaquetas se muestran en la tabla 2.
Tabla 2. Resultados de los parámetros de calidad de las plaquetas congeladas.
| Unidad | Volumen (ml) | Contaje plaquetario % | Cultivo aerobio | Cultivo anaerobio |
|---|---|---|---|---|
| 1 | 59 | 80,76 | NEG | NEG |
| 2 | 63 | 63 | NEG | NEG |
| 3 | 54 | 81,25 | NEG | NEG |
| 4 | 55 | 79,41 | NEG | NEG |
| 5 | 57 | 80,64 | NEG | NEG |
| 6 | 64 | 75 | NEG | NEG |
| 7 | 58 | 74,19 | NEG | NEG |
| 8 | 57 | 81,48 | NEG | NEG |
| 9 | 55 | 63,33 | NEG | NEG |
| 10 | 83 | 70,37 | NEG | NEG |
| Parámetro | Valor medio |
|---|---|
| Recuperación plaquetaria (%) | 69 |
| Control microbiológico | NEG |
| Volumen (ml) | 60,5 |
Las determinaciones del recuento de plaquetas se muestran en la tabla 3.
Tabla 3.
| Unidad | Recuento inicial (x1011 plt/bolsa) | Antes de la congelación (x1011 plt/bolsa) | Tras descongelación (x1011 plt/bolsa) | 6 h post descongelación (x1011 plt/bolsa) |
|---|---|---|---|---|
| 1 | 2,6 | 2,3 | 2,4 | 2,1 |
| 2 | 3,1 | 2,6 | 3,0 | 2,7 |
| 3 | 3,2 | 3,2 | 3,2 | 2,6 |
| 4 | 3,4 | 2,9 | 3,3 | 2,7 |
| 5 | 3,1 | 2,9 | 3,1 | 2,5 |
| 6 | 3,2 | 2,7 | 3,0 | 2,4 |
| 7 | 3,1 | 2,7 | 2,6 | 2,3 |
| 8 | 2,7 | 2,5 | 2,5 | 2,2 |
| 9 | 3,0 | 2,6 | 2,3 | 1,9 |
| 10 | 2,7 | 2,2 | 2,3 | 1,9 |
| Recuento inicial | Antes de la congelación | Tras descongelación | 6 h post descongelación | |
|---|---|---|---|---|
| Contaje medio de plaquetas por unidad (x1011 plt/bolsa) | 3,01 | 2,66 | 2,77 | 2,33 |
Los resultados del registro de temperatura durante la simulación del transporte se muestran en la figura 3.
Como se puede observar, las plaquetas se encuentran a una temperatura inferior a -80 °C durante un periodo de cinco días siendo la temperatura ambiente de 24 °C. Los registradores que reflejan la temperatura real de las plaquetas son los denominados como interior paquete y bolsa control, respectivamente.
DISCUSIÓN Y CONCLUSIONES
Las plaquetas congeladas proporcionan accesibilidad a este recurso a largo plazo en situaciones en las que no exista disponibilidad de productos frescos. Y como hemos mostrado en este procedimiento de validación, la producción de plaquetas congeladas no se considera un proceso demasiado exigente desde una perspectiva tecnológica, y estas pueden ser descongeladas y reconstituirse de una manera relativamente sencilla. En este sentido, y mediante la validación de este procedimiento de congelación de plaquetas, el CTFAS trabaja en la línea de tratar de reducir la huella logística del apoyo sanitario a las operaciones militares.
Además de esta importante mejora logística, las plaquetas congeladas ya se han utilizado en bajas militares, con efectos clínicos satisfactorios y sin reacciones adversas reportadas8,12. En su trabajo, Noorman et al. (2016) analizaron los resultados clínicos y la seguridad de 1143 unidades de plaquetas congeladas transfundidas a 272 bajas de combate en Afganistán entre los años 2006 y 2010, demostrando efectividad, aunque los autores no realizaron comparaciones con plaquetas frescas o sangre completa8.
En los estudios de caracterización de plaquetas realizados in vitro, se han observado cambios significativos en la estructura y función de las unidades de plaquetas después de la descongelación que provocan un aumento de la actividad procoagulante de las mismas13. Sin embargo, algunos estudios recientes realizados in vivo han demostrado eficacia y seguridad de la transfusión de plaquetas congeladas en pacientes con hemorragia14,15.
Entre los años 2015 y 2017, en el estudio multicéntrico CLIP-I, 41 pacientes de alto riesgo de cirugía cardiaca fueron aleatorizados a la hora de recibir hasta tres unidades de plaquetas criopreservadas o almacenadas en líquido por paciente. En este ensayo clínico aleatorizado, en comparación con las plaquetas almacenadas en líquido, las plaquetas criopreservadas no se relacionaron con un aumento de efectos adversos16.
En la actualidad se están desarrollando dos ensayos multicéntricos, aleatorizados y controlados, CLIP-II y CLIPNZ-II, los cuales tiene como objetivo evaluar la eficacia, seguridad y rentabilidad de las plaquetas criopreservadas en comparación con las plaquetas almacenadas en líquido convencionales, en el tratamiento del sangrado activo debido a la cirugía17.
En definitiva, y desde que el Dr. Robert Valeri desarrolló el primer método de criopreservación plaquetas, las unidades de plaquetas congeladas han estado disponibles durante más de cincuenta años. Sin embargo, su uso rutinario se ha visto limitado probablemente por las complicaciones técnicas asociadas al proceso de congelación y descongelación, y por el impacto que el procedimiento provoca en las plaquetas18. Por estos motivos, el protocolo de validación del procedimiento de congelación de plaquetas desarrollado por el CTFAS permite disponer de este hemocomponente y asegurar su suministro en entornos operativos.