INTRODUCCIÓN
La artrosis (OA) es una enfermedad crónica que se caracteriza por una degradación progresiva del cartílago articular que recubre la superficie de las articulaciones sinoviales, que permiten el movimiento del esqueleto sin que se produzca dolor. Los condrocitos de pacientes con artrosis sufren cambios en el fenotipo asociados con un incremento en la actividad catabólica e inflamatoria1,2, junto con un incremento en la senescencia celular y del fenotipo secretor asociado a senescencia (SASP)2,3. Nuestro grupo de investigación ha demostrado previamente que los condrocitos en el cartílago articular poseen largas proyecciones citoplasmáticas que atraviesan la matriz extracelular (MEC)4, capaces de formar conexiones y uniones comunicantes (UCs) a través de canales de conexina-43 (Cx43)4,5. En el año 2013, nuestro grupo de investigación publicó resultados relevantes asociados con alteraciones de la actividad de la Cx43 en artrosis, indicando que desde estadios muy tempranos de la enfermedad existe un incremento y cambios en la localización de la proteína en el cartílago de pacientes con artrosis6. Posteriormente, utilizando modelos animales observamos que el dominio C-terminal de la Cx43 juega un papel fundamental en la estructura y composición del cartílago articular7.
La Cx43 está implicada en procesos de regeneración tisular en piel, corazón y en otros tejidos8,9. Varios autores han puesto de manifiesto que la artrosis podría incluirse dentro de enfermedades relacionadas con alteraciones en el proceso de regeneración tisular10,11. De hecho, los condrocitos artrósicos sufren desdiferenciación celular y presentan mayores niveles de proliferación celular12,13, probablemente debido a un intento de reparar el daño producido en el cartílago. La presencia de condrocitos desdiferenciados de forma crónica, desencadena la sustitución progresiva de cartílago articular por fibrocartílago asociado a degeneración y pérdida funcional en la articulación14-19. En esta línea de trabajo, es importante destacar que el uso de moléculas que promueven la condrogénesis, y por tanto la re-diferenciación del condrocito, poseen un efecto protector en modelos de OA20. Estas moléculas reciben el nombre de fármacos modificadores de la OA (DMOADs, del inglés Disease-Modifying Osteoarthritis Drugs), entre los que se encuentra la kartogenina, la cual se ha visto que promueve la condrogénesis en células madre mesenquimales humanas y también mejora la regeneración del cartílago en ratones sometidos a daño inflamatorio y/o mecánico en la articulación20. Otras DMOADs, como TD198946, TAK-778 o AG-041R, también se han descrito como moléculas promotoras de la condrogénesis con potencial terapéutico en reparación del cartílago articular21-23. El cartílago de pacientes con OA presenta niveles elevados de la Cx43 junto con alteraciones en el proceso de regeneración tisular. Nuestro objetivo ha sido estudiar si alteraciones en la actividad de la Cx43 y de la comunicación intercelular a través de UCs estarían relacionadas con cambios en el fenotipo celular y senescencia asociados a progreso de la enfermedad.
MATERIAL Y MÉTODOS
Recogida de muestras y cultivo celular
Las muestras de cartílago se recogieron y procesaron como se ha descrito previamente4 después de que los donantes firmaran el consentimiento informado y de la aprobación del Comité Ético de Investigación Clínica de Galicia (C.0003333, 2012/094 y 2015/029). Se utilizó la línea celular de condrocitos humanos T/C-28a2, procedente de condrocitos sanos primarios que fueron transfectados con la partícula vírica SV40, generosamente donada por la Dra. Goldring (The Hospital for Special Surgery, Nueva York – EE.UU.). Los condrocitos se cultivaron en medio DMEM (del inglés Dulbecco’s modified Eagle’s Medium, Lonza) suplementado con un 10% de suero bovino fetal (FBS, del inglés Fetal Bovine Serum, Gibco) y una mezcla de antibióticos al 1% (P/S; Penicilina 100 U/mL, Estreptomicina 100 μg/mL, Gibco).
Western blot
El análisis de niveles proteicos totales o nucleares se llevó a cabo mediante la técnica de Western blot. Cantidades equivalentes de proteínas fueron separados en geles de acrilamida desnaturalizantes al 10% y transferidas a una membrana de fluoruro de polivinilideno (PVDF). Tras el bloqueo con leche desnatada diluida en tris salino tamponado (TBS), las membranas fueron incubadas toda la noche a 4ºC con anticuerpos primarios anti α-tubulina (Sigma-Aldrich, T9026), Cx43 (Sigma-Aldrich, C6129) Twist-1 (SCBT, sc-81417), antígeno nuclear de proliferación celular o PCNA (SCBT, sc-56), p53 (SCBT, sc-126), factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas o NF-Kß (SCBT, sc-8008) o Lamina A (SCBT, sc-20680). Después de la incubación con el anticuerpo primario, se lavaron las membranas con TBS y se incubaron con sus correspondientes anticuerpos secundarios marcados con peroxidasa de rábano (HRP) durante 1 hora a temperatura ambiente. Una vez eliminado el exceso de anticuerpo con TBS la señal se visualizó en una cámara de revelado LAS-3000 (Fujifilm).
Immunofluorescencia
Para la detección de proteínas por inmunofluorescencia, las células previamente fijadas con paraformaldehído al 2% fueron incubadas con glicina 0,1 M (Sigma-Aldrich) durante 10 minutos. Posteriormente, se realizó una permeabilización de las membranas celulares con Triton X100 (Sigma-Aldrich) al 0,2% en tampón fosfato salino (PBS), durante 10 minutos. Las uniones inespecíficas fueron bloqueadas mediante una incubación de 30 minutos con 1% de suero de albúmina bovina (BSA, Sigma-Aldrich) en PBS. Posteriormente, las células fueron incubadas con el anticuerpo primario durante 1 hora a temperatura ambiente. Tras tres lavados de 10 minutos con PBS, las células fueron incubadas con el anticuerpo secundario marcado con un fluoróforo durante 1 hora, en oscuridad y a temperatura ambiente. Se realizaron otros tres lavados de 10 minutos con PBS, seguido de una tinción de núcleos con 4',6-diamidino-2-fenilindol –DAPI–(Sigma-Aldrich). Las imágenes se realizaron en un microscopio Olympus BX61 con un cámara DP71.
Inmunohistoquímica
Las micromasas de condrocitos fueron embebidas en O.C.T.TM (Optimum Cutting Temperature) y cortadas en secciones de 4 µm, las cuales fueron incubadas con peróxido de hidrógeno al 3% durante 10 minutos. Las secciones fueron incubadas con el anticuerpo primario anti-colágeno tipo II durante 1 hora a temperatura ambiente. Tras realizar tres lavados con PBS, las secciones se incubaron con OptiView HQ Universal Linker (Roche) durante 10 minutos. Posteriormente, se incubaron durante 8 minutos con OptiView HRP Multimer (Roche), se lavó el exceso de reactivo y se reveló la señal en una solución de DAB al 0,1% en peróxido de hidrógeno al 0,02%.
Citometría de flujo
Para la medida de los niveles proteicos mediante citometría de flujo, las células fueron fijadas con paraformaldehído al 1% durante 10 minutos, se lavaron con una solución de lavado (PBS + 0.5% BSA + 2mM EDTA), y se tiñeron con anticuerpos anti Cx43-APC (R&D Systems, FAB7737A), endoglina o CD105 - PE (Immunostep, 105PE-100T) o antígeno CD166 (ALCAM) o CD166- APC (Immunostep, 1399990314). El análisis se llevó a cabo en un citómetro FACSCaliburTM.
Transfección celular
La línea celular T/C-28a2 fue transfectada mediante electroporación con el kit Amaxa® Cell Line Nucleofector® kit V (Lonza) en un aparato Cell Line NucleofectorTM (Lonza). Se electroporó 1 millón de células con 3 μg del plásmido pIRESpuro2 (Clontech) que contiene la secuencia del gen de la Cx43 humana, generosamente donado por la Dra. Arantxa Tabernero (INCYL, Universidad de Salamanca, España). A las 24 horas el medio fue cambiado por medio con P/S y antibiótico para la selección de los condrocitos que contienen el plásmido.
Por otro lado, también se llevó a cabo la electroporación de la línea T/C-28a2 con un vector CRISPR (modificado de Addgene #48138) con la enzima Cas9 VP12 (derivada de Addgene #72247) unido a un marcador GFP (proteína verde fluorescente), con una guía que tiene como diana 20 nucleótidos del gen de la Cx43. Este vector ha sido generosamente donado por el Dr. Trond Aasen (Instituto de Investigación Vall d’Hebron, Universidad Autónoma de Barcelona, España). Células electroporadas y positivas para GFP fueron sembradas en una placa de 96 pocillos y expandidas como clones.
Expresión génica
Los niveles de expresión génica se llevaron a cabo mediante la extracción de ARNm con TRIzol (Invitrogen), retrotranscripción con el kit SuperScript® VILO™ (Invitrogen) y cuantificación mediante PCR cuantitativa en tiempo real en un LightCycler® 480 (Roche). Se utilizaron cebadores para:
hipoxantina fosforibosiltransferasa-1 -HPRT-1-(5’ – TTGAGTTTGGAAACATCTGGAG – 3’; 5’ – GCCCAAAGG-GAACTGATAGTC – 3’), - GJA1 (5’ – ACATGGGTGACTG-GAGCGCC – 3’; 5’ – ATGATCTGCAGGACCCAGAA – 3’),
interleukina-1β-IL-1β.(5’ – CGAATCTCCGACCAC-CACTAC – 3’; 5’ – TCCATGGCCACAACAACTGA – 3’),
interleukina-6 -IL-6-(5’ – TGTAGCCGCCCCACACA – 3’; 5’ – GGATGTACCGAATTTGTTTGTA – 3’),
prostaglandina-endoperóxido sintasa-2 -PTGS2- (5’– CTTCACGCATCAGTTTTTCAAG – 3’; 5’– TCACCGTAAA-TATGATTTAAGTCCAC – 3’),
metaloproteasa 3 -MMP-3- (5’– CCCTGGGTCTCTTT CACTCA – 3’; 5’ – GCTGACAGCATCAAAGGACA – 3’),
inhibidor-2 de quinasa dependiente de ciclina -CDKN2-(5’ – GAGCAGAACGATAGGGCTTG – 3’; 5’ –CAT GTGCCCTCT CCTCCTAA – 3’).
Actividad de las UCs
La comunicación celular a través de uniones comunicantes se evaluó mediante un ensayo Scrape Loading/Dye Transfer (SL/DT). Para ello se realiza un corte sobre cé-
Rev Osteoporos Metab Miner. 2019;11(2):46-54
lulas confluentes con un bisturí y la punta de una aguja en presencia del compuesto fluorescente Lucifer Yellow (LY, Cell Projects Ltd© Kent, UK), incubando a 37ºC durante 5 minutos. Las células dañadas que logran reparar la membrana toman del medio el compuesto fluorescente. Se evaluó la transferencia del LY desde la línea de corte en un microscopio de fluorescencia invertido (Nikon Eclipse Ti) y se calculó la ratio entre células no dañadas positivas para LY entre el número de células que toman el compuesto a través de un daño en la membrana.
Senescencia
La senescencia celular se evaluó según la actividad β-galactosidasa con un kit comercial con X-gal como sustrato (Senescence Cells Histochemical Kit, Sigma-Aldrich) y también mediante citometría de flujo con el sustrato diβ-galactopiranósido, que da lugar a fluorescencia verde al ser hidrolizado (Invitrogen). En el caso del X-gal, las células con activadad β-galactosidasa se teñirán de azul verdoso, con lo que se pueden analizar en un microscopio de luz visible. Por otro lado, la hidrólisis del sustrato di-β-galactopiranósido se detectó en un citómetro FACS-CaliburTM, y la fluorescencia media se normalizó a los niveles de las células no tratadas.
RESULTADOS
La Cx43 activa la actividad catabólica en condrocitos de pacientes con OA
En concordancia con lo observado en tejido6, los condrocitos articulares en cultivo primario procedentes de donantes con OA (OAc) presentaron niveles de Cx43 significativamente mayores que aquéllos aislados de donantes sanos (N) detectados por citometría de flujo (Figura 1A). Los niveles elevados de Cx43 se correlacionaron con mayores niveles de comunicación intercelular a través de UCs, cuantificada mediante un ensayo SL/DT de transferencia de LY (Figura 1B). Con el objetivo de estudiar el efecto en el fenotipo celular de niveles elevados de la Cx43 y de comunicación intercelular a través de UCs, se utilizó como modelo de estudio una línea celular de condrocitos de una donante sana, T/C-28a2. La Cx43 fue sobreexpresada utilizando un vector con el gen de la Cx43 humana bajo el promotor del CMV24 (Figura 1C). El incremento de la Cx43 en la línea celular de condrocitos humanos T/C-28a2 se correlacionó con un aumento de la actividad de las UCs detectada por el ensayo SL/DT (Figura 1D). El ensayo de expresión génica mediante RT-PCR mostró un incremento significativo en la expresión génica de interleuquina 1-β (IL-1β), ciclooxigenasa-2 (COX-2) y metaloproteasa-3 (MMP-3) cuando la Cx43 fue sobreexpresada en la línea de condrocitos sana (T/C – Cx43) (Figura 1E).
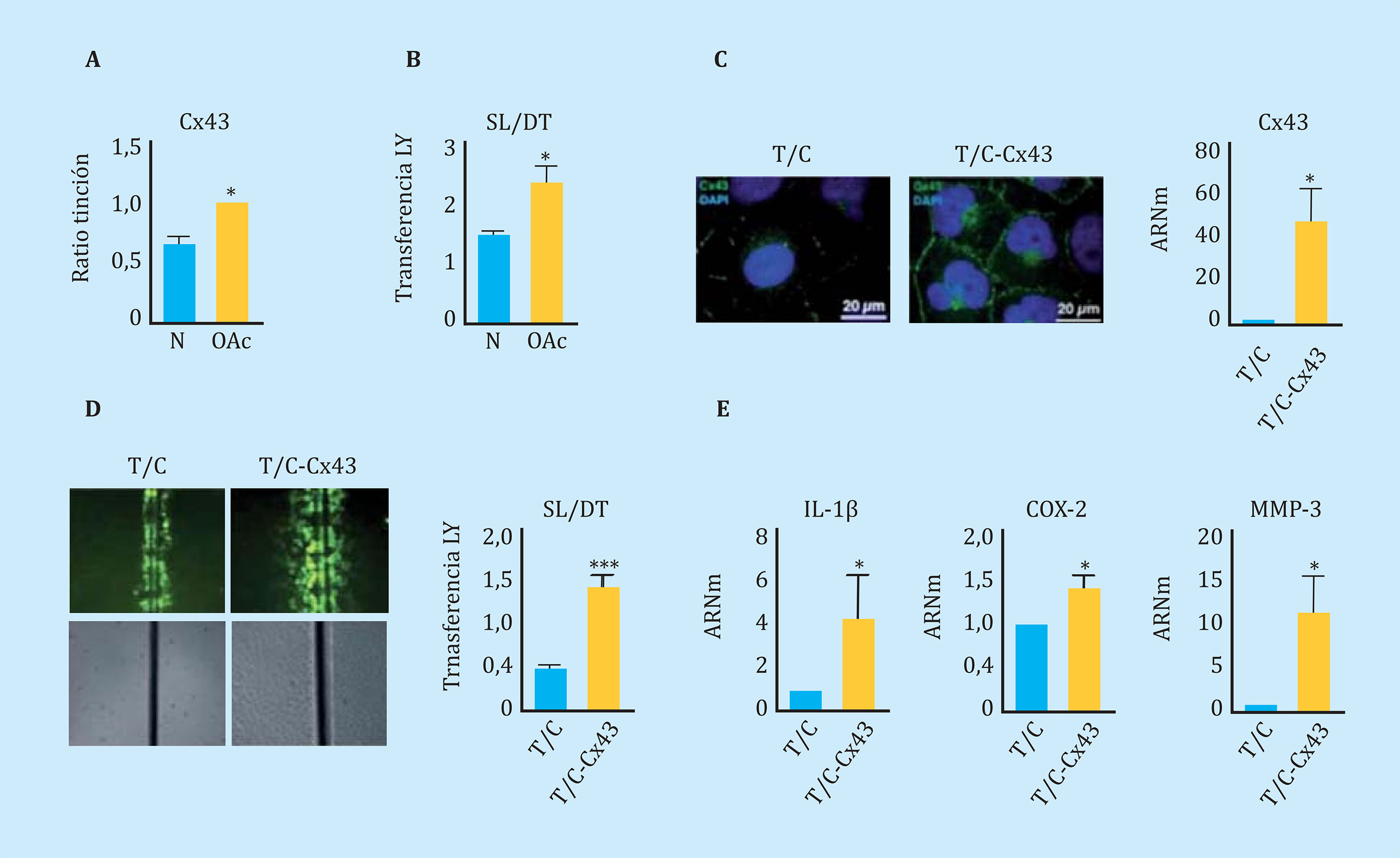
Figura 1 (A) Niveles de Cx43 analizados por citometría de flujo comparando condrocitos humanos sanos (N) y artrósicos (OAc) en cultivo monocapa. n=3, media ± error estándar de la media (EEM); ***p<0,0001; test . de Student. (B) Cuantificación del ensayo de comunicación celular Scrape Loading/Dye Transfer (SL/DT) comparando condrocitos de donantes sanos (N) y artrósicos (OAc). n=8, media ± EEM; **p<0,01; test de Mann-Whitney. (C) A la izquierda, inmunofluorescencia para la Cx43 (verde) en condrocitos T/C-28a2 (T/C) y la misma línea transfectada con un plásmido para sobreexpresar la Cx43 (T/C-Cx43). Los núcleos han sido teñidos con DAPI (azul). A la derecha, niveles de expresión génica de la Cx43 en estas dos líneas de condrocitos. n=5, media ± EEM; *p<0,05; test de Mann-Whitney. (D) Cuantificación del ensayo de comunicación celular SL/DT, comparando la línea T/28a2 (T/C) y transfectada con un plásmido para sobreexpresar la Cx43 (T/C-Cx43). n=10, media ± EEM; ***p<0,0001; test de Mann-Whitney. (E) Niveles de expresión génica de IL-1β, COX-2 y MMP-3 en la línea T/C-28a2 que sobre-expresa la Cx43 (T/C-Cx43) en comparación a la línea transfectada con un plásmido control (T/C). n=4, media ± EEM; *p<0,05; test de Mann-Whitney
Activación desdiferenciación celular en OA
Mediante ensayos de citometría de flujo estudiamos los niveles de marcadores de desdiferenciación celular en condrocitos de pacientes con artrosis y condrocitos aislados de donantes sanos, con el objetivo de confirmar la presencia de condrocitos inmaduros en muestras de cartílago ciación CD105 y CD166 (Figura 3C), así como de la exde pacientes con OA. Mediante citometría de flujo, se de-presión génica de IL-1β, IL-6, COX-2 y MMP-3 detectados tectaron mayores niveles del marcador “Stem” CD166 en por citometría de flujo y análisis de la expresión génica OAc en cultivo primario en comparación con condrocitos respectivamente (Figura 3D). El efecto de la Cx43 en sanos (Figura 2A). En concordancia con estos resultados, plasticidad celular en OAc fue confirmado en cultivo 3D. el incremento de la Cx43 en condrocitos sanos (línea ce-La modulación de los niveles de Cx43 en presencia de lular) utilizando un vector de expresión (T/C-Cx43 o línea oleuropeína 10 μM en micromasas y en medio condroT/C-28a2 transfectada con un plásmido para sobreexpre-génico mejoró la estructura de la matriz extracelular, desar la Cx43) desencadenó en un incremento significativo tectándose un incremento significativo en los depósitos en los niveles de los dos marcadores “stem-like” CD166 y de colágeno II y proteoglicanos en la matriz de la estruc-CD105, respecto a las células control con niveles bajos de tura 3D (Figura 4). Cx43 (T/C-28a2) (Figura 2B).

Figura 2 (A) Medida del marcador de desdiferenciación CD166 por citometría de flujo en condrocitos artrósicos (OAc) y condrocitos de donantes sanos (n=9, media ± EEM; ***p<0,0001; test de Mann-Whitney). (B) Niveles de los marcadores CD105 (n=5) y CD166 (n=7) medidos por citometría de flujo en la línea celular T/C-28a2 que sobreexpresa la Cx43 (T/C-Cx43) en comparación a la misma línea transfectada con un plásmido control (T/C). Media ± EEM; *p<0,05; test de Mann-Whitney
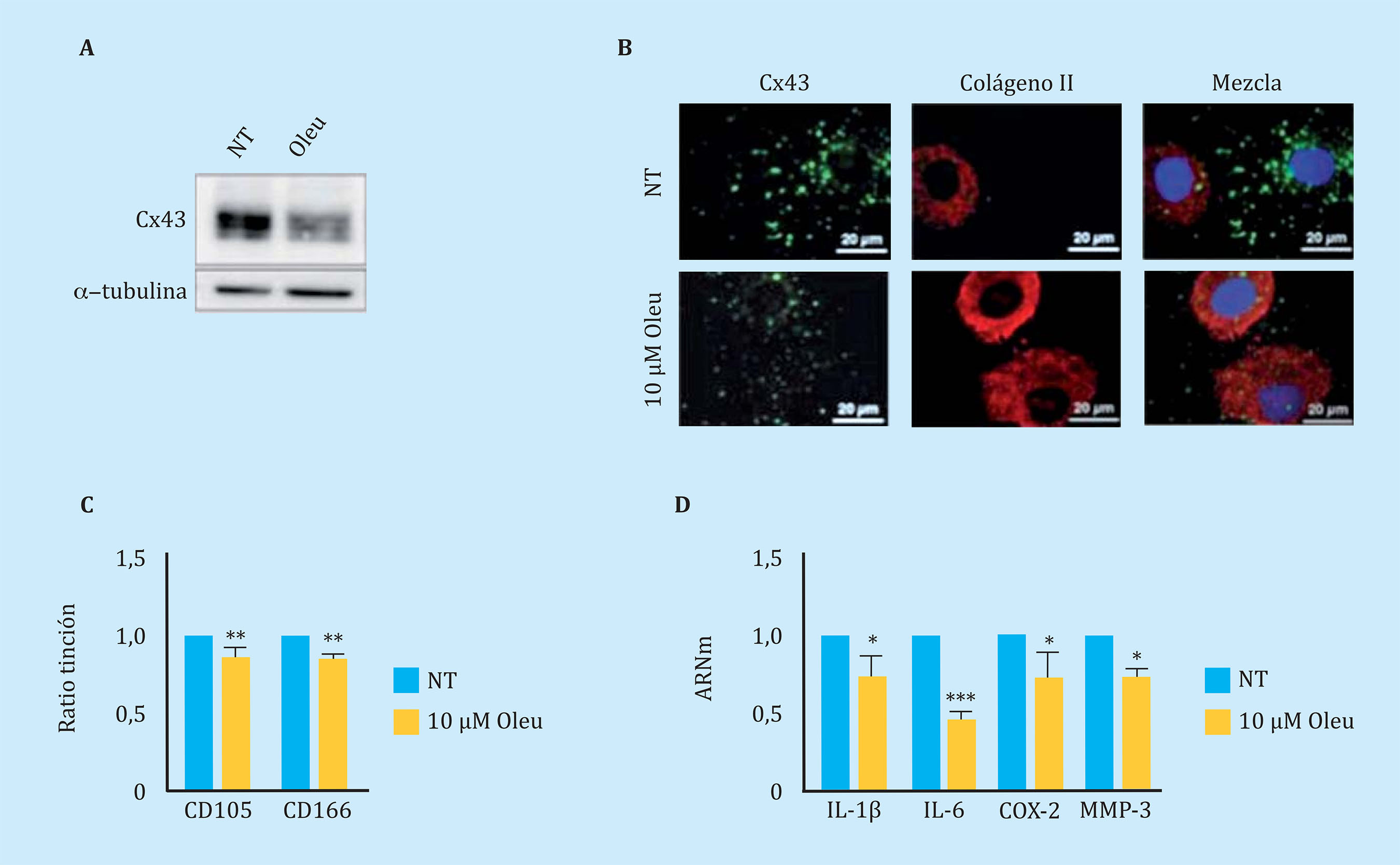
Figura 3 (A) Western blot para detectar Cx43 en condrocitos artrósicos (OAc) en cultivo primario no tratados (NT) o tratados con 10 μM oleuropeína (Oleu) durante 2 horas. (B) Co-inmunofluorescencia de Cx43 (verde) y colágeno tipo II (rojo) de OAc tratados con 10 μM oleuropeína durante 2 h. Los núcleos celulares aparecen en azul debido a la tinción con DAPI. Las flechas blancas indican Cx43 localizada en la membrana celular. (C) Niveles de los marcadores CD105 y CD166 medidos por citometría de flujo en OAc tratados con oleuropeína 10 μM durante 7 días (n=5, media ± EEM; **p<0,01; test de Mann-Whitney). (D) Niveles de expresión génica de IL-1β, IL-6, COX-2 y MMP-3 en OAc tratados con 10 μM oleuropeína durante 2 horas (n=3-7, media ± E.E.M; *p<0,05, ***p<0,0001; test de Mann-Whitney)
La disminución de la actividad de la Cx43 y de las UCs activa re-diferenciación celular en OA
Con el objetivo de disminuir la actividad de la Cx43 en OAc, se estudió el efecto de diferentes moléculas en los niveles y actividad de la Cx43. En este estudio, observamos que el polifenol oleuropeína disminuye los niveles de la Cx43 en OAc (Figura 3A). La disminución de los niveles de la Cx43 mejoró el fenotipo del condrocito OA detectado por un incremento en el principal marcador de condrocitos articulares, el colágeno II (Figura 3B). El tratamiento de OAc con una concentración de 10 µM de oleuropeína durante 7 días dio lugar a una disminución significativa de los niveles de marcadores de desdiferenciación CD105 y CD166 (Figura 3C), así como de la expresión génica de IL-1β, IL-6, COX-2 y MMP-3 detectados por citometría de flujo y análisis de la expresión génica respectivamente (Figura 3D). El efecto de la Cx43 en plasticidad celular en OAc fue confirmado en cultivo 3D. La modulación de los niveles de Cx43 en presencia de oleuropeína 10 µM en micromasas y en medio condrogénico mejoró la estructura de la matriz extracelular, detectándose un incremento significativo en los depósitos de colágeno II y proteoglicanos en la matriz de la estructura 3D (Figura 4).

Figura 4 Secciones del cultivo tridimensional de condrocitos artrósicos (OAc) cultivados en medio condrogénico (MC) con/sin oleuropeína 10 µM durante 30 días. En el panel superior, inmunohistoquímica de una micromasa para colágeno tipo II (n=4-6, media ± EEM; *p<0,05; test t de Student). Abajo, tinción de azul de toluidina para detectar proteoglicanos, que producen viraje de color azul a rosa-violeta (n=6, media ± EEM; **p<0,01; test de Mann-Whitney)
La Cx43 activa TEM y senescencia celular en OAc
La sobreexpresión de la Cx43 en la línea de condrocitos T/Cx28a2, se correlacionó con un incremento en el núcleo de PCNA, proteína utilizada como marcador de proliferación celular, y con activación del factor de transcripción relacionado con TEM, Twist-1, detectado por translocación e incremento de los niveles del factor de transcripción a nivel nuclear (Figura 5A). Los condrocitos transfectados para sobreexpresar la Cx43 también mostraron mayores niveles nucleares de NF-kß, uno de los factores de transcripción más importantes en la regulación de síntesis del componente SASP (Figura 5A). Niveles elevados de la Cx43 se correlacionaron con elevados niveles de los factores implicados en senescencia celular p53 (Figura 5B) y p16 (Figura 5C). El tratamiento de OAc con oleuropeína 10 µM redujo los niveles de Cx43 (Figura 3A) y de senescencia celular detectada por la actividad β-galactosidasa mediante microscopía óptica y por citometría de flujo (Figura 5D). Con el objetivo de confirmar el efecto de la disminución de Cx43 en TEM y senescencia celular, se transfectó la línea T/Cx28a2 con un plásmido CRISPR/Cas9, obteniendo células heterocigotas para el gen de la Cx43 (Figura 6A). Niveles reducidos de Cx43 en la línea T/C-28a2 se correlacionó con una disminución significativa de los marcadores “stem-like” CD166 y CD105 (Figura 6B). La disminución de los niveles de Cx43 en estas células, desencadenó en una disminución en los niveles de los factores de transcripción Twist-1 (TEM) y NF-kß (SASP) a nivel nuclear (Figura 6C), disminuyendo los niveles de senescencia celular, detectada mediante actividad β-galactosidasa y citometría de flujo (Figura 6D). Los condrocitos T/Cx28a2 con bajos niveles de Cx43 (CRISPR-Cx43) mostraron niveles significativamente menores de síntesis de los mediadores pro-inflamatorios IL-1β e IL-6, y de la proteasa MMP-3, con respecto a la línea T/Cx28a2 sin transfectar.

Figura 5 (A) Western blot comparando los niveles de PCNA, NF-Kß, y Twist-1 nuclear en los condrocitos que sobreexpresan la Cx43 (T/C-Cx43) con respecto a los mismos condrocitos transfectados con un plásmido control (T/C).

Figura 6 (A) A la izquierda, niveles de expresión génica de la Cx43 en los condrocitos T/C-28a2 (T/C) y la misma línea con sólo una copia de Cx43 (CRISPR-Cx43). n=4, media ± EEM; *p<0,05; test de Mann-Whitney. A la derecha, inmunofluorescencia para la Cx43 (verde) en condrocitos T/C-28a2 (T/C) y la misma línea transfectada con sólo una copia de Cx43 (CRISPR-Cx43). Los núcleos han sido teñidos con DAPI (azul). (B) Niveles de los marcadores CD105 y CD166 medidos por citometría de flujo en la línea celular T/C-28a2 con una sola copia de Cx43 (CRISPR-Cx43) en comparación a la misma línea sin transfectar (T/C). n=7, media ± EEM; *p<0,05, **p<0,01; test de Mann-Whitney (C) Western blot para detectar Twist-1, NF-kβ y N-Cadherina comparando un extracto nuclear de la línea T/C-28a2 (T/C) y de la misma línea con baja cantidad de Cx43 (CRISPR-Cx43). Se ha utilizado la proteína lamina A como control de carga. (D) Cuantificación mediante citometría de flujo de niveles de β-galactosidasa en la línea T/C-28a2 (T/C) y la misma línea con sólo una copia de Cx43 (CRISPR-Cx43). n=4, media ± EEM; *p<0,05; test de Mann-Whitney. (E) Niveles de expresión génica de IL-1β, IL-6 y MMP-3 medidos en las mismas células. n=4, media ± EEM; *p<0,05; test de Mann-Whitney)
DISCUSIÓN
Durante la artrosis, los condrocitos presentan niveles incrementados de la proteína transmembrana Cx436 y su fenotipo se ve alterado impidiendo que puedan participar en la regeneración del tejido y llevar a cabo su función, desencadenando en la progresiva degeneración del tejido. La desdiferenciación relacionada con fenómenos de transición epitelio-mesénquima (TEM) es un proceso celular que participa en la regeneración de tejidos al permitir a las células desdiferenciarse a un estado más inmaduro para activar procesos entre los que se incluyen proliferación celular y migración, con el objetivo de reemplazar las células dañadas y remodelar la matriz extracelular25,26. Sin embargo, cuando esta desdiferenciación ocurre de forma crónica puede ocasionar el desarrollo de fibrosis en el contexto de regeneración tisular27,28. En este estudio hemos descrito que los niveles de Cx43 y comunicación intercelular a través de UCs en artrosis se correlacionan positivamente con los marcadores de desdiferenciación celular CD105 y CD166. Además, hemos comprobado que este estado puede ser revertido parcialmente mediante el uso de moléculas que disminuyen los niveles de Cx43, mejorando el fenotipo de los condrocitos artrósicos y de la MEC en ensayos in vitro. La disminución de la Cx43 dio lugar a re-diferenciación celular y, por tanto, a una menor expresión de citoquinas pro-inflamatorias y enzimas degradadoras de la matriz del cartílago articular. Nuestros resultados también ponen de manifiesto que niveles elevados de la Cx43 en condrocitos se relacionan con un incremento en senescencia asociada a una mayor expresión de p16INK4a y altos niveles de p53. Estudios recientes remarcan la importancia de la senescencia en artrosis29-33. De hecho, Jeon et al. publicaron un artículo en Nature Medicine donde mostraron la senescencia como una nueva diana terapéutica para tratar la artrosis y promover la regeneración del cartílago33,34. En este estudio demostramos por primera vez la relación entre la sobre-actividad de la Cx43 en condrocitos humanos y la activación de desdiferenciación y senescencia celular que desembocan en alteraciones en el proceso de regeneración y favorecen el progreso de la enfermedad. A partir de estos resultados, terapias dirigidas a disminuir los niveles de Cx43 en artrosis surgen como una interesante aproximación terapéutica para la artrosis.
En conclusión, estos hallazgos sugieren que el incremento en la actividad de la Cx43 que se alcanza desde estadios muy tempranos de la OA6 podría contribuir a la degeneración del cartílago articular y de la articulación al activar desdiferenciación celular vía TEM y senescencia celular, contribuyendo a la síntesis de enzimas que degradan la liberación de citoquinas que contribuyen al proceso degenerativo en la articulación. Estos resultados demuestran que la Cx43 y las UCs actúan como regulador de la desdiferenciación/re-diferenciación y senescencia en condrocitos, probablemente activando proteínas relacionadas con TEM, como Twist-1, y de citoquinas pro-inflamatorias como IL-1β. La disminución en los niveles de Cx43 en OAc promueve su re-diferenciación disminuyendo la expresión de mediadores inflamatorios y senescencia, y a su vez se acompaña de mayor depósito de Col2A1 y proteoglicanos en la matriz extracelular. El uso de moléculas como la oleuropeína y el diseño de estudios que permitan disminuir la actividad de la Cx43 in vivo probablemente constituya un primer paso en el desarrollo de estrategias terapéuticas innovadoras para el tratamiento eficaz de la artrosis desde estadios tempranos de la enfermedad al restaurar la regeneración del tejido.











 texto en
texto en 


