INTRODUCCIÓN
El interés por la proteína relacionada con la parathormona (PTHrP) surgió de la hipercalcemia asociada al cáncer, el síndrome paraneoplásico más común que afecta hasta un 20% de pacientes con cáncer avanzado (1). En la década de los 80 del siglo pasado se observó que la mayoría de los pacientes con hipercalcemia tumoral presentan características de pseudohiperparatiroidismo, lo que hizo pensar en la PTH o un factor similar segregado por el tumor como responsable de este síndrome. Fue al final de esta década cuando tres grupos independientes aislaron y caracterizaron el verdadero factor causal, que resultó presentar una homología estructural con la PTH en su extremo N-terminal; de ahí su nombre con el que se conoce, PTHrP (2-4). Niveles plasmáticos elevados de PTHrP se han detectado en una mayoría de pacientes con hipercalcemia tumoral (5,6), en los que la PTHrP induce incrementos de resorción ósea y de reabsorción tubular de calcio como causa de la hipercalcemia.
Sin embargo, su caracterización condujo a un resultado inesperado: la PTHrP ha resultado ser una citoquina presente en una variedad de tejidos normales, donde ejerce acciones auto/paracrinas y/o intracrinas; de hecho, la hipercalcemia tumoral es una de las escasas situaciones en que la PTHrP ejerce acciones endocrinas por la hipersecreción tumoral (7). Así pues, el descubrimiento de la PTHrP es un magnífico ejemplo de investigación traslacional en biomedicina: la investigación clínica de un síndrome paraneoplásico se saldó con el descubrimiento de una nueva citoquina celular. Es más, como veremos a continuación, la PTHrP “ha vuelto a la clínica” de alguna manera, al contemplarse actualmente como un nuevo agente en el armamentarium farmacológico de los agentes osteoformadores en la osteoporosis.
LA PTHrP: UNA CITOQUINA MULTIFUNCIONAL EN EL METABOLISMO ÓSEO
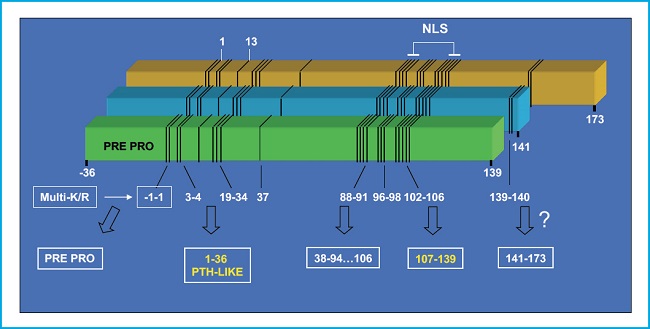
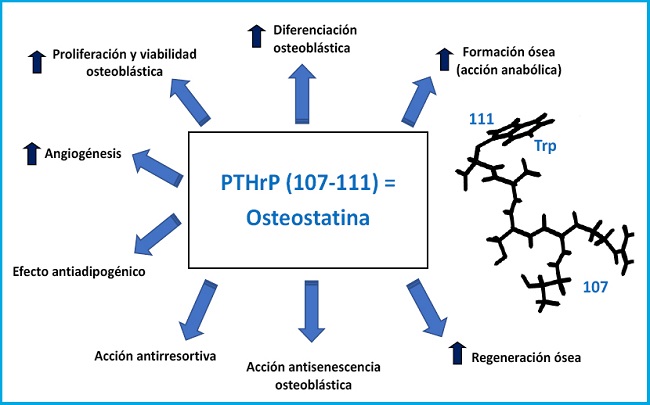
El gen de la PTHrP contiene múltiples exones y se localiza en el brazo corto del cromosoma 12, en posición análoga a la del gen de la PTH en el cromosoma 11, y ambos tienen un origen ancestral común. Mediante procesamiento alternativo de su ARNm, el gen de la PTHrP en humanos da lugar a tres isoformas proteicas de 139, 141 y 173 aminoácidos. Su rotura proteolítica genera diversos fragmentos con distinta bioactividad (7,8) (Fig. 1). Su fragmento N-terminal contiene homología estructural con la PTH, en las regiones 1-13 y 14-34, que permite su interacción con el mismo receptor de PTH tipo 1 (PTHR1) (9). La región media contiene un dominio de localización nuclear/nucleolar (NLS) con propiedades funcionales singulares en varios tipos celulares incluyendo los osteoblastos (10). El fragmento C-terminal contiene la secuencia (107-111) (conocida como osteostatina), un potente inhibidor de la actividad osteoclástica (11,12), cuyas propiedades osteogénicas se tratarán más adelante en este editorial.
La PTHrP es abundante en el tejido óseo, donde está presente en las células hematopoyéticas de la médula ósea, en condrocitos y en células de estirpe osteoblástica (8). La importancia del papel óseo de la PTHrP se ha puesto de manifiesto en ratones con manipulación genética de su gen. La comparación de ratones con supresión homozigótica para el gen de la PTHrP (-/-) o de la PTH (-/-) conduce a resultados interesantes: mientras estos últimos ratones presentan dismorfismo óseo pero son viables, los primeros presentan una severa condrodisplasia con disminución de desarrollo endocondral y excesiva mineralización causante de la muerte por asfixia de estos neonatos (13). Los ratones mutantes para PTH (-/-) en la etapa post natal muestran un incremento de hueso trabecular asociado a un aumento de PTHrP; de hecho, dicho incremento desaparece al cruzarlos con los heterozigotos de PTHrP (+/-) (14). Estos ratones con haploinsuficiencia de PTHrP son viables pero presentan una osteoporosis prematura a los 3 meses de edad, caracterizada en el esqueleto apendicular por un descenso de volumen óseo y alteración de la estructura trabecular, así como un aumento de apoptosis osteoblástica y un déficit de osteoprogenitores en la médula ósea (15). Además, el efecto anabólico de la PTH (1-34) administrada de modo intermitente se encontró incrementado en estos ratones PTHrP (+/-) (15); planteando la hipótesis de que los distintos niveles óseos de PTHrP podrían explicar la variabilidad observada en la respuesta anabólica a la teriparatida [la PTH (1-34) comercializada] en pacientes osteoporóticos. Estos hallazgos indican que la PTHrP es un factor esencial para el mantenimiento del hueso trabecular durante el crecimiento. La deficiencia de PTHrP ósea podría contribuir a la baja formación ósea en la osteoporosis involutiva, ya que su expresión está disminuida en los huesos largos de ratones viejos y en los osteoblastos humanos primarios con la edad del donante (16,17). Por otra parte, ratones mutantes que expresan una PTHrP truncada (1-84) presentan un crecimiento retardado, así como apoptosis ósea, senescencia y osteopenia prematuras (18). Más recientemente, transfectando células osteoblásticas con plásmidos que expresan formas mutadas de la PTHrP, demostramos un efecto de su dominio NLS sobre la viabilidad y la diferenciación osteoblástica (10). Además, la región C-terminal de la PTHrP ha demostrado inhibir la senescencia inducida por la IL-1beta en cultivos primarios de osteoblastos humanos de pacientes con artrosis (19). Estudios in vitro también han mostrado la capacidad del fragmento C-terminal de la PTHrP -similar a la del fragmento N-terminal homólogo a la PTH- para aumentar la viabilidad osteoblástica en osteoblastos primarios humanos (20). De interés, este efecto del fragmento C-terminal demostró ser estrictamente dependiente de la transactivación del receptor 2 del factor del endotelio vascular (VEGFR2) (20,21). El efecto antiapoptótico de la PTHrP en los osteoblastos es particularmente importante porque constituye un elemento clave en la acción anabólica de la PTH (22).
Utilizando el ratón ovariectomizado como modelo establecido de osteoporosis primaria, nuestro grupo demostró una eficacia similar de ambos péptidos N- y C-terminal de la PTHrP, administrados cada dos días durante 4-8 semanas, para mejorar el deterioro de la estructura trabecular en el fémur por microtomografía computarizada (µCT); un efecto asociado al aumento de osteocalcina, un marcador de formación ósea y a una inhibición de marcadores resortivos, que incluyen la expresión del gen Sost en el tejido óseo y los residuos de piridinolina, producto de degradación del colágeno tipo 1 en plasma (23). El grupo de Andy F Stewart y cols. fue pionero en utilizar la PTHrP (1-36) para estudiar su eficacia en la osteoporosis primaria en humanos. La inyección diaria de este péptido a dosis mayores que la de PTH (40 µg) durante 3 meses en mujeres postmenopáusicas produjo un aumento de densidad mineral ósea en la columna lumbar similar con ambos péptidos, pero fue superior en la cadera (un hueso predominantemente cortical) y en el cuello femoral con la PTHrP. Además, la PTH aumentó el propéptido N-terminal y los telopéptidos C-terminales del colágeno tipo 1, marcadores de formación y de resorción ósea, respectivamente; mientras la PTHrP (1-36) solo afectó al primer marcador (24). Más recientemente, se ha sintetizado un péptido derivado de la PTHrP (1-36) con 10 sustituciones aminoacídicas en su extremo C-terminal, la abaloparatida, que ha demostrado eficacia para incrementar la masa ósea con menor riesgo de hipercalcemia que el tratamiento con teriparatida (25). Así, en un ensayo en fase 2 en mujeres postmenopáusicas con osteoporosis severa se observó la mayor eficacia de la abaloparatida frente a la teriparatida para aumentar la densidad mineral ósea en localizaciones esqueléticas extravertebrales. Además, el ensayo en fase 3 multicéntrico doble ciego y controlado con placebo Abaloparatide Comparator Trial in Vertebral Endpoints (ACTIVE) ha demostrado una mayor eficacia de la abaloparatida a los 18 meses de tratamiento para reducir el riesgo de fracturas vertebrales y no vertebrales en esta situación. La abaloparatida ha sido aprobada por la FDA para el tratamiento de la osteoporosis postmenopáusica con elevado riesgo de fracturas. Las diferencias de acción sobre el componente resortivo entre la PTH y la PTHrP se atribuyen a su interacción con diferentes conformaciones del PTHR1: la PTH predominantemente con una conformación independiente (R0) de proteínas G, que da lugar a una respuesta de AMPc prolongada que favorece el componente resortivo a través del RANKL; la PTHrP con una conformación dependiente de proteínas G, que induce una respuesta de más corta duración, favoreciendo su acción anabólica (25).
La regeneración ósea post fractura puede estar comprometida en la osteoporosis y los datos actuales indican que la PTH sistémica resulta eficaz en esta situación (26). Por ello, se ha evaluado la eficacia de la PTHrP en un modelo experimental de regeneración ósea, la ablación medular en la tibia (27). Utilizando ratones osteoporóticos por tratamiento con metilprednisolona, demostramos que la administración secuencial (cada 2 días) de PTHrP (1-36) o PTHrP (107-139) incrementó la regeneración ósea tras la ablación medular (28). Teniendo en cuenta este hallazgo, estudiamos el posible efecto osteorregenerador de la osteostatina, la secuencia responsable de la acción antirresortiva del fragmento C-terminal de la PTHrP (11), cuya simplicidad estructural lo hace especialmente atractivo desde una perspectiva traslacional. La impregnación con osteostatina de una cerámica de sílice mesoporosa (SBA-15, sintetizada y caracterizada por el grupo de la Prof. Vallet-Regí) confiere propiedades osteogénicas al biomaterial en cultivos de osteoblastos murinos de la línea MC3T3-E1 (29). El implante de este mismo material con osteostatina en un defecto cavitario (que no regenera por sí solo) en la epífisis femoral de conejos sanos u osteoporóticos, indujo la neoformación ósea a las 4-8 semanas en los animales sanos (30), y a las 2 semanas en los osteoporóticos (31). Posteriormente, se utilizó un material biodegradable (un polímero de gelatina-glutaraldehído-hidroxiapatita) impregnado con osteostatina o PTHrP (1-37) e implantado en un defecto no cavitario en la tibia de ratas viejas osteopénicas, con o sin diabetes mellitus. La presencia de ambos péptidos de la PTHrP en el implante indujo de manera similar la reparación total del defecto óseo a las 4 semanas (32). Un aspecto particularmente interesante en relación a la osteostatina es que se ha demostrado su acción anabólica in vivo en un modelo de ratón diabético (con baja formación ósea). La histomorfometría ósea dinámica demostró que el tratamiento con dosis equivalentes de osteostatina o PTHrP (1-37) durante 3 días consecutivos normalizó a las dos semanas la disminución de superficie mineralizada y la velocidad de aposición mineral, así como la formación ósea, en las vértebras de estos ratones (33).
En definitiva, la PTHrP ha resultado ser un factor esencial para el desarrollo y el mantenimiento del tejido óseo. Además, sus acciones osteogénicas no se circunscriben solo a su región N-terminal con homología estructural con la PTH. Los aspectos tratados en esta Editorial tienen un significado especial al considerar el aumento de la osteoporosis involutiva asociado a nuestra longevidad que determina la demanda creciente de moléculas osteoformadoras y osteorregeneradoras para reparar las fracturas por fragilidad ósea. En este sentido, la investigación básica y traslacional han demostrado ser claves para identificar nuevas estrategias terapéuticas basadas en la PTHrP: en uso clínico como la abaloparatida, o en desarrollo potencial como la osteostatina -un péptido derivado de la secuencia C-terminal de la PTHrP-, cuyas propiedades lo hacen particularmente atractivo para promover la formación y la regeneración ósea (Fig. 2).











 texto en
texto en